Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Veterinaria (Montevideo)
versión impresa ISSN 0376-4362versión On-line ISSN 1688-4809
Veterinaria (Montev.) vol.52 no.201 Montevideo abr. 2016
Evaluación in vitro de agentes secuestrantes de aflatoxinas
In vitro evaluation of sequestering agents for aflatoxins
Pan D1 *, García y Santos C 2, Bettucci L1
1Laboratorio de Micología, Facultad de Ciencias, Facultad de Ingeniería, Universidad de la República Julio Herrera y Reissing 565, Montevideo, Uruguay.
2 Laboratorio de Toxicología, Facultad de Veterinaria, Universidad de la República.
*Autor para correspondencia: Dinorah Pan. dpan@fing.edu.uy
Recibido: 13/4/2015 Aceptado: 20/8/2015
Resumen
La presencia de micotoxinas en alimentos es un problema de gran importancia a nivel mundial que provoca serios perjuicios sanitarios y económicos. Para limitar los efectos de las micotoxinas a los animales uno de los métodos más utilizados es la aplicación de secuestrantes. Estos son polímeros inorgánicos u orgánicos que al añadirse a los alimentos forman complejos con las micotoxinas en la luz intestinal disminuyendo así su absorción. Por este motivo se evaluó la eficacia de cuatro secuestrantes, dos alumino silicatos hidratados de calcio y sodio, uno de glucomananos esterificados y otro del tipo multi modular para aflatoxina B1 (AFB1). La capacidad de adsorción fue evaluada in vitro y bajo condiciones de pH similares a las del tracto gastrointestinal de los animales. La concentración de AFB1 fue determinada mediante cromatografía líquida de alta resolución (HPLC). Con la excepción del producto de glucomananos esterificados, el porcentaje de unión de aflatoxina B1 obtenido para los secuestrantes estudiados fue alto (> 76%). Estos resultados sugieren que la mayoría de los secuestrantes utilizados en este estudio son potenciales agentes químicos-biológicos que podrían ser utilizados para disminuir los efectos de las aflatoxinas en animales.
Palabras clave: aflatoxinas, secuestrantes de micotoxinas, HSCAS, glucomananos esterificados
Summary
The contamination of animal feed with mycotoxins represents a worldwide problem that causes serious diseases in animals and economic losses. One of the most used methods for protecting animals against mycotoxins is the utilization of adsorbents. These are inorganic or organic components that added to foods form complexes with mycotoxins in the gastrointestinal tract thus decreasing its absorption. Four mycotoxin binder products including two hydrated sodium calcium aluminosilicates, one esterified glucomannan and one multi modular were used to determine their efficacity to bind aflatoxin B1. The binding ability for AFB1 was conducted by an in vitro assay, which simulated the pH condition of the gastrointestinal tract of animals. AFB1 contents was determinated by high performance liquid chromatographic (HPLC). With the exception of the esterified glucomannan product, the binding percent of AFB1 was high (> 76%) by the sequestering agents used in the current study. These results suggest that most commercial adsorbent products used in this study are potential chemical - biological agents that might be used to decrease the effects of aflatoxins in animals.
Keywords: aflatoxin, mycotoxin binders, HSCAS, esterified glucomannan
Introducción
La presencia de micotoxinas en alimentos es un problema de gran importancia a nivel mundial. La FAO estima que el 25% de los granos de cereales y oleaginosas en el mundo están anualmente contaminados con micotoxinas (Wu, 2007), provocando serios perjuicios tanto sanitarios (daños a la salud humana y animal) como económicos (afectando la cantidad y la calidad industrial de las cosechas y alterando las condiciones del mercado doméstico). Las micotoxinas son metabolitos secundarios de bajo peso molecular producidos, principalmente, al final de la fase exponencial o al inicio de la fase estacionaria de crecimiento de los hongos (Bullerman y Bianchi, 2007). La mayoría de las micotoxinas conocidas son producidas por especies de los géneros Aspergillus, Penicillium y Fusarium, que colonizan un amplio rango de cereales y oleaginosas, ya sea en forma exclusiva o bien con otras especies con las que coexisten.
El género Aspergillus produce diferentes micotoxinas, siendo las especies de Aspergillus seccion Flavi las productoras de las aflatoxinas B1, B2, G1 y G2, mientras que M1 es el derivado metabólico de la B1 de mayor significado toxicológico. Las aflatoxinas B1 y M1 son las más tóxicas y los daños resultantes del consumo de granos contaminados van desde daño agudo del hígado, incluyendo necrosis y hemorragia, hasta cáncer hepático (Prandini y col., 2009). En animales también ocasionan disminución en la tasa de crecimiento y baja productividad (leche, huevos, etc). Son también inmunosupresoras, teratogénicas y mutagénicas (Sweeney y Dobson, 1998). Cabe destacar que las aflatoxinas B1 y M1 están clasificadas como carcinógeno grado 1 por la Agencia Internacional de Investigación en Cáncer (IARC, 2002). Pueden estar presentes en leche y derivados, carne de cerdo o huevos si el animal consume suficiente cantidad de alimento contaminado (Creppy, 2002).
Para limitar los efectos de las aflatoxinas en los animales existen métodos biológicos, químicos, físicos y la aplicación de secuestrantes. Estos últimos, son polímeros inorgánicos u orgánicos de gran peso molecular que, al añadirse a los alimentos, son capaces de formar complejos irreversibles con las micotoxinas en la luz intestinal disminuyendo su absorción para luego ser excretados en las heces. El resultado final es una reducción del nivel de micotoxina en la sangre que no afecte significativamente el desempeño productivo del animal cuando recibe un alimento contaminado.
Entre los secuestrantes inorgánicos se encuentran los alúmino silicatos hidratados de calcio y sodio (HSCAS) y entre los orgánicos los glucomananos esterificados (EGM) y un tercer tipo denominado multimodular (MM). Estos aditivos se activarían al ponerse en contacto con los jugos digestivos, formando complejos insolubles y estables con las micotoxinas, no permitiendo que se absorban en el tracto gastrointestinal (Díaz y Smith, 2008). Los HSCAS consisten básicamente en arcillas de aluminio y silicio combinados con otros minerales en arreglos tridimensionales. Este arreglo forma estructuras con amplia superficie de contacto y porosidad, denominadas aluminosilicatos (García y col., 2004).
Los EGM se obtienen a partir de la esterilización de la pared celular de las levaduras Saccharomyces cerevisiae. Las micotoxinas serían atrapadas en la matriz del glucomannano en el tracto gastrointestinal, lo que impediría su posterior absorción (Raju y Devegowda, 2000). Esta capacidad de adsorción de micotoxinas se vería favorecida por la disposición tridimensional de los polisacáridos y su naturaleza porosa, por lo que serían efectivas para contrarrestar micotoxinas tales como aflatoxina, zearalenona y ochratoxina (Yianninkouris y col., 2004).
El MM está formado por minerales, microorganismos, sustancias fitogénicas y constituyentes ficolíticos. La fracción mineral está constituida por una mezcla de minerales que actúan sinérgicamente en la adsorción selectiva y estable de aflatoxinas y fumonisinas cuando se dan condiciones de pH ácido (Gargees y Shareef, 2008). La fracción biológica está compuesta por enzimas que serían capaces de inactivar las micotoxinas poco polares (por ejemplo las toxinas del género Fusarium), degradando sus grupos funcionales (como el 12-13 epoxi de los trichotecenos) o hidrolizando enlaces éster, (como zearalenona), convirtiéndolas en metabolitos inactivos y no tóxicos. La fracción microbiana incluye microorganismos que tendrían la capacidad de proliferar rápidamente en el tracto gastrointestinal y producir un sistema enzimático que neutralizaría e inactivaría las micotoxinas por biotransformación (Dänicke y col., 2004; Díaz y Smith, 2008).
Los ensayos in vitro han proporcionado una buena idea de la afinidad y capacidad de unión de los secuestrantes a las micotoxinas, por lo que se ha utilizado como un método para seleccionar diferentes tipos de secuestrantes (Kong y col., 2014; Marroquin-Cardona y col., 2009; Thieu y col., 2008; Sabater-Vilar y col., 2007). Por lo tanto, el objetivo de este trabajo fue evaluar la eficacia in vitro de diferentes tipos de secuestrantes comerciales para aflatoxinas.
Materiales y Métodos
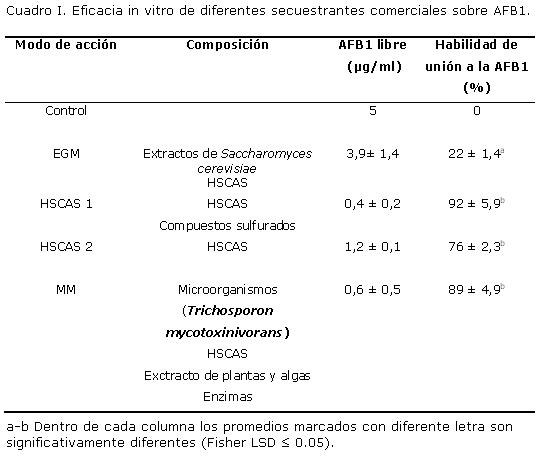
Se evaluó la eficacia in vitro de cuatro secuestrantes comerciales para aflatoxina B1 según la metodología propuesta por Diaz y col., 2002. Entre los secuestrantes ensayados se encuentran dos del tipo alumino silicatos hidratados de calcio y sodio (HSCAS), uno de glucomananos esterificados (EGM) y otro del tipo denominado multi modular (MM) (Cuadro I). Cada agente secuestrante (1,1 g) se adicionó a frascos de Erlenmeyer de 125 ml conteniendo 100 ml de metanol al 10%, a pH 2.5, y se agitó durante 30 min a 37ºC para simular las condiciones durante el pasaje gástrico de los animales monogástricos. Luego se ajusto el pH a 7 para simular el pasaje intestinal y se incubaron toda la noche en agitación constante a 180 rpm. Al término de este tiempo, 900 µl de cada una de las soluciones de secuestrantes fueron adicionados a tubos de microcentrífuga conteniendo 5 µg de estándar de AFB1 (Trilogy®, Trilogy Analytical Laboratory Inc., Washington, USA) y 100 µl de metanol. Como control se utilizaron 900 µl de aguada destilada.y 100 µl de metanol. Los tubos fueron incubados a temperatura ambiente durante una hora con agitaciones periódicas cada 15 min y luego se centrifugaron a 1500 rpm durante 10 min. Todos los ensayos fueron realizados por triplicado. Se determinó la concentración de AFB1 presente en el sobrenadante mediante cromatografía líquida de alta resolución (HPLC). Para ello una alícuota de 200 µl del sobrenadante fue derivatizada con una solución de 700 µl de ácido trifluoroacético/ácido acético glacial/ agua (20:10:70) a 65ºC durante 8.5 min. Una alícuota de 50 µl de la solución derivatizada fue inyectada en el sistema HPLC. Dicho sistema consistió de una bomba Shimadzu LC-10ADvp y un detector de fluorescencia Shimadzu RF-10Axl. Las separaciones cromatográficas se realizaron en una columna de fase reversa (C18,150 x 4.6 mm d.i., 5 µm de tamaño de partícula) (Nucleodur®, Macherey-Nagel, Düren, Germany), conectada a una precolumna (8 x 4 mm d.i., 5 µm de tamaño de partícula; Nucleodur®, Macherey-Nagel, Düren, Germany). La fase móvil empleada fue acetonitrilo:etanol:agua (1:1:4), a una velocidad de flujo de 1,5 ml/min. La flourescencia de las aflatoxina derivatizadas fue registrada a una longitud de onda de 360 nm exitación y 440 nm de emisión. El límite de detección fue de 2 ng/mL.
El porcentaje de aflatoxina unida al adsorbente fue calculado mediante la diferencia entre la cantidad inicial de aflatoxina en el medio de ensayo y la cantidad final en el sobrenadante. Estos datos se analizaron mediante análisis de varianza (ANOVA) y los promedios fueron comparados usando el test de Fisher LSD para determinar diferencias significativas entre los controles y los diferentes secuestrantes.
Resultados
Todos los secuestrantes analizados tuvieron la capacidad de unirse a la AFB1 (Cuadro I), siendo EGM el que presentó la menor capacidad de unión (22%), respecto al resto de los productos utilizados (p<0.05). También se pudo observar que los secuestrantes HSCAS 1 y MM que tienen otros compuestos además de aluminosilicatos, presentaron la mayor capacidad de unión (Cuadro I).
Discusión
Con la excepción del producto de glucomananos esterificados, el porcentaje de unión de AFB1 obtenido para los secuestrantes estudiados fue alto (> 76%) y similar al encontrado en estudios realizados in vitro por otros autores (Diaz y col., 2002; Jard y col., 2011; Kong y col., 2014).
Varios trabajos han demostrado que los secuestrantes HSCAS tienen una alta afinidad por AFB1, pues forman un complejo entre el grupo β- carbonil de la aflatoxina y los iones aluminio del secuestrante, que es estable a temperaturas de 25ºC y 37ºC y en un rango de pH de 2 a 10 (Huwig y col., 2001; Phillips y col., 1988, 1990). Además, se ha demostrado la capacidad in vivo de este agente secuestrante, al 0.5% y 2% de la dieta, de prevenir la aflatoxicosis en aves (pollos y pavos), cerdos y rumiantes (ganado lechero, corderos y cabras) (Ramos y Hernández, 1997).
Sin embargo, el uso de este tipo de sucuestrante no parece ser efectivo para adsorber otras micotoxinas como zearalenona, ocratoxina y tricotecenos (Dänicke y col., 2004; Santin y col., 2002; Osweiler, 2000). Por otra parte, los sucuestrantes minerales tienen la desventaja de poder adsorber vitaminas y minerales esenciales para la nutrición animal (Jard y col., 2011).
Al igual que en este estudio, trabajos previos utilizando adsorbentes multi modulares han encontrado altos valores de unión a la AFB1 y demostrado que el principal mecanismo de acción es la adsorción debido a la polaridad de esta micotoxina (Celik y col., 2000; Marroquín-Cardona y col., 2009; Kong y col., 2014). A diferencia de los HSCAS, este tipo de adsorbente tiene la ventaja de presentar baja adsorción de nutrientes y antibióticos (Gargees y Shareef, 2008).
La baja capacidad de unión que se obtuvo in vitro con los productos a base de glucomananos es similar a la encontrada por Marroquín-Cardona y col. (2009), pero diferente a la obtenida por Diaz y col. (2002) y Kong y col. (2014), donde este tipo de secuestrantes presentaron más de un 90% de unión a la AFB1. Esta diferencia puede deberse a que parte de la unión de la AFB1 a los β-D-glucanos es mediante uniones de Van der Waals y puentes de hidrogeno, los cuales son reversibles y dependen de la orientación de las moléculas (Yiannikouris y col., 2006). Se ha demostrado también que la adsorción de las aflatoxinas a este tipo de secuestrantes está afectada por el pH del medio, siendo la adsorción máxima pH 4 (Diaz y Smith, 2008). Por otra parte, se ha demostrado que la eficacia de unión a la AFB1 por este tipo de producto está correlacionada con el contenido y tipo de cenizas. Los secuestrantes EGM que contienen más del 30% de cenizas mostraron valores de adsorción superiores al 90%, mientras que productos conteniendo menos del 10% de cenizas no superaron el 20% de adsorción (Fruhauf y col., 2012). En este estudio no fue posible determinar la composición del adsorbente, pero es posible que presente bajos niveles de cenizas hecho que explicaría, en parte, la baja capacidad de unión obtenida. Por este motivo, es importante conocer la composición de los adsorbentes que se comercializan en nuestro mercado.
Conclusiones
Se puedo observar que la mayoría de los secuestrantes comerciales analizados son potenciales agentes químico-biológicos que podrían ser utilizados para disminuir los efectos de las aflatoxinas en animales. Cabe destacar que la afinidad obtenida en este estudio in vitro puede ser diferente cuando el agente secuestrante se encuentre en condiciones in vivo. Sin embargo, si un producto no adsorbe una micotoxina in vitro hay pocas probabilidades de que lo haga in vivo. La capacidad de acción demostrada por estos productos amerita profundizar su estudio bajo diferentes condiciones para obtener resultados más precisos.
Agradecimientos
Este trabajo fue financiado por CSIC (VUSP Mod 1) y CONAPROLE.
Bibliografía
1. Bullerman L, Bianchini A. (2007) Satbility of mycotoxins during food processing. Int J Food Microbiol119:140-146.
2. Celik A, Oguz H, Demet O, Donmez H, Boydak M, Sur E. (2000). Efficacy of polyvinylpolypyrrolidone in reducing the immunotoxicity of aflatoxin in growing broilers. Br Poul Sci 41:430-439.
3. Creepy E. (2002). Update of survey, regulation and toxic effects of mycotoxins in Europe. Toxicol Lett 127:19-28.
4. Dänicke S, Valenta H, Doll M, Ganter M, Flachowsky G. (2004). On the effectiveness of a detoxifying agent in preventing fusario-toxicosis in fattering pigs. Anim Feed Sci. Technol 114:141-157.
5. Diaz D, Hagler W, Hopkins B, Whitlow L. (2002). Aflatoxin binders I: in vitro binding assay for aflatoxin B1 by several potential sequestering agents. Mycopathologia 156:223-226.
6. Diaz D, Smith T. (2008). Mycotoxin sequestering agents: practical tools for the neutralisation of mycotoxins. En: Diaz D. The mycotoxin blue book. Nottingham, United Kindgom, Nottingham University Press pp 323-339.
7. Fruhauf S, Schwartz H, Ottner F, Krska R,Vekiru E. (2012). Yeast cell based feed additives: studies on aflatoxin B1 and zeralenone. Food Addit Contam 29:217-231.
8. García A, Martínez R, Ordóñez J, González E. (2004). In vitro binding ability of ochratoxin A by commercial mycotoxin binders available in Mexico. Vet Mex 35:351-358.
9. Gargees M, Shareef A. (2008). Mycofix ameliorative effect on Newcastle disease antibody production in broiler chickens during aflatoxicosis. Iraqi J Vet Sci 22: 29-34.
10. Huwig A, Freimund S, Kappeli O, Dutler H. (2001). Mycotoxin detoxification of animal feed by different adsorbents. Toxicol Lett 122:179-188.
11. International Agency for Research on Cancer. (2002). IARC monographs on the evaluation of the carcinogenic risk of chemicals to man: some traditional herbal medicines, some mycotoxins, naphthalene and styrene. Lyon (France): IARC 82:171.
12. Jard G, Liboz T, Mathieu F, Guyonvarc´h A, Lebrihi A. (2011). Review of mycotoxin reduction in food and feed: from prevention in the field to detoxification by adsorption or transformation. Food Addit Contam 28:1590-1609.
13. Kong C, Youp-Shin S, Gyun-Kim B. (2014). Evaluation of mycotoxin sequestering agents for aflatoxin and deoxynivalenol: an in vitro approach. SpringerPlus 3:346-349.
14. Marroquin-Cardona A, Deng Y, Taylor J, Hallmark C, Johnson N, Phillips T. (2009). In vitro and in vivo characterization of mycotoxin-binding additives used for animal feeds in Mexico. Food Addit Contam 26:733-743.
15. Osweiler, G. (2000). Mycotoxins: Contemporary Issues of Food Animal Health and Productivity. Vet Clin North Am Food Anim Pract 16: 511-530.
16. Phillips T, Clement B, Kubena L, Harvey R. (1990). Detection and detoxification of aflatoxins: Prevention of aflatoxicosis and aflatoxin residues with hydrated sodium calcium aluminosilicate. Vet Hum Toxicol 32:15-19.
17. Phillips T, Kubena L, Harvey R, Taylor D, Heidelbaugh N.(1988). Hydrated sodium calcium alumi-nosilicate: a high affinity sorbent for aflatoxin. Poult Sci 67:253-260.
18. Prandini A, Tansini G, Sigolo S, Filippi L, Laporta M, Piva G. (2009). On the occurrence of aflatoxin M1 in milk and dairy products. Food Cem Toxicol 47:984-991.
19. Raju M, Devegowda G. (2000). Influence of esterified-glucomannan on performance and organ morphology, serum biochemistry and haematology in broilers exposed to individual and combined mycotoxicosis (aflatoxin, ochratoxin and T-2 toxin). Br Poult Sci 41:640-650.
20. Ramos A, Hernández E. (1997). Prevention of aflatoxicosis in farm animals by means of hydrated sodium calcium aluminosilicate addition to feedstuffs: a review. Anim Feed Sci Technol 65:197-206.
21. Sabater-Vilar M, Malekinejad H, Selman M, van der Doelen M, Fink-Gremmels J. (2007). In vitro assessment of adsorbents aiming to prevent deoxynivalenol and zearalenone mycotoxicoses. Mycopathologia 163:81-90.
22. Santin E, Maiorka E, Krabble E, Alessi A. (2002). Effect of hydrated sodium calcium aluminosilicate on the prevention of the toxic effects of ochratoxin. J Appl Poult Res 11:22-28.
23. Sweeney M, Dobson A. (1998). Mycotoxin production by Aspergillus, Fusarium and Penicillium species. Int J Food Microbiol 43:141-158.
24. Thieu N, Ogle B, Pettersson H. (2008). Efficacy of bentonite clay in ameliorating aflatoxicosis in piglets fed aflatoxin contaminated diets. Trop Anim Health Prod 40:649-656.
25. Wu F. (2007). Measuring the economic impacts of Fusarium toxins in animal feeds. Anim Feed Sci Technol 137:363-374.
26. Yiannikouris A, André G, Poughon L, Francois J, Dussap CG, Jeminet G, Bertin G, Jouany J. (2006). Chemical and conformational study of the interactions involved in mycotoxin complexation with -D-glucans. Biomacromolecules 7:1147-1155.
27. Yianninkouris A, André G, Buleon A, Jeminet G, Canet I, Francois J, Bertin G, Jouany J. (2004). Comprehensive conformational study of key interactions envolved in zearalenone complexation with beta-D-glucans. Biomacromolecules 5:2176-2185.