Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Medicina Interna
versión impresa ISSN 0250-3816versión On-line ISSN 1688-423X
Arch. Med Int vol.37 no. 3 Montevideo nov. 2015
Artículo original
Cardiotoxicidad inducida por Trastuzumab en pacientes uruguayas portadoras de cáncer de mama HER positivo
Trastuzumab-induced cardiotoxicity in uruguayan patients
with HER positive breast cancer
Dra. Natalia Camejo
Asistente del Servicio de Oncología Clínica. Hospital de Clínicas.
Facultad de Medicina. UdelaR
Dra. Andrea Schiavone
Médico Residente de Oncología. Médica de la Asociación Española Primera en Salud.
Dra. Mariana Díaz
Médico Residente de Oncología. Médica de la Asociación Española Primera en Salud
Dra. Natalia Reborido
Médico Residente de Cardiología de la Asociación Española Primera en Salud
Dra. Cecilia Castillo
Profesora Adjunta del Servicio de Oncología Clínica. Hospital de Clínicas.
Facultad de Medicina. UdelaR.
Dr. Gabriel Parma
Asistente de la Cátedra de Cardiología. Hospital de Clínicas.
Facultad de Medicina. UdelaR.
Dr. Horacio Vázquez
Cardiólogo de la Asociación Española Primera en Salud.
Jefe de Policlínica de Cardiología.
Dr. Alvaro Vázquez
Director administrativo de los Servicios Oncológicos de la Asociación Española Primera en Salud. Director Médico del Centro de Diagnóstico y Tratamiento Mamario (CENDyTMA). Asociación Española Primera en Salud.
Dr. Gabriel Krygier
Profesor Agregado del Servicio de Oncología Clínica. Hospital de Clínicas. Facultad de Medicina. UdelaR.
Dra. Lucía Delgado
Profesora Directora del Servicio de Oncología Clínica. Hospital de Clínicas. Facultad de Medicina. UdelaR.
Recibido: 29/04/15 - Aceptado: 5/10/15
Departamento e Institución responsables: Servicio de Oncología Clínica. Hospital de Clínicas “Dr. Manuel Quintela”. Universidad de la República. Montevideo, Uruguay. Servicios Oncológicos- Centro de Diagnóstico y Tratamiento Mamario (CENDyTMA), Asociación Española Primera en Salud.
Correspondencia: Dra. Natalia Camejo. Dirección: Servicio de Oncología Clínica. Hospital de Clínicas. Avda. Italia s/n. CP 11600. Montevideo – Uruguay. E-mail: ncam3@yahoo.com
RESUMEN: Arch Med Interna 37(3):
Objetivo: Valorar la frecuencia y severidad de la cardiotoxicidad inducida por Trastuzumab (TTZ) en pacientes portadoras de cáncer de mama (CM) HER 2 positivo, asistidas en los Servicios de Oncología del Hospital de Clínicas y de la Asociación Española Primera en Salud. Métodos: Estudio observacional retrospectivo, que incluyó pacientes del Hospital de Clínicas y de la Asociación Española diagnosticadas de CM HER 2 positivo, que recibieron tratamiento con TTZ entre enero de 2007 y diciembre de 2013. Resultados: Se incluyeron 69 pacientes, la mayoría de las cuales tuvieron CM localizado, y cuya media de edad fue 50,1 años. 27% de las pacientes presentó cardiotoxicidad, y el 26% de éstas desarrolló insuficiencia cardíaca sintomática; todas recibieron tratamiento médico adecuado, siendo la insuficiencia cardíaca reversible en la mayoría de los casos. Conclusiones: La frecuencia de cardiotoxicidad observada en el estudio fue del 27 % (IC 95 %: 16,27; 38,8). Con las limitaciones propias del estudio, éste permite verificar similitudes con otras poblaciones reportadas, variando la frecuencia entre 3,7 y 34 %. Sin embargo, la proporción de pacientes que presentaron insuficiencia cardíaca sintomática (7%) fue algo superior a la reportada en la literatura, que es del 4%. La cardiotoxicidad fue reversible en la mayoría de las pacientes.
Palabras clave: Cáncer de mama HER positivo, Trastuzumab, cardiotoxicidad.
ABSTRACT: Arch Med Interna 37(3):
Objective: To evaluate the frequency and severity of Trastuzumab-induced cardiotoxicity in HER2 positive breast cancer (BC) patients assisted in Oncologic Services of the Hospital de Clínicas and Asociación Española Primera en Salud. Methods: Retrospective observational study of HER2 positive BC patients from Hospital de Clínicas and Asociación Española under systemic therapy with Trastuzumab (TTZ) from January 2007 to December 2013. Results: The study included 69 patients, most were early BC, mean age was 50,1 years . 27% of the patients developed cardiotoxicity and 26 % of them developed symptomatic heart failure. All patients received adequate medical treatment and the most instances were reversible Conclusions: The frequency of cardiotoxicity observed in the study was 27% (IC 95 %: 16,27; 38,8). With the limitations of the study, it can verify reported similarities with other populations, oscillating frequency between 3.7 and 34%. However, the proportion of patients who had symptomatic heart failure (7%) was higher than that reported in the literatura wich is 4%. Cardiotoxicity was reversible in most patients.
Key words: Breast cancer HER positive, trastuzumab, cardiotoxicity
Introducción
Al igual que lo observado internacionalmente, el cáncer de mama (CM) en Uruguay es con mucho el más frecuente en el sexo femenino, y también la principal causa de muerte por cáncer. Cada año se registran unos 1840 casos nuevos y unas 660 mujeres mueren como consecuencia de esta enfermedad. Esto representa una tasa estandarizada (a la población mundial estándar) de incidencia de unos 74 casos por 100.000 mujeres y una tasa de mortalidad (también estandarizada por edad) de unos 22 casos por 100.000 mujeres (1, 2).
Si bien tradicionalmente el estadío tumoral avanzado, el compromiso ganglionar y el grado histológico alto se consideran factores pronósticos y se asocian con una menor sobrevida (3, 4), la identificación de marcadores biológicos predictivos de respuesta al tratamiento y pronósticos ha permitido reconocer subtipos con diferentes características clínico-patológicas y evolutivas. En este sentido, la identificación de la proteína HER2 codificada por el oncogén erbB2 y su validación como marcador pronóstico y predictivo de la respuesta a terapias dirigidas y otros tratamientos sistémicos, ha contribuido a optimizar el tratamiento de las pacientes con CM (5-7).
En nuestro país, la prevalencia de sobre-expresión de HER2 en los cánceres mamarios invasivos es del 10 %, porcentaje algo menor que el observado en las pacientes de otros países, tanto europeos y norteamericanos como latinoamericanos, donde se registran tasas en torno al 20 % (5). Las pacientes HER2 positivas tienen un peor pronóstico, una menor sobrevida libre de enfermedad (SVLE) y una menor sobrevida global (SVG) (8,9).
El Trastuzumab (TTZ) es un anticuerpo monoclonal humanizado con alta afinidad y especificidad por el dominio extracelular de HER2. En setiembre de 1998 fue aprobado por la Administración de Medicamentos y Alimentos (FDA) para el CM metastásico HER2 positivo, y en junio del 2006 fue aprobado por la Agencia Europea de Medicamentos (EMEA) para el CM precoz que sobreexpresa el HER 2. Actualmente, su uso está aprobado para el tratamiento del CM metastásico HER 2 positivo en monoterapia, combinado con quimioterapia, hormonoterapia u otros agentes anti HER2 (lapatinib, pertuzumab) (8-12); para el tratamiento adyuvante y neoadyuvante del CM utilizado en forma concurrente o secuencial con quimioterapia (13,14).
Es activo en monoterapia y en combinación con varias drogas; las combinaciones más efectivas en el tratamiento sistémico adyuvante son las que combinan TTZ y taxanos concurrente, mientras que, en el tratamiento sistémico paliativo, las combinaciones más eficaces son con pertuzumab, docetaxel, paclitaxel, capecitabine, vinorelbine y gemcitabine.
Los resultados de múltiples estudios demuestran un beneficio en SVG y sobrevida libre de progresión (SVLP) en las pacientes con CM metastásico (14,15). Los estudios confirman también un beneficio estadísticamente significativo del TTZ adyuvante asociado a la quimioterapia tanto en SVG como en SVLE (16, 17). Si bien la duración óptima del tratamiento adyuvante no ha sido establecida, se recomienda su administración durante un año, ya sea en forma semanal o cada tres semanas.
La mayor parte de las pacientes presentan una excelente tolerabilidad al tratamiento (18,19). La toxicidad cardíaca se presenta en alrededor del 3 % de las pacientes que reciben TTZ en monoterapia, en un 13 % de las que lo reciben en forma concurrente con taxanos y en un 27 % de las que lo reciben en concomitancia con antraciclinas (19,20). Frecuentemente se presenta como un descenso asintomático de la fracción de eyección del ventrículo izquierdo (FEVI) pero también puede manifestarse como insuficiencia cardíaca congestiva (ICC) que, si bien es reversible en la mayoría de los casos, cuando se suspende el tratamiento y/o se realiza el tratamiento estándar para la insuficiencia cardíaca puede ser ocasionalmente fatal (21).
La probabilidad de desarrollar ICC no está relacionada con la dosis del fármaco recibida. Haber recibido tratamiento sistémico con antraciclinas o tratamiento radiante sobre la pared toráxica, ser portador de una disfunción cardíaca y/o una FEVI basal por debajo de la normalidad, son factores de riesgo conocidos para el desarrollo de cardiotoxicidad (22, 23).
Debido a la importancia del papel de TTZ en la terapéutica actual del tratamiento del CM HER2 positivo y a la relevancia clínica de dicha toxicidad, que puede condicionar la continuación del tratamiento y, por tanto, afectar la evolución y el pronóstico de las pacientes, creemos relevante realizar una valoración del perfil de toxicidad del tratamiento con este fármaco. Por otra parte, no hemos encontrado publicaciones sobre cardiotoxicidad inducida por este agente en pacientes de nuestro medio con CM, lo que permite presumir que el presente estudio resultará útil.
Objetivos
El objetivo de este estudio es evaluar la frecuencia y la severidad de la cardiotoxicidad asociada al tratamiento con TTZ en pacientes portadoras de cáncer de mama HER 2 positivo asistidas en los Servicios de Oncología del Hospital de Clínicas y de la Asociación Española Primera en Salud. Se describirán las características de tales pacientes, su manejo y su evolución.
Material y Métodos
Estudio observacional retrospectivo en el que se incluyeron todas las mujeres con CM HER2 positivo determinado por IHQ, FISH o CISH que recibieron TTZ con criterio neoadyuvante, adyuvante o paliativo desde el 01.01.2007 al 31.12.2013 en el Servicio de Oncología Clínica del Hospital de Clínicas y en el Centro de diagnóstico y tratamiento mamario (CENDyTMA) de la Asociación Española Primera en Salud. El estudio fue aprobado por las autoridades de ambas instituciones.
La recolección de datos se realizó mediante el estudio minucioso de historias clínicas de las pacientes diagnosticadas de CM HER 2 positivo en un periodo de 7 años. Se mantuvo el anonimato de las pacientes en el análisis estadístico y se consideraron las normas éticas establecidas en la Declaración de Helsinki de la Asociación Médica Mundial, atendiendo a su última enmienda de octubre de 2013.
Se recogieron variables relacionadas con las características basales de las pacientes: edad al diagnóstico y al inicio del tratamiento del TTZ, estadío (según el sistema TNM, 7ma. ed. 2010) y presencia de factores de riesgo cardiovascular: consumo de tabaco y/o alcohol, enfermedad cardíaca previa, dislipemia, hipertensión arterial, obesidad y sedentarismo. Variables relacionadas con el tratamiento: duración del mismo, esquema semanal o trisemanal, empleo de antraciclinas concurrente o secuencial y la exposición a radioterapia. Variables relacionadas con la seguridad del tratamiento: fracción de eyección del ventrículo izquierdo (FEVI) previa al inicio del tratamiento con TTZ y, una vez comenzado el mismo, en forma trimestral. Se tuvo en cuenta el método utilizado para valorar la FEVI (ecocardiograma, centellograma) así como si fue realizado por el mismo técnico, o no en los diferentes controles.
Se valoró la cardiotoxicidad de acuerdo con los criterios publicados y desarrollados por el Grupo de Investigación y Supervisión de TTZ. Ellos establecen que se está ante una toxicidad cardíaca si se cumple al menos uno de estos criterios: una disminución de la FEVI de por lo menos 5 % alcanzando una FEVI menor al 55 % coincidiendo con signos o síntomas de IC, o una disminución de la FEVI de por lo menos 10 % alcanzando una FEVI menor al 55 %, en ausencia de signos o síntomas de IC (24).
Para las pacientes que desarrollaron insuficiencia cardíaca sintomática, se utilizó la escala funcional de la NYHA (New York Heart Association) (25).
El análisis estadístico se realizó SPSS 15.0 para Windows y Epidat 3.1. Se utilizaron herramientas de estadística descriptiva, tales como distribución de frecuencias y medidas de resumen. Se aplicaron test de asociación para variables cualitativas: chi-cuadrado de Pearson, test exacto de Fisher, según cálculo de valores esperados. El nivel de significación utilizado fue del 5%. Se realizó estimación del riesgo a través del OR con su intervalo de confianza.
Resultados
El análisis incluyó 69 pacientes con diagnóstico de CM invasivo HER 2 positivas que recibieron TTZ; 13 pacientes (18,8%) en el Hospital de Clínicas y 56 pacientes (81,2%) en la Asociación Española.
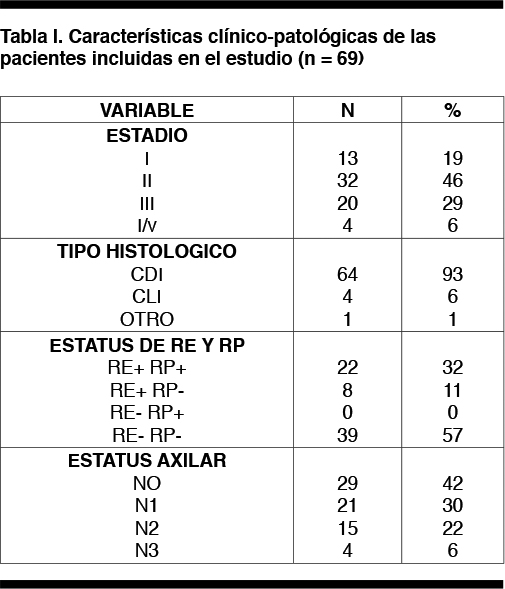
La edad media al diagnóstico fue 50,1 años (DS 12.5, rango 27-77 años). La distribución por estadios al momento del diagnóstico fue la siguiente: 13 pacientes (19%) fueron EI, 31 (46%) EII, 20 (29%) EIII y 4 (6%) E IV, siendo el CDI el tipo histológico más frecuente en 64 pacientes (93%). Treinta y nueve (57%) fueron receptor de estrógeno y progesterona negativos. Las características de las pacientes se muestran en la tabla 1.
Del total de las pacientes, 28 (40,5 %) presentaron algún factor de riesgo cardiovascular: 19 (27,5%) HTA; 12 (17,3%) tabaquismo; 11 (16%) obesidad; 4 (5,8%) dislipemia; 6 (8,6 %) sedentarismo; 1 (0,7 %) era portadora de cardiopatía isquémica, y ninguna paciente era alcoholista o portadora de insuficiencia cardíaca congestiva. Del total de pacientes portadoras de factores de riesgo cardiovascular, 16 (57 %) se encontraban en tratamiento farmacológico y 14 (50%) de ellas con buen control y seguimiento.
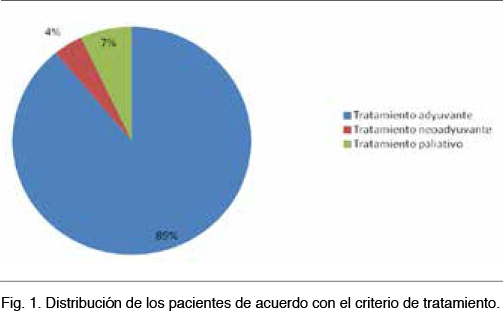
Del total de las pacientes estudiadas, 61 (89%) recibieron TTZ con criterio adyuvante, 3 (4%) como neoadyuvante, y 5 (7%) con criterio paliativo (Figura 1). La mayoría recibió tratamiento cada 21 días, el promedio de ciclos recibidos fue de 15. Cuarenta y dos pacientes (61%) recibieron previamente tratamiento con antraciclinas y 41 (59,4%) recibieron tratamiento con radioterapia adyuvante (Tabla 2).
Según los criterios desarrollados por el Grupo de Investigación y Supervisión de TTZ, 19 pacientes (27%) presentaron toxicidad cardíaca. La mediana de tiempo en la que se produjo la aparición de la toxicidad cardíaca fue de 9 meses desde el inicio del tratamiento.
Cinco de las pacientes que presentaron cardiotoxicidad (26%) desarrollaron insuficiencia cardíaca sintomática; el síntoma más frecuente manifestado fue disnea y no se produjo ninguna muerte por cardiotoxicidad. Según la escala funcional de la NYHA, 2 pacientes (10%) se catalogaron como de clase III, una (5%) clase II y en el resto no fue posible recoger el dato.
Las 14 pacientes restantes (74 %) tuvieron una disminución de la FEVI mayor o igual al 10%, alcanzando una FEVI menor al 55% sin desarrollar síntomas de IC.
La insuficiencia cardíaca desarrollada durante el tratamiento fue reversible en la mayoría de las pacientes.
De las 19 pacientes que presentaron cardiotoxicidad, en 6 (31%) se observó la existencia previa de algún factor de riesgo cardiovascular: obesidad, HTA, tabaquismo, sedentarismo y dislipemia. Dieciséis de las pacientes afectadas (84%) habían recibido tratamiento previo con antraciclinas y 11 (17%) recibieron tratamiento radiante a nivel de mama, pared torácica o territorio ganglionar izquierdo (Tabla 2).
De las 5 pacientes que desarrollaron cardiotoxicidad sintomática, ninguna presentaba factores de riesgo cardiovascular, pero todas habían recibido tratamiento con antraciclinas, y dos de ellas habían recibido radioterapia a nivel de mama, pared torácica o territorio ganglionar izquierdo.
Todas las pacientes que desarrollaron cardiotoxicidad recibieron tratamiento médico adecuado conducido por cardiólogo. De las 14 pacientes que desarrollaron cardiotoxicidad asintomática, 12 (85 %) suspendieron el tratamiento en forma transitoria retomando el mismo más adelante, y 2 (15%) lo hicieron en forma definitiva.
Al analizar por separado la influencia de factores predisponentes para presentar disfunción cardíaca, sólo el tratamiento con antraciclinas se asoció significativamente con el desarrollo de cardiotoxicidad (p=0,0143). El aumento del riesgo encontrado fue clínicamente significativo (OR= 4,92, IC 95%: 1,27- 19,0).
Discusión
La cardiotoxicidad relacionada con TTZ fue descrita inicialmente en mujeres con CM metastásico, con tasas de incidencia superiores cuando se administraba concurrentemente con antraciclinas. A partir de estos datos, con el fin de disminuir el desarrollo de la misma se desaconsejó la utilización concomitante de antraciclinas.
Posteriormente, en varios estudios clínicos (EC) en adyuvancia (NSABP B 31, NCCTGN 9831, BCIRG 006, HERA) (19, 26,27) se reportaron tasas de ICC asintomatica inferiores al 4 % que se consideraron aceptables, mientras que las tasas de toxicidad cardíaca sintomática reportadas varían desde 3,7% en el estudio HERA a 34 % en los estudios NSABP y NCCTG, producto tal vez de las diferencias en el diseño de los ensayos, el tipo de quimioterapia administrada y las distintas definiciones de eventos cardiacos. Sin embargo, la frecuencia de cardiotoxicidad entre la población de mujeres tratadas fuera de un estudio clínico no se conoce.
En el presente estudio, la frecuencia de cardiotoxicidad fue del 27% (IC 95 %: 16,27; 38,8), siendo similar a la reportada en la mayoría de los EC que oscila entre un 3,7 a un 34 %, según lo mencionado previamente. Catorce pacientes (20%) desarrolló toxicidad cardíaca asintomática, mientras que 5 (7 %) desarrollaron ICC sintomática; siendo esta última cifra algo superior a la reportada en la literatura (4 %), como fue comentado anteriormente.
Al igual que lo evidenciado en la literatura, la insuficiencia cardíaca desarrollada durante el tratamiento fue reversible para la mayoría de las pacientes.
Ninguna de las pacientes que desarrolló ICC sintomática presentaba factores de riesgo cardiovascular. Sin embargo, todas ellas habían recibido tratamiento con antraciclinas, lo que podría explicar la tasa más elevada de cardiotoxicidad.
Entre los factores de riesgo asociados al desarrollo de cardiotoxicidad durante el tratamiento con TTZ, se destacan como factores de riesgo independientes: la edad mayor a 50 años y la exposición previa a antraciclinas. En el presente estudio, la exposición previa a antraciclinas fue un factor de riesgo para el desarrollo de cardiotoxicidad, asociándose al desarrollo de la misma.
Dentro de las limitaciones de este estudio, deben mencionarse su carácter retrospectivo, el corto periodo de seguimiento y el bajo número de pacientes, como factores que le impiden tener potencia para poder obtener resultados significativos y conocer la cardiotoxicidad a largo plazo. Se debe tener en cuenta que la mayoría de los ecocardiogramas de seguimiento para una misma paciente fueron realizados por diferentes técnicos, siendo esta otra limitante, ya que es un estudio técnico dependiente.
Conclusiones
La frecuencia de cardiotoxicidad fue similar a la reportada en los EC que valoran el beneficio del TTZ en adyuvancia. En la mayoría de las pacientes la misma fue asintomática y revirtió con la suspensión transitoria de TTZ. Por otra parte, en la mayoría de las pacientes que desarrollaron insuficiencia cardíaca asintomática, revirtió con la suspensión de TTZ y el tratamiento médico conducido por cardiólogo. Se destaca como factor de riesgo para el desarrollo de cardiotoxicidad, la exposición previa al tratamiento con antraciclinas, lo que es coincidente con lo reportado en los EC que emplean TTZ en el tratamiento sistémico adyuvante.
Agradecimientos
Para el reclutamiento se contó con el apoyo del sector de archivo médico de CENDyTMA de la Asociación Española, del Hospital de Clínicas y en particular del registro informático de la UDA de Mastología de dicho Hospital. Para el análisis de los datos, con el apoyo de Alejandro Noria del Servicio de Coordinación de Investigación y Enseñanza del Hospital de Clínicas. Se agradece al Prof. Dr.Tabaré Vazquez, ex Director de los Servicios Oncológicos de la Asociación Española Primera en Salud, por permitirnos realizar el trabajo en los servicios bajo su dirección.
Bibliografía
1) Muñoz MJ. Impacto del cáncer de mama en Uruguay: período 2006-2010. Tend med. 2013; 21:133-135.
2) Comisión Honoraria de Lucha contra el Cáncer. Programa Vigilancia Epidemiológica. Registro Nacional de Cáncer. Informe Anual periodo 2006-2010. Disponible en http://www.comisioncancer.org.uy/uc_357_1.html (consulta 10/08/2014)
3) Chang J, Hilsenbeck S. Marcores de pronostico y de predicción. En: Harris JR, Lippman ME, Morrow M, Osborne CK. Enfermedades de la mama . 4 ed. Madrid: Lippincott Williams & Wilkins, 2011. p. 444-458.
4) Vázquez T, Krygier G, Barrios E, Cataldi S, Vázquez A, Alonso R ,et al. Análisis de sobrevida de una población con cáncer de mama y su relación con factores pronósticos: estudio de 1.311 pacientes seguidas durante 230 meses. Rev Med Urug. 2005; 21: 107-12.
5) Delgado L, Fresco R, Santander G, Aguiar S, Camejo N, Ferrero L et al. Expresión tumoral de HER-2, Receptores de Estrógenos y de Progesterona y su relación con características clínico-patológicas en pacientes uruguayas con cáncer de mama. Rev Med
6) Conzen SD, Grushko TA, Olopade OI. Cancer of the breast. En: De Vita, Hellman and Rosenberg (eds). Cancer principles and practice of oncology. 8º ed.
7) Nielsen DL, Andersson M, Kamby C. HER2-targeted therapy in breast cancer. Monoclonal antibodies and tyrosine kinase inhibitors. Cancer Treat Rev. 2009;35:121-3
8) Dawood S, Broglio K, Buzdar AU, Hortobagyi GN, Giordano SH. Prognosis of women with metastatic breast cancer by HER2 status and trastuzumab treatment: an institutional-based review. J Clin Oncol 2010; 28:92-98.
9) Castillo C, Camejo N, Delgado L, Fresco R, Santander G ,Aguiar S et al. Análisis de sobrevida según perfil biológico de pacientes uruguayas con cáncer de mama. Rev Med Urug. 2012;28:241-249
10) Baselga J, Cortés J, Kim SB, Im SA, Hegg R, Im YH, et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. N Engl J Med 2012; 366:109-19.
11) Kaufman B, Mackey JR, Clemens MR, Bapsy PP, Vaid A, Wardley, A et al. Trastuzumab plus anastrozole versus anastrozole alone for the treatment of postmenopausal women with human epidermal growth factor receptor 2-positive, hormone receptor-positive metastatic breast cancer: results from the randomized phase III TAnDEM study. J Clin Oncol 2009; 27:5529-37.
12) Slamon DJ, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A, et al. N Engl J Med 2001; 344:783-92.
13) Petrelli F, Borgonovo K, Cabiddu M,Ghilardi M, Barni S.Neoadjuvant chemotherapy and concomitant trastuzumab in breast cancer: a pooled analysis of two randomized trials. Anticancer Drugs 2011; 22:128-35.
14) McKeage K, Perry CM. Trastuzumab: a review of its use in the treatment of metastatic breast cancer overexpressing HER2. Drugs 2002; 62:209-43.
15) Harris CA, Ward RL, Dobbins TA, Drew AK, Pearson S. The efficacy of HER2-targeted agents in metastatic breast cancer: a meta-analysis. Ann Oncol 2011; 22:1308-17.
16) Slamon D, Eiermann W, Robert N, Pienkowski T, Martin M, Press M, et al. Adjuvant Trastuzumab in HER 2 positive Breast Cancer. N. Eng J Med 2011; 365:1273.
17) Gianni L, Dafni U,
18) Hudis CA. Trastuzumab: mechanism of action and use in clinical practice. N Engl J Med. 2007; 357: 39-51.
19) Viani GA, Afonso SL, Stefano EJ, De Fendi LI, Soares FV. Adjuvant trastuzumab in the treatment of her-2-positive early breast cancer: a meta-analysis of published randomized trials. BMC Cancer. 2007; 7:153.
20) Yavas O, Yazici M, Eren O, Oyan B. The acute effect of Trastuzumab infusion on ECG parameters in metastatic breast cancer patients. Swiss Med Wkly. 2007; 137:556-8.
21) Ewer MS, Gibbs HR, Swafford J, Benjamin RS. Cardiotoxicity in patients receiving transtuzumab (Herceptin): primary toxicity, synergistic or sequential stress, or surveillance artifact? Semin Oncol. 1999; 26:96-101.
22) Floyd JD, Nguyen DT, Lobins RL, Basir Q, Doll DC, Perry MC. Cardiotoxicity of cancer therapy. J Clin Oncol. 2005; 23: 7685-96.
23) Curigliano G, Cardinale D, Suter T, Plataniotis G, de Azambuja E, Sandri MT, et al. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines. Ann Oncol. 2012; 23 Suppl 7:vii155-66.
24) The Criteria Committee of the
25) Perez EA, Romond EH, Suman VJ, Jeong JH,
26) Procter M, Suter TM, de Azambuja E, Dafni U, van Dooren V, Muehlbauer S et al. Longer-term assessment of trastuzumab-related cardiac adverse events in the Herceptin Adjuvant (HERA) trial. J Clin Oncol 2010; 28:3422-3428.
27) Smith I, Procter M,