Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Medicina Interna
versión impresa ISSN 0250-3816versión On-line ISSN 1688-423X
Arch. Med Int vol.37 no. 2 Montevideo jul. 2015
ARCHIVOS DEL INSTITUTO DE NEUROLOGÍA
Topiramato en el tratamiento preventivo de la migraña: experiencia en una policlínica neuropediátrica
Topiramate for the prevention of migraine
Experience at a Child Neurology Clinic
Dr. Conrado Medici
Profesor Adjunto de Neuropediatría. Cátedra de Neuropediatría. Centro Hospitalario Pereira Rossell, Montevideo, Uruguay
Dra. Valeria Fraga
Profesora Adjunta de Neuropediatría. Cátedra de Neuropediatría. Centro Hospitalario Pereira Rossell, Montevideo, Uruguay
Dra. Andrea Rey
Profesora Agregada de Neuropediatría. Cátedra de Neuropediatría. Centro Hospitalario Pereira Rossell, Montevideo, Uruguay
Dra. Eugenia Chaibún
Residente de Neuropediatría. Cátedra de Neuropediatría. Centro Hospitalario Pereira Rossell, Montevideo, Uruguay
Dra. Andrea Taranto
Postgrado de Neuropediatría. Cátedra de Neuropediatría. Centro Hospitalario Pereira Rossell, Montevideo, Uruguay
Dr. Diego Costales
Residente de Neuropediatría. Cátedra de Neuropediatría. Centro Hospitalario Pereira Rossell, Montevideo, Uruguay
Dra. Virginia Pedemonte
Asistente de Neuropediatría. Cátedra de Neuropediatría. Centro Hospitalario Pereira Rossell, Montevideo, Uruguay
Dr. Gabriel González
Profesor de Neuropediatría. Cátedra de Neuropediatría. Centro Hospitalario Pereira Rossell, Montevideo, Uruguay
Recibido: 19/06/15 - Aceptado: 05/07/15
Correspondencia: Dr. Conrado Medici, Bulevar Artigas 1550, 27093597, 270. Correo electrónico: conrado.medici@gmail.com
Resumen: Arch Med Interna 37(2): 94-97
La migraña es la cefalea primaria más frecuente en la infancia y su incidencia aumenta con la edad. Su tratamiento incluye conocer los factores desencadenantes, ajustes en el estilo de vida, manejo de los episodios de cefalea y en algunos casos medicación preventiva. El Topiramato ha mostrado ser eficaz como tratamiento preventivo. El objetivo de este trabajo fue evaluar la respuesta y la seguridad al tratamiento preventivo con Topiramato en pacientes pediátricos. Estudio prospectivo, realizado entre el 01/04/2008 y el 31/10/2013. Se confeccionó un protocolo de estudio, diagnóstico y seguimiento. Se utilizó Topiramato en pacientes con más de 3 episodios de migraña al mes, considerando buena respuesta la reducción mayor al 50% de los mismos. 190 pacientes consultaron por cefaleas. Un 63.9% presentaban migraña. Un 48% fue tratado con Topiramato, siendo eficaz en un 89.6%. En 2 pacientes no hubo respuesta y en 4 se discontinuó por empeoramiento o efectos secundarios que desaparecieron al discontinuarlo. En conclusión el Topiramato es eficaz y seguro en el tratamiento de la migraña en pediatría.
Palabras clave: Cefalea, Migraña, Topiramato.
Abstract: Arch Med Interna 37(2): 94-97
Migraine is the most frequent primary headache in pediatric population, and incidence increases with age. Treatment includes know precipitating factors, changes in life style, acute headaches treatment and in some cases preventive medications. Topiramate has proven efficacy in preventive treatment. The objective of this work was to assess response and safety of Topiramate for migraine in a pediatric population. We made a prospective study, between 04/01/2008 to 10/31/2013. Topiramate was started in patients with 3 or more headache episodes per month and effectiveness was considered when a 50% or more reduction in episodes occurred. 190 patients consulted in this period. 63.9% had migraine. 48% were treated with Topiramate, being effective in 89.6% of patients. In 2 patients there was no response to treatment and in 4 patients treatment was discontinued due to worsening of headaches or secondary effects that disappeared after treatment discontinuation. In conclusion Topiramate is effective and secure for migraine preventive treatment in pediatric population.
Keywords: Headaches, Migraine, Topiramate
Introducción
Las cefaleas constituyen un síntoma de consulta frecuente en pediatría y provocan ansiedad en el paciente y en el grupo familiar, determinando consultas tanto en emergencia como en policlínica. Es el síntoma neurológico más frecuente (1). La prevalencia de las cefaleas es de hasta un 50% en niños y aumenta gradualmente hasta un 80% en adolescentes(2,3). Las cefaleas pueden ser una patología invalidante, impactando en la calidad de vida de los pacientes, determinando problemas atencionales y ausentismo escolar, lo que puede reducir el rendimiento académico(1,4,5).
El gold standard para el diagnóstico del tipo de cefaleas es la historia clínica con una anamnesis exhaustiva que determine sus características principales. Las cefaleas se clasifican según la Clasificación Internacional de las Cefaleas (ICHD) de la International Headache Society (IHS)(3), cuya última versión es la tercera edición(6).
La migraña es el tipo más frecuente de cefalea primaria en la infancia, su incidencia aumenta con la edad ocurriendo en un 1 a 3% de los preescolares, 11% entre los 5 y 15 años y 28% entre 15 y 19 años(3,4,7,8). El diagnóstico y tratamiento adecuado de la migraña es esencial. Hasta un 25% de los pacientes migrañosos son candidatos a tratamiento preventivo, el cual esta indicado frente a la elevada frecuencia de los episodios, a la severidad de los mismos, a la falta de respuesta a los tratamientos abortivos y frente a episodios de inicio súbito(9). Su objetivo es reducir la frecuencia, severidad y los disturbios producidos por las cefaleas(8). El efecto puede durar meses en aparecer y se considera eficaz si se reducen por lo menos un 50% de la frecuencia mensual de cefaleas(9). El tratamiento preventivo incluye determinar los factores desencadenantes, ajustes en el estilo de vida, manejo apropiado de los episodios de cefalea y en caso necesario el uso de medicación preventiva(10). Los niños se benefician de los tratamientos no farmacológicos como ejercicio físico aeróbico regular, dormir en forma adecuada, modificaciones de la dieta tanto en calidad como en cantidad evitando ayunos prolongados, limitación en la ingesta de cafeína y analgésicos y manejo del estrés(8). Dentro del tratamiento farmacológico se pueden utilizar los Beta bloqueantes como el Propranolol o el Metoprolol, calcio antagonistas como la Flunarizina o el Verapamil, antiepilépticos como el Ácido Valproico y el Topiramato (TPM) o antidepresivos(3,8-11). Otros tratamientos como la acupuntura, la riboflavina y la coenzima Q10 han sido descritos con resultados diversos(3,8,9,12).
El objetivo de este trabajo fue evaluar la respuesta y el perfil de seguridad al tratamiento preventivo con TPM en pacientes con migraña que consultan en la policlínica de cefaleas de la Cátedra de Neuropediatría del Centro Hospitalario Pereira Rossell.
Material y métodos
Estudio prospectivo, descriptivo, realizado en la policlínica especializada de cefaleas del Servicio de Neuropediatría de la Facultad de Medicina, Universidad de la República (UdelaR), Centro Hospitalario Pereira Rossell (CHPR), Montevideo, Uruguay, realizado entre el 1º de abril del 2008 al 31 de octubre del 2013.
Se incluyeron los pacientes de hasta 15 años con migraña con y sin aura diagnosticados en base a la ICHD, segunda edición(13). Se confeccionó un Protocolo de estudio, diagnóstico y seguimiento. Se utilizó un diario de cefaleas para determinar la evolución de las mismas y la respuesta al tratamiento.
Se realizó tratamiento preventivo con TPM a los pacientes con migraña con más de 3 episodios por mes. El tratamiento se comenzó con 0,5 mg/kg/día en 2 dosis diarias aumentando lentamente hasta llegar a 1 mg/kg/día, frente a una respuesta insuficiente se aumentó hasta un máximo de 2 mg/kg/día, no pasando en ningún caso los 100 mg/día. Se consideró buena respuesta al tratamiento la reducción mayor a un 50% en el número de episodios. Se interrogó al paciente y a la familia sobre la presencia de efectos adversos.
Los datos fueron analizados utilizando el programa estadístico SPSS 19. Para definir si existe una diferencia estadísticamente significativa en la respuesta al tratamiento con TPM se usó el test de chi-cuadrado, se consideró estadísticamente significativa una p menor a 0,05.
Resultados
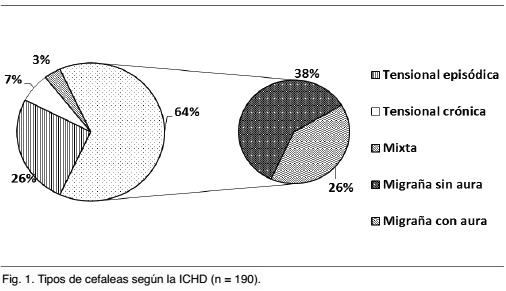
En este período 190 pacientes consultaron por cefaleas primarias, de los cuales un 63,9% (n = 121) cumplían criterio de migraña. La Gráfica 1 muestra la distribución del tipo de cefaleas clasificadas según la ICHD.
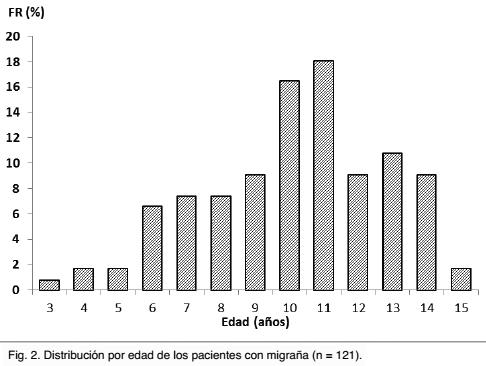
La migraña fue más frecuente en el sexo femenino (60%, n = 73), siendo esta diferencia estadísticamente significativa (Chi-cuadrado p 0,023). La media de edad de los niños con migraña fue de 9,63 ± 2,78 años (rango 3 a 15 años), siendo para los varones de 9,5 ± 2,6 años y para las niñas de 9,78 ± 2,9 años. La Gráfica 2 muestra la distribución por edad de los pacientes.
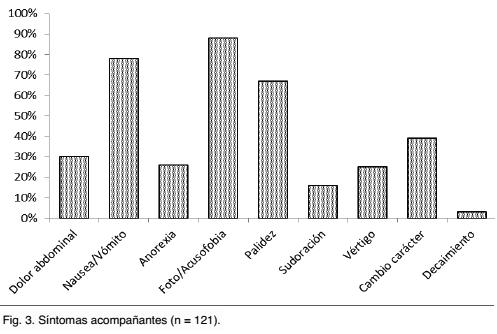
Un 66% de los niños con migraña tenían antecedente familiar de migraña. En un 80% se encontraron factores desencadenantes de las cefaleas, siendo los mismos: estrés (47%), ejercicio físico (34%), alimentos (20%), exposición solar (38%), falta de sueño (8%) y en un 9% de las niñas se vinculó con el ciclo menstrual. Las cefaleas fueron predominantemente pulsátiles (60%), intensas (76%), localizadas más frecuentemente a nivel frontal (53%) tanto unilateral como bilateral, retroocular (12%) y holocraneana (11%), y de horas de duración (88%). Todos los pacientes presentaron síntomas acompañantes, siendo los más frecuentes la foto y/o acusofobia (88%), las náuseas y/o vómitos (78%) y la palidez (67%). La gráfica 3 muestra la distribución de los mismos.
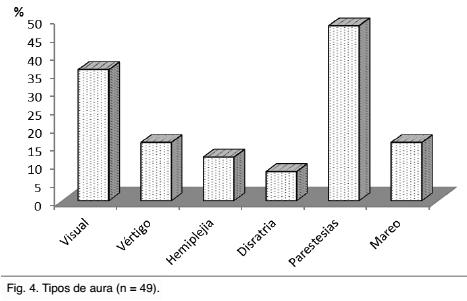
Un 40% (n = 49) de los pacientes con migraña presentaban migraña con aura. La Gráfica 4 muestra la incidencia de los diferentes tipos de aura referidos por los pacientes.
Un 48% de los pacientes con migraña (n = 58) fueron tratados con TPM. En un pequeño grupo de pacientes se optó por usar tratamiento preventivo con Di valproato de sodio (n = 3) o con Amitriptilina (n = 4) dado la presencia de comorbilidad psiquiátrica o por asociar epilepsia. El TPM fue eficaz en un 89,6% (n = 52) de los pacientes, lo que fue estadísticamente significativo (Chi-cuadrado p < 0,001). En 2 pacientes no hubo respuesta al tratamiento y en 4 se debió suspender por efectos secundarios (gastrointestinales, fatiga, debilidad muscular, trastornos mnésicos, dificultad en la evocación de palabras). Los efectos adversos revirtieron con la suspensión del tratamiento. Si bien los pacientes no fueron pesados sistemáticamente, un 10% refirió un discreto descenso de peso, pero que no requirió suspensión del tratamiento. Destacamos que en los casos en que el tratamiento fue eficaz el mismo se prolongó durante 6 a 12 meses, siendo luego suspendido, con buena evolución.
Discusión y comentarios
La migraña sin aura fue el tipo de cefalea más frecuente, lo que coincide con los datos de la literatura(4,14). La migraña fue más frecuente en las mujeres que en los varones, no existiendo diferencias en el promedio de edad entre ambos sexos. Estudios epidemiológicos muestran que la migraña predomina en varones antes de los 12 años y en mujeres a partir de esa edad(3,4,7,8).
Los pacientes con migraña presentaron en un 66% antecedente familiar de migraña, al igual que en la bibliografía, donde el antecedente familiar se presenta en un 26-90%(14-16). Como ya ha sido descripto previamente, los pacientes con migraña presentaron más frecuentemente cefaleas unilaterales, retroorbitarias, pulsátiles e intensas, acompañadas de náuseas / vómitos y fotofobia / acusofobia y palidez(14). El estrés fue el principal factor desencadenante, al igual que en otras series(17). En los pacientes con migraña el ejercicio, la exposición solar y los alimentos fueron otros factores desencadenantes frecuentemente encontrados(14). En 20% de los pacientes con migraña no se encontraron factores desencadenantes. En la literatura los desencadenantes más frecuentes son el estrés, la deprivación de sueño, el uso de videojuegos, la exposición solar, las luces y los sonidos, el ejercicio, el ayuno y alimentos como bebidas cola y chocolate(8,14,17).
El tratamiento preventivo con TPM resultó eficaz en un 89.6% de los niños, no fue eficaz en 2 niños y en 4 se debió suspender por efectos secundarios que revirtieron con la suspensión. Se observó un discreto descenso de peso en un 10% de los niños que no requirió suspensión del tratamiento. El TPM es un fármaco antiepiléptico que ha demostrado, tanto en adultos como en niños, ser eficaz para el tratamiento de las migrañas, determinando una reducción de la frecuencia, severidad y duración de las cefaleas, y mejoría en los escores de discapacidad(7,18-20). En adultos los metaanálisis Cochrane mostraron que es eficaz y seguro como tratamiento profiláctico de la migraña episódica(21). La FDA aprobó su uso para la migraña en adolescentes de 12 a 17 años(22). Se plantea que juega un rol en la regulación autonómica cerebrovascular(23). Los trabajos muestran que es seguro y bien tolerado, sin evidenciar efectos adversos severos y no se ha demostrado una reducción de peso significativa(7,18). Su eficacia y seguridad es similar a la de la flunarizina y el propanolol, otros dos fármacos que se usan de primera línea en el tratamiento de la migraña(24,25). La dosis de TPM que ha mostrado ser eficaz como tratamiento preventivo tanto en niños como en adultos, con escasos efectos adversos es hasta 100mg al día, ya que dosis superiores no han mostrado mejoría en la respuesta existiendo mayor riesgo de efectos adversos y abandono del tratamiento(7,25-29). Dentro de los efectos adversos del TPM los más frecuentes son las infecciones respiratorias altas, dolor abdominal, mareos y parestesias que se observan hasta en un 51% de los pacientes(7,29). La mayoría de los efectos adversos se observan en los 2 primeros meses de inicio del tratamiento y para evitar su aparición se debe realizar su titulación en forma lenta(9,29). Si bien ha sido demostrado en pacientes epilépticos que el TPM a 400 mg al día produce un enlentecimiento en la velocidad de procesamiento mental y de la fluencia verbal, esto no ha sido encontrado en los pacientes con tratamiento profiláctico para la cefalea, probablemente debido a que las dosis son más bajas y que la titulación es más lenta(29). En algunos trabajos han sido descriptos dificultad en la atención, en la memoria y en el pensamiento, pero sin haberse realizado evaluaciones neuropsicológicas formales(18). Respecto de los posibles efectos secundarios urinarios, se ha visto que la frecuencia de cálculos urinarios en los pacientes con migraña es mayor que en la población general, independiente del tratamiento con TPM(30). En nuestros pacientes el tratamiento preventivo se continuó durante 6 a 12 meses. En la literatura no está claro cuánto tiempo se debería continuar ya que se ha visto que la suspensión luego de 6 meses de tratamiento puede determinar un aumento en el número de días con migraña, en el uso de medicamentos abortivos y una disminución en la calidad de vida de los paciente(31).
En conclusión el TPM es un fármaco seguro y eficaz en el tratamiento de la migraña en niños.
Bibliografía
1. Kernick D, Reinhold D, Campbell J L. Impact of headache on young people in a school population. Br J Gen Pract 2009;59:678-81.
2. Lewis D W. Pediatric migraine. Neurol Clin 2009;27:481-501.
3. Hershey A D, Winner P K. Pediatric migraine: recognition and treatment. J Am Osteopath Assoc 2005;105:2S-8S.
4. Abu-Arefeh I, Russell G. Prevalence of headache and migraine in schoolchildren. BMJ 1994;309:765-9.
5. Powers SW, Patton SR, Hommel KA, Hershey AD. Quality of life in childhood migraines: clinical impact and comparison to other chronic illnesses. Pediatrics 2003;112:e1-5.
6. Headache Classification Committee of the International Headache Society (IHS). The International Classification of Headaches Disorders, 3rd edition (beta version). Cephalalgia 2013;33:629-808
7. Lewis D, Winner P, Saper J, Ness S, Polverejan E, Wang S, et al. Randomized, double-blind, placebo-controlled study to evaluate the efficacy and safety of topiramate for migraine prevention in pediatric subjects 12 to 17 years of age. Pediatrics 2009;123:924-34.
8. Lewis D W, Yonker M, Winner P, Sowell M. The treatment of pediatric migraine. Pediatr Ann 2005;34:448-60.
9. Schurks M, Diener H C, Goadsby P. Update on the prophylaxis of migraine. Curr Treat Options Neurol 2008;10:20-9.
10. Wasiewski W W. Preventive therapy in pediatric migraine. J Child Neurol 2001;16:71-8.
11. Lewis D W, Winner P. The pharmacological treatment options for pediatric migraine: an evidence-based appraisal. Neuro Rx 2006;3:181-91.
12. Schiapparelli P, Allais G, Castagnoli Gabellari I, Rolando S, Terzi M G, Benedetto C. Non-pharmacological approach to migraine prophylaxis: part II. Neurol Sci 2010;31 Suppl 1:S137-9.
13. Headache Classification Subcommittee of the International Headache Society. The International Classification of Headache Disorders: 2nd edition. Cephalalgia 2004;24 Suppl 1:9-160.
14. Unalp A, Dirik E, Kurul S. Prevalence and clinical findings of migraine and tension-type headache in adolescents. Pediatr Int 2007;49:943-9.
15. Gupta R, Bhatia M S. Comparison of clinical characteristics of migraine and tension type headache. Indian J Psychiatry 2011;53:134-9.
16. Di Blasi A, Arroyo H, Fejerman N. Cefaleas y migrañas. En: Fejerman N.Fernández Alvarez E, editores. Neurología Pediátrica,
17. Neut D, Fily A, Cuvellier J C, Vallee L. The prevalence of triggers in paediatric migraine: a questionnaire study in 102 children and adolescents. J Headache Pain 2012;13:61-5.
18. Hershey A D, Powers S W, Vockell A L, LeCates S, Kabbouche M. Effectiveness of topiramate in the prevention of childhood headaches. Headache 2002;42:810-8.
19. Deaton TL, Mauro LS. Topiramate for migraine prophylaxis in pediatric patients. Ann Pharmacother 2014;48:638-43.
20. Fallah R, Akhavan Karbasi S, Shajari A, Fromandi M. The efficacy and safety of topiramate for prophylaxis of migraine in children.
21. Mulleners WM,
22. FDA News release [en línea]. Silver Spring:
23. Karadas O, Gul HL, Ozturk B, Eroglu E, Demirkaya S. The effects of topiramate therapy on cerebral metabolism in migraine with aura patients. Turk Neurosurg 2014;24:704-9
24. Kim H, Byun SH, Kim JS, Lim BC, Chae JH, Choi J, et al. Comparison of flunarizine and topiramate for the prophylaxis of pediatric migraine. Eur J Pediatr Neurol 2013;17:45-9
25. Diener H C, Tfelt-Hansen P, Dahlof C, Lainez M J, Sandrini G, Wang S J, et al. Topiramate in migraine prophylaxis--results from a placebo-controlled trial with propranolol as an active control. J Neurol 2004;251:943-50.
26. Bussone G, Diener H C, Pfeil J, Schwalen S. Topiramate 100 mg/day in migraine prevention: a pooled analysis of double-blind randomised controlled trials. Int J Clin Pract 2005;59:961-8.
27. Brandes J L, Saper J R, Diamond M, Couch J R, Lewis D W, Schmitt J, et al. Topiramate for migraine prevention: a randomized controlled trial. JAMA 2004;291:965-73.
28. Winner P, Pearlman E M, Linder S L, Jordan D M, Fisher A C, Hulihan J. Topiramate for migraine prevention in children: a randomized, double-blind, placebo-controlled trial. Headache 2005;45:1304-12.
29. Silberstein S D. Topiramate in migraine prevention. Headache 2005;45 Suppl 1:S57-65.
30. Tsai MJ,
31. Diener H C, Agosti R, Allais G, Bergmans P, Bussone G, Davies B, et al. Cessation versus continuation of 6-month migraine preventive therapy with topiramate (PROMPT): a randomised, double-blind, placebo-controlled trial. Lancet Neurol 2007;6:1054-62.