Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Medicina Interna
versión impresa ISSN 0250-3816versión On-line ISSN 1688-423X
Arch. Med Int vol.36 no. 3 Montevideo nov. 2014
ARCHIVOS DEL INSTITUTO DE NEUROLOGÍA
Estudio de una cohorte uruguaya de pacientes portadores de Glioblastoma tratados con radioterapia y Temozolamida
Analysis of a Uruguayan cohort of patients with Glioblastoma treated with radiotherapy and Temozalamide
Dra. Natalia Piñeiro
Médico especialista en Medicina Interna.
Ex Asistente de Clínica Medica 2.
Médico Asistente del Fondo Nacional de Recursos. Montevideo.
Dr. Abayubá Perna
Profesor Adjunto de Neurología. Instituto de Neurología
Asesor Bioestadístico del Fondo Nacional de Recursos. Montevideo.
Lic. Marcela Baldizzoni
Especialista en Gestión de Servicios de Salud.
Especialista en Gestión de Calidad UNIT. Especialista en Cuidados Intensivos e Intermedios.
Especialista en Control de Infecciones Intrahospitalarias. Lic. en Enfermería del Fondo Nacional de Recursos. Montevideo.
Dr. Fernando Correa
Médico Especialista en Medicina Interna y Hematología. Profesor
Agregado de Clínica Médica. Facultad de Medicina UdelaR. Médico Asistente del Fondo Nacional de Recursos. Montevideo.
Resumen:
Objetivos: conocer la sobrevida a dos años de pacientes con diagnóstico de Glioblastoma multiforme (GBM) tratados con Temozolamida con cobertura del Fondo Nacional de Recursos (FNR), evaluar la seguridad del tratamiento y los factores pronósticos. Metodología: cohorte de pacientes portadores de GBM, tratados con Temozolamida entre mayo de 2009 y diciembre 2011. Fuente de información: base de datos del FNR. Resultados: Se incluyeron 81 pacientes. La mediana de sobrevida global fue de 18 meses. Vivos a dos años: 33% de los pacientes. El análisis multivariado encontró a la edad y al peor estado funcional del paciente como los factores de riesgo para mortalidad. 8 pacientes tuvieron efectos adversos severos. Discusión: Se presentan los primeros resultados nacionales vinculados al tratamiento combinado de los GBM. La sobrevida fue similar a la reportada en los estudios de referencia internacionales y mayor que la descripta para el tratamiento radiante exclusivo. El beneficio es mayor en aquellos pacientes jóvenes con buena capacidad funcional previa al inicio del tratamiento. Su seguridad fue considerada como aceptable.
Palabras clave: Glioblastoma multiforme, Temozolamida.
Abstract:
Objectives: find out the two-year survival of patients diagnosed with Multiform Glioblastoma (MGB) treated with Temozolamide funded by the National Resource Fund (FNR), and evaluate the safety of therapy and prognostic factors. Methodology: cohort of patients with MGB, treated with Temozolamide between May 2009 and December 2011. Data source: database of the FNR. Results: the 81 patients included had a median overall survival of 18 months; 33% of them were still alive at two years. The multivariate analysis found that the patient’s age and functional status were the risk factors for mortality. Eight patients had severe adverse effects. Discussion: Presentation of the first national results related to the combined therapy of MGB. Survival was similar to that reported in the international reference studies and greater than that described for radiation therapy alone. Benefits were greater in young patients presenting with a good functional capacity before starting therapy. The safety of therapy was deemed acceptable.
Keywords: Multiform glioblastoma, Temozolamide.
Introducción
Los tumores malignos primarios del sistema nervioso central (SNC) constituyen un grupo heterogéneo de tumores, de los cuales el glioblastoma multiforme (GBM), (Grado IV de la clasificación de la OMS), es el más frecuente y también el más agresivo en la población adulta.
La incidencia de los tumores primarios del SNC se ha incrementado en nuestro país en las últimas tres décadas; según datos aportados por la Comisión Honoraria de Lucha Contra el Cáncer, anualmente se diagnostican aproximadamente 200 casos nuevos y fallecen aproximadamente 160. De acuerdo a estadísticas internacionales entre un 10 y 20% corresponden a GBM no existiendo en nuestro país datos vinculados a él.
El tratamiento actual no es curativo y la estrategia terapéutica consiste en su máxima resección continuando con radioterapia más quimioterapia con criterio paliativo.(1,2,3)
El pronóstico es pobre, siendo la sobrevida mediana, con cirugía exclusiva de aproximadamente cuatro meses; la radioterapia postoperatoria permite prolongar significativamente la sobrevida a un año. (4,5)
En el año 2005 fue publicado el primer estudio fase III (EORTC-NCIC trial) que evidenció un beneficio adicional en la sobrevida a dos años, utilizando como tratamiento Temozolamida además de la radioterapia y la cirugía.(6,7)
En los últimos años, el FNR ha incorporado a su cobertura financiera medicamentos de alto costo como la Temozolamida para el tratamiento de tumores del SNC.(8)
La Temozolamida es un agente alquilante, antineoplásico, derivado de la dacarbazina; aprobado por la FDA (Food and Drug Administration)(9) y la EMEA(10) (Agencia Europea de Medicamentos) para el tratamiento de pacientes con glioblastoma multiforme de nuevo diagnóstico concomitante con radioterapia (RT) y posteriormente como tratamiento en monoterapia.
El protocolo de tratamiento consiste, en una primera etapa de 42 días de Temozolamida (a una dosis de 75 mg/m2) concurrente con radioterapia (60 Gy administradas en 30 fracciones). Durante esta etapa se requiere profilaxis para neumonía por Neumocystis Jiroveci. La etapa de mantenimiento se inicia cuatro semanas luego de completado el tratamiento concurrente y consiste en 6 ciclos de tratamiento con temozolamida administrados cada 28 días. En el primer ciclo se utiliza una dosis de 150 mg/m2/día durante cinco días. Si esta dosis se tolera bien desde el 2° al 6° ciclo se utiliza una dosis de 200 mg/m2/día durante cinco días.
Los eventos adversos más frecuentes son digestivos e incluyen anorexia, constipación, náuseas, vómitos, y hematológicos como linfopenia, neutropenia, trombocitopenia.
Objetivos
Conocer la sobrevida a dos años de los pacientes con diagnóstico de GBM con cobertura del FNR tratados con temozolamida, evaluar la seguridad del tratamiento y analizar posibles factores pronósticos vinculados a este tipo de tumor.
Material y métodos
Se realizó un estudio observacional, retrospectivo, descriptivo, de una cohorte histórica de pacientes, tratados con temozolamida con cobertura por el FNR.
Se incluyeron todos los pacientes que iniciaron el tratamiento con quimioterapia con Temozolamida y radioterapia entre mayo de 2009 y diciembre de 2011.
Los criterios de inclusión fueron contar con diagnóstico histopatológico de glioblastoma multiforme, con exéresis quirúrgica o biopsia previa e indicación de radioterapia más quimioterapia postoperatoria.
Los criterios de exclusión fueron pobre expectativa de vida por otras situaciones comórbidas, enfermedades psiquiátricas severas, hepatopatía, leucopenia y/o plaquetopenia previo al inicio del tratamiento, creatinina mayor a 1,5 veces el valor normal, embarazo y lactancia.
Se analizó la sobrevida utilizando como fecha de corte junio de 2012.
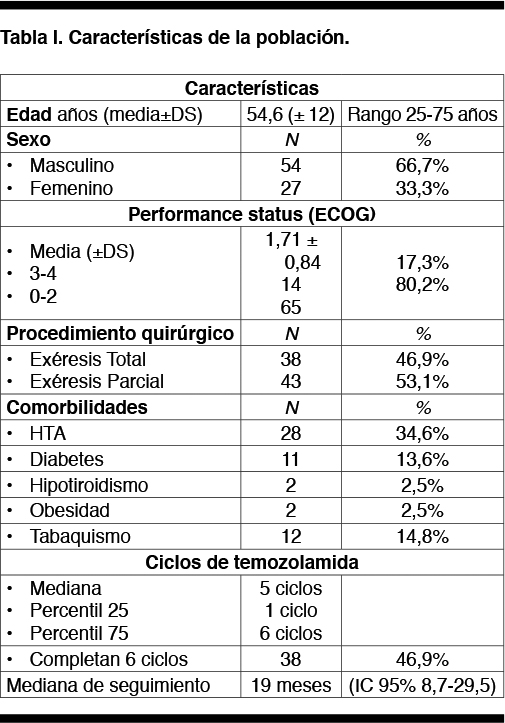
Las variables utilizadas para describir a la población fueron la edad, el género, el performance status ECOG, (The Eastern Europen Oncology Group) al inicio del tratamiento concurrente, presencia de comorbilidades (hipertensión, diabetes, tabaquismo, hipotiroidismo, obesidad), procedimiento quirúrgico (exéresis total o parcial).
El ECOG es una escala que evalúa la capacidad funcional del paciente con un rango de 0 a 5 correspondiendo 0 a una actividad normal y 5 a la muerte.
Se estratificó a la población en dos grupos acorde a su performance status ECOG entre 0 y 2, y entre 3 y 4 y según la extensión de la cirugía (resección total o parcial); se analizó la sobrevida en los diferentes estratos.
Las variables analizadas en relación al tratamiento fueron la mediana de ciclos de temozolamida recibidos, la sobrevida y la seguridad del mismo.
La seguridad del tratamiento se evaluó mediante el reporte de eventos adversos realizado durante el seguimiento utilizándose las definiciones del CTCAE (Common Terminology Criteria for Adverse Events).
Se utilizó como fuentes de información la base de datos del FNR la cual incluye los formularios de solicitudes con datos aportados por los médicos tratantes y formularios de seguimiento con datos obtenidos de los reportes de los pacientes y familiares durante el seguimiento telefónico y presencial.
Los datos de las muertes se obtuvieron de la información del registro de fallecimientos del Ministerio de Salud Pública, del registro de fallecimientos del sistema de seguridad social, de la información reportada por los oncólogos tratantes y del seguimiento telefónico.
Análisis Estadístico
Para la descripción de la población se utilizaron proporciones, media, desvío estándar, mediana (con sus intervalos de confianza al 95%) y rango.
Para el análisis de sobrevida, se realizó en primera instancia un análisis bivariado por el método de Kaplan Meier, comparándose las curvas de sobrevida por el método de Log Rank.
Posteriormente se realizó un análisis multivariado mediante una Regresión de Cox por el método de Wald, y se utilizó como criterio de selección de variables para incluir en el modelo multivariado, un valor p menor a 0,10 en el análisis bivariado.
Todas las pruebas estadísticas se efectuaron estableciendo un umbral para el error tipo I de alfa = 0,05.
Se utilizó el paquete estadístico SPSS 11.1.
Resultados
Entre mayo de 2009 y diciembre de 2011 iniciaron tratamiento con quimiorradioterapia un total de 81 pacientes.
Las características de la población se describen en la Tabla I.
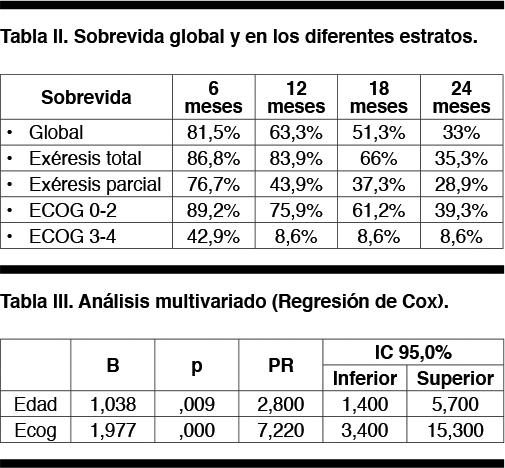
En la Tabla II se detallan funciones de supervivencia.
La mediana de sobrevida global fue de 18 meses (IC 95% 14.1-22.2); a los dos años se encontraban vivos un 33% de los pacientes.
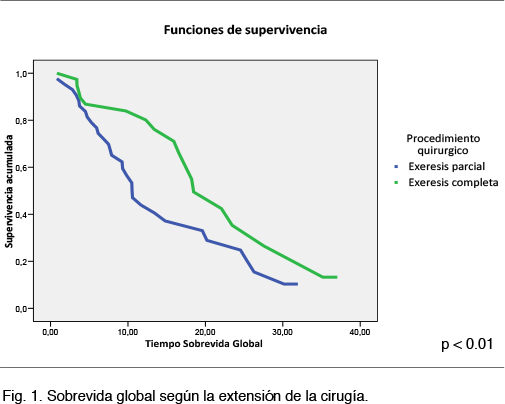
La mediana de sobrevida para el grupo con exéresis total fue de 18.5 meses (IC 95% 13.5-23.4), y para el grupo con exéresis parcial mediana de 10.6 meses (IC 95% 8.2-12.9) (p 0.01), Figura 1.
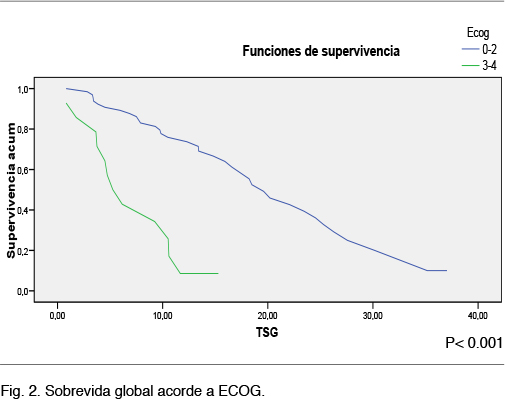
La mediana de sobrevida global para el grupo dentro de la estatificación de ECOG 0-2 fue de 19 meses (IC 95% 15-24,2), y para el grupo ECOG 3-4 de 5.7 meses (IC 95% 2,6-7,8) (p 0,001), Figura 2.
En la Tabla III se muestran los resultados del análisis multivariado por Regresión de Cox, en dicha tabla sólo se muestran las variables significativas, se incluyeron además las variables Sexo y Procedimiento Quirúrgico que no fueron retenidas por el modelo.
Se reportaron eventos adversos en 40 pacientes (49,3%); en 32 de ellos estos fueron grado 1 o 2 y en 8 pacientes grado 3.
Los más frecuentes fueron los gastrointestinales y hematológicos (leucopenia, y plaquetopenia).
Discusión
Este trabajo permitió obtener los primeros resultados nacionales vinculados al tratamiento combinado de los Glioblastomas en el Uruguay.
El GBM constituye el tipo más frecuente y agresivo de los mismos, con una expectativa de vida de 1 año luego del diagnóstico.(11)
El tratamiento combinado de temozolamida con radioterapia en el postoperatorio de los pacientes constituye actualmente la mejor estrategia terapéutica. El estudio fase III EORTC-NCIC, a dos años de seguimiento evidenció un incremento en la sobrevida global en comparación con radioterapia exclusiva, 2,5 veces mayor para el grupo con tratamiento combinado (27% grupo radioterapia + temozolamida versus 10 % en el grupo radioterapia sola).
Identificar los factores vinculados a una mejor respuesta continúa siendo hoy en día un reto; se describen como factores pronósticos independientes la edad, performance status, localización del tumor (11, 12,13) ,extensión de la cirugía (14, 15,16) y el tratamiento con radioterapia y quimioterapia. (17, 18,19)
La evaluación del tratamiento evidenció una mediana de sobrevida global de 18 meses, encontrándose vivos a dos años un 33%, mientras que los estudios que demostraron el beneficio de la terapia combinada mostraron una mediana de sobrevida global de 14,6 meses. (3,4)
Este trabajo encontró al buen estado funcional del paciente y a la edad como los dos factores predictores independientes para mortalidad. El procedimiento quirúrgico no se asoció finalmente a la mortalidad.
En relación a la seguridad del tratamiento casi la mitad de los pacientes presentaron algún evento adverso; la mayoría fueron de grado 1 o 2 resolviéndose los mismos con tratamiento sintomático. Los eventos adversos grado 3 fueron poco frecuentes y requirieron disminución de dosis e incluso suspensión del tratamiento.
Como conclusiones encontramos que la sobrevida de los pacientes tratados con temozolamida y radioterapia para el tratamiento del GBM es similar a la reportada en los estudios de referencia internacionales y mayor que la descrita para el tratamiento radiante exclusivo.
El beneficio es mayor en aquellos pacientes jóvenes con buena capacidad funcional previa al inicio del tratamiento.
La seguridad del mismo fue considerada como aceptable.
Bibliografía
1. Winger M J, Macdonald D R, Cairncross J G. Supratentorial anaplastic gliomas in adults. The prognostic importance of extent of resection and prior low-grade glioma. J Neurosurg. Oct 1989;71(4):487-93.
2. Black PM. Brain tumor. Part 1. N Engl J Med. May 23 1991;324 (21):1471-6.
3. Black PM. Brain tumor. Part 2. N Engl J Med. May 30 1991;324 (22):1555-64.
4. Walker MD,Green SB, Byar DP,et al. Randomized comparisons of radiotherapy and nitrosoureas for the treatment of malignant glioma after surgery. N Engl J Med 1980;303:1323-29.
5. Laperriere N, Zuraw L,Cairncross G. Radiotherapy for newly diagnosed malignant glioma in adults: a systematic review. Radiother Oncol 2002;64:259-73.
6. Roger Stupp, Warren P. Mason, Martin J. van den Bent, et al. Radiotherapy plus Concomitant and Adjuvant Temozolomide for Glioblastoma. N Engl J Med 2005;352:987-96.
7. Roger Stupp, Warren P. Mason, Martin J. van den Bent, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone in glioblastoma in randomized phase III study: 5 – year analysis of de EORTC – NCIC trial. www.thelancet.com/oncology Published online March 9, 2009.
8. Fondo Nacional de Recursos. Política y gestión de la cobertura de medicamentos de alto costo. Relevamiento de la experiencia internacional y respuesta del Fondo Nacional de Recursos. Publicación Técnica Nº 13. Montevideo: FNR, 2010. Disponible en: http://www.fnr.gub.uy/sites/default/files/Publicaciones/FNR_publicacion_tecnica_13_PDF.
9. Martin H. Cohen, John R. Johnson, and Richard Pazdur. Food and Drug Administration Drug Approval Summary: Temozolomide Plus RadiationTherapy for theTreatment of Newly Diagnosed Glioblastoma Multiforme Clin Cancer Res 2005;11(19) October 1, 2005.
10. Disponible en la pagina web de la Agencia Europea del Medicamento (EMEA) http://www.emea.europa.eu/
11. De Angelis L M. Brain tumors. N Engl J Med 2001;344 :114-23.
12. Stark A M, Nabavi A, Mehdorn H M, et al. Glioblastoma multiforme: report of 267 cases treated at a single institution. Surg Neurol 2005;63 :162-9.
13. Xiangyu Ma, Yafeng Lv, Jia Liu, Donghai Wang, Qibing Huang, Xinyu Wang. Survival analysis of 205 patients with glioblastoma multiforme: Clinical characteristics,treatment and prognosis in China. Journal of Clinical Neuroscience 16 (2009)1595-598.
14. Stark AM, Nabavi A, Mehdorn H M, et al. Glioblastoma multiforme: report of 267 cases treated at a single institution.Surg Neurol 2005;63 :162 -9.
15. Lacroix M, Abi-Said D, Fourney D R,et al. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection and survival. J Neurosurg 2001;95:190-8.
16. Stummer W, Pichlmeier U, Meinel T, Wiestler O D, Zanella F, Reulen H J. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. Lancet Oncol 2006;7:392 401.
17. Kreth, F W, Warnke, P C, Scheremet, R, Ostertag, CB. Surgical resection and radiation therapy versus biopsy and radiation therapy in the treatment of glioblastoma multiforme. J Neurosurg 1993; 78:762.
18. Mineo J F, Bordron A, Baroncini M,et al. Prognosis factors of survival time in patients with glioblastoma multiforme: a multivariate analysis of 340 patients. Acta Neurochir (Wien) 2007; 149:245-53.
19. Medical Research Council Brain Tumors Working Party. Randomized trial of procarbazine, lomustine, and vincristine in the adjuvant treatment of high-grade astrocytoma: A Medical Research Council trial. J Clin Oncol 2001;19 509 -518.