Services on Demand
Journal
Article
Related links
Share
Archivos de Medicina Interna
Print version ISSN 0250-3816On-line version ISSN 1688-423X
Arch. Med Int vol.36 no. 3 Montevideo Nov. 2014
Caso clínico
Primer caso de falla hepática aguda por virus de la Hepatitis E en Uruguay
First case of Hepatitis E Virus- induced acute liver failure in Uruguay
Dra. Victoria Mainardi
Médica Internista. UDA Centro Nacional Hepato-Bilio-Pancreático - Servicio de Enfermedades Hepáticas - HCFFAA. Montevideo, Uruguay.
Dr. Gonzalo Ardao
Jefe del Servicio de Anatomía Patológica del HCFFAA. UDA Centro Nacional Hepato-Bilio-Pancreático - Servicio de Enfermedades Hepáticas - HCFFAA. Montevideo, Uruguay.
Dr. Santiago Mirazo
Laboratorio de Virología, Facultad de Ciencias, UdelaR. Montevideo, Uruguay.
Br. Cecilia D’Albora
Laboratorio de Virología. Facultad de Ciencias, UdelaR. Montevideo, Uruguay
Dr. Marcelo Valverde
Médico Internista. Prof. Adj. de Clínica Médica “A” - Hospital de Clínicas (Facultad de Medicina - UdelaR). UDA Centro Nacional Hepato-Bilio-Pancreático - Servicio de Enfermedades Hepáticas - HCFFAA. Montevideo, Uruguay.
Dra. Rossana Gaibizzo
Gastroenteróloga. Medica Uruguaya. Montevideo, Uruguay.
Dra. Solange Gerona
Gastroenteróloga - Hepatóloga. UDA Centro Nacional Hepato-Bilio-Pancreático - Servicio de Enfermedades Hepáticas - HCFFAA. Jefa del Programa Nacional de Trasplante Hepático - Unidad Bi-Institucional Hospital de Clínicas - HCFFAA.
Recibido: 08/09/14 - Aceptado: 12/11/14.
Centros de trabajo: Laboratorio de Virología, Facultad de Ciencias, UdelaR y UDA Centro Nacional Hepato-Bilio-Pancreático - Servicio de Enfermedades Hepáticas - HCFFAA. Montevideo.
Correspondencia: Dra. Victoria Mainardi. E-mail: victoria_mainardi@hotmail.com. Teléfono: 099597486.
Resumen:
La infección por el Virus de la Hepatitis E (VHE) en individuos inmunocompetentes generalmente se presenta como hepatitis aguda autolimitada. En determinados escenarios clínicos (embarazadas y pacientes con enfermedad hepática crónica) puede manifestarse como falla hepática aguda. Se han descripto casos de hepatitis crónica en inmunocomprometidos. En Uruguay se han reportado 14 casos de hepatitis aguda autolimitada por VHE. En el presente artículo se describe el primer caso de falla hepática aguda por VHE en Uruguay.
Palabras clave: Virus de la Hepatitis E, Falla hepática aguda.
Abstract:
Hepatitis E Virus (HEV) typically causes an acute and self-limiting infection in immune-competent individuals, though acute liver failure is described in some settings (pregnancy, chronic liver disease). Chronic hepatitis has been described in immunosuppressed patients. Fourteen autochthonous cases of self-limiting acute hepatitis for HEV were reported in Uruguay. The first case of acute liver failure for HEV is described in the present article.
Keywords: Hepatitis E Virus, Acute Liver Failure.
Introducción
El VHE es causa de hepatitis aguda autolimitada en pacientes inmunocompetentes, con baja tasa de mortalidad (0,5-4%). En determinados escenarios clínicos tales como embarazadas y pacientes con enfermedad hepática crónica puede presentarse como falla hepática aguda con tasas de mortalidad de hasta 30%(1-5). En los últimos años se han descripto casos de hepatitis crónica en inmunocomprometidos: receptores de trasplante de órgano sólido bajo tratamiento inmunosupresor, pacientes hematooncológicos y portadores del virus de inmunodeficiencia humana (VIH)(6-12). Recientemente se han reportado 2 casos de hepatitis crónica en pacientes aparentemente inmunocompetentes(12,13). Existe un subdiagnóstico de la infección por VHE, debido a que la mayoría de los casos son paucisintomáticos; en los casos de hepatitis aguda no siempre se realiza la búsqueda sistemática del mismo, y cuando se realiza los test diagnósticos tienen una sensibilidad limitada(1-3,14). Se estima que 10% de las hepatitis agudas de etiología indeterminada son debidas a VHE15. Un estudio seroepidemiológico realizado en Uruguay encontró una prevalencia de 1,2% de anticuerpos anti-VHE en 252 donantes de sangre analizados y 2,8% en 214 pacientes ambulatorios16.
Se describen 4 genotipos (Gen) de VHE en humanos con distinto perfil clínico y epidemiológico. Los Gen 1 y 2 se transmiten de forma fecal-oral, siendo responsables de grandes epidemias de hepatitis aguda, así como de casos esporádicos en países en vías de desarrollo (Gen 1 en Asia, África, Cuba, Venezuela y recientemente Uruguay; Gen 2 en África y México). El Gen 1 se relaciona a alta mortalidad durante el embarazo. Los Gen 3 y 4 se encuentran ademas en cerdos y venados, existiendo una transmisión zoonótica por consumo de carne poco cocida. Son responsables de casos esporádicos de hepatitis aguda así como de hepatitis crónica (Gen 3) tanto en países desarrollados como en vías de desarrollo. En Latinoamérica predomina el Gen 3(1,2,17-21).
Uruguay es considerado un país de baja endemia. En el período 2010-2011 se reportaron 13 casos autóctonos de hepatitis aguda autolimitada a VHE Gen 3 en adultos inmunocompetentes. Los pacientes no tenían relación entre ellos y la fuente de contagio no pudo ser identificada, no habiéndose aislado hasta el momento VHE en cerdos autóctonos(22,23). El primer caso de infección por VHE Gen 1 fue identificado en 2013, presentándose también como una hepatitis aguda autolimitada(16).
A continuación se describe el primer caso de falla hepática aguda en nuestro país confirmado mediante determinación de ARN de HEV por técnica de PCR, y con hallazgos histológicos característicos.
Caso clínico
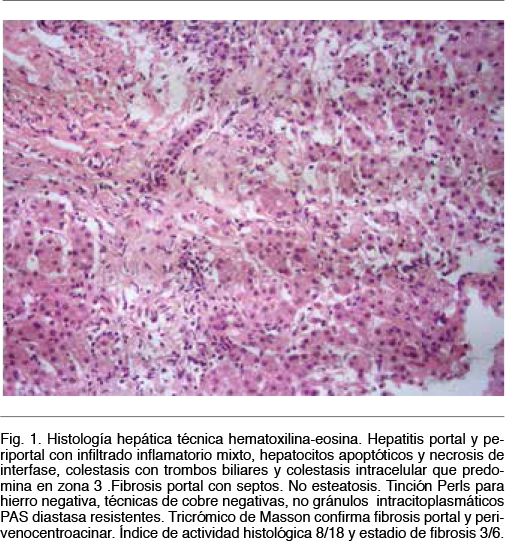
Sexo femenino, 16 años, procedente de zona urbana, estudiante de ciclo básico. Vivienda con agua potable y saneamiento. Sin antecedentes ambientales a destacar. Niega consumo de derivados porcinos. No viajes al exterior en los últimos 45 días. Consumo ocasional de bebidas alcohólicas, niega ingesta de fármacos, yuyos u hongos hepatotóxicos. Sin antecedentes personales patológicos ni ginecoobstétricos, no ha iniciado relaciones sexuales. Sin antecedentes familiares de enfermedades hepáticas ni autoinmunes. Consulta por ictericia en apirexia. Coluria y astenia en los días previos. No dolor abdominal. Al examen se destaca la ausencia de encefalopatía y la palpación de un hígado aumentado de consistencia, sin otros estigmas de hepatopatía crónica. En la analítica presenta un hepatograma alterado con transaminasas x 10 del límite superior de la normalidad (LSN), GGT y FAL x 3 del LSN, bilirubina de 30 mg/dl a predominio de la directa, y una disminución del tiempo de protrombina de 42%. Ecografía hepática sin alteraciones. Con diagnóstico de falla hepática aguda ingresa a Cuidados Intermedios de su institución, solicitando consulta con el Centro de Trasplante Hepático. De la analítica inicial destinada a la búsqueda etiológica se destaca: serología para virus de hepatitis A (VHA), B (VHB) y C (VHC) negativos; Virus Epstein Barr (EBV), Citomegalovirus (CMV), VIH y leptospira negativos; proteinograma electroforético sin aumento de las gamaglobulinas, anticuerpos de autoimnunidad hepática antimúsculo liso (ASMA), antimicrosomales tipo 1 de hígado y riñón (LKM-1), antimitocondriales (AMA) y antinucleares (ANA) negativos. Se solicitó serología y determinación de ARN por técnica de reacción en cadena de la polimerasa (PCR) en sangre y materia fecal para VHE de acuerdo al método descrito por Mirazo et al(22); y ceruloplasmina, cupruria y examen oftalmológico con lámpara de hendidura, para descartar Enfermedad de Wilson. El PCR en sangre y materia fecal a partir de análisis bioinformáticos (MEGA 5.0 software) fue positivo, confirmando el diagnóstico de infección por VHE Gen 3. La serología, por su parte, resultó negativa (Mikrogen recomLine HEV IgM/IgG, Alemania). La cupruria resultó por encima del LSN, con ceruloplasmina normal y ausencia de anillo de Kayser-Fleischer en el examen oftalmológico. Ante la duda diagnóstica de Enfermedad de Wilson se realizó una biopsia hepática que descarto depósitos de cobre y evidencio hallazgos típicos de hepatitis por VHE (Figura 1), con hepatitis portal y periportal con infiltrado inflamatorio mixto, hepatocitos apoptóticos y necrosis de interfase, colestasis con trombos biliares y colestasis intracelular que predomina en zona 3, y fibrosis portal con septos. Índice de actividad histológica 8/18 y estadio de fibrosis 3/6. La paciente evolucionó favorablemente con tratamiento de soporte, con mejoría clínico-analítica completa, manteniendo seguimiento de forma ambulatoria (Tabla I).
Discusión
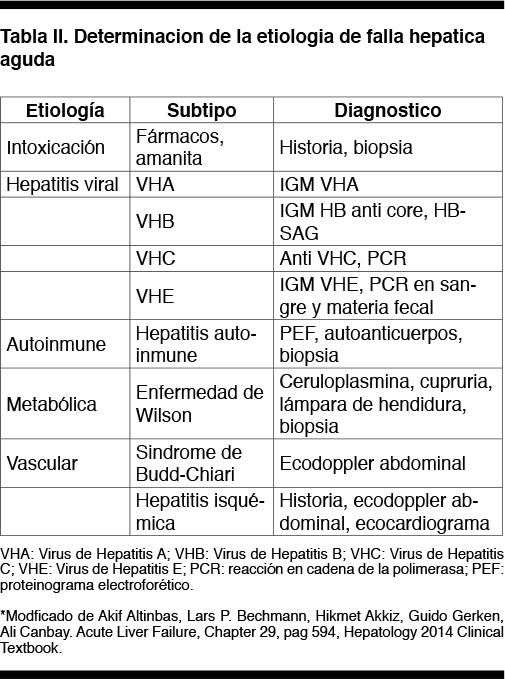
El síndrome de hepatitis aguda se caracteriza por un conjunto de síntomas y signos (astenia, ictericia, dolor abdominal) asociado a alteraciones bioquímicas (aumento de las transaminasas por encima de 10 veces el LSN), que puede ser causado por distintas entidades nosológicas. En primer lugar se debe categorizar la severidad de la hepatitis mediante la valoración de signos de falla hepática: coagulopatía y encefalopatía. La presencia de un tiempo de protombina menor al 50% clasifica a la falla hepática aguda como grave; de ellas aproximadamente un 10% evolucionarán a falla fulminante definida por la presencia de encefalopatía, cuadro de elevada mortalidad que puede requerir un trasplante hepático de urgencia. Ante la presencia de falla hepática aguda se deben tomar tres conductas en simultáneo: internación, contacto con el Centro de Trasplante Hepático y solicitud de estudios para valoración etiológica (serología viral, panel de anticuerpos, estudios imagenológicos, y eventualmente biopsia hepática) ya que existen tratamientos específicos para determinadas etiologías. Las causas se clasifican en: 1. Tóxicas: no existiendo noción de esta causa en nuestro paciente; 2. Virales: por VHA, VHB, VHC, VHE, CMV, EBV; 3. Inmunológicas: hepatitis autoinmune y síndromes de superposición; 4. Metabólicas: Enfermedad de Wilson; 5. Vasculares: Sindrome de Budd-Chiari, hepatitis isquémica; 6. Relacionadas al embarazo: hígado graso agudo del embarazado, síndrome HELLP (Tabla II)(2-27).
No sorprende que a pesar de la presencia confirmada por PCR de VHE, la serología para el mismo fuese negativa. Esto se debe a la baja sensibilidad de las técnicas de ELISA para VHE, mas aún en nuestro medio donde el Gen 3 es el predominante y las mismas están diseñadas principalmente con antígenos del Gen 1(1). La determinación de ARN viral mediante PCR es una técnica con una elevada especificidad y sensibilidad pero por un periodo corto de tiempo (durante la viremia), coincidente con la fase sintomática. Por dicha razón es fundamental su solicitud precoz tanto en sangre como en materia fecal, siendo algo más prolongada la excreción del VHE por esta última vía(1).
La biopsia hepática no es necesaria para el diagnóstico de infección por VHE. En este caso la indicación estuvo sustentada en la duda diagnóstica respecto a la concomitancia de una Enfermedad de Wilson. La histología descarto depósitos de cobre lo que alejo dicho diagnóstico y evidenció hallazgos histólogos típicos de una hepatitis por VHE. La presencia de fibrosis lleva al planteo de la coexistencia de una hepatopatía de base de etiología no aclarada sobre la cual el virus haya determinado una noxa adicional con la consiguiente falla hepática.
Respecto al tratamiento de la infección por VHE, en caso de hepatitis aguda es exclusivamente sintomático, ante el desarrollo de falla hepática aguda, si bien existen reportes de casos en los que se realizó tratamiento antiviral, no existe evidencia para recomendar su uso, siendo el trasplante hepático el único tratamiento aceptado(1,13,28). En caso de hepatitis crónica por VHE en pacientes bajo tratamiento inmunosupresor se recomienda la reducción del mismo, si esto no es posible o de no lograr erradicar la infección a pesar de ello, estaría indicado el tratamiento antiviral con interferón pegilado o ribavirina dependiendo del escenario clínico(1,29-39). Respecto a la profilaxis existe actualmente una vacuna para Gen 1, aprobada por el momento solo en China y disponible para su comercialización(1,18,38).
Comentarios finales
Se detectó el primer caso de falla hepática aguda asociado a la infección por VHE en nuestro país. Se destaca, en caso de hepatitis aguda de etiología indeterminada, así como crónica en inmunodeprimidos, la conveniencia de solicitar determinación del ARN viral por PCR en sangre y materia fecal en forma precoz además de la serología debido a su relativamente baja sensibilidad.
Bibliografía
1. Mirazo S, Ramos N, Mainardi V, Gerona S, Arbiza J. Transmission, diagnosis, and management of hepatitis E: an update. Hepat Med. 2014;6:45-59
2. Kumar S, Subhadra S, Singh B,Panda BK. Hepatitis E virus: the current scenario. Int J Infect Dis. 2013;17 (4): 228–233.
3. Rein DB, Stevens GA, Theaker J, Wittenborn JS, Wiersma ST. The global burden of hepatitis E virus genotypes 1 and 2 in 2005. Hepatology. 2012; 55 (4): 988–997.
4. Taniguchi M, Kim SR, Mishiro S, Takahashi K, Shin MH, Yun H et al. Epidemiology of hepatitis E in Northeastern China, South Korea and Japan. J Infect. 2009; 58 (3): 232–237.
5. Patra S, Kumar A, Trivedi SS, Puri M, Sarin SK. Maternal and fetal outcomes in pregnant women with acute hepatitis E virus infection. Ann Intern Med. 2007; 147 (1): 28–33.
6. Schlosser B, Stein A, Neuhaus R, Pahl S, Ramez B, Kruger DH, et al. Liver transplant from a donor with occult HEV infection induced chronic hepatitis and cirrhosis in the recipient. J Hepatol. 2012; 56 (2): 500–502.
7. Le Coutre P, Meisel H, Hofmann J, Röcken C, Vuong GL, Neuburger S, et al. Reactivation of hepatitis E infection in a patient with acute lymphoblastic leukaemia after allogeneic stem cell transplantation. Gut. 2009; 58 (5): 699–702.
8. Koenecke C, Pischke S, Heim A, Raggub L, Bremer B, Raupach R, et al. Chronic hepatitis E in hematopoietic stem cell transplant patients in a low-endemic country? Transpl Infect Dis. 2012; 14 (1): 103–106.
9. Gérolami R, Moal V, Colson P. Chronic hepatitis E with cirrhosis in a kidney-transplant recipient. N Engl J Med. 2008; 358 (8): 859–860.
10. Kamar N, Selves J, Mansuy JM, Ouezzani L, Péron JM, Guitard J, et al. Hepatitis E virus and chronic hepatitis in organ-transplant recipients. N Engl J Med. 2008; 358 (8): 811–817.
11. Pischke S, Suneetha PV, Baechlein C, Barg-Hock H, Heim A, Kamar N, et al. Hepatitis E virus infection as a cause of graft hepatitis in liver transplant recipients. Liver Transpl. 2010; 16 (1): 74–82.
12. González Tallón AI, Moreira Vicente V, Mateos Lindemann ML, Chécar Justo LM. Chronic hepatitis E in an immunocompetent patient. Gastroenterol Hepatol. 2011; 34 (6): 398–400.
13. Grewal P1, Kamili S, Motamed D. Chronic hepatitis E in an immunocompetent patient: a case report. Hepatology 2014; 59 (1): 347-348.
14. Dalton HR, Bendall R, Ljaz S, Banks M. Hepatitis E: an emerging infection in developed countries. Lancet Infect Dis. 2008; 8 (11): 698-709.
15. Gonzalez J, Alonso A, Fainboim H, Ramonet M, Ciocca C, Schroder T et al. Hepatitis E and Acute Hepatitis in Argentina. Hepatology 1994; 19 (4): A121.
16. Cruells MR, Mescia G, Gaibisso R, Ramirez M, Guterrez M, Kohen S et al. Epidemiological study of hepatitis A and E viruses in different populations in Uruguay. Gastroenterol Hepatol. 1997; 206: 295-298.
17. Echevarría JM, Gonzalez JE, Lewis-Ximenez LL, Lopez Dos Santos DR, Munné MS, Pinto MA et al. Hepatitis E Virus Infection in Latin America: A review. J Med Virol 2013; 85: 1037-1045.
18. Mirazo S, Ramos N, Arbiza J. Molecular epidemiology of hepatitis e virus in south america: current status. Virus Reviews and Research 1-10Published ahead of print September 10, 2012.
19. Mirazo S, Mainardi V, Ramos N, Gerona S, Rocca A, Arbiza J. Indigenous Hepatitis E Virus Genotype 1 Infection, Uruguay. Emerg Infect Dis 2014; 20 (1): 171-174
20. Meng XJ. Zoonotic and foodborne transmission of hepatitis E virus. Semin Liver Dis. 2013; 33 (1): 41–49.
21. Meng XJ. From barnyard to food table: the omnipresence of hepatitis E virus and risk for zoonotic infection and food safety. Virus Res. 2011; 161 (1): 23–30.
22. Mirazo S, Ramos N, Russi JC, Gagliano G, Arbiza J. Detection and molecular characterization of sporadic cases of acute human hepatitis E virus infection in Uruguay Arch Virol 2011; 156(8): 1451-1454.
23. Mirazo S, Ramos N, Russi JC, Arbiza J. Genetic heterogeneity and subtyping of human Hepatitis E virus isolates from Uruguay. Virus Res. 2013;173:364–70.
24. Lee WM. Recent Developments in Acute Liver Failure. Best Pract Res Clin Gastroenterol. 2012; 26 (1): 3–16.
25. Lee WM, Stravitz RT, and Larson AM. Introduction to the Revised American Association for the Study of Liver Diseases Position Paper on Acute Liver Failure 2011. Hepatology 2012; 55(3): 965-967
26. Lee WM, Larson AM, and Stravitz RT. AASLD Position Paper: The Management of Acute Liver Failure: Update 2011. Hepatology, 2011 Sep: 1-22
27. Bernal W, Auzinger G, Dhawan A, Wendon J. Acute Liver Failure. Lancet 2010; 376: 190–201
28. Gerolami R, Borentain P, Raissouni F, Motte A, Solas C, Colson P. Treatment of severe acute hepatitis E by ribavirin. J Clin Virol. 2011; 52 (1): 60–62
29. Péron JM, Dalton H, Izopet J, Kamar N. Acute autochthonous hepatitis E in western patients with underlying chronic liver disease: a role for ribavirin? J Hepatol. 2011; 54 (6): 1323–4
30. Kamar N, Garrouste C, Haagsma EB, Garrigue V, Pischke S, Chauvet C, et al. Factors associated with chronic hepatitis in patients with hepatitis E virus infection who have received solid organ transplants. Gastroenterology 2011; 140 (5): 1481–1489
31. Jagjit Singh GK, Ijaz S, Rockwood N, Farnworth SP, Devitt E, Atkins M, et al. Chronic Hepatitis E as a cause for cryptogenic cirrhosis in HIV. J Infect. 2013;66(1): 103–106
32. Parvez MK. Chronic hepatitis E infection: risks and controls. Intervirology 2013; 56 (4): 213–216
33. Chaillon A, Sirinelli A, De Muret A, Nicand E, d’Alteroche L, Goudeau A. Sustained virologic response with ribavirin in chronic hepatitis E virus infection in heart transplantation. J Heart Lung Transplant. 2011; 30 (7): 841–843.
34. Mallet V, Louvet A, Lebray P, Hillaire S, Roulot D, Hillon P, et al. Ribavirin treatment for chronic hepatitis E: a case-series. Hepatology 2011; 54 (1): 495S.
35. Schildgen O, Müller A, Simon A. Chronic hepatitis E and organ transplants. N Engl J Med. 2008; 358 (23): 2521–2
36. Alric L, Bonnet D, Beynes-Rauzy O, Izopet J, Kamar N. Definitive clearance of a chronic hepatitis E virus infection with ribavirin treatment. Am J Gastroenterol. 2011; 106 (8): 1562–1563.
37. Fujiwara S, Yokokawa Y, Morino K, Hayasaka K, Kawabata M, Shimizu T. Chronic hepatitis E: a review of the literature. J Viral Hepat. 2014; 21 (2): 78–89.
38. Riezebos-Brilman A, Puchhammer-Stöckl E, Van der Weide HY, Haagsma EB, Jaksch P, Bejvl I, et al. Chronic hepatitis E infection in lung transplant recipients. J Heart Lung Transplant. 2013; 32 (3): 341–346.
39. Pischke S, Stiefel P, Franz B, Bremer B, Suneetha PV, Heim A, et al.Chronic hepatitis e in heart transplant recipients. Am J Transplant 2012, 12(11):3128-33.