Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Medicina Interna
versión impresa ISSN 0250-3816versión On-line ISSN 1688-423X
Arch. Med Int vol.36 no. 2 Montevideo jul. 2014
Revisión
Diagnóstico y tratamiento del Hepatocarcinoma: puesta a punto del tema y rol del internista
Diagnosis and therapy of Hepatocarcinoma: update of the topic and the internist’s role
Dr. Josemaría Menéndez
Ex Residente de Medicina Interna - Hepatología Clínica. UDA Centro Nacional Hepato-Bilio-Pancreático - Servicio de Enfermedades Hepáticas - HCFFAA.
Dr. Marcelo Valverde
Medicina Interna - Hepatología Clínica. Prof. Adj. de Clínica Médica “A” - Hospital de Clínicas (Facultad de Medicina - UdelaR). UDA Centro Nacional Hepato-Bilio-Pancreático - Servicio de Enfermedades Hepáticas - HCFFAA.
Dra. Victoria Mainardi
Medicina Interna. Ex Residente de Medicina Interna - Hospital de Clínicas (Facultad de Medicina - UdelaR). UDA Centro Nacional Hepato-Bilio-Pancreático - Servicio de Enfermedades Hepáticas - HCFFAA.
Dra. Paola Scalone
Gastroenterología - Hepatología Clínica. UDA Centro Nacional Hepato-Bilio-Pancreático - Servicio de Enfermedades Hepáticas - HCFFAA.
Dra. Andrea Rocca
Ex Asistente de Clínica Médica - Hepatología Clínica. UDA Centro Nacional Hepato-Bilio-Pancreático - Servicio de Enfermedades Hepáticas - HCFFAA.
Dra. Solange Gerona
Gastroenterología - Hepatología Clínica. UDA Centro Nacional Hepato-Bilio-Pancreático - Servicio de Enfermedades Hepáticas - HCFFAA. Jefa del Programa Nacional de Trasplante Hepático - Unidad Bi-Institucional Hospital de Clínicas - HCFFAA.
Recibido: 05/09/13 - Aceptado: 04/06/14
Centro de trabajo: UDA Centro Nacional Hepato-Bilio-Pancreático (CeNaHBP) - Servicio de Enfermedades Hepáticas - Hospital Central de las Fuerzas Armadas (HCFFAA) - Unidad Bi-Institucional de Trasplante Hepático (Hospital de Clínicas - HCFFAA)
Correspondencia o solicitud de separatas: Dr. Josemaría Menéndez. Dirección: 8 de octubre 3060 - HCFFAA - Servicio de Enfermedades Hepáticas. Teléfonos: 24876666 (interno 8180-8183) - 099163334. jmenendez79@gmail.com
resumen: Arch Med Interna 2014 - 36(2):60-65
El carcinoma hepatocelular es el tumor hepático maligno más frecuente, el 5o más prevalente en el mundo y la tercera causa de mortalidad por cáncer. En más de un 90% de los casos está asociado a cirrosis, su incidencia en dicha población es del 3 al 5%, siendo la primera causa de muerte en este grupo de pacientes. Se espera un incremento de esta incidencia en las próximas 2 décadas. En los últimos años se han desarrollado nuevas estrategias diagnósticas y terapéuticas que han modificado radicalmente el pronóstico de esta enfermedad. Al asentar sobre una patología donde el manejo médico es primordial el internista cumple un rol fundamental en el adecuado abordaje de esta neoplasia. Tareas como la prevención, la vigilancia, el diagnostico precoz y el enfoque multi e interdisciplinario, en los distintos estadios evolutivos de la enfermedad, son algunos de los aspectos más relevantes. El accionar con el médico hepatólogo es fundamental, definiendo en conjunto las distintas conductas a seguir en las instancias pre y postratamiento.
Palabras clave: Hepatocarcinoma, Vigilancia, Cribado, Ablación por radiofrecuencia, Inyección percutánea con etanol, Quimioembolización transarterial, Trasplante hepático, Revisión.
ABSTRACT: Arch Med Interna 2014 - 36(2):60-65Hepatocellular carcinoma is the most common malignant liver tumor, the 5th most prevalent worldwide and the 3rd leading cause of death from cancer. Over 90% of cases are associated with cirrhosis, the incidence in this population is 3 to 5%, been the leading cause of death in this population. It is expected that the incidence would increase in the next 2 decades. In recent years new diagnostic and therapeutic strategies have been developed, that have dramatically changed the treatment strategies in early stages of the disease. As this tumor develops primarily in cirrhotic patients, where the global management of the patient is crucial, the Internist plays a fundamental role in the proper approach. Tasks such as prevention, surveillance, early diagnosis and multi and interdisciplinary approach, in the different stages of the disease, are just some of the most relevant aspects. The interaction between physician and Hepatologist is essential, working together to define the different actions in pre-and post-treatment phases.
Keywords: Hepatocellular carcinoma, Surveillance, Screening, Radiofrequency ablation, Percutaneous ethanol injection, Transarterial chemoembolization, Liver transplantation, Review.
Introducción
El carcinoma hepatocelular (HCC) es el tumor hepático maligno más frecuente, el 5o más prevalente en el mundo y el 3o en mortalidad. En más de un 90% de los casos está asociado a cirrosis, su incidencia en esta población es del 3 al 5%, constituyendo la primera causa de muerte en este grupo de pacientes.1,2 Estudios de tendencia proyectan un incremento de esta incidencia en las próximas 2 a 3 décadas.2 En nuestro país se estima una incidencia de 100 casos al año3. Los factores de riesgo para su desarrollo son múltiples, destacando la presencia de cirrosis (independientemente de su etiología), así como la infección crónica por virus de la hepatitis C (VHC), virus de la hepatitis B (VHB), la obesidad y la diabetes.4,5,6 Desde el punto de vista clínico los pacientes se mantienen asintomáticos hasta que el tumor se encuentra en un estadio avanzado, lo que limita la implementación de estrategias terapéuticas pretendidamente curativas. A partir del desarrollo de síntomas vinculados al tumor, la progresión a la muerte suele ser rápida7. Esta característica de la historia natural de la enfermedad es la que durante décadas ha estado arraigada en el cuerpo médico, y de ahí la errónea asunción que frecuentemente se plantea considerando que un paciente con hepatocarcinoma es un paciente terminal. En las dos últimas décadas hemos asistido a una verdadera revolución a nivel mundial en lo que respecta al conocimiento y comprensión de esta enfermedad (desde la biología molecular y la genética hasta la epidemiología global). Este hecho ha derivado en el desarrollo de nuevas estrategias diagnósticas y terapéuticas, con posibilidad cierta de instituir tratamientos pretendidamente curativos con sobrevidas a 5 años que superan el 70% cuando la detección es precoz8. Inclusive en estadios más avanzados hay evidencia de peso a favor de la institución de tratamientos capaces de prolongar en forma significativa la sobrevida.9 El proceso de diagnóstico, estadificación y seguimiento obliga a una relación estrecha entre los diversos especialistas y a la aplicación de nuevas herramientas tecnológicas; por lo tanto un abordaje multi e interdisciplinario es esencial para optimizar el manejo del paciente.3,10 El objetivo de la siguiente revisión es analizar las recomendaciones sugeridas en cada instancia y estadío según el estado actual del conocimiento, destacando el rol del internista en cada una de ellas.
Métodos
Se realizó una revisión sistemática en: Pubmed, EMBASE, Web of Science, SciELo, LILACS, Organización Mundial de la Salud (OMS) y Ministerio de Salud Pública del Uruguay. Los criterios de búsqueda fueron mediante el uso de las siguientes palabras clave: hepatocarcinoma, vigilancia, cribado, ablación por radiofrecuencia, inyección percutánea con etanol, quimioembolización transarterial, trasplante hepático y revisión, tanto en español como en inglés. Se seleccionaron metaanálisis, estudios randomizados controlados y revisiones sistemáticas. Fueron incluidas las guías diagnostico-terapéuticas de las principales sociedades científicas que abordan el tema, publicaciones científicas nacionales, e informes de rigor científico con información local. Así mismo fueron incluidos artículos seleccionados que, si bien no cumplen con los criterios previamente citados, constituyen “pilares” en la generación del conocimiento de esta patología.
Programas de prevención, vigilancia y diagnóstico precoz
Prevención
El 90% de los HCC se presentan sobre un hígado cirrótico. Por lo que toda medida que tienda a la prevención de la cirrosis también constituye un método de prevención de HCC. Esto se ha demostrado fuertemente mediante campañas de vacunación para VHB buscando disminuir las tasas de infección crónica por VHB, mediante las cuales se han logrado en forma secundaria, una disminución de la incidencia de HCC.11 En Uruguay las principales etiologías de la cirrosis en pacientes portadores de HCC son el alcoholismo, las infecciones crónicas por VHB/VHC y la enfermedad por hígado graso no alcohólico (NAFLD)/esteatohepatitis no alcohólica (NASH)12. Teniendo en cuenta el elevado consumo de alcohol en el Uruguay13, el asumir esta realidad como una problemática de salud es fundamental. Este tóxico debe ser considerado no solo como un factor de riesgo para el desarrollo de cirrosis, sino como una sustancia con potente acción carcinogénica, actuando tanto en la iniciación, como en la promoción y la progresión del HCC14. La NAFLD/NASH constituye la expresión a nivel hepático del sindrome metabólico. Es la principal causa de hepatopatía crónica en poblaciones occidentales y hasta un 25% de los pacientes con NASH evolucionan a la cirrosis.15. Si bien su prevalencia es desconocida en el Uruguay, el estudio ENSO 216 demostró que el 54% de la población adulta presenta sobrepeso y el 20% obesidad, como principales determinantes de esta patología. En este contexto es esperable un aumento de la incidencia en esta etiología como causa de cirrosis y de hepatocarcinoma en los próximos años. En lo que refiere a hepatitis crónicas virales, en zonas del planeta donde la infección por el virus de la hepatitis B (VHB) es endémica, como en el Sudeste Asiático o África constituye el principal factor de riesgo, al punto en que el HCC es el primar cáncer en frecuencia2. Para la Organización Mundial de Salud (OMS) Uruguay se encuentra en una zona de baja sero-prevalencia (entre 1,5 y 2% de la población) tanto para VHB como para VHC17,18. De todos modos constituye una problemática de gran relevancia, ya que un elevado porcentaje de pacientes portadores de HCC son seropositivos.
El internista, así como el médico de atención primaria tienen un rol fundamental mediante:
· la detección y tratamiento del consumo nocivo de alcohol y el alcoholismo.
· prevención, detección y derivación oportuna de los pacientes con infección por VHB y VHC. Estas medidas incluyen la vacunación universal contra la Hepatitis B (actualmente parte del esquema de vacunación), la educación sobre el adecuado manejo del material corto-punzante, uso del preservativo, uso de material descartable en caso de usuarios a drogas intravenosas, y el screening de grupos de riesgo no cubiertos por el esquema de vacunación (trabajadores de la salud, trabajadores sexuales, hombres que tienen sexo con hombres, personas nacidas entre 1945 y 1965) o incluso universal. Así mismo es fundamental la interconsulta oportuna con el hepatólogo para el abordaje conjunto de este tipo de pacientes.
· prevención del NAFLD/NASH mediante la promoción de estilos de vida saludables, así como un enérgico abordaje de los demás determinantes del síndrome metabólico (obesidad, diabetes, dislipemia).
Vigilancia
Desde los emblemáticos trabajos de Ebara19 y Sheu20 en la década de los 80 se ha demostrado que el diagnóstico precoz del HCC permite instituir tratamientos pretendidamente curativos y por lo tanto aumentar la sobrevida global. El HCC es una patología que cumple los requisitos necesarios para poder establecer un programa de cribado: es una neoplasia frecuente con una importante morbimortalidad, la población objetivo es de fácil identificación y la herramienta diagnóstica a utilizar (ecografía) es inocua, de bajo costo y disponible en todos los centros. La mayoría de las sociedades internacionales vinculadas al tema tales como la American Association for de Study of Liver Disease (AASLD)21, la European Association for the Study of the Liver & European Organisation for Research and Treatment of Cancer (EASL/EORTEC)22 y la Latin American Asociation for de Study of the Liver (LAASL)23, recomiendan en sus pautas de manejo del HCC que aquellos pacientes con alto riesgo de desarrollar dicha neoplasia deben ser parte de un programa de vigilancia con realización de una ecografía a cargo de un técnico experimentado cada 6 meses. La determinación de Alfa feto proteína (AFP) ha caído en desuso dada su baja sensibilidad y especificidad, así como la falta de unanimidad en lo que respecta al punto de corte a utilizar. Debe tenerse en cuenta que solo un tercio de los HCC elevan este biomarcador. De todos modos y considerando la dificultad técnica que implica la búsqueda ecográfica de un nódulo predominante en el contexto de un hígado cirrótico, principalmente en manos de técnicos no expertos, es aceptable la solicitud de AFP en forma complementaria24. Los pacientes candidatos a ingresar a programas de vigilancia con ecografía (y eventual determinación de AFP) cada 6 meses son:
· cirróticos de cualquier etiología (Child-Pugh A o B), y todo paciente en lista de espera para trasplante hepático. Ante hepatopatías en fase terminal no candidatos a trasplante no es necesario este seguimiento.
· portadores de hepatitis crónica por VHB independientemente de estar o no en fase cirrótica. (La integración del genoma viral al genoma del huésped y los procesos inflamatorios a nivel del hepatocito parecen ser las vías principales de la carcinogénesis en el VHB+ no cirrótico)25.
· pacientes con antecedentes familiares de HCC independientemente de la presencia de infección viral o de otras patologías predisponentes.
Diagnóstico precoz
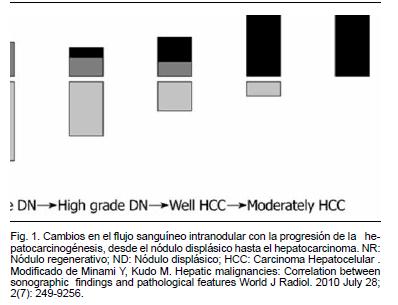
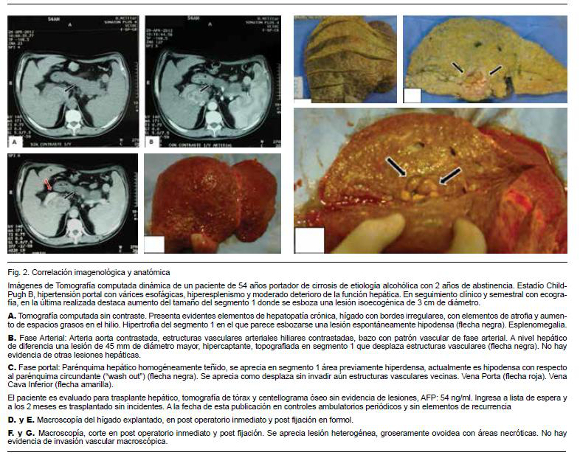
Ante un hallazgo ecográfico sospechoso de HCC es necesario llevar adelante estudios que confirmen o descarten el diagnóstico. Hoy en día el HCC puede ser diagnosticado mediante estudios de imagen dinámicos contrastados como tomografía multicorte de más de 8 hileras (TC) o resonancia magnética (RNM) siendo necesaria la biopsia para confirmación diagnóstica únicamente en casos seleccionados5. El principio de los estudios dinámicos se basa en características propias del tumor. El HCC es un tumor con marcada actividad pro-angiogénica. A medida que el tumor crece, la vascularización portal habitual va dejando lugar a una vascularización predominantemente arterial. Esto lleva a que el tumores de más de 2 cm se nutran fundamentalmente por vía arterial (neovascularización por ramas de la arteria hepática)26. (Figura 1) El parénquima hepático es vascularizado en un 80% por la vena porta y en un 20% por la arteria hepática. En el estudio dinámico se toman imágenes en distintas fases (sin contraste, en fase arterial, fase portal y fase tardía) de este modo el comportamiento vascular del tumor permite hacer diagnóstico. El comportamiento típico de un HCC en el contexto de hígado cirrótico es la captación del contraste en fase arterial (“wash in”) mientras el resto del parénquima está aún sin contraste, y el lavado en fase portal (“wash out” precoz), momento en el que el nódulo no presenta contaste y el resto del parénquima se encuentra más intensamente contrastado27 (Figura 2). En la resonancia magnética, otros parámetros como la saturación grasa, y las técnicas de difusión pueden colaborar con la identificación de la naturaleza de los nódulos. Cuando se realiza un estudio y este no es concluyente (TC o RNM) debe realizarse el siguiente. La sensibilidad es de 70% vs 87% y la especificidad de 77% vs 84% para TC y RNM respectivamente28. Con el objetivo de consensuar la interpretación de imágenes hepáticas de pacientes en riesgo de desarrollar HCC, en 2011 se ha presentado una estrategia creada por las principales asociaciones científicas mundiales vinculadas al tema. El Li-RADS ( Liver Imaging Reporting and Data System)29 categoriza nódulos reconocidos en TC o RNM como definitivamente benignos, probablemente benignos, probabilidad intermedia de malignidad o benignidad, probablemente HCC y HCC definitivo (Categorías 1 a 5). La RNM permite adicionalmente diferenciar entre nódulos de regeneración, nódulos displásicos (pre-malignos) y HCC con mayor sensibilidad que la TC27. Esta discriminación es mucho más dificultosa en tumores de menos de 2 cm. En la práctica clínica es fundamental aportar al médico imagenólogo la mayor cantidad de datos posible del paciente. Se debe aclarar que se solicita un estudio dinámico (o trifásico) pues los detalles de coordinación y técnicos difieren según la institución. Un estudio mal realizado no es de valor diagnóstico y expone al paciente a radiación y riesgo de nefrotoxicidad por contraste, con todo lo que ello implica considerando la patología de base (descompensación de la cirrosis, desarrollo de síndrome hepatorrenal, etc.). La interpretación de las imágenes es un punto de crucial valor. En centros de referencia internacionales es frecuente que estas imágenes sean evaluadas por técnicos especializados, dedicados casi exclusivamente a esta patología. En Uruguay, dado el “n” de pacientes y las características del trabajo médico hacen que esa eventualidad sea poco probable. Por tal motivo cobra gran relevancia la evaluación de estos casos clínicos en el contexto de ámbitos multidisciplinarios, donde en una misma instancia el caso sea presentado y evaluado por médico radiólogo, hepatólogo, cirujano hepato-bilio-pancreático, radiólogo intervencionista y oncólogo. Está demostrado que la evaluación y el tratamiento del HCC en centros especializados determina una mayor sobrevida para los pacientes30. Esto debe hacer cambiar la perspectiva del médico internista que asiste a un paciente con diagnóstico probable de HCC, ya que él, como médico tratante pasa a ser pieza activa, articulando e integrándose en la asistencia a este grupo interdisciplinario y no cumpliendo un simple rol de “derivador”. En lo que respecta a la necesidad de realizar biopsia hepática de lesiones dudosas, referencias internacionales señalan la necesidad de su realización en un 30% de los casos27. Si el resultado es positivo confirma el diagnóstico, pero si es negativo no lo descarta. Suelen ser procedimientos de cierta dificultad técnica por las características del hígado y la frecuente coagulopatía asociada. El riesgo de siembra peritoneal o del trayecto biópsico es de 2,5%31
Estadificación y tratamiento
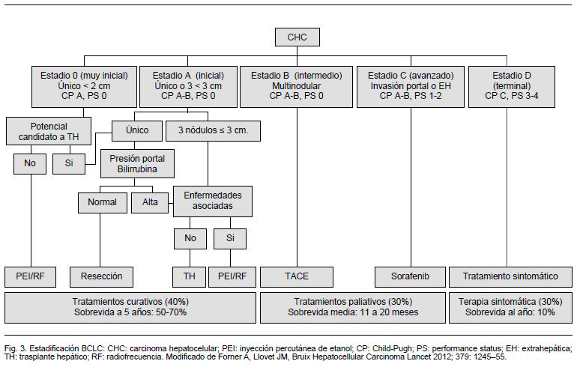
En paralelo a los avances respecto al diagnóstico precoz se ha desarrollado una búsqueda dirigida a optimizar la sistematización diagnóstica, clasificación y estadificación pronóstica, que permitan guiar la toma de decisiones. Múltiples modelos han surgido en los que se combinan parámetros de función hepática con parámetros de extensión lesional tumoral32, de estos la clasificación de Barcelona Clinic Liver Cancer (BCLC)33, que fue diseñada a partir de resultados de estudios controlados randomizados y extensos estudios de cohorte, ha logrado amplia validación a nivel mundial. Según esta estadificación, a partir del performance status del sujeto, la estadificación de la cirrosis según Child-Pugh, y la extensión lesional según Okuda6, los pacientes se clasifican en estadíos 0 (muy precoz), A (precoz), B (intermedio), C (avanzado) y D (terminal). A cada uno de estos se plantea una estrategia terapéutica y un pronóstico diferente (Figura 3).
Estadío 0 (muy precoz) y A (precoz)
Como muestra el esquema de la clasificación de BCLC estos estadíos corresponden a lesiones que van desde el carcinoma “in situ” hasta la presencia de tres lesiones de hasta 3 cm de diámetro cada una, o una lesión única de 5 cm, sin evidencia de invasión vascular macroscópica o extensión extra hepática (criterios de Milán)34. Lo que caracteriza a ambos grupos es que son candidatos a tratamientos pretendidamente curativos. El porcentaje de pacientes en este grupo va en paralelo a la eficacia y eficiencia de los programas de detección precoz, ya que se trata de lesiones subclínicas y asintomáticas. La supervivencia a 5 años en este estadio con tratamiento es próxima al 70%, superando ampliamente las tasas de sobrevida de otras neoplasias e inclusive de diversas enfermedades cardiovasculares más prevalentes35. Las estrategias terapéuticas en estos estadíos están pautadas por la presencia o no de comorbilidades, las características propias del tumor y de la enfermedad de base. Los tratamientos propuestos van desde terapias locorregionales ablativas hasta cirugía de resección o trasplante hepático.
Terapias ablativas guiadas por imagen
La ablación induce necrosis tumoral tanto por inyección de productos químicos (etanol, ácido acético), como por acción física por calor (radiofrecuencia, láser o microondas) o por frío (crioablación). Estas técnicas son habitualmente guiadas por ecografía y pueden ser realizadas por vía percutánea, laparoscópica o por cirugía convencional36. En tumores con diámetro menor a 2 cm se logran tasas de necrosis tumoral próximas al 100% tanto con ablación radiofrecuencia (RFA) como con inyección percutánea con alcohol (PEI) o alcoholización. La PEI requiere mayor número de sesiones y presenta mayor tasa de fallo de tratamiento en lesiones que superan los 2 cm. La RFA requiere menor número de sesiones (generalmente única) y es planteable en tumores únicos de hasta un máximo de 5 cm, por lo que se considera la técnica de primera línea37,38. Dados los excelentes resultados en pacientes en estadío 0 (Child A con lesión única menor a 2 cm), con sobrevidas que superan 70% a 5 años, la RFA es planteable incluso como una alternativa a la cirugía resectiva19,39.
Resección quirúrgica
Constituye una indicación mayor en pacientes con lesión única, sobre hígado sano, o en pacientes cirróticos con enfermedad estable, con buena función y sin evidencia de hipertensión portal40,41. Si bien este procedimiento no trata la enfermedad hepática de base, en manos experimentadas ofrece una supervivencia posrresección mayor a 50% a 5 años.
Trasplante Hepático
El trasplante hepático es el tratamiento de elección en aquellos sujetos con HCC que no son candidatos óptimos para resección quirúrgica, que no tienen ninguna enfermedad extra-hepática que contraindique el procedimiento y que se presenten dentro de los criterios de Milán4-6,11. En estas condiciones se logran tasas de supervivencia del 75% a 5 años con una tasa de recurrencia anual del 8%12. Este procedimiento tiene la ventaja de curar concomitantemente el HCC y la enfermedad hepática de base. Es de destacar que frecuentemente (principalmente cuando el tiempo estimado en lista de espera supera los 6 meses) debe recurrirse a “terapias puente” mediante las cuales se logra enlentecer o detener la progresión tumoral y con ello evitar la caída de lista. Estas terapias incluyen los tratamientos ablativos ya analizados (PEI o RFA) así como la quimioembolización trans-arterial (TACE) que se analizará posteriormente, dependiendo de las carácterísticas de cada caso en particular. Esta decisión habitualmente se toma en el seno del programa de trasplante, y con el paciente ya ingresado en lista de espera42. Asimismo se pueden aplicar terapias de “down-staging” dirigidas a lograr disminuir el estadio de la enfermedad, fundamentalmente de estadíos B de BCLC a estadio A, con el objetivo de incluir al paciente en criterios de trasplantabilidad. La técnica más utilizada es la TACE, siendo fundamental una adecuada selección de los pacientes y la correcta definición de lo que se considera una respuesta adecuada para minimizar el riesgo de recurrencia postrasplante43.
Estadío B (intermedio)
Este estadío está definido por la presencia de lesiones intrahepáticas mayores a 5 cm, multinodularidad (excediendo criterios de Milán), pero sin evidencia de invasión vascular, en pacientes con adecuada función hepática y estado general conservado. El único recurso terapéutico que ha demostrado impacto en sobrevida en este estadío según estudios controlados randomizados44 y metaanálisis45 es la TACE. Mediante cateterización arterial de ramas nutricias del tumor se realiza en primera instancia la instilación de agentes quimioterápicos (doxorrubicina emulsionada en lipiodol) con posterior embolización mecánica de estas ramas con micro-esferas plásticas o de gelfoam. Este doble mecanismo lesional lleva a la hipoxia y necrosis tumoral. En general es un procedimiento bien tolerado, y en manos experimentadas las complicaciones esperables son escasas y de bajo riesgo46. Los efectos secundarios más frecuentes, que constituyen el síndrome posquimioembolización son dolor abdominal, vómitos y fiebre. Más raramente pueden presentar irritación peritoneal y colecistitis isquémica, y excepcionalmente embolias sistémicas44. En los últimos años se ha introducido el uso de microesferas cargadas con doxorubicina (DC-beads) que permiten una liberación más prolongada del fármaco a nivel tumoral, minimizando la exposición sistémica y con ello logrando mejores resultados y menos efectos adversos, a expensas de un aumento en los costos del procedimiento47. Ambas técnicas están disponibles en el Uruguay.
Estadío C (avanzado)
Este estadío corresponde al paciente con hepatocarcinoma avanzado, con extensión extrahepática y/o invasión vascular, pero con un aceptable estado general y función hepática relativamente preservada, autoválidos, con performance status 1 y 2. Si bien estamos ante una enfermedad avanzada, se ha desarrollado un fármaco con blanco molecular (targeted therapy), inhibidor multiquinasa que actúa inhibiendo los factores proangiogénicos y estabilizando la progresión tumoral (Sorafenib). Éste ha demostrado resultados favorables según 2 estudios randomizados48,49 y un metaanálisis50 respecto a la sobrevida global, lo que ha llevado a postularlo como el estándar de tratamiento a nivel mundial para este estadío. Si bien el incremento en la sobrevida global es en torno a los 3 a 4 meses promedialmente, dentro del grupo de pacientes respondedores existe una gran heterogeneidad logrando algunos sobrevidas próximas a los 2 años con enfermedad estable o con progresión radiológica pero no clínica. Los eventos adversos más frecuentes son, diarrea, alopecia y el síndrome mano-pie. Este último (eritrodistesia palmoplantar) se caracteriza como una dermatitis ulcerativa, frecuentemente dolorosa, que puede afectar la vida diaria dependiendo de su intensidad. Se previene con cuidados locales, y frecuentemente responde ante disminución transitoria de la dosis. Es infrecuente la suspensión del tratamiento por esta causa. La diarrea, se trata en forma sintomática con loperamida. Es de destacar que, como muchos de los fármacos con blanco molecular, es de costo elevado, y que actualmente no es financiado por instituciones públicas o privadas en Uruguay, debiendo acceder al fármaco mediante un recurso de amparo legal. En 2011 el Ministerio de Salud Pública realizó un Informe Público en el que plantea que el fármaco no es coste-efectivo en nuestro medio51. Recientemente se han publicado nuevas estrategias terapéuticas en las que la utilización de dosis escalonadas disminuye la incidencia de efectos secundarios, y mejora el balance coste-efectividad.52 El rol del internista en esta etapa del cuidado es evidente, previniendo y tratando los síntomas, tanto vinculados al tumor como a los efectos adversos, preparando al paciente y su entorno, y planificando el seguimiento con el equipo de cuidados paliativos.
Estadío D (terminal)
Corresponde a pacientes portadores de enfermedad avanzada, con severo deterioro de la función hepática e impacto significativo en la capacidad funcional. Estos pacientes son candidatos a tratamiento paliativos sintomáticos, donde el paliativista cobra un papel fundamental.
Tratamiento Multimodal
De acuerdo con lo anteriormente expuesto los tratamientos pretendidamente curativos incluyen trasplante hepático, resección y terapias ablativas (PEI/RFA). Los tratamientos paliativos como la TACE y el Sorafenib mejoran la sobrevida en estadíos intermedios y avanzados respectivamente. Sin embargo debe tenerse en cuenta que los estadíos y estrategias terapéuticas no constituyen “compartimientos estancos”. La evidencia actual avala la combinación de estrategias terapéuticas permitiendo la aplicación de tratamientos pretendidamente curativos a un mayor número de pacientes53. Detallamos algunas a continuación.
Combinación de terapias ablativas entre sí y con TACE
Consiste en combinar tratamientos de RF y/o PEI entre sí y con TACE. La base fisiopatológica es que la combinación de técnicas de agravio celular (isquemia, toxicidad química y térmica) posibilita que la necrosis celular obtenida sea más efectiva54.
Trasplante de “salvataje”
en caso de haberse logrado la erradicación de la enfermedad post-resección quirúrgica, aquellos casos que presentan elementos de mal pronóstico en la pieza anatómica (bajo grado de diferenciación o invasión microvascular), así como los que presentan recaída intra-hepática podrían ser candidatos a la realización de trasplante hepático para evitar la progresión del HCC55.
“Down-staging” y terapias puente
Constituyen terapias multimodales en el contexto del trasplante hepático, a las cuales ya se hizo referencia.
Otras combinaciones de estrategias ablativas, resectivas, locorregionales y/o sistémicas
Múltiples son los protocolos de investigación que buscan resultados favorables, tanto en lo que refiere en tiempo de sobrevida global como en tiempo a progresión tumoral al combinar distintas estrategias56. Este es un área del conocimiento médico en el enfoque terapéutico del HCC en constante desarrollo y crecimiento.
Consideración final
Como se ha analizado, los avances en el enfoque clínico de esta patología en los últimos años han sido sustanciales. Las claves actuales, como ocurre con otras enfermedades crónicas, van de la mano de la prevención, la identificación de las poblaciones de riesgo y el estricto seguimiento de las mismas para lograr su detección precoz, siendo este el principal determinante pronóstico. La evidencia actual apoya el abordaje multi e interdisciplinario con el objetivo de ofrecerle al paciente el mejor tratamiento para su estadío. Teniendo en cuenta que es una neoplasia de genio evolutivo poco predecible, frecuentemente muy agresiva, el adecuado uso del tiempo es crucial. Hoy en día el HCC diagnosticado precozmente es un cáncer curable y el Uruguay cuenta con los recursos necesarios para dar respuesta a pacientes portadores de esta patología. El médico internista debe cumplir un rol relevante en la captación y seguimiento del paciente en cada uno de sus estadíos.
Bibliografía
1 Zapata E. Eficacia de los programas de cribado de hepatocarcinoma: ¿Mejoran las opciones terapéuticas de estos pacientes? Revista Española de Enfermedades Digestivas, 2010; 102(8):484-488.
2 Parkin DM, Bray F, Ferlay J, Pisani J. Estimating the world cancer burden: Globalcan 2000. Int. J Cancer 2001; 94:153-156.
3 Barrios E, Vassallo JA, Alonso R, Garau M, Museti C. III Atlas de Incidencia de Cancer en el Uruguay 2002-2006. http://www.urucan.org.uy/uilayer/ve/Atlas_Inc_2002_2006.pdf
4 Caldwell SH, Crespo DM, Scot Kang H, Al-Osaimi AMS. Obesity and hepatocellular carcinoma. Gastroenterology 2004; 127: S97-S103.
5 El-Serag HB, Tran T, Ecerhart JE. Diabetes increases the risk of chronic liver disease and hepatocellular carcinoma. Gastroenterology 2004; 126:460-468.
6 Mohandas KM. Hepatitis B associated hepatocellular carcinoma: Epidemiology, diagnosis and treatment. Hep B Annual 2004;1:140-52.
7 Okuda K, Ohtsuki T, Obata H, Tomimatsu M, Okazaki N, Hasegawa H et al. Natural history of hepatocellular carcinoma and prognosis in relation to treatment study of 850 patients. Cancer, 56: 918–928. doi: 10.1002/1097-0142.
8 V. Mazzaferro, Regalia E, Doci R, Andreola S, Pulvirenti A, Bozzetti F et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996; 334:693-9.
9 Lencioni R, Chen X, Dagher L, Venook A. Treatment of Intermediate/Advanced Hepatocellular Carcinoma in the Clinic: How Can Outcomes Be Improved?. The Oncologist 2010;15 (suppl 4):42-52.
10 Forner A, Ayuso C, Real M, Sastre J, Robles R, Sangro B et al. Diagnóstico y tratamiento del carcinoma hepatocelular. Med Clin (Barc).2009;132(7):272–287.
11 Lee CL, Ko YC. Hepatitis B Vaccination and Hepatocellular Carcinoma in Taiwan Pediatrics Vol. 99 No. 3 March 1, 1997 pp. 351-353.
12 Gerona. S, Valverde M, Menendez J, Scalone P, Rocca A, Leites A et al. Epidemilogical aspects of hepatocellular carcinoma in a referente center of Uruguay (12 years experience). Annals of Hepatology, 2012; 11 (5):799.
13 Quinta encuesta nacional en hogares sobre consumo de drogas. Informe de investigación Mayo 2012.Junta Nacional de Drogas. Observatorio Nacional de Drogas. Presidencia de la República Oriental del Uruguay. Disponible en Infodrogas.gub.uy/images/stories/pdf/v_enc_hogares_2011.pdf
14 Stickel F, Schuppan D, Hahn EG, Seitz, HK. Cocarcinogenic effects of alcohol in hepatocarcinogenesis Gut 2002;51:132–139
15 Schwenger KJ, Allard JP. World J Gastroenterol. 2014 Feb 21;20(7):1712-23. Clinical approaches to non-alcoholic fatty liver disease.
16 Pisabarro R, Gutiérrez M, Bermúdez C, Prendez D, Recalde A,Chaftare Y, Manfred A. Segunda Encuesta Nacional de Sobrepeso y Obesidad (ENSO 2) adultos (18-65 años o más) Rev Med Urug 2009; 25: 14-26
17 Roman S, Jose-Abrego A, Fierro NA, Escobedo-Melendez G, Ojeda-Granados C, Martinez-Lopez E, Panduro A. Hepatitis B virus infection in Latin America: A genomic medicine approach. World J Gastroenterol. 2014 Jun 21;20(23):7181-7196.
18 Mohd Hanafiah K, Groeger J, Flaxman AD, Wiersma ST. Global epidemiology of hepatitis C virus infection: new estimates of age-specific antibody to HCV seroprevalence. Hepatology. 2013 Apr;57(4):1333-42.
19 Ebara M, Ohto M, Shinagawa T, Sugira N, Kimura K, Matsutani, S et al. Natural history of minute hepatocellular carcinoma smaller than three centimeters complicating cirrhosis. A study in 22 patients. Gastroenterology 1990, 90 (2) 289-98.
20 Sheu J, Sung J, Chen D, Lai M, Wang T, Yu J et al. Early detection of hepatocellular carcinoma by real-time ultrasonography. A prospective study Cancer 1985;56 (3) 660-666.
21 Bruix J, Sherman M. AASLD Practice Guidelines: Management of Hepatocellular Carcinoma: An Update Hepatology 2010.
22 Llovet JM, Ducreux M, Lencioni R, Di Bisceglie A, Galle P, Dufour JF et al. EASL AORTEC Clinical Practice Guidelines on Hepatocellular Carcinoma Journal of Hepatology 2012 vol. 56 j 908–943.
23 Méndez-Sánchez N, Ridruejo E, Alves de Mattos A, Chávez-Tapia NC, Zapata R, Paraná R et al. , Latin American Association for the Study of the Liver (LAASL) Clinical Practice Guidelines: Management of Hepatocellular Carcinoma. Ann Hepatol. 2014 May;13 Suppl 1:4-40
24 Hu B, Tian X, Sun J, Meng X. Evaluation of individual and combined aplications of serum biolarkers for diagnosis of hepatocellular carcinoma: a meta-analysis. Int J Mol Sci. 2013 Dec 2;14(12):23559-80.
25 Pollicino T1, Saitta C, Raimondo G. Hepatocellular carcinoma: the point of view of the hepatitis B virus. Carcinogenesis. 2011 Aug;32(8):1122-32.
26 Minami Y1, Kudo M. Hepatic malignancies: Correlation between sonographic findings and pathological features. World J Radiol. 2010 Jul 28;2(7):249-56.
27 Hayashi M1, Matsui O, Ueda K, Kawamori Y, Kadoya M, Yoshikawa J, et al. Correlation between the blood supply and grade of malignancy of hepatocellular nodules associated with liver cirrhosis: evaluation by CT during intraarterial injection of contrast medium. AJR Am J Roentgenol. 1999 Apr;172(4):969-76.
28 El-Serag HB, Marrero JA, Rudolph L, Reddy KR. Diagnosis and treatment of hepatocellular carcinoma. Gastroenterology. 2008 May;134(6):1752-63.
29 Mitchell DG, Bruix J, Sherman M, Sirlin CB. LI-RADS (Liver Imaging Reporting and Data System): Summary, discussion, consensus of the LI-RADS Management Working Group and future directions. Hepatology. 2014 Jul 12. doi: 10.1002/hep.27304.
30 Yopp AC, Mansour JC, Beg MS, Arenas J, Trimmer C, Reddick M, et al. Establishment of a multidisciplinary hepatocellular carcinoma clinic is associated with improved clinical outcome. Ann Surg Oncol. 2014 Apr;21(4):1287-95.
31 Silva MA, Hegab B, Hyde C, Guo B, Buckels JA, Mirza DF. Needle track seeding following biopsy of liver lesions in the diagnosis ofhepatocellular cancer: a systematic review and meta-analysis. Gut. 2008 Nov;57(11):1592-6. doi: 10.1
32 Choi SB, Lee JG, Kim KS. The prognosis and survival analysis according to seven staging systems of hepatocellular carcinoma following curative resection. Hepatogastroenterology 2008;55:2140-2145.
33 Llovet JM, Brú C, Bruix J. Prognosis of hepatocellular carcinoma: The BCLC staging classification. Semin Liver Dis 1999;19:329-338.
34 Mazzaferro V, Bhoori S, Sposito C, Bongini M, Langer M, Miceli R et al. Milan criteria in liver transplantation for hepatocellular carcinoma: An evidence-based analysis of 15 years of experience. Liver Transpl, 17: S44-S57. doi: 10.1002/lt.22365.
35 Mérida L, Poveda F, Camafort M, Rivas F, Martín M, Quirós R, et al Supervivencia a largo plazo del ictus isquémico Rev Clin Esp.2012;212:223-8 - Vol. 212 Num.5
36 Forner A, Llovet JM, Bruix J. Hepatocellular Carcinoma Lancet 2012; 379: 1245–55.
37 Lencioni R. Loco-regional treatment of hepatocellular carcinoma. Hepatology 2010; 52: 762–73.
38 Germani G, Pleguezuelo M, Gurusamy K, Meyer T, Isgro G, Burroughs AK. Clinical outcomes of radiofrequency ablation, percutaneous alcohol and acetic acid injection for hepatocelular carcinoma: a meta-analysis. J Hepatol 2010; 52: 380–88
39 Orlando A, Leandro G, Olivo M, Andriulli A, Cottone M. Radiofrequency thermal ablation vs. percutaneous ethanol injection for small hepatocellular carcinoma in cirrhosis: meta-analysis of randomized controlled trials. Am J Gastroenterol 2009; 104: 514-24
40 Bismuth H, Majno PE. Hepatobiliary surgery. J Hepatol. 2000;32(1 Suppl): 208–24.
41 Bruix J, Castells A, Bosch J, Feu F, Fuster J, Garcia-Pagan JC. Surgical resection of hepatocellular carcinoma in cirrhotic patients: Prognostic value of preoperative portal pressure. Gastroenterology. 1996;111(4):1018–22.
42 Majno PE, Lencioni R, Mornex F, et al. Is treatment of HCC on the waiting list necessary? Liver Transpl 2011; 17 (suppl 2): S98-108.
43 Yao F, Kerlan RK, Hirose R, et al. Excellent Outcome Following Down-Staging of Hepatocellular Carcinoma Prior to Liver Transplantation: An Intention-to-Treat Analysis Hepatology;48(3): 819-27.
44 Lo CM, Ngan H, Tso WK. Randomized controlled trial of lipiodol chemoembolization for unresecable hepatocellular carcinoma. Hepatology 2002;35:1167-1171.
45 Llovet JM, Briux J. Systemic review of randomized trials for unresecable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology 2003: 37:429-442
46 Bruix J,Sala M, Llovet JM. Chemoembolization for hepatocellular carcinoma. Gastroenterology. 2004;127(5Suppl1):S179–88.
47 Varela M, Real MI, Burrel M. Chemoembolization of hepatocellular carcinoma whith drug eluting beads: efficacy and Doxorubicin pharmacokinetics. J of Hepatology 2007; 46: 474-481.
48 Llovet JM, RIcci S, Mazzaferro V, Hilgard P, Gane E. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008 Jul 24; 359(4):378-90. Estudio SHARP.
49 Cheng AL, Kang YK, Chen Z, Tsao CJ, Qin S, Kim JS et al. Efficacy and safety of sorafenib in patients in the Asia–Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebocontrolled trial. Lancet Oncol 2009; 10:25-34. Estudio SHARP Asia
50 Zhang T, Ding X, Wei D, Cheng P, Su X, Liu H et al. Sorafenib improves the survival of patients with advanced hepatocellular carcinoma: a meta-analysis of randomized trials. Anticancer Drugs. 2010 Mar;21(3):326-32.
51 http://www2.msp.gub.uy/andocasociado.aspx?5218,23587
52 Cammà C, Cabibbo G, Petta S, Enea M, Iavarone M, Grieco A; WEF study group; SOFIA study group. Cost-effectiveness of sorafenib treatment in field practice for patients with hepatocellular carcinoma. Hepatology. 2013 Mar;57(3):1046-54.
53 Cabibbo G, Latteri F, Antonucci M, et al. Multimodal approaches to the treatment of hepatocellu-lar carcino-ma. Nat Clin Pract Gastroenterol Hepatol. 2009 Mar;6(3):159-69.
54 Azab M, Zaki S, El-Shetey AG, et al Radiofrequency ablation combined with percutaneous ethanol injection in patients with hepatocellular carcinoma. Arab J Gastroenterol. 2011 Sep;12(3):113-8.
55 Hwang S, Lee SG, Moon DB, et al. Salvage living donor liver transplantation after prior liver re-section for hepatocellular carcinoma. Liver Transpl 2007; 13: 741-6.
56 Dufour JF, Hoppe H, Heim MH, Helbling B, Maurhofer O, Szucs-Farkas Z, et al. Continuous ad-ministration of sorafenib in combination with transarterial chemoembolization in patients with hepatocellular carcinoma: results of a phase I study. Oncologist 2010;15:1198–1220.