Services on Demand
Journal
Article
Related links
Share
Archivos de Medicina Interna
Print version ISSN 0250-3816On-line version ISSN 1688-423X
Arch. Med Int vol.36 no. 1 Montevideo Mar. 2014
Arch Med Interna 2014 - 36(1): 17-27
Revisión
Síndrome Hepatorrenal: abordaje clínico y estrategia terapéutica
Hepatorenal Syndrome: clinical approach and therapeutic strategy
Dr. Marcelo Valverde
Prof. Adj. Clínica Médica. Facultad de Medicina. UdelaR.
UDA - CeNaHBP - HCFFAA. Montevideo.
Dr. Josemaría Menéndez
Ex Res. Medicina Interna - Hepatología Clínica. UDA - CeNaHBP - HCFFAA. Montevideo.
Dra. Daniela Olivari
Medicina Interna - Hepatología Clínica. Asistente de Clínica Médica “C”. Facultad de Medicina - UdelaR.
UDA - CeNaHBP - Servicio de Enfermedades Hepáticas - HCFFAA. Montevideo.
Dra. Paola Scalone
Gastroenterología - Hepatología Clínica. UDA - CeNaHBP - HCFFAA.Montevideo.
Dra. Andrea Rocca
Ex Asist. Clínica Médica. Facultad de Medicina. UdelaR. -Hepatología Clínica. UDA - CeNaHBP - HCFFAA. Montevideo.
Dr. Santiago Acle
Posg. Centro de Nefrología - Hospital de Clínicas. Facultad de Medicina - UdelaR. Montevideo.
Dra. Solange Gerona
Gastroenterología - Hepatología Clínica. UDA - CeNaHBP. Jefa del Programa Nacional de Trasplante Hepático - Unidad Bi-Institucional Hospital de Clínicas - HCFFAA. Montevideo.
Centro de trabajo: UDA Centro Nacional Hepato-Bilio-Pancreático (CeNaHBP) - Servicio de Enfermedades Hepáticas - Hospital Central de las Fuerzas Armadas (HCFFAA) - Unidad Bi-Institucional de Trasplante Hepático (Hospital de Clínicas - HCFFAA)
Correspondencia: Dr. Marcelo Valverde, 8 de octubre 3060 - HCFFAA - Servicio de Enfermedades Hepáticas Teléfono: 24876666 (interno 8180-8183) - 099182687 E- mail: dr.marcelovalverde@gmail.com
Recibido: 29/05/13 - Aceptado: 28/02/14
Resumen:
El síndrome hepatorrenal (SHR) se define como el desarrollo de injuria renal en un paciente cirrótico en ausencia de una causa identificable que la explique. De acuerdo con la velocidad de instalación y la severidad de la falla renal, se describen 2 tipos (tipo I y tipo II). El SHR tipo I se caracteriza por un rápido y progresivo deterioro de la función renal con un pronóstico ominoso, mientras que en el SHR tipo II el desarrollo de la falla renal es de instalación más insidiosa y de menor gravedad, pero de todas formas con un mal pronóstico a corto plazo. La media de sobrevida global de esta entidad es de aproximadamente 3 meses (2 semanas para el SHR tipo I vs. 4 a 6 meses para el SHR tipo II), aunque la implementación de estrategias terapéuticas tiene un claro impacto en el pronóstico. Dado que no existen pruebas de laboratorio específicas para su diagnóstico, éste se basa en datos clínico-analíticos y en la exclusión de otras causas de injuria renal en este contexto. El tratamiento definitivo de esta entidad es el trasplante hepático, siendo los fármacos vasoconstrictores sistémicos análogos de la vasopresina en combinación con albúmina la terapéutica puente de elección a él.
Palabras clave: Síndrome hepatorrenal, Injuria renal, Cirrosis
ABSTRACT:
Hepatorenal syndrome (HRS) is defined as the onset of renal failure without an identifiable cause in a cirrhotic patient. According with the installation speed and the severity of the renal failure, two types are described: type I and type II. Type I is characterized by a rapid and progressive deterioration of renal function with an ominous prognosis. Type II, presents with an insidious and less severe development of renal failure, but always bears a poor short-term prognosis. Although the implementation of therapeutic strategies has a clear impact on the prognosis, the median overall survival of these patients is approximately 3 months (2 weeks for type I HRS vs. 4 to 6 months for type II HRS). Since there are no specific tests for the diagnosis, it is based on a combination of clinical and laboratory data as well as the exclusion of other kinds of renal injury. Systemic vasoconstrictors drugs analogues of vasopressin combined with albumin are the treatment of choice before liver transplantation, which constitutes the definitive treatment of this entity.
Keywords: Hepatorenal syndrome, Renal failure, Cirrhosis
Definición, clasificación y bases fisiopatológicas
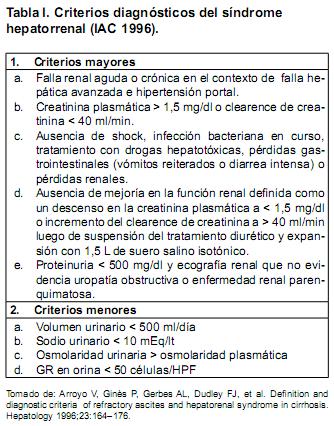
El síndrome hepatorrenal (SHR) se define como el desarrollo de injuria renal en un paciente cirrótico en ausencia de una causa identificable ella.(1) Es de carácter funcional y potencialmente reversible, y ocurre como resultado de la intensa vasodilatación esplácnica que caracteriza al estado hemodinámico de la cirrosis avanzada, que determina el desarrollo de vasoconstricción arteriolar intrarrenal. Como consecuencia de dichas alteraciones se produce una intensa reducción del flujo sanguíneo renal y del filtrado glomerular que explica la falla renal en este contexto. Presenta una incidencia aproximada de un 18% al año y de hasta un 39% a cinco años(2). Su diagnóstico es esencialmente de exclusión, debiendo descartarse otras causas de injuria renal en dicho contexto. En 1994 el Club Internacional de Ascitis definió los criterios para el diagnóstico de SHR tipo I y tipo II(1), los cuales fueron publicados por primera vez en 1996 y modificados posteriormente en 2007(3) (Tablas I y II).
De acuerdo con la velocidad de instalación y la severidad de la falla renal se describen 2 tipos de SHR denominados tipo I y tipo II. El SHR tipo I se caracteriza por un rápido y progresivo deterioro de la función renal que frecuentemente sucede en relación con un factor precipitante. Generalmente ocurre en el contexto de una falla hepática aguda (p. ej. hepatitis alcohólica aguda), en agudizaciones de una enfermedad hepática crónica (“acute on chronic liver failure”), o en pacientes portadores de una cirrosis avanzada después de un proceso precipitante (p. ej. peritonitis bacteriana espontanea [PBE], hemorragia digestiva alta [HDA]), aunque en algunos pacientes puede ocurrir en ausencia de cualquier causa identificable. Por definición el SHR tipo I se plantea cuando el valor de creatinina plasmática aumenta más de 100% del valor inicial con un valor absoluto superior a 2,5 mg/dl, en un plazo menor a 2 semanas. En el SHR tipo II el desarrollo de falla renal es moderada y estable, de instalación más insidiosa y de menor gravedad que en el tipo I. Generalmente se produce en pacientes con ascitis refractaria e hiponatremia, y puede desencadenarse de forma espontánea o tras un evento precipitante (p. ej. PBE).(1) Debe tenerse en cuenta que los pacientes con SHR tipo II también pueden desarrollar un SHR tipo I espontáneamente o tras un evento desencadenante.
Las causas de injuria renal que deben excluirse antes del diagnóstico de SHR incluyen: hipovolemia, shock, enfermedades renales parenquimatosas y utilización de fármacos potencialmente nefrotóxicos. Debe sospecharse la existencia de una nefropatía cuando existe una proteinuria o hematuria significativa, o ante la presencia de alteraciones en la ecografía renal (disminución del tamaño renal, alteraciones de la diferenciación córtico-medular, elementos sugestivos de uropatía obstructiva).
En lo que respecta a los eventos desencadenantes o “gatillo” para el desarrollo del SHR, la intercurrencia de infecciones bacterianas en un paciente cirrótico (principalmente PBE) es el factor de riesgo más importante.(4,5,6,7) Como ejemplo de esta relación, el SHR ocurre en aproximadamente el 30% de los pacientes que presentan una PBE7, y su tratamiento reduce significativamente el riesgo de desarrollar SHR, mejorando la sobrevida.(7) Otros factores de riesgo a considerar son la hemorragia digestiva, la ascitis refractaria y la hiponatremia, así como toda cirrosis descompensada que requiera hospitalización independientemente de la causa que la justifique. Cabe destacar que los pacientes cirróticos que desarrollan injuria renal en el contexto de una infección bacteriana sin shock séptico, presentan alteraciones hemodinámicas, de los sistemas vasoactivos endógenos y de la función renal comparable a las observadas en el SHR “clásico”, lo que sugiere que la fisiopatología de las dos entidades es la misma. Por tanto, en la nueva definición de SHR, la falla renal que se desarrolla en el contexto de una infección pero en ausencia de shock séptico también se cataloga como un SHR “asociado a infección”.
Desde el punto de vista fisiopatológico existen cuatro factores que intervienen en la patogenia del SHR: 1) el desarrollo de vasodilatación esplácnica que provoca una reducción del volumen circulante eficaz con una disminución en la presión arterial media; 2) la activación del sistema nervioso autónomo simpático y del sistema renina-angiotensina-aldosterona que causa vasoconstricción renal y cambios en la autorregulación del flujo renal(8); 3) el desarrollo de miocardiopatía cirrótica con disfunción sistodiastólica, que conduce a una disminución del gasto cardíaco, mecanismo compensador relativo secundario a la vasodilatación sistémica; y por último 4) el aumento de la síntesis de diversos mediadores vasoactivos que pueden afectar el flujo sanguíneo renal o la hemodinamia glomerular (p. ej. leucotrienos, tromboxano A2, F2-isoprostanos, endotelina-1).
Actualmente existe una multiplicidad de teorías y publicaciones acerca de la fisiopatología del SHR que exceden el propósito de esta publicación.(9,10,11)
El pronóstico de los pacientes con cirrosis que desarrollan un SHR continúa siendo pobre, con una media de sobrevida global de aproximadamente 3 meses (en ausencia de tratamiento). De acuerdo con el tipo de SHR y con la gravedad de la enfermedad de base el pronóstico varía, siendo la media de sobrevida de 2 semanas para el SHR tipo I, de 30 días para pacientes con score de MELD elevado(12), y de 4 a 6 meses en pacientes con SHR tipo II. La implementación de estrategias terapéuticas destinadas a prevenir o tratar esta entidad tiene un claro impacto en el pronóstico y establecer un diagnóstico precoz es fundamental para mejorar la sobrevida. A pesar de los notables avances en lo que respecta a las técnicas de laboratorio, continúa siendo la monitorización estricta de la función renal el pilar fundamental para su identificación temprana.
Estimación de la función renal y algoritmo diagnóstico
La evaluación de la función renal debe realizarse de manera rutinaria en todos los pacientes con cirrosis avanzada (principalmente en aquellos con ascitis) mediante la solicitud de creatinina plasmática. El diagnóstico de injuria renal en pacientes cirróticos se establece cuando ésta es > 1,5 mg/dL. Sin embargo, si bien este método es el más práctico y ampliamente aceptado para la estimación de la función renal en la práctica clínica, su determinación en pacientes cirróticos podría ser inexacta, ya que subestimaría la disfunción renal debido a una menor producción de creatinina por parte del hígado, sumado a la disminución en el consumo de proteínas, a la malnutrición proteica y a la pérdida de masa muscular que presentan estos pacientes.(13,14) Además, si se utiliza el el método de Jaffe (colorimétrico), se puede subestimar la concentración plasmática de creatinina por la interferencia de la hiperbilirrubinemia.(15) Por dicha razón, debe tenerse en cuenta que valores de creatinina plasmática > 1,5 mg/dL se corresponden con una disminución significativa del filtrado glomerular (≤ 30 ml/min.), y valores entre 1 y 1,5 mg/dL pueden estar asociados con tasas de filtración glomerular entre 30 y 60 ml/min. La solicitud de clearence de creatinina como parámetro de depuración renal sería de mayor utilidad, ya que correlaciona la concentración de creatinina plasmática con su excreción urinaria. Sin embargo, los valores de depuración obtenidos por esta técnica tienden a sobreestimar el filtrado glomerular en pacientes con insuficiencia renal en hasta un 40% o más, debido al incremento de la secreción de creatinina.(16,17) En los últimos años la cistatina C se ha posicionado como un marcador sensible para evaluar la función renal.
Sin embargo estudios recientes han demostrado que, al igual que la dosificación de creatinina plasmática, la concentración de cistatina C se ve afectada por la edad, el género, la masa muscular y la concomitancia de enfermedad hepática avanzada.(18,19) El cálculo del filtrado glomerular mediante el clearence de inulina o radioisótopos constituiría la forma más precisa de estimar la función renal, pero su determinación es técnicamente compleja y de mayor costo, además de no existir estudios de validación en pacientes con cirrosis avanzada.(20,21,22) Las ecuaciones utilizadas para el cálculo del filtrado glomerular (p. ej. Cockcroft-Gault, MDRD, CKD-EPI) son ampliamente utilizadas para la población general, pero tienden a sobreestimar la función renal en cirróticos, por lo cual no han sido validadas para este grupo de pacientes. A futuro sería de utilidad contar con una ecuación específica para el cálculo del filtrado glomerular en pacientes con cirrosis avanzada. Asimismo habría que evaluar el papel de los biomarcadores de injuria renal como NGAL (lipocalina asociada a gelatinasa de neutrófilos), IL-18 y KIM-1 (molécula de injuria renal 1) en el contexto de la falla renal del paciente cirrótico. Por lo anteriormente expuesto, a pesar de sus limitaciones, la creatininemia debe considerarse el parámetro de referencia para la valoración de la función renal en el paciente cirrótico, y debe monitorizarse estrechamente para realizar un diagnóstico oportuno de injuria renal.
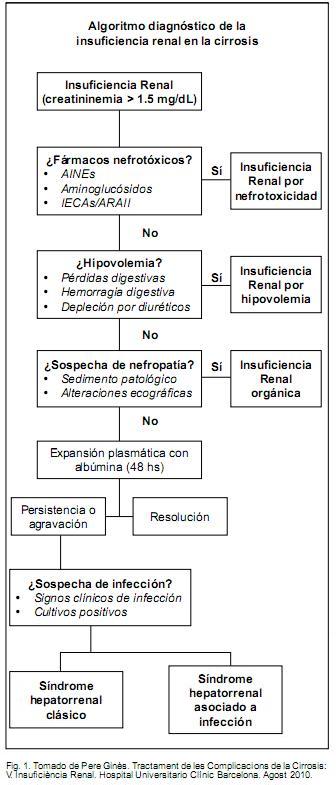
A continuación se presenta un algoritmo diagnóstico de los diferentes tipos de insuficiencia renal que pueden desarrollarse en el contexto del paciente cirrótico elaborado por Pere Ginès en 2010 (Figura 1)(23). Dado que no existen pruebas específicas para el diagnóstico de los diferentes tipos de insuficiencia renal, éste se basará en una combinación de datos clínicos y analíticos, así como en la exclusión de otros tipos de injuria renal.
De acuerdo con dicho algoritmo el diagnóstico diferencial de la insuficiencia renal en los pacientes con cirrosis incluye cuatro fases secuenciales:
1. Descartar nefrotoxicidad por fármacos: los fármacos que con más frecuencia pueden producir insuficiencia renal en los pacientes con cirrosis hepática son los antiinflamatorios no esteroideos (AINEs), aminoglucósidos, vasodilatadores, inhibidores de la enzima conversora de angiotensina (IECAs) y los antagonistas de los receptores de angiotensina II (ARAII). Aunque el vínculo causa-efecto no se puede establecer de una manera absolutamente concluyente si existe una relación cronológica clara entre la administración de uno de estos fármacos y el desarrollo de injuria renal. La implicancia patogénica del fármaco es altamente probable.
2. Evaluar hipovolemia: la segunda fase en el diagnóstico diferencial de la injuria renal en la cirrosis consiste en la evaluación de posibles pérdidas de volumen intravascular relacionadas con pérdidas digestivas (hemorragia digestiva, vómitos y/o diarrea), urinarias (diuresis excesiva secundaria a diuréticos) o iatrogénicas (paracentesis de gran volumen sin expansión apropiada). Se requiere una hipovolemia importante para provocar falla renal, de manera que es altamente improbable que hemorragias digestivas clínicamente no significativas o pérdidas digestivas de escasa cuantía sean su causa. En estas situaciones hay que buscar siempre otra causa que explique la injuria renal. Las pérdidas urinarias como consecuencia de una diuresis excesiva secundaria al tratamiento diurético son una causa frecuente de falla renal en los pacientes con ascitis. El riesgo aumenta significativamente cuando la pérdida media de peso en pacientes con ascitis sin edemas supera los 500 g/día y en pacientes con edemas supera los 1.000-1.500 g/día. El cuadro clínico característico de injuria renal secundaria a diuréticos ocurre en aquellos pacientes con diuresis elevadas y pérdida de peso importante en los últimos días, que se presentan con signos de deshidratación y con escasas o nulas manifestaciones del síndrome ascítico-edematoso. En la mayoría de los casos la falla renal no es severa y los pacientes consultan por signos de deshidratación y/o encefalopatía hepática, siendo excepcional que presenten elementos clínicos de uremia. La mayor parte de pacientes presentan también hiponatremia e hiperpotasemia. El cuadro clínico suele ser muy característico, de modo que en la mayoría de los casos no es necesario evaluar parámetros hemodinámicos (p. ej. presión venosa central) para confirmar el diagnóstico de hipovolemia. En otros casos la falla renal se produce durante el tratamiento diurético sin que se haya producido una respuesta diurética muy intensa, o incluso en ausencia de respuesta. El mecanismo patogénico de la insuficiencia renal en estos pacientes no es bien conocido, sin embargo ésta revierte al interrumpir el tratamiento diurético.
3. Considerar enfermedades renales intrínsecas: los pacientes con cirrosis pueden desarrollar injuria renal debido a enfermedades renales intrínsecas (nefropatías propiamente dichas) tales como glomerulopatías, nefropatías túbulo-intersticiales, nefropatía diabética o nefropatía hipertensiva. De todas ellas solamente se ha establecido una relación patogénica con la cirrosis en el caso de las glomerulonefritis secundarias al depósito de inmunocomplejos, que pueden producirse en el contexto de la cirrosis por el virus de las hepatitis C y B, así como en la cirrosis alcohólica. En estas etiologías de la cirrosis la existencia de alteraciones histológicas sugestivas de glomerulonefritis es muy frecuente, tal como se ha demostrado en estudios necrópsicos y en pacientes sometidos a trasplante hepático a quienes se ha realizado biopsia renal. Sin embargo, sólo en una pequeña proporción de casos las alteraciones histológicas glomerulares son de intensidad suficiente para provocar una reducción importante del filtrado glomerular que determine falla renal. En estos casos normalmente existen alteraciones del sedimento urinario (hematuria, presencia de cilindros hialinos y proteinuria). Si la hemostasis y la situación clínica del enfermo lo permiten es importante contar con una biopsia renal para confirmar el diagnóstico específico de la alteración glomerular responsable de la falla renal. En caso de que no sea posible hacer una biopsia renal, el diagnóstico de glomerulopatía asociada a la cirrosis hepática se basa en la presencia de hematuria y/o proteinuria en un contexto clínico adecuado (cirrosis hepática alcohólica o por virus C o B) en ausencia de otras enfermedades que puedan asociarse a nefropatía (p. ej. diabetes mellitus). Debe tenerse en cuenta que la Enfermedad de Wilson puede asociar falla hepática e injuria renal, principalmente en el contexto de la denominada “crisis wilsoniana”. El diagnóstico de falla renal debido a otras enfermedades renales tales como nefritis túbulo-intersticial o nefropatía hipertensiva o diabética, se basa en los criterios diagnósticos habituales.
4. Screening de infecciones bacterianas intercurrentes: las infecciones bacterianas son la causa más frecuente de injuria renal en pacientes con cirrosis hepática en el ámbito hospitalario. La falla renal se observa en aproximadamente el 30% de los pacientes con cirrosis hepática e infecciones bacterianas intercurrentes. La PBE es el ejemplo paradigmático de infección bacteriana responsable de falla renal, aunque otros tipos de infecciones bacterianas inespecíficas también la pueden desencadenar, en especial las respiratorias, las que comprometen piel y partes blandas, las bacteriemias y la sepsis sin foco clínico evidente. En el contexto de la PBE la frecuencia de injuria renal es de 30%, pero se reduce hasta el 10% con la administración de albúmina. Dada la elevada incidencia de infecciones y falla renal en el contexto de la cirrosis se justifica la búsqueda exhaustiva de un proceso infeccioso intercurrente en todo paciente cirrótico que desarrolle falla renal.
La investigación debe incluir signos clínicos sugestivos (fiebre, elementos de respuesta inflamatoria sistémica, dolor abdominal, tos productiva, sintomatología urinaria, evidencia de infección de piel y partes blandas), así como datos analíticos y microbiológicos (leucocitosis con fórmula, VES, proteína C reactiva, procalcitonina, radiografía de tórax, paracentesis diagnóstica con recuento de PMN, sedimento urinario, urocultivo y hemocultivos). Cuando la falla renal ocurre en el contexto de infecciones bacterianas, en ausencia de shock séptico, persiste a pesar de una adecuada expansión con albúmina y cumple con los criterios de SHR, se cataloga como SHR asociado a infección.
5. Síndrome hepatorrenal: por último cabe acotar que el SHR es un diagnóstico de exclusión. Si tras una investigación exhaustiva no existe ninguna evidencia de administración de fármacos nefrotóxicos, hipovolemia, shock o enfermedades renales intrínsecas, y la falla renal persiste, entonces se debe plantear dicho diagnóstico.(23)
Manejo terapéutico: prevención, medidas generales y tratamiento específico
Prevención
El reconocimiento oportuno de los factores de riesgo para el desarrollo del SHR en un individuo cirrótico o cursando una hepatitis aguda grave es fundamental para poder instituir medidas preventivas que logren evitar el desarrollo de esta grave complicación.
Albúmina
Los pacientes cirróticos con PBE y aquellos que presentan cifras de PAS < 90 mmHg deberían ser tratados con albúmina intravenosa ya que esta medida ha demostrado disminuir la incidencia de SHR y mejorar la sobrevida.
Pentoxifilina
De acuerdo con los resultados de un estudio aleatorizado y doble ciego, el tratamiento a corto plazo (4 semanas) con pentoxifilina (400 mg/8 h) tendría impacto en la prevención del SHR en pacientes con hepatitis alcohólica grave.(24) Otra serie demostró que en este tipo de pacientes, la administración de pentoxifilina a razón de 400 mg/8 horas por 28 días reduce la incidencia de SHR (8 a 24%), así como la mortalidad (35 a 46%) respecto al grupo control.(25)
Por su parte, un estudio reciente demostró que el tratamiento con pentoxifilina no se asoció con una mejoría en la sobrevida, aunque sí demostró una reducción en la incidencia de complicaciones (incluyendo la falla renal) en la cirrosis avanzada(26). Se necesitan más estudios para establecer la utilidad de la pentoxifilina en la prevención del desarrollo de SHR en los pacientes con cirrosis con el objetivo de establecer formalmente su indicación.
Norfloxacina
Según un estudio aleatorizado doble ciego, el tratamiento con norfloxacina (400 mg/día) como profilaxis primaria de la PBE redujo la incidencia del SHR en la cirrosis avanzada(27). En aquellos pacientes con un bajo tenor proteico en el líquido ascítico (< 15 g/L), asociado a un franco deterioro de la función hepática y/o renal (BT > 3 mg/dL, Child-Pugh > 10, natremia < 130 mEq/L, o creatininemia > 1,2 mg/dL), la administración prolongada de norfloxacina (400 mg/día) reduce el riesgo de SHR y mejora la sobrevida. Sin embargo no existe suficiente evidencia científica para realizar su indicación sistemática como profilaxis del SHR.
Nefroprevención
Debe evitarse la administración de aminoglucósidos, AINEs, IECAs y ARAII en pacientes con cirrosis avanzada. En aquellos casos en los que sea necesaria la realización de estudios radiológicos contrastados debe indicarse tratamiento preventivo de nefropatía inducida por contraste, con estricta monitorización de la función renal.
Medidas generales
El tratamiento debe instituirse tan pronto como sea posible con el objetivo de evitar la progresión de la falla renal y la morbimortalidad vinculada a ella. El paciente debe ser ingresado en una unidad de cuidados intensivos o intermedios, con una estricta monitorización clínico-analítica, incluyendo signos vitales, manifestaciones clínicas vinculadas a la falla hepática e hipertensión portal, diuresis horaria, presión venosa central, función renal, medio interno y función hepática. Debe evaluarse la existencia de un proceso infeccioso en curso mediante estudios microbiológicos (cultivos), reactantes de fase aguda e imagenología (p. ej. radiografía de tórax), e instituirse el tratamiento antibiótico oportunamente. Asimismo debe descartarse la hemorragia digestiva como factor desencadenante o coadyuvante del cuadro clínico, mediante una adecuada valoración clínica, analítica y eventualmente endoscópica.
Manejo del balance hidrosalino
Es estrictamente necesario realizar una adecuada monitorización hemodinámica y del balance hídrico como parámetros clínicos del estado hemodinámico del paciente cirrótico, sustrato fundamental para el desarrollo del SHR. Sin embargo, los parámetros clínicos clásicos (p. ej. frecuencia cardíaca, presión arterial, relleno capilar, relleno venoso) son insuficientes, y en algunos casos deberían complementarse con la valoración de la presión venosa central (PVC) y con parámetros ecocardiográficos (p. ej. diámetro de vena cava inferior, parámetros de fin de diástole)(28,29), para lograr una aproximación más fiel del perfil hemodinámico del paciente cirrótico.
La estrategia clave es prevenir la hipoperfusión renal, para lo cual es fundamental mantener un adecuado volumen circulante eficaz. Por su parte, debe evitarse el aporte excesivo de volumen para prevenir manifestaciones de hipervolemia y el desarrollo o progresión de la hiponatremia dilucional, que generalmente coexiste en estos casos. Debe recordarse que estos pacientes presentan alteraciones en la capacidad renal para excretar sodio, pero también en los mecanismos de eliminación de agua libre.
En dichas condiciones fisiopatológicas, la retención renal de agua es proporcionalmente superior a la de sodio, por lo cual la natremia habitualmente es < 135 mEq/L. Por tanto debe limitarse la administración de líquidos vía oral, así como las soluciones hipotónicas por vía intravenosa. Si bien la cantidad de aporte diario debe ser individualizada para cada paciente, como regla general la cantidad de aporte total (oral y parenteral) en casos de hiponatremia debe ser < 1.500 ml/día. Asimismo es importante reducir el aporte de sodio (vía oral y/o parenteral) porque este tipo de falla renal ocurre en el contexto de un aumento del líquido extracelular con ascitis, edemas e hiponatremia dilucional, por lo cual la administración de sodio puede producir un balance positivo, aumentando el síndrome ascítico-edematoso y agravando aun más la hiponatremia.
Tratamiento antibiótico
Es fundamental que aquellos pacientes con un proceso infeccioso bacteriano inespecífico en curso reciban tratamiento antibiótico precozmente. Por su parte, los pacientes bajo tratamiento antibiótico profiláctico para el desarrollo de PBE deben mantenerlo durante el curso del SHR. Sin embargo no existen datos que avalen el uso de antibióticos como tratamiento empírico de infecciones no probadas en pacientes cirróticos para prevenir o evitar la progresión del SHR.
Betabloqueantes
No existen datos acerca del impacto de mantener o suspender el tratamiento con betabloqueantes en pacientes con SHR que se encuentran bajo tratamiento preventivo de la hemorragia variceal.
Paracentesis evacuadora
No existe suficiente evidencia respecto al papel de la paracentesis evacuadora en pacientes con SHR tipo I. Dado que la evacuación de líquido ascítico (aun bajo expansión con albúmina) puede agravar la disfunción circulatoria del paciente cirrótico deberían evitarse paracentesis evacuadoras de gran volumen.
Sin embargo su indicación está justificada en aquellos casos con ascitis a tensión como única medida efectiva de soporte sintomático ya que estos pacientes tienen contraindicación para el tratamiento diurético estándar. En el SHR tipo II puede realizarse dicho procedimiento, con adecuada expansión plasmática y estricta monitorización clínico-analítica.
Diuréticos
Los diuréticos deben ser suspendidos en aquellos pacientes con planteo de SHR tipo I. No hay datos que apoyen el uso del furosemide, sin embargo su administración puede ser útil para mantener la diuresis en aquellos pacientes con sobrecarga de volumen. La espironolactona está contraindicada formalmente debido al elevado riesgo de hiperpotasemia potencialmente mortal. Los pacientes con SHR tipo II (con falla renal moderada) y ascitis pueden recibir diuréticos bajo estricta vigilancia de parámetros clínicos (diuresis, hemodinamia sistémica) y analíticos (función renal, ionograma, natriuria) debiendo mantener el mismo en caso de existir buena respuesta y ausencia de complicaciones.
Tratamiento específico
Tratamiento farmacológico - fármacos vasoconstrictores sistémicos
El tratamiento de elección para el SHR tipo I es la administración de fármacos vasoconstrictores sistémicos pertenecientes al grupo de análogos de la vasopresina.(30) El fundamento para su uso en el contexto del SHR es que este grupo de fármacos mejora la disfunción circulatoria propia de la cirrosis avanzada a través de la vasoconstricción del lecho esplácnico (extremadamente dilatado), mejorando la presión arterial media y la presión de perfusión renal.(31,32) Según una revisión sistemática reciente de estudios aleatorizados con vasoconstrictores, se ha demostrado que el tratamiento con terlipresina se asocia con una franca mejoría de la función renal y disminuye significativamente las tasas de mortalidad (OR -0.34, IC del 95%: -0.56 a -0.12).-(33) Dos grandes ensayos aleatorizados y controlados fueron publicados posteriormente, en los cuales se asignaron al azar a terlipresina más albúmina o albúmina sola.
La mejoría de la función renal fue significativamente mayor en el grupo con terlipresina (44% versus 9%), aunque la sobrevida a tres meses fue similar en ambos grupos(34) (Tablas III y IV). De acuerdo con los datos disponibles, dicho tratamiento es efectivo en aproximadamente el 40-50% de los pacientes.(5,15) La terlipresina generalmente se inicia con una dosis de 1 mg/4-6 h, pudiendo incrementarse la dosis hasta un máximo de 2 mg/4-6 h en aquellos casos en los que no exista reducción de la creatinina plasmática en al menos un 25% respecto al valor basal a las 48-72 hs. El tratamiento debe mantenerse hasta que la creatinina plasmática haya disminuido por debajo de 1,2-1,5 mg/dL (respuesta completa), de existir respuesta pero no cumplirse dicho objetivo debe suspenderse a los 14 días del inicio del tratamiento. En casos de no respuesta el tratamiento debe suspenderse en un plazo máximo de 7 a 10 días.
La respuesta al tratamiento se caracteriza por una reducción lenta y progresiva de la creatinina plasmática acompañada de un aumento de la presión arterial, diuresis y natremia. El tiempo promedio de respuesta es de 14 días, por lo general depende de los valores de creatinina plasmática pre-tratamiento, siendo esta más rápida cuanto menor sea la creatininemia basal al diagnóstico.(35) Otros parámetros predictivos de buena respuesta son los valores de bilirrubina plasmática pre-tratamiento < 10 mg/dL, y un aumento de la presión arterial media > 5 mmHg al 3er. día del inicio del tratamiento.(17) La recurrencia post-suspensión del tratamiento es poco común, y el retratamiento con terlipresina es generalmente eficaz. El efecto secundario más frecuente es la isquemia miocárdica, esplácnica o digital, que ocurre en hasta un 12% de los pacientes.(5,15) Es importante destacar que la mayoría de los estudios excluyeron a pacientes con cardiopatía isquémica, enfermedad vascular periférica, enfermedad cerebrovascular, o con un riesgo cardiovascular absoluto muy elevado. En la mayoría de los estudios la terlipresina se administró en combinación con albúmina (1 g/kg en el día 1 seguido de 20 a 40 g/día) para mejorar la eficacia del tratamiento(36). En aquellos casos en los que existan signos de sobrecarga de volumen o la PVC se eleve a > 15 cmH2O debe suspenderse la administración de albúmina y agregar furosemide hasta normalizar la volemia. En lo que refiere a otras estrategias terapéuticas, la octapresina (u ornipresina) administrada en conjunto con regímenes de expansión plasmática o en asociación con la realización de un shunt peritoneo-venoso (para reducir la liberación de sustancias vasoconstrictoras renales), produjo un aumento en la tasa de filtrado glomerular,(37,38) sin embargo este régimen además de ser invasivo y complejo técnicamente podría inducir isquemia renal significativa.-(39)
Otros agentes vasoconstrictores utilizados en el tratamiento del SHR tipo I incluyen noradrenalina y midodrina asociada a octreotide, administrados en combinación con albúmina. En ambos planes terapéuticos existió una mejoría de la función renal, pero el número de pacientes incluidos fue escaso y los estudios no fueron realizados contra grupos control sin tratamiento vasoconstrictor (Tabla V).(40,41) Un estudio realizado por Duvoux et al. en el 2002, que incluyó pacientes con SHR tipo I tratados con noradrenalina y albúmina, mostró una disminución significativa de los valores de creatinina plasmática en el 83% de los pacientes, no existiendo evidencia del impacto en términos de sobrevida(42). Los datos publicados sugieren que la terapia de combinación con midodrina (agonista selectivo alfa-1 adrenérgico) y octeotride (análogo de la somatostatina) puede ser altamente eficaz y segura, mientras que el tratamiento con cada uno de ellos de forma independiente no parecería ser beneficioso. La base racional para su utilización se sustenta en que la midodrina es un vasoconstrictor sistémico y el octeotride es un inhibidor de la liberación de agentes vasodilatadores endógenos, por lo cual la terapia combinada podría mejorar tanto la hemodinamia renal como la sistémica.(43)
En un estudio que comparó esta combinación contra dopamina, la midodrina con octeotride fue más eficaz en términos de recuperación de la función renal y en sobrevida.(44) En otro estudio que comparó este tratamiento combinado contra un grupo control con tratamiento estándar se demostró una reducción significativa de la mortalidad (49% vs. 67%) y una mayor reducción de la creatinina plasmática a menos de 1,5 mg/dL (30% vs. 14%)(45). Por último, el tratamiento de terlipresina combinada con albúmina en pacientes con SHR tipo II también se asociaría con una mejoría de la función renal en hasta un 60 a 70% de los pacientes, no obstante existe todavía escasa información sobre el uso de la terlipresina en estos casos.(46,47)
En algunos centros de referencia se indica tratamiento con terlipresina y albúmina en aquellos pacientes con SHR tipo II con creatininemia > 2 mg/dL que están en lista de espera de trasplante hepático, con el objetivo de lograr optimizar la función renal previo al trasplante, dado el impacto que esto determina en la sobrevida postrasplante.
En suma, en base a lo expuesto previamente, el tratamiento de primera línea en el SHR tipo I debe incluir la asociación de terlipresina en combinación con albúmina. El objetivo de la terapia debe ser lograr la mejoría de la función renal suficientemente como para disminuir la creatinina plasmática a < 1,5 mg/dL (respuesta completa). Si la creatinina sérica no disminuye al menos 25% después de 3 días de tratamiento, la dosis de terlipresina se debe aumentar de forma gradual hasta un máximo de 2 mg/4 hora. Para aquellos casos con respuesta parcial o sin respuesta, el tratamiento debe ser interrumpido en un plazo de 14 días. Otros estudios avalan la suspensión de la terlipresina si no hay reducción de la creatinina al tercer día de iniciado el fármaco. Las contraindicaciones para la terapia con terlipresina incluyen las enfermedades cardiovasculares (particularmente la cardiopatía isquémica), la enfermedad vascular periférica, la enfermedad cerebrovascular y la hipertensión arterial no controlada. Los pacientes tratados con terlipresina deben ser estrictamente monitorizados para detectar oportunamente el desarrollo de arritmias, isquemia miocárdica, esplácnica o digital e insuficiencia cardíaca, en cuyo caso debe modificarse la dosis o suspenderse el tratamiento.
Si bien es poco frecuente, en aquellos casos en los cuales exista recidiva del SHR tras la suspensión del tratamiento con terlipresina, el mismo debe reiniciarse, ya que generalmente existe buena respuesta con la reintroducción del fármaco.
Derivación portosistémica intrahepática por vía transyugular (TIPS)
Existen pocos estudios destinados a evaluar el rol del TIPS en el SHR(48,49) (Tabla VI). Un ensayo que incluyó 16 pacientes a los que se les colocó un TIPS (6 con SHR) demostró una reducción significativa de la creatininemia y un aumento concomitante en la excreción urinaria de sodio en un plazo de 2 semanas post-procedimiento(50)-.
Dicha respuesta fue seguida de una mejoría discreta pero sostenida de la función renal en las siguientes seis a ocho semanas. En otra serie fueron evaluados 7 pacientes con SHR, en los cuales la colocación de TIPS se asoció con una mejora gradual de la tasa de filtrado glomerular (9 a 27 ml/min), de la concentración de creatinina plasmática, así como una reducción en la actividad de los sistemas renina-angiotensina-aldosterona y autónomo simpático, lo cual sugiere una evidente mejoría en la hemodinamia sistémica(51)-.
El promedio de sobrevida después de la colocación del TIPS fue de aproximadamente cinco meses, significativamente mayor que la esperable sin dicho procedimiento. Por su parte, el TIPS ha demostrado ser una alternativa terapéutica útil para mejorar la función renal y el control de la ascitis en pacientes con SHR tipo II en el contexto de ascitis refractaria, pero no ha demostrado un impacto significativo en términos de sobrevida(52)-.
Diferentes series demostraron una marcada tendencia a la mejoría de la función renal, con aumento en la tasa de filtrado glomerular y mejoría de la creatininemia en este grupo de pacientes(53)-. A pesar de los beneficios analizados, su aplicabilidad en la práctica clínica podría ser limitada porque un número significativo de pacientes tienen contraindicaciones para su utilización, tales como bilirrubina sérica > 5 mg/dL, INR > 2, Child-Pugh > 11, encefalopatía hepática manifiesta y enfermedad cardiopulmonar severa(54)-. Con el objetivo de seleccionar adecuadamente aquellos pacientes candidatos a TIPS se diseñó un sistema de puntuación basado en el modelo predictivo de supervivencia aplicado en 231 pacientes(55)-. Sobre la base de este modelo, a los pacientes con un score MELD > 18 no deberían colocárseles TIPS ya que tendrían una sobrevida media menor a tres meses post-procedimiento.
En conclusión, estos resultados sugieren que en determinados pacientes con SHR, la colocación de un TIPS puede proporcionar beneficios a corto plazo. Teniendo en cuenta los riesgos asociados con el procedimiento, debe ser considerado sólo como último recurso en pacientes que no son candidatos a trasplante hepático, o como terapia puente en aquellos que se encuentran en lista de espera para el mismo.
Derivación peritoneo-venosa quirúrgica
La realización de una derivación peritoneo-venosa quirúrgica puede mejorar la hemodinamia sistémica y producir una discreta reducción de la concentración de creatinina plasmática, pero no ha demostrado una mejoría en términos de sobrevida(56). Por su parte debe tenerse en cuenta que es un procedimiento invasivo, no exento de complicaciones, lo que debería limitar su indicación a situaciones en las cuales no exista otra alternativa terapéutica disponible.
Terapia de reemplazo renal
La terapia de sustitución renal mejora la sobrevida a corto plazo en los pacientes cirróticos portadores de injuria renal aguda reversible con indicación de hemodiálisis de urgencia(57)-. No existen estudios que comparen los resultados de la terapia de reemplazo renal contra el tratamiento médico estándar. Sin embargo, debe tenerse en cuenta que aquellas condiciones que habitualmente definen la necesidad de terapias de sustitución de la función renal (p. ej. hiperpotasemia grave, acidosis metabólica, sobrecarga de volumen) son aplicables para casos de SHR. Por tanto, la terapia de reemplazo renal es de utilidad en pacientes que no responden al tratamiento médico estándar con fármacos vasoconstrictores y que cumplan con los criterios de inclusión habitual para el tratamiento sustitutivo de la función renal. Respecto a la técnica, tanto la hemodiálisis como la hemofiltración han sido utilizadas para el tratamiento del SHR tipo I(58,59)-.
Las terapias de reemplazo renal continuo presentan ventajas técnicas respecto a las intermitentes, y son de preferencia en aquellos pacientes hemodinámicamente inestables o con riesgo de desarrollar hipertensión endocraneana, tal como ocurre en el contexto de la falla hepática fulminante o en casos de falla hepática aguda sobre crónica (acute on chronic liver failure)(60, 61).
Terapia de soporte hepático artificial
Dado que en el sustrato etiopatogénico y fisiopatológico de la falla hepática subyace la acumulación de toxinas endógenas (bilirrubinas, amonio, lactato, glutamina, benzodiacepinas endógenas, citoquinas proinflamatorias, etc.), durante décadas se ha priorizado la investigación de sistemas extracorpóreos de detoxificación con el objetivo de eliminar dichas sustancias.
Para entender el funcionamiento de los métodos de soporte hepático hay que considerar que en el plasma del paciente con falla hepática se acumulan sustancias hidrosolubles (no unidas a albúmina) e hidrofóbicas (unidas a albúmina). Para este último tipo de sustancias, los principios biofísicos de la hemodiálisis convencional (difusión y convección) no son útiles, debiendo utilizarse técnicas especiales como la aféresis, adsorción y difusión facilitada a través de diálisis con albúmina(62) (MARS®/Prometheus®). Existe evidencia disponible sobre la utilidad de los sistemas de soporte hepático artificial en pacientes con SHR tipo I, sin embargo son necesarios mayor número de estudios para confirmar dichos hallazgos(63,64) (Tabla VII). Con respecto al parámetro de mayor peso “per se” como la sobrevida, el ensayo HELIOS demostró un impacto estadísticamente significativo con la utilización de terapia de fraccionamiento plasmático con separación de albúmina y aféresis (FPSA) (Prometheus®) en aquellos pacientes cursando un AoCLF con score de MELD > 30 (p = 0,02) o con SHR tipo I (p = 0,04)(65).
Por su parte, si bien aún resta mucho por definir en relación a las situaciones específicas en las cuales el beneficio de la aplicación de esta técnica es indiscutible, existe firme evidencia del impacto clínico y bioquímico obtenido debido a la capacidad de detoxificación de estos sistemas. La indicación puntual de esta terapéutica podría quedar reservada para aquellas situaciones que ocurren en el contexto de la injuria hepática aguda (o aguda sobre crónica) que libradas a su evolución natural determinan un pronóstico ominoso, como es el caso del SHR. De todas formas debe considerarse como una terapia “puente” hasta el trasplante hepático o hasta la resolución espontánea del cuadro clínico, y por ende ser técnicas de aplicación limitadas en el tiempo.
Trasplante hepático
El trasplante hepático es el tratamiento de elección para el SHR tipo I y II, por lo cual aquellos pacientes con dicho diagnóstico deben ser evaluados para su ingreso a lista de espera. Las tasas de sobrevida son de aproximadamente 65% en el SHR tipo I.(66) La menor tasa de sobrevida en comparación con los pacientes sin SHR se debe a que la injuria renal es un predictor de mala evolución post-trasplante. Debe tenerse en cuenta que los pacientes con SHR tipo I tienen una elevada mortalidad en lista de espera por lo que deberían ser priorizados para el trasplante. Aunque no existen estudios prospectivos, el tratamiento “puente” del SHR con fármacos vasoconstrictores combinados con albúmina en el pretrasplante, puede mejorar los resultados post-trasplante, por lo cual todo paciente con SHR debe recibir el tratamiento médico estándar previo al trasplante.(67) Por último, la reducción de los niveles de creatinina sérica post-tratamiento y el consiguiente descenso en la puntuación MELD no debe cambiar la decisión ni la priorización en lista, ya que el pronóstico después de la recuperación del SHR tipo I continúa siendo ominoso. No parece haber ninguna ventaja en el uso combinado de trasplante hepático y renal versus trasplante hepático en pacientes con SHR tipo I, con la excepción del subgrupo de pacientes que hayan requerido terapia de sustitución renal prolongada (> 6-12 semanas), valores elevados de creatinina plasmática, u otros factores de riesgo para la progresión de la falla renal (HTA, diabetes, obesidad), dada la baja probabilidad de obtener la recuperación de la función renal en dichos casos.(68,69) Dado que no existe sólida evidencia sobre el impacto específico de los factores analizados en la recuperación de la función renal, la decisión del trasplante combinado hepatorrenal debe ser considerada caso a caso.
BIBLIOGRAFÍA
1. Arroyo V, Ginès P, Gerbes AL, Dudley FJ, Gentilini P, Laffi G, et al. Definition and diagnostic criteria of refractory ascites and hepatorenal syndrome in cirrhosis.
Hepatology 1996;23:164-176.
2. Ginès A, Escorsell A, Ginès P, Saló J, Jiménez W, Inglada L, et al. Incidence, predictive factors, and prognosis of the hepatorenal syndrome in cirrhosis with ascites.
Gastroenterology 1993;105:229-236.
3. Salerno F, Gerbes A, Ginès P, Wong F, Arroyo V. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Gut 2007;56:1310-1318.
4. Sort P, Navasa M, Arroyo V, Aldeguer X, Planas R, Ruiz del Arbol L, et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and
spontaneous bacterial peritonitis. N Engl J Med 1999;341:403-409.
5. Fasolato S, Angeli P, Dallagnese L, Maresio G, Zola E, Mazza E, et al. Renal failure and bacterial infections in patients with cirrhosis: epidemiology and clinical features.
Hepatology 2007;45:223-229.
6. Thabut D, Massard J, Gangloff A, Carbonell N, Francoz C, Nguyen-Khac E, et al. Model for end-stage liver disease score and systemic inflammatory response are major
prognostic factors in patients with cirrhosis and acute functional renal failure. Hepatology 2007;46:1872-1882.
7. Terra C, Guevara M, Torre A, Gilabert R, Fernández J, Martín-Llahí M, et al. Renal failure in patients with cirrhosis and sepsis unrelated to spontaneous bacterial peritonitis: value of MELD score. Gastroenterology 2005;129:1944-1953.
8. Stadlbauer V, Wright GA, Banaji M, Mukhopadhya A, Mookerjee RP, Moore K, et al. Relationship between activation of the sympathetic nervous system and renal blood flow autoregulation in cirrhosis. Gastroenterology 2008;134:111-119.
9. Ginès P, Cárdenas A, Schrier RW. Liver disease and the kidney. In: Schrier Robert W, editor. Diseases of the kidney & urinary tract. 8th ed., vol. III. Lippincott Williams &
Wilkins; p. 2179-2205.
10. Ginès P, Schrier RW. Renal failure in cirrhosis. N Engl J Med 2009;361:1279-1290.
11. Dagher L, Moore K. The hepatorenal syndrome. Gut 2001;19: 729-737.
12. Alessandria C, Ozdogan O, Guevara M, Restuccia T, Jiménez W, Arroyo V, et al. MELD score and clinical type predict prognosis in hepatorenal syndrome: relevance to
liver transplantation. Hepatology 2005;41:1282-1289.
13. Sherman DS, Fish DN, Teitelbaum I: Assessing renal function in cirrhotic patients: problems and pitfalls. Am J Kidney Dis 2003, 41:269-278.
14. Figueiredo FA, Dickson ER, Pasha TM, Porayko MK, Therneau TM, Malinchoc M, et al. Utility of standard nutritional parameters in detecting body cell mass depletion in patients with end-stage liver disease. Liver Transpl 2000,6:575-581.
15. Knapp ML, Hadid O: Investigations into negative interference by jaundiced plasma in kinetic Jaffe methods for plasma creatinina determination. Ann Clin Biochem 1987,
24:85-97.
16. Caregaro L, Menon F, Angeli P, , Merkel C, Bortoluzzi A, et al. Limitations of serum creatinine level and creatinine clearance as filtration markers in cirrhosis. Arch Intern
Med 1994; 154:201.
17. Papadakis MA, Arieff AI. Unpredictability of clinical evaluation of renal function in cirrhosis. Prospective study. Am J Med 1987; 82:945.
18. Gerbes AL, Gulberg V, Bilzer M, Vogeser M: Evaluation of serum cystatin C concentration as a marker of renal function in patients with cirrhosis of the liver. Gut 2002,
50:106-110.
19. Xirouchakis E, Marelli L, Cholongitas E, Manousou P, Calvaruso V, Pleguezuelo M, et al.1 Comparison of cystatin C and creatinine-based glomerular filtration rate
formulas with 51Cr-EDTA clearance in patients with cirrhosis. Clin J Am Soc Nephrol 2010, 6:84-92.
20. Gaspari F, Perico N, Remuzzi G: Measurement of glomerular filtration rate. Kidney Int Suppl 1997, 63:S151-154.
21. Skluzacek PA, Szewc RG, Nolan CR, Riley DJ, Lee S, Pergola PE: Prediction of GFR in liver transplant candidates. Am J Kidney Dis 2003, 42:1169-1176.
22. Skluzacek PA, Szewc RG, Nolan CR, Riley DJ, Lee S, Pergola PE: Prediction of GFR in liver transplant candidates. Am J Kidney Dis 2003, 42:1169-1176.
23. Pere Ginès. Tractament de les Complicacions de la Cirrosis: V. Insuficiència Renal. Hospital Universitario Clínic Barcelona. Agost 2010
24. Akriviadis E, Bortla R, Briggs W, Han S, Reynolds T, Shakil O. Pentoxifylline improves short-term survival in severe acute alcoholic hepatitis: a double-blind,
placebo-controlled trial. Gastroenterology 2000;119:1637-1648.
25. Cárdenas A, Ginés P, Uriz J, Bessa X, Salmerón JM, Mas A, et al. Renal failure after upper gastrointestinal bleeding cirrosis: incidence, Clinical course, predictive factor and short-term prognosis. Hepatology. 2001;34(4 Pt 1):671-6.
26. Lebrec D, Thabut D, Oberti F, Perarnau JM, Condat B, Barraud H, et al. Pentoxifylline does not decrease short term mortality but does reduce complications in patients with advanced cirrhosis. Gastroenterology 2010;138:1755-1762.
27. Fernández J, Navasa M, Planas R, Montoliu S, Monfort D, Soriano G, et al. Primary prophylaxis of spontaneous bacterial peritonitis delays hepatorrenal syndrome and
improves survival in cirrhosis. Gastroenterology 2007;133:818-824.
28. Charron C, Caille V, Jardin F, Vieillard-Baron A: Echocardiographic measurement of fluid responsiveness. Curr Opin Crit Care 2006, 12:249-254.
29. Umgelter A, Wagner K, Reindl W, Nurtsch N, Huber W, Schmid RM: Haemodynamic effects of plasma-expansion with hyperoncotic albumin in cirrhotic patients with renal failure: a prospective interventional study. BMC Gastroenterol 2008, 8:39.
30. Kew MC, Varma RR, Sampson DJ, Sherlock S. The effect of octapressin on renal and intrarenal blood flow in cirrhosis of the liver. Gut 1972;13:293-296.
31. Moreau R, Lebrec D. The use of vasoconstrictors in patients with cirrhosis: type 1 HRS and beyond. Hepatology 2006;43:385-394.
32. Ginès P, Guevara M. Therapy with vasoconstrictor drugs in cirrhosis: the time has arrived. Hepatology 2007;46:1685-1687.
33. Gluud LL, Christensen K, Christensen E, Krag A. Systematic review of randomized trials on vasoconstrictor drugs for hepatorenal syndrome. Hepatology 2010;51:576-584.
34. Martin L, Lahi M, Pepin MN, Guevara M, et al. Terlipressin and albúmina vs albúmina in patients with cirrhosis and hepatorenal syndrome: a randomized study.
Gastroenterology 2008;134:1352-1359.
35. Nazar A, Pereira GH, Guevara M, Martin-Llahí M, Pepin MN, Marinelli M, et al. Predictors of response to therapy to terlipressin and albumin in patients with cirrhosis and type 1 hepatorenal syndrome. Hepatology 2010;51:219-226.
36. Ortega R, Ginès P, Uriz J, Cárdenas A, Calahorra B, De Las Heras D et al. Terlipressin therapy with and without albúmina for patients with hepatorenal syndrome: results
of a prospective, nonrandomized study. Hepatology 2002;36:941-948.
37. Lenz K, H örtnagl H, Druml W, Reither H, Schmid R, Schneeweiss BH, et al. Ornipressin in the treatment of functional renal failure in decompensated liver cirrhosis. Effects on renal hemodynamics and atrial natriuretic factor. Gastroenterology 1991; 101:1060.
38. Gülberg V, Bilzer M, Gerbes AL. Long-term therapy and retreatment of hepatorenal syndrome type 1 with ornipressin and dopamine. Hepatology 1999; 30:870.
39. Guevara M, Ginès P, Fernández-Esparrach G, Sort P, Salmerón JM, Jiménez W, et al. Reversibility of hepatorenal syndrome by prolonged administration of ornipressin and plasma volume expansion. Hepatology 1998; 27:35.
40. Angeli P, Volpin R, Gerunda G, Craighero R, Roner P, Merenda R, et al. Reversal of type 1 hepatorenal syndrome with the administration of midodrine and octreotide.
Hepatology 1999;29:1690-1697.
41. Wong F, Pantea L, Sniderman K. Midodrine, octreotide, albumin, and TIPS in selected patients with cirrhosis and type 1 hepatorenal syndrome. Hepatology 2004;40:55-64.
42. Duvoux C, Zanditenas D, Hézode C, Chauvat A, Monin JL, Roudot-Thoraval F, et al. Effects of noradrenalin and albumin in patients with type I hepatorenal syndrome: a pilot study. Hepatology 2002;36:374-380.
43. Kalambokis G, Economou M, Fotopoulos A, Al Bokharhii J, Pappas C, Katsaraki A, et al. The effects of chronic treatment with octreotide versus octreotide plus midodrine on systemic hemodynamics and renal hemodynamics and function in nonazotemic cirrhotic patients with ascites. Am J Gastroenterol 2005; 100:879.
44. Angeli P, Volpin R, Gerunda G, Craighero R, Roner P, Merenda R, et al. Reversal of type 1 hepatorenal syndrome with the administration of midodrine and octreotide. Hepatology 1999; 29:1690.
45. Esrailian E, Pantangco ER, Kyulo NL, Hu KQ, Runyon BA. Octreotide/Midodrine therapy significantly improves renal function and 30-day survival in patients with type 1 hepatorenal syndrome. Dig Dis Sci 2007; 52:742.
46. Martin L, Lahi M, Pepin MN, Guevara M, Díaz F, Torre A, Monescillo A, et al. Terlipressin and albúmina vs albúmina in patients with cirrhosis and hepatorenal syndrome: a randomized study. Gastroenterology 2008;134:1352-1359.
47. Alessandria C, Venon WD, Marzano A, Barletti C, Fadda M, Rizzetto M. Renal failure in cirrhotic patients: role of terlipressin in clinical approach to hepatorenal syndrome type 2. Eur J Gastroenterol Hepatol 2002;47:401-404.
48. Brensing KA, Textor J, Perz J, Schiedermaier P, Raab P, Strunk H, et al. Long term outcome after transjugular intrahepatic portosystemic stent-shunt in non-transplant cirrhotics with hepatorenal syndrome: a phase II study. Gut 2000,47:288-295.
49. Testino G, Ferro C, Sumberaz A, Messa P, Morelli N, Guadagni B, et al. Type-2 hepatorenal syndrome and refractory ascites: role of transjugular intrahepatic portosystemic stent-shunt in eighteen patients with advanced cirrhosis awaiting orthotopic liver transplantation. Hepatogastroenterology 2003, 50:1753-1755.
50. Brensing KA, Textor J, Strunk H, Klehr HU, Schild H, Sauerbruch T: Transjugular intrahepatic portosystemic stent-shunt for hepatorenal syndrome. Lancet 1997, 349:697-698.
51. Guevara M, Gines P, Bandi JC, Gilabert R, Sort P, Jimenez W, et al. Transjugular intrahepática portosystemic shunt in hepatorenal syndrome: effects on renal function and vasoactive systems. Hepatology 1998, 28:416-422.
52. Ochs A, Rössle M, Haag K, Hauenstein KH, Deibert P, Siegerstetter V, et al. The transjugular intrahepatic portosystemic stent-shunt procedure for refractory ascites. N Engl J Med 1995; 332:1192.
53. Wong F, Sniderman K, Liu P, Blendis L. The mechanism of the initial natriuresis after transjugular intrahepatic portosystemic shunt. Gastroenterology 1997; 112:899.
54. Brensing KA, Textor J, Perz J, Schiedermaier P, Raab P, Strunk H, et al. Longterm outcome after transjugular intrahepatic portosystemic-stent shunt in non-transplant cirrhotics with hepatorena syndrome: a phase II study. Gut 2000;47:288-295.
55. Malinchoc M, Kamath PS, Gordon FD, Peine CJ, Rank J, ter Borg PC. A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts. Hepatology 2000; 31:864.
56. Linas SL, Schaefer JW, Moore EE, Good JT Jr, Giansiracusa R, et al. Peritoneovenous shunt in the management of the hepatorenal syndrome. Kidney Int 1986; 30:736.
57. Witzke O, Baumann M, Patschan D, Patschan S, Mitchell A, Treichel U, et al. Which patients benefit from hemodialysis therapy in hepatorenal syndrome? J Gastroenterol Hepatol 2004, 19:1369-1373.
58. Keller F, Heinze H, Jochimson F, Passfall J, Schuppan D, Büttner P. Risk factors and outcome of 107 patients with decompensated liver disease and acute renal failure (including 26 patients with hepatorenal syndrome): the role of hemodialysis. Ren Fail 1995;17:135-146.
59. Capling RK, Bastani B. The clinical course of patients with type 1 hepatorenal syndrome maintained on hemodialysis. Ren Fail 2004;26:563-568.
60. Davenport A, Will EJ, Davison AM, Swindells S, Cohen AT, Miloszewski KJ, et al. Changes in intracranial pressure during haemofiltration in oliguric patients with grade IV hepatic encephalopathy. Nephron 1989, 53:142-146.
61. Davenport A, Will EJ, Davison AM: Effect of renal replacement therapy on patients with combined acute renal and fulminant hepatic failure. Kidney Int Suppl 1993, 41:S245-251.
62. Stange J, Ramlow W, Mitzner S, Schmidt R, Klinkmann H. Dialysis against a recycled albumin solution enables the removal of albumin-bound toxins. Artif Organs. 1993;17:809-13.
63. Mitzner SR, Stange J, Klammt S, Risler T, Erley CM, Bader BD, et al. Improvement of hepatorenal syndrome with extracorporeal albumin dialysis MARS: results of a prospective, randomized, controlled clinical trial. Liver Transpl 2000;6:287-289.
64. Laleman W, Wilmer A, Evenepoel P, Elst IV, Seegers M, Zaman Z, et al. Crit Care 2006;10:R108.
65. Rifai K, Kribben A, Gerken G, Haag S, Herget-Rosenthal S, Treichel U, et al. A prospective randomized controlled multicenter study of extracorporeal liver support by fractionated adsorption (Prometheus) in patients with acute-onchronic liver failure (HELIOS study). Hepatology 2010;52 (4S):333A.
66. Gonwa TA, Morris CA, Goldstein RM, Husberg BS, Klintmalm GB. Long-term survival and renal function following liver transplantation in patients with and without hepatorenal syndrome - experience in 300 patients. Transplantation 1991;51:428-430.
67. Restuccia T, Ortega R, Guevara M, Ginès P, Alessandria C, Ozdogan O, et al. Effects of treatment of hepatorenal syndrome before transplantation on posttransplantation outcome. A case-control study. J Hepatol 2004;40:140-146.
68. Jeyarajah DR, Gonwa TA, McBride M, Testa G, Abbasoglu O, Husberg BS, et al. Hepatorenal syndrome: combined liver kidney transplants versus isolated liver transplant. Transplantation 1997;64:1760-1765.
69. Charlton MR, Wall WJ, Ojo AO, Ginès P, Textor S, Shihab FS, et al. International liver transplantation expert panel. Report of the first international liver transplantation society expert panel consensus conference on renal insufficiency in liver transplantation. Liver Transpl 2009;15:S1-S34.