Services on Demand
Journal
Article
Related links
Share
Archivos de Medicina Interna
Print version ISSN 0250-3816On-line version ISSN 1688-423X
Arch. Med Int vol.35 no.3 Montevideo Dec. 2013
Revisión
Psoriasis Vulgar moderada y severa: opciones terapéuticas (tratamientos convencionales)
Moderate and Severe Psoriasis Vulgaris: therapy options(conventional therapies)
Dr. Miguel Martínez
Profesor Director de la Cátedra de Dermatología. Facultad de Medicina. UdelaR. Montevideo.
Dra. Patricia Levrero
Asistente de la Cátedra de Dermatología. Facultad de Medicina. UdelaR. Montevideo.
Dra. Rosanna Carusso
Drmatóloga. Ex Residente de la Cátedra de Dermatología. Facultad de Medicina. UdelaR. Montevideo.
Dr. Cristian Morales
Residente de la Cátedra de Dermatología. Facultad de Medicina. UdelaR. Montevideo.
Dra. Valeria Arretche
Residente de la Cátedra de Dermatología. Facultad de Medicina. UdelaR. Montevideo.
Dra. Andrea Nicola
Residente de la Cátedra de Dermatología. Facultad de Medicina. UdelaR. Montevideo.
Dra. Mercedes Fossati
Residente de la Cátedra de Dermatología. Facultad de Medicina. UdelaR. Montevideo.
Dra. Mariela Cueto
Residente de la Cátedra de Dermatología. Facultad de Medicina. UdelaR. Montevideo.
Dra. Natalia Dorado
Residente de la Cátedra de Dermatología. Facultad de Medicina. UdelaR. Montevideo.
Dra. Cecilia García
Residente de la Cátedra de Dermatología. Facultad de Medicina. UdelaR. Montevideo.
Dra. Claudia Guebenlian
Residente de la Cátedra de Dermatología. Facultad de Medicina. UdelaR. Montevideo.
Dra. Macarena Restano
Residente de la Cátedra de Dermatología. Facultad de Medicina. UdelaR. Montevideo.
RESUMEN: Arch Med Interna 2013 - 35(3):93-100
La psoriasis es una enfermedad de filiación inmunológica, frecuente a nivel mundial. En población europea y en EE.UU. reporta una prevalencia del 0,6 al 4%. No hay reportes en Uruguay. La forma clásica de presentación es la vulgar en placas. Si bien en la mayoría de los casos es paucisintomática y las terapias tópicas permiten su control (psoriasis leve), en una proporción importante de casos es capaz de afectar severamente la calidad de vida al generalizarse o asociar afectación de otros órganos, o en casos extremos inclusive llevar a la muerte. El objetivo principal de este artículo es brindar recomendaciones unificadas sobre el tratamiento de la psoriasis vulgar en placas moderada y severa. En esta parte se discuten tratamientos sistémicos “convencionales”, priorizando la fototerapia, metotrexato, ciclosporina A y retinoides. Aquí no se incluirán las terapias dirigidas contra blancos moleculares (llamadas “terapias biológicas”) que ya constituyen alternativas convencionales en los países desarrollados.
Palabras clave: Psoriasis vulgar moderada y severa, Tratamiento psoriasis, fototerapia, Metotrexato, Ciclosporina A, Acitretín.
ABSTRACT: Arch Med Interna 2013 - 35(3):93-100
Psoriasis is a common worldwide disease and is considered of immune affiliation. In Europe and the U.S. population reported a prevalence of 0.6 to 4%. There are no reports of Uruguay prevalence. The classic presentation is vulgar plates. Although in most cases the disease is paucisymptomatic and topical therapies allows control (mild psoriasis), in a significant proportion can severely affect quality of life associated with generalized psoriasis or involvement of other organs. Even lead to death. The main objective of this article is to provide unified guidelines on the treatment of chronic plaque psoriasis with moderate to severe presentation. This part discusses systemic “conventional” treatments, giving priority to phototherapy, methotrexate, cyclosporin A and retinoids. The so called “Biologic Therapies” wich are already conventional alternatives in developed countries, will be the subject of Part II of these recommendations.
Keywords: Moderate and severe psoriasis vulgaris, Psoriasis treatment, Phototherapy, Methotrexate, Cyclosporine A, Acitretin.
INTRODUCCIÓN
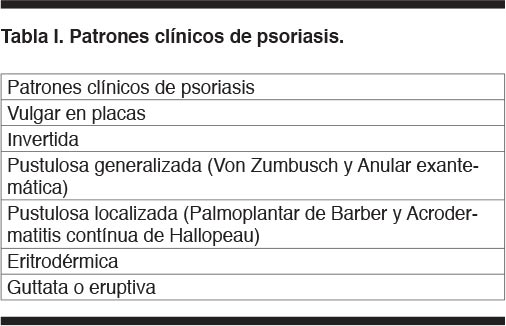
La psoriasis es una dermatosis crónica que afecta fundamentalmente piel y faneras, caracterizada por una respuesta inmunológica que determina proliferación de los queratinocitos con cambios arquitecturales en dermis y epidermis, presenta una predisposición genética de tipo poligénica, sobre la que actúan factores desencadenantes como traumatismos, medicamentos, infecciones y estrés. En sus formas moderada y severa puede determinar importante compromiso con gran afectación de la calidad de vida, al punto que muchos autores la comparan por la repercusión que ocasionan, a la que determina la diabetes y ciertas enfermedades neoplásicas (1). Clínicamente, tiene diferentes patrones de presentación. La psoriasis vulgar o en placas es la forma más común (llegando a ser el 90% de todas las formas de psoriasis) y se manifiesta como placas eritematosas bien delimitadas, de distribución simétrica, predominando en cuero cabelludo, codos, ombligo, región sacra y rodillas, están cubiertas por una escama blanca o plateada fina llamada micácea. Otras formas de presentación clínica cutánea de psoriasis se describen en Tabla I.
La psoriasis es una enfermedad de distribución universal, tiene similar incidencia en ambos sexos y es más frecuente en la raza blanca. En Europa y Estados Unidos alcanza una prevalencia de 0,8 a 4.8%. (2,3). Se ha reportado prevalencia algo inferior en la población asiática (4). En Latinoamérica en general existen muy pocos reportes y en Uruguay en particular desconocemos su prevalencia.
Los antecedentes familiares de psoriasis se observan en cerca de un tercio de los casos. Gudjonsson y Elder demostraron que si ambos padres padecen la enfermedad, el 41% de sus descendientes también la padecerá. Si solo un progenitor está afectado, el 14% de sus hijos la padecerá y apenas el 6% en el caso de un hermano afectado (5).
Entre el 20 y 30% de los pacientes con psoriasis asocian una artritis psoriásica, la cual puede preceder, ser concomitante o posterior a las manifestaciones cutáneas de la psoriasis. Es una artritis inflamatoria asociada a la psoriasis, clasificada dentro de las espondiloartropatías seronegativas (factor reumatoideo negativo o ausente), asociadas a HLA-B27. La psoriasis y la artritis psoriásica comparten características histológicas e inmunológicas, lo que sugiere mecanismos patogénicos similares (6). En estas enfermedades no se detecta la presencia de auto-anticuerpos. Hay un incremento selectivo de linfocitos T CD4 en la membrana sinovial y de CD8 en el líquido sinovial y hueso subcondral debajo de las entesis. Igual que ocurre en la piel, los linfocitos T CD8 muestran una expansión clonal posiblemente en respuesta a un estímulo hasta hoy desconocido. Los linfocitos T CD4 son policlonales y están polarizados fundamentalmente a Th1 y, en menor medida, a Th17. En consonancia con una respuesta Th1 y Th17, existe un incremento en la sinovial tanto de macrófagos activados que secretan TNF-α como de neutrófilos. Se sugiere que, tanto la respuesta inmunitaria citotóxica como la respuesta Th1 y Th17, pueden participar en el desencadenamiento y/o la perpetuación de la artritis psoriásica (6). Clínicamente se presenta como una oligoartritis asimétrica de pequeñas articulaciones de manos y pies. La inflamación simultánea de las articulaciones digitales y la de sus vainas tendinosas ocasionan los “dedos en salchicha” o dactilitis, hecho frecuente en el curso de esta enfermedad. Estudios con Resonancia Magnética Nuclear (RMN), sugieren que la tenosinovitis aislada sin compromiso capsular, es suficiente causa de dactilitis. Las entesitis de la inserción del tendón de Aquiles o de la fascia plantar se observan frecuentemente. La espondilitis ocurre en general acompañando una artritis periférica. Estos pacientes presentan dolor lumbar y reducción de la movilidad de la columna. El compromiso prolongado de la columna cervical puede provocar subluxación atlantoaxoidea.
La afectación ungular acompaña muy frecuentemente a todas las formas clínicas de psoriasis y en ciertas presentaciones y ocupaciones lleva a una gran afectación en la calidad de vida y constituye un elemento de sospecha de la existencia de artritis psoriásica.
Las diferentes presentaciones de psoriasis y la eventual afectación de otros órganos determinan distintas opciones terapéuticas. Estudios epidemiológicos han demostrado que los pacientes con psoriasis asocian con mayor frecuencia que la población general enfermedad de Crohn y signos de síndrome metabólico que llevan a ateroesclerosis con enfermedad coronaria.
Respecto a la severidad, la mayoría de los autores coinciden en que al menos en poblaciones europeas y de EE.UU., cerca del 80% de los pacientes presentan una psoriasis leve. La psoriasis moderada oscila entre el 13 y el 15% y la forma severa es del 9% (7).
Existen índices de medición de la misma basados en la extensión y características clínicas de la enfermedad y en el deterioro de la calidad de vida. Estos parámetros permiten una valoración integral del paciente.
El índice más utilizado es el PASI (Psoriatic Area Severity Index), que permite evaluar la severidad según el grado de eritema, infiltración y descamación de la lesiones con relación al porcentaje de área topográfica comprometida, dando una puntuación de 0 a 72 (8). Si bien no hay acuerdo entre los diversos autores respecto a los puntos de corte, los más utilizados son: leve de 0 a 7, moderado de 7 a 10 y severo mayor a 10. Este índice es de gran ayuda en la decisión y valoración terapéutica, controles posteriores y realización de estudios clínicos. Se considera que un tratamiento es efectivo si logra una disminución del 50 a 75% con respecto al PASI inicial (9,10).
Otro índice utilizado en la práctica clínica es la determinación del área de superficie corporal (Body Surface Area, BSA), el cual consiste en el cálculo directo de la superficie corporal afectada, constituyendo una primera aproximación a la cuantificación de la gravedad. Para esto se utiliza la regla de los 9% (usada en evaluación de quemaduras) o también empleando la palma de mano (incluyendo los dedos) correspondiendo al 1% de la superficie corporal. Se considera psoriasis leve cuando el BSA es menor o igual a 3%, moderada de 3 a 10% y severa mayor a 10% (8).
Para valorar la calidad de vida, un índice empleado habitualmente es el Dermatology Life Quality Index (DLQI). Se puede utilizar en cualquier afectación cutánea. El mismo consiste en 10 preguntas sobre la repercusión de su dermatosis en la vida cotidiana, la semana previa a la consulta (11).
METODOLOGÍA
Para la elaboración de estas recomendaciones para el tratamiento llamado “convencional” de psoriasis moderada y severa, los integrantes de la Unidad de Psoriasis del Hospital de Clínicas, Facultad de Medicina, realizaron una revisión exhaustiva de las bases de datos de PubMed (NCI, USA) y SciELO (BIREME-FAPSESP). Dicha revisión incluyó fundamentalmente trabajos originales y en menor medida revisiones o guías terapéuticas, descartándose aquellas publicaciones claramente financiadas por la Industria Farmacéutica. También se tuvo en cuenta la experiencia de dicha unidad en más de 5 años de labor ininterrumpida en la asistencia de pacientes portadores de psoriasis de difícil manejo. Para la confección de la bibliografía se seleccionaron cuidadosamente artículos originales en cada uno de los tópicos tratados, incluyéndose solamente aquellas guías terapéuticas que aportaban información nueva y/o relevante.
TRATAMIENTO TÓPICO COMPLEMENTARIO
El tratamiento tópico que se detalla, se utiliza como tratamiento complementario, sabiendo que en la psoriasis leve, es el pilar del tratamiento.
Emoliencia. La emoliencia cumple un papel muy importante ya que permite la reparación de la barrera cutánea dañada. Se indica en todos los pacientes. Se utiliza vaselina sólida o cremas o emulsiones sin perfumes ni colorantes que contengan ácidos grasos libres, colesterol y ceramidas. Se recomienda su aplicación diaria, luego del baño y a demanda (1,8).
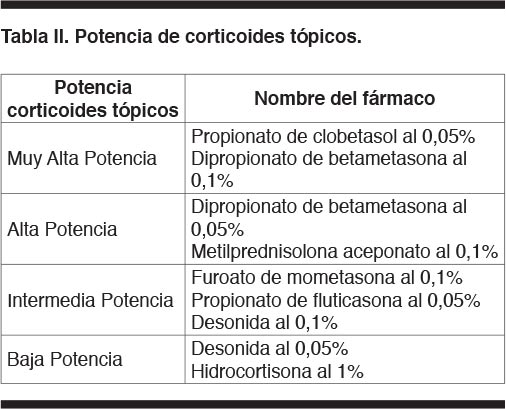
Corticoides tópicos. Son la piedra angular del tratamiento tópico de la psoriasis. Su eficacia depende de la potencia y de la capacidad de penetración de la piel (12). Se agrupan según la potencia la cual guarda relación con su concentración y vehículo. La Tabla II señala los grupos más utilizados en Uruguay y para su elección se debe considerar el sitio de la piel donde se aplicará (potencia baja o mediana en pliegues o rostro, alta potencia en palmas y plantas).
Su acción es antiinflamatoria por inhibición de la fosfolipasa A2 que impide la síntesis de eicosanoides, antiproliferativa por inhibir la síntesis de ADN e inmunosupresora al suprimir la síntesis de moléculas proinflamatorias (1,7). Además actúa como vasoconstrictor a nivel de la dermis (12). Como efectos adversos genera a nivel local atrofia cutánea, telangiectasias, estrías dérmicas, foliculitis, rosácea y acné esteroideo, hipertricosis y dermatitis perioral (13). Para prevenir la taquifilaxia en el uso prolongado de corticoides, se recomienda la combinación con ácido salicílico, calcipotriol, tazaroteno o alquitrán según corresponda, o la realización de pulsos intermitentes (8). Se debe utilizar con precaución en niños menores de 12 años o frente a la sospecha de eccema microbiano sobreinfectado, micosis cutánea y acné. Son categoría C en el embarazo y están contraindicados en el herpes cutáneo y la rosácea (13).
Análogos de la vitamina D3. El calcipotriol actúa disminuyendo la proliferación celular, e in vitro se ha comprobado que aumenta la diferenciación de cultivos de queratinocitos humanos (en parte, al regular la respuesta epidérmica al calcio). No produce atrofia cutánea ni efecto rebote. La utilización concomitante con corticoides ha demostrado ser superior a la monoterapia y evita algunos efectos secundarios de ambos (8). Considerada por la FDA como categoría C en embarazo y está desaconsejada en la lactancia. Se debe valorar riesgo/beneficio frente a alteraciones del metabolismo fosfo-cálcico, insuficiencia renal y/o insuficiencia hepática moderada (en formas severas está formalmente contraindicado) (14).
Retinoides tópicos. El tazaroteno es un retinoide de tercera generación. Modula la diferenciación epidérmica, con potente efecto antiproliferativo, por lo que es de elección en placas de psoriasis con marcada hiperqueratosis (15). Si bien se acepta su uso como monoterapia, su combinación con corticoides tópicos es de elección, logrando así la disminución de los efectos adversos de ambos fármacos (16). También se ha demostrado aumento de eficacia al combinarse con fototerapia. Su efecto se observa a las 2 semanas de iniciada la terapia y al discontinuar su uso no hay efecto rebote(17). Está contraindicado en el embarazo (categoría C) y en la lactancia (18).
Queratolíticos. Son de utilidad en psoriasis donde las placas presentan gran componente escamoso. Disminuyendo la unión intercorneocitaria aumentan la velocidad de eliminación de la escama. Además presentan acción bacteriostática, fungicida y fotoprotectora. El ácido salicílico (del 3 al 5%) es el más utilizado en nuestro medio y su combinación con vaselina sólida en particular, conocida como vaselina salicilada. En grandes cantidades puede causar intoxicación con sintomatología neurológica y/o digestiva (8).
Alquitrán. El alquitrán de hulla se utiliza hace más de un siglo. Su eficacia es difícil de evaluar debido a la falta de estudios. Su mecanismo de acción no se conoce, si bien se describen efectos antiinflamatorios y antiproliferativos. Ya no se utiliza como monoterapia pero es frecuente que se encuentre como componente de lociones o champús para cuero cabelludo. En ocasiones, la brea también se utiliza en combinación con la radiación ultravioleta B en el tratamiento de la psoriasis resistente al tratamiento. Presenta mal olor, mancha la ropa y puede producir dermatitis de contacto y/o foliculitis. Está contraindicado en la psoriasis pustulosa generalizada y en la eritrodermia. Las contraindicaciones relativas son la foliculitis preexistente o el acné (1).
Otros tratamientos tópicos de uso muy limitado, incluyen la antralina y la urea al 5 a 20%.
TRATAMIENTO SISTÉMICO CONVENCIONAL
Debe ser individualizado, dinámico, rotatorio, combinado, secuencial, intermitente y de mantenimiento, para evitar la resistencia y minimizar los efectos secundarios (19).
Fototerapia
La fototerapia consiste en la exposición del paciente a irradiación ultravioleta en cabinas o sobre lámparas en el caso de fototerapia localizada. Se basa en el uso de radiación electromagnética no ionizante para generar efectos fototóxicos y/o fotodinámicos en la piel con objetivos terapéuticos. Es la primera opción de tratamiento sistémico (de estar disponible, tener acceso y no estar contraindicado). Se debe tener en cuenta la posibilidad del paciente de realizar un tratamiento que implique desplazamiento hacia el lugar donde se lleva a cabo, 2 o 3 veces por semana. La fototerapia con radiación ultravioleta B (UVB), con longitud de onda de 311 a 313 nm, narrow band (UVB nb), es considerada como primera elección a la hora de prescribir tratamiento con fototerapia en la psoriasis por su eficacia y seguridad (1). La fotoquimioterapia con psoralenos (PUVA) combina el uso de psoralenos (P) y de radiación UV de longitud de onda larga (UVA). Al comparar ambas modalidades, una revisión reciente muestra que si bien ambos resultan efectivos en el tratamiento de la psoriasis, el PUVA presenta mayor efectividad (80% llega al PASI 75 al cabo de 6 meses, frente al 70% de los tratados con UVBnb) y mayor rapidez de acción (se logran respuestas parciales en 17 sesiones vs 25 del UVBnb) (20). Los efectos adversos inmediatos (cefaleas, nauseas) como a mediano y largo plazo (oculares, cutáneos, hepáticos y digestivos) provocados por el efecto combinado del psoraleno y el UVA determinan la preferencia por el UVBnb.
La fototerapia en general está contraindicada en pacientes que cursen con trastornos graves en los mecanismos de reparación del ADN (xeroderma pigmentoso), en aquellos con elevado riesgo para desarrollar neoplasias cutáneas malignas agresivas como el síndrome de nevo displásico familiar, antecedente de melanoma en familiar directo o con melanoma previo o cuando la exposición a la radiación ultravioleta sea un conocido agravante de otra enfermedad de base, como el lupus. (21,22).
Radiación ultravioleta “B” narrow band (UVBnb): la terapéutica con UVBnb no requiere fotosensibilizante y se realiza mediante la exposición directa a la luz. La dosis de cada aplicación se determina mediante protocolo basado en la dosis eritematógena mínima (DEM) o en el fototipo del paciente (23). Las dosis administradas son bajas: iniciales de 0,1 o 0,2 J/cm2 según el fototipo y dosis máximas de 1.4 J/cm2. La dosis acumulativa es cercana a 20 J/cm2. Con 15 a 20 sesiones se consigue buenos resultados en el 50% de los pacientes (8,21). Si bien es de preferencia en todos los casos, es de elección en jóvenes, embarazadas, durante la lactancia, en pacientes con antecedentes de patología oftalmológica, con insuficiencia hepática o renal severa, o cuando existe intolerancia a psoralenos. No se requiere exámenes paraclínicos previos (8).Los efectos secundarios agudos consisten en prurito, eritema, quemaduras, xerosis, aumento en la incidencia de herpes simple, y a largo plazo, fotodaño crónico, así como cáncer cutáneo (8). Sin embargo, una reciente revisión en pacientes tratados con UVBnb, no mostró asociación significativa con carcinoma basocelular, carcinoma espinocelular o melanoma, con una mediana de seguimiento de 5,5 años (21,25). Las contraindicaciones ya fueron señaladas.
Radiación ultravioleta “A” (UVA): utiliza longitud de onda comprendida entre 320 y 400 nm, correspondiente a la radiación UVA. Generalmente se utiliza previa sensibilización del paciente con psolarenos, que son furocumarinas lineales que se encuentran en plantas y en forma de compuestos de origen sintético. La fotoquimioterapia PUVA, se fundamenta en la interacción entre la radiación ultravioleta A y psolareno, lo que condiciona reacciones fototóxicas repetidas y controladas. Los psolarenos más utilizados son el 8 metoxipsoraleno (8 MOP), y el 5 metoxipsoraleno (5 MOP), por vía oral o tópica. En nuestro país solo se encuentra disponible el 8 MOP. El 8 MOP se administra a una dosis de 0,4 a 0,6 mg/kg vía oral, dos horas previas a la exposición a radiación UVA (8). Las aplicaciones se realizan 2 a 3 veces por semana (no en días consecutivos). En los días en que se realiza, los pacientes deben mantener prevención ocular con cristales de fotoprotección para UVA. Los efectos adversos agudos que se asocian tanto con el psoraleno como con la UVA son la intolerancia gastrointestinal, cefaleas, mareos, prurito, fotofobia, eritema o quemadura, xerosis y aumento en la incidencia de herpes simple (8,21). En forma mediata, la dosis de PUVA acumulada en esquemas prolongados (más de 250 sesiones o 1000-1500 J/cm2) se puede asociar a fotodaño crónico y a un aumento en la incidencia de carcinoma espinocelular, especialmente en fototipos I y II (8,21,26-29). La asociación con melanoma maligno es controversial (21). El daño ocular se previene con el uso de lentes apropiados pero es recomendable un control oftalmológico previo (8,21). Es conveniente contar con un perfil hepático previo y controles periódicos en función de los antecedentes y de la extensión de la enfermedad (22).Son contraindicaciones relativas la presencia de cataratas, disfunción hepática, fotodaño crónico severo, antecedente de cáncer de piel no melanoma, inmunosupresión, y tratamientos concomitantes con agentes fototóxicos. El psoraleno es categoría C del embarazo (21). No se recomienda en menores de 12 años. Las contraindicaciones absolutas ya fueron señaladas.
La fotoquimioterapia PUVA produce un beneficioso efecto terapéutico, que no se produce con ambos componentes por separado. Es muy efectivo, con rápida respuesta y largos períodos de remisión, pero a largo plazo tiene riesgo de producir efectos secundarios.
Metotrexato
El metotrexato (MTX) es un antimetabolito análogo del ácido fólico, que interfiere impidiendo la síntesis del ácido desoxitimidílico (dTMP), indispensable para la síntesis de ADN, presentando una acción antiinflamatoria, antiproliferativa e inmunosupresora.
Es la primera opción terapéutica si existe contraindicación para recibir tratamiento con fototerapia o en caso de inaccesibilidad o frente a ausencia de respuesta. Es la primera opción terapéutica cuando se asocia con artritis psoriásica.
Previo al tratamiento varias guías aconsejan solicitar: hemograma, funcional y enzimograma hepático, azoemia, creatininemia, radiografía de tórax, PPD, βHCG en caso de paciente de sexo femenino en edad reproductiva y serología para VHB, VHC (30). En cuanto a la realización de radiografía de tórax y PPD para descartar la posibilidad de tuberculosis, si bien no es una recomendación universalmente aceptada, algunos autores lo recomiendan como parte de la valoración general en pacientes candidatos a recibir MTX. El screening de tuberculosis también serviría como referencia en caso de complicación pulmonar como efecto adverso del fármaco (19,30). También existe controversia sobre la recomendación de la vacunación antineumococcica, antigripal y contra el virus de la hepatitis B previo al inicio del tratamiento (31). En Uruguay se ha documentado la utilidad de la vacunación antigripal y antineumocóccica en ciertos grupos de riesgo (32) si bien el estudio no incluyó este grupo de pacientes.
La vía de administración más utilizada MTX es la oral. La vía parenteral, si bien ha demostrado ser algo más efectiva –en particular la subcutánea– se ha asociado con afectación neurológica y pulmonar, y se han reportado casos de linfoma B (33-35).
Dado el potencial tóxico y la posible aparición de reacciones idiosincráticas graves (hematológicas) o leves pero de consideración (mucositis, transaminasemia), se recomienda comenzar con una dosis prueba de 5 mg por una semana, realizando hemograma y funcional y enzimograma hepático a la semana de la primera dosis (30).
La dosis terapéutica recomendada es entre 7.5 a 15 mg por semana, con una dosis máxima oral de 25 mg a 30 mg semanales (8). A partir de 1971 se popularizó el fraccionamiento oral en tres dosis a intervalos de 12 horas, una vez a la semana o esquema de Weinstein en la suposición no demostrada, que se evitan o reducen los efectos adversos gastrointestinales (36). Estudios recientes relativizan estas ventajas si bien señalan que la eficacia clínica fue superior y los efectos adversos hepáticos inferiores en pacientes que recibieron dosis semanales repartidas en 3 tomas cada 8 horas (37).
Independientemente del esquema terapéutico empleado, se aconseja esperar entre 4 y 12 semanas para evaluar eficacia y una vez obtenida la mejoría clínica, disminuir 2,5 mg por semana. Si no se ha logrado respuesta adecuada a las 12 semanas con una dosis de 20 mg/semana, se aconseja cambiar por otra opción terapéutica ya que el aumento de dosis no logrará el control de la enfermedad (8). La suspensión brusca de MTX no suele asociarse a un efecto rebote de las lesiones. Se aconseja el aporte de 5 mg de ácido fólico a las 24 a 48 horas de la administración del MTX, ya que un reciente meta análisis indica que esto tiende a reducir la toxicidad hematológica, mucocutánea, gastrointestinal y reduce de forma significativa la hepatotoxicidad, aunque no previene ni reduce la toxicidad pulmonar (30).
Se debe evitar el uso concomitante con antiinflamatorios no esteorideos (AINEs), ciertos antibióticos (sulfas, tetraciclinas, ciprofloxacina) y otros medicamentos como furosemide, fenitoína, ciclosporina A, dado que aumentan la toxicidad del MTX al interferir con su vía de excreción (30). Por esa misma razón, en pacientes con insuficiencia renal se debe reducir la dosis a la mitad cuando el clearence de creatinina se encuentre entre 20 y 50 ml/min y está contraindicado si es menor de 20 ml/min (38).
Durante el tratamiento es aconsejable la realización de hemograma completo cada 15 días por un mes y luego cada 4 semanas según leucocitosis. También se aconseja realizar un funcional y enzimograma hepático cada 8 semanas. La elevación de las transaminasas tres veces su nivel normal es indicación de disminución de dosis al 50% y de persistir suspender el fármaco. Si dicha elevación se mantuviera luego de la suspensión, se sugiere evaluar la realización de una biopsia hepática, ya que la ecografía es poco sensible en la detección del daño hepático (30).
Precauciones: alteraciones renales, evitar concepción en hombres y mujeres en tratamiento con MTX. Luego de su suspensión, se debe esperar un ciclo ovulatorio (1 mes) en la mujer y un ciclo de espermatogénesis en el hombre (3 meses) (30). Durante el tratamiento con MTX deben evitarse la vacunación con vacunas vivas (polio oral, sarampión, parotiditis, rubeola, varicela y fiebre amarilla) (30).
Contraindicaciones: alcoholismo, hepatopatías, embarazo, lactancia, infección grave activa, alteraciones hematológicas, inmunodepresión, úlcera péptica aguda (19,30).
Retinoides
El acitretín es un retinoide sintético de segunda generación, por ser metabolito del etretinato. No se conoce exactamente el mecanismo de acción, sin embargo, se sabe que modula la diferenciación celular de la epidermis con disminución del espesor del estrato córneo, de la inflamación de dermis y epidermis. Si bien el acitretín no se encuentra disponible en Uruguay, es una opción terapéutica en pacientes que presentan contraindicaciones o que no respondieron a la fototerapia ni al MTX, y también en otras formas de psoriasis como la pustulosa.
La vía de administración disponible es la oral. Se aconseja comenzar con una dosis inicial de entre 0,3 a 0,5 mg/kg/día (25 a 50 mg/día) por un período de 3 a 4 semanas y se incrementa hasta encontrar el equilibrio entre la eficacia y la tolerancia de los efectos colaterales. La ingesta junto con alimentos grasos aumenta su biodisponibilidad (8,40).
La respuesta es gradual y normalmente requiere de 3 a 6 meses en llegar a su punto máximo. Se puede ver un empeoramiento de la psoriasis en el inicio del tratamiento (40,41).Puede ser necesario en algunos casos, aumentar la dosis hasta un máximo de 75 mg al día (40).
Se debe solicitar βHCG en caso de mujer en edad reproductiva, hemograma, funcional y enzimograma hepático, perfil lipídico y función renal, previo al inicio del tratamiento.
Durante el tratamiento se aconseja realizar pruebas de función hepática, colesterol y triglicéridos cada 4 semanas por 4 a 6 meses, y luego cada 3 meses. También se recomienda solicitar hemograma completo y función renal mensualmente por 2 meses, y luego cada 3 meses (40). Si los valores de enzimas hepáticas triplican su valor se sugiere suspender el tratamiento. Dado que se han reportado casos de hiperostosis esquelética y calcificación extraósea en el hombre tras tratamientos prolongados con etretinato, de presentar dolores o limitación al movimiento vertebral se sugiere solicitar una radiografía simple que puede mostrar imágenes características (40).
Precauciones: insuficiencia hepática y/o renal leve, hiperlipidemia leve. Mujer en edad fértil, ya que se desaconseja el embarazo hasta 3 años después de la suspensión del tratamiento (40).
Contraindicaciones: insuficiencia hepática severa (se debe evitar su uso cuando las enzimas hepáticas se eleven más de 2 veces el valor basal), insuficiencia renal moderada a severa, hiperlipidemia, uso concomitante de tetraciclinas o MTX y consumo de alcohol (40). El acitretin es categoría C de la FDA en el embarazo (19).
Ciclosporina A
La ciclosporina es un fármaco inmunosupresor que actúa selectivamente sobre las células T. Forma un complejo con la ciclofilina, e inhibe la actividad de la calcineurina fosfatasa. Como resultado, la calcineurina fosfatasa es incapaz de fosforilar el factor nuclear de las células T activadas, factor de transcripción de genes que codifican la interleucina-2 (necesaria para activación de la vía de las células T), el interferón gamma, y el factor de estimulación de granulocitos y macrófagos. La ciclosporina también inhibe la hiperproliferación de queratinocitos, la liberación de histamina de los mastocitos, y regula en menos la expresión de moléculas de adhesión celular en el endotelio capilar dérmico.
Es uno de los tratamientos más eficaces para la psoriasis, debido a su rápido inicio de acción. En pacientes con empujes severos induce una remisión rápida por lo que puede ser utilizado como puente hacia otras terapias. También se usa en pacientes con psoriasis severa que no responden o tienen contraindicación para los otros tratamientos sistémicos (8,19).
Posología: las guías de consenso actuales recomiendan una dosis inicial de 2,5 mg/kg/día, a menos que sea necesario una rápida mejoría, en donde se puede utilizar hasta 5 mg/kg/día (42). En general se utiliza el peso corporal ideal. De no existir una respuesta adecuada con dosis bajas de ciclosporina luego de 4 semanas de tratamiento, se recomienda un incremento gradual de 0,5 a 1,0 mg/kg/día en intervalos de 2 a 4 semanas, hasta un máximo de 5 mg/kg/día. Obtenida la respuesta óptima, la dosis se puede reducir gradualmente de 0,5 a 1,0 mg/kg/día a intervalos de 2 semanas hasta la dosis más baja posible que mantenga el control de la enfermedad. La dosis de 5 mg/kg/día se puede utilizar hasta un máximo de 1 año. Si no se ha alcanzado una respuesta adecuada después de 3 meses de tratamiento con la dosis máxima, debe buscarse otra opción terapéutica (42). La dosis diaria de ciclosporina se fracciona en dos dosis y se ingiere a la misma hora del día para minimizar la variación en la concentración sérica intraindividual. Existe una mayor concentración plasmática cuando la droga es administrada antes de las comidas. El jugo de pomelo se debe evitar durante el tratamiento ya que impide la metabolización de la ciclosporina al inhibir a la enzima CYP34A por su contenido en furanocumarinas. Hay que tener en cuenta que si bien no se han reportado casos, el jugo de lima también posee furanocumarinas. En nuestro país, según el decreto Nº 12/2007 del MSP, las diferentes marcas comerciales no son intercambiables hasta tanto no se demuestre la bioequivalencia mediante ensayos in vivo e in vitro (43).
Interacciones medicamentosas: la toma concomitante de fármacos nefrotóxicos, como los AINEs, aminoglucósidos, ciprofloxacina, clotrimazol, y los fibratos, pueden potenciar su nefrotoxicidad y ésta a su vez puede retrasar el metabolismo de la digoxina, simvastatina, prednisolona, diclofenac, y metotrexate, lo que conduce a una mayor concentración y toxicidad de estos fármacos (44). Los efectos secundarios de la ciclosporina (HTA, nefrotoxicidad, temblor, gastrointestinales, hipertricosis, hipertrofia gingival, disionías y parestesias) han limitado en gran medida su uso en dermatología. En su mayor parte son dosis dependientes y reversibles al suprimir el fármaco, aunque las anormalidades estructurales renales pueden ser persistentes y están relacionadas con el tratamiento prolongado (2 años o más) y con dosis mantenidas de más de 5 mg/kg/día (44).
Un instrumento para el control de la toxicidad renal, es la valoración de los cambios de la creatinina plasmática. Frente a incrementos superiores al 60% del nivel basal debe interrumpirse. Entre 60 y 30% (dos lecturas consecutivas con un intervalo de 2 semanas) se aconseja disminuir la dosis administrada a 1 mg/kg/día por 4 semanas, incluso si se han logrado valores normales. Si la creatinina sérica no mejora después de 4 semanas, debe reducirse o interrumpirse (44).
La asociación con cáncer no cutáneo, particularmente linfomas, ha sido reportada en tratamientos intensos y prolongados, pero si la dosis no supera los 5 mg/kg/día y el tratamiento no es mayor a 2 años, el riesgo es similar al de la población general (44).
Se aconseja solicitar previo al inicio del tratamiento: control de presión arterial, función renal, ionograma con magnesio, examen de orina, uricemia, funcional y enzimograma hepático, perfil lipídico, PPD y βHCG si corresponde (19). Durante el tratamiento se aconseja controlar los valores de presión arterial regularmente y la valoración de la función renal en la segunda, cuarta y octava semana y luego mensual. Solicitar en la evolución, una vez al mes hemograma, ionograma con magnesio, funcional y enzimograma hepático, perfil lipídico, ácido úrico, examen de orina y después de 1 año de tratamiento continuo, valorar el filtrado glomerular (6).
Debe indicarse realizar higiene dental cuidadosa y control con odontólogo cada 6 meses para controlar la hipertrofia gingival. También se recomienda administrar vacunas antineumocóccica y antigripal anualmente y control dermatológico periódico valorando lesiones premalignas y malignas cutáneas (44).
Precauciones: consumo excesivo de alcohol (puede aumentar los valores de ciclosporina), en pacientes con antecedentes de neoplasia (a excepción de carcinoma basocelular), o que hayan recibido fototerapia con PUVA con dosis mayores a 1.000 J/cm2 (44).
Contraindicaciones relativas: embarazo (si bien no es teratogénico, se considera categoría C) (18), lactancia, pacientes con antecedente de epilepsia, disfunción hepática, diabetes, obesidad, condiciones premalignas, edad avanzada mayor de 65 años, consumo de drogas o alcohol y tratamiento previo y prolongado con PUVA. (44).
Contraindicaciones absolutas: HTA descontrolada, insuficiencia renal severa, inmunodepresión e infecciones graves (44).
A MODO DE CONCLUSIÓN
La psoriasis es una enfermedad multifactorial en la que tanto factores genéticos como ambientales contribuyen a la disregulación de los mecanismos celulares de control de la inflamación. Así, las placas de psoriasis pueden ser disparadas o exacerbadas por condiciones externas que incluyen infección y estrés físico o psíquico, frío y diversos medicamentos. La formación de placas de psoriasis involucra un interjuego de células dendríticas, linfocitos T, células presentadoras de antígenos, citoquinas y receptores de vasos sanguíneos. La presencia de linfocitos T activados en las placas de psoriasis y la respuesta a terapias dirigidas a dichos linfocitos sugirieron la naturaleza inmunológica de la enfermedad. Hoy se conoce buena parte de los mecanismos patogénicos en juego.
Cuando la enfermedad está limitada a áreas típicas (cuero cabelludo, codos y rodillas, ombligo, pliegue interglúteo, conducto auditivo externo) puede ser manejada con éxito mediante agentes tópicos (emolientes, corticoides (nivel de evidencia I) (45), análogos de la vitamina D (nivel de evidencia I) (46), tazaroteno (nivel de evidencia I) (47), pero en un porcentaje no despreciable de casos, ya sea por la extensión, el compromiso articular o el detrimento de la calidad de vida del paciente, se hace necesaria la introducción de terapias sistémicas.
Las llamadas terapias “convencionales” (Figura 1), que fueron analizadas en esta revisión pueden ser muy efectivas y su costo es moderado. Sin embargo se asocian, tanto a corto como a largo plazo, a importantes efectos adversos (hepato y nefrotoxicidad, HTA, dislipidemia, desarrollo de neoplasias y teratogenicidad).
La fototerapia es considerada la primera opción terapéutica (nivel de evidencia I) (20)., tratándose de la opción menos agresiva, que posee claras contraindicaciones y requiere una importante adherencia al tratamiento, pudiendo determinar fotocarcinogénesis a largo plazo.
El metrotexate por su parte es una de los fármacos “patrón” en el tratamiento de formas severas, si bien posee un menor nivel de evidencia (nivel de evidencia II) (48). En efecto pese a la generalización de su uso y su inclusión como terapia sistémica en todas las guías, pautas y recomendaciones, la revisión sistemática realizada por Naldi y Griffiths no encontró estudios con un nivel aceptable de diseño acerca del uso de metrotexate en psoriasis (49).
La Ciclosporina A constituye un importante recurso terapéutico sobre todo en los casos graves donde se requiere un tratamiento de rápida acción (nivel de evidencia I) (50).
El Acitretin posee una eficacia demostrada en los casos donde se requiere un tratamiento sistémico (nivel de evidencia I) (51).
En general a mediano plazo se hace necesaria la rotación de tratamientos debido a la resistencia adquirida, que junto a la refractariedad en muchos casos llevan a escasos resultados con altos niveles de insatisfacción.
Desde hace algunos años la introducción de las terapias llamadas “biológicas” brindan nuevas alternativas terapéuticas.
BIBLIOGRAFÍA
1. Griffiths C, Barker J. Psoriasis en Rook’s Textbook of Dermatology, Eighth Edition. Wiley-Blackwell. Oxford, UK. 2010. Vol 1. pp. 20.1-20.60.
2. Samarasekera E, Sawyer L, Parnham J, Smith CH; Guideline Development Group. Assessment and management of psoriasis: summary of NICE guidance. BMJ 2012;345:e6712.
3. Langley RG, Krueger GG, Griffiths CE. Psoriasis: Epidemiology, clinical features, and quality of life. Ann Rheum Dis 2005;64 Supl. 2:18–23; discussion 24-5.
4. Yip Y. The prevalence of psoriasis in the Mongoloid race. J Am Acad Dermatol 1984;10:965-68.
5. Gudjonsson J E, Elder J T. Psoriasis: epidemiology. Clin Dermatol 2007;25:535-46.
6. González S, Querio R, Ballina J. Actualización en la patogenia de la artritis psoriásica. Reumatol Clin 2012;8 Supl.1:1–6.
7. Lebwohl M. Psoriasis. Lancet 2003;361(9364):1197- 1204.
8. Chalela J, González C, Castro L. Guías de manejo de psoriasis. Consenso colombiano. Asociación Colombiana de Dermatología y Cirugía Dermatológica (ASOCOLDERMA). Bogotá, 2008.
9. Naldi L. Scoring and monitoring the severity of psoriasis. What is the preferred method? What is the ideal method? Is PASI passé? facts and controversies. Clin Dermatol 2010;28(1):67-72.
10. Carlin CS, Feldman SR, Krueger JG, Menter A, Krueger CG. A 50% reduction in the Psoriasis Area and Severity Index (PASI50) is a clinically significant endpoint in the assessment of psoriasis. J Am Acad Dermatol 2004;50(6):859-66.
11. Puig L. ¿Es realmente útil el PASI como parámetro de medida de severidad en la psoriasis?. Servicio de Dermatología. Hospital de la Santa Creu i Sant Pau, Barcelona. 2008. Disponible en http://aedv.es/grupo_psoriasis/archivo/utilidad%20PASI.pdf.
12. Feldman S.R. Treatment of psoriasis. And UpToDate, Ofori A.O (Ed), UpToDate 2013.
13. Menter A, Korman NJ, Elmets CA, Feldman SR, Gelfand JM, Gordon KB, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 3. Guidelines of care for the management and treatment of psoriasis with topical therapies. J Am Acad Dermatol 2009;60:643-59.
14. Murdoch D, Clissold SP. Calcipotriol. A review of its pharmacological properties and therapeutic use in psoriasis vulgaris. Drugs 1992;43(3):415-29.
15. Guerra A. Tazaroteno: un nuevo retinoide de uso tópico. Actas Dermosifiliogr 1999;90:71-78.
16. Lebwohl M. Strategies to optimize efficacy, duration of remission, and safety in the treatment of plaquepsoriasis by using tazarotene in combination with a corticosteroid. J Am Acad Dermatol 2000;43(2 Pt 3):S43-6.
17. Lebwohl M, Ali S. Treatment of psoriasis. Part 1. Topical therapy and phototherapy. J Am Acad Dermatol 2001;45(4):487-98; quiz 499-502.
18. Tyler KH, Zirwas MJ. Pregnancy and dermatologic therapy. J Am Acad Dermatol 2012;19.pii: S0190-9622(12)01039-0.
19. Menter A, Korman NJ, Elmets CA, Feldman SR, Gelfand JM, Gordon KB, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 4. Guidelines of care for the management and treatment of psoriasis with traditional systemic agents. J Am Acad Dermatol 10.1016/j.jaad.2009.03.027.
20. Archier E, Devaux S, Castela E, Gallini A, Aubin F, Le Maître M et al. Efficacy of psoralen UV-A therapy vs. narrowband UV-B therapy in chronic plaque psoriasis: a systematic literature review. J Eur Acad Dermatol Venerol 2012;26 Supl 3:11-21.
21. Menter A, Korman NJ, Elmets CA, Feldman SR, Gelfand JM, Gordon KB, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 5. Guidelines of care for the treatment of psoriasis with phototherapy and photochemotherapy. J Am Acad Dermatol 2010;62:114-35.
22. Ubogui J, Saposnik M. Ultraviolet phototherapy in Dermatology. Dermatol Argent 2008;14(4):267-275.
23. Wolff K, Gschnait F, Honigsmann H, Konrad K, Parrish JA, Fitzpatrick TB. Phototesting and dosimetry for photochemotherapy. Br J Dermatol 1977;96:1-10.
24. Dawes RS, Wainwrhigt NJ, Cameron H, Ferguson J. Narrowband ultraviolet B phototherapy for chronic plaque psoriasis: three times or five times weekly treatment?. Br J Dermatol. 1998;138:833-9.
25. Hearn RM, Kerr AC, Rahim KF, Ferguson J, Dawe RS. Incidence of skin cancers in 3867 patients treated with narrow-band ultraviolet B phototherapy. Br J Dermatol 2008;159:931-5.
26. Stern RS, Thibodeau LA, Kleinerman RA, Parrish JA, Fitzpatrick TB. Risk of cutaneous carcinoma in patients treated with oral methoxsalen photochemotherapy for psoriasis. N Engl J Med 1979;300:809-13.
27. Stern RS, Laird N, Melski J, Parrish JA, Fitzpatrick TB, Bleich HL. Cutaneous squamous-cell carcinoma in patients treated with PUVA. N Engl J Med 1984;310:1156-61.
28. Nijsten TE, Stern RS. The increased risk of skin cancer is persistent after discontinuation of psoralen 1 ultraviolet A: a cohort study. J Invest Dermatol 2003;121:252-8.
29. Murase JE, Lee EE, Koo J. Effect of ethnicity on the risk of developing nonmelanoma skin cancer following long-term PUVA therapy. Int J Dermatol 2005;44:1016-21.
30. Carretero G, Puig L, Dehesa L, Carrascosa JM, Ribera M, Sánchez-Regaña M, et al. Metotrexato: guía de uso en psoriasis. Actas Dermosifiliogr 2010;101(7):600–613.
31. Kroger AT, Atkinson WL, Marcuse EK, Pickering LK. General recommendations on immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2006;55(RR-15):1-48.
32. Bagnulo H, Velázquez A, Dibarboure H, Opertti A, Fernandez G, Sosa B, Gambogi R, Haretche A. Programa de vacunación de grupos de riesgo. Fondo Nacional de Recursos. Uruguay – 2004. Rev Panam Infectol 2005;7(3):15-21
33. Braun J. Methotrexate: optimizing the efficacy in rheumatoid arthritis. Ther Adv Musculoskelet Dis 2011;3:151-8.
34. Sommer WH, Ganiere V, Gachoud D, Keta A, Abou-Hajar A, Dudler J, et al. Neurological and pulmonary adverse effects of subcutaneous methotrexate therapy. Scand J Rheumatol 2008;37:306-9.
35. Giard C, Avenel-Audran M, Croué A, Verret JL, Martin L. Primary cutaneous Epstein-Barr virus-associated B-cell lymphoma arising at the site of subcutaneous injections of methotrexate. J Clin Oncol 2010;28:e717-8.
36. Weinstein GD, Frost P. Methotrexate for Psoriasis. A New Therapeutic Schedule. Arch Dermatol 1971;103:33-8.
37. Radmanesh M, Rafiei B, Moosavi ZB, Sina N. Weekly vs. daily administration of oral methotrexate (MTX) for generalized plaque psoriasis: a randomized controlled clinical trial. Int J Dermatol 2011;50:1291-3.
38. Bonafont X, Bonal J. Dosificación de medicamentos en la insuficiencia renal. Semin Fund Esp Reumatol 2009;10(1):24-28.
39. Kalb R, Stober B, Weinstein G, Lebwohl M. Methotrexate and psoriasis: Consensus conference. J Am Acad Dermatol 2011;64(6):1179-97.
40. Ormerod AD, Campalani E, Goodfield MJD. British Association of Dermatologists guidelines on the efficacy and use of acitretin in dermatology. Br J Dermatol 2010;162(5):952–63.
41. Dogra S, Jain A, Kanwar AJ. Efficacy and safety of acitretin in three fixed doses of 25, 35 and 50mg in adult patients with severe plaque type psoriasis: a randomized, double blind, parallel group, dose ranging study. J Eur Acad Dermatol Venereol 2012;27:e305-31.
42. Amor KT, Ryan C, Menter A. The use of cyclosporine in dermatology: Part I. J Am Acad Dermatol 2010;63(6):925-946.
43. Uruguay. Decreto N° 12/007. Recomendaciones técnicas para la realización de estudios de bioequivalencia. MSP. Montevideo, Uruguay. 12 de enero de 2007.
44. Ryan C, Amor KT, Menter A. The use of cyclosporine in dermatology: Part II. J Am Acad Dermatol 2010;63(6):949-972.
45. Mason J, Mason AR, Cork MJ. Topical preparations for the treatment of psoriasis: a systematic review, BJD 2002, 142(3), 351–364.
46. Darren M Ashcroft, Alain Li Wan Po, Hywel C Williams, Christopher E M Griffiths, Systematic review of comparative efficacy and tolerability of calcipotriol in treating chronic plaque psoriasis, BMJ 2000;320:963.
47. Gerald D. Weinstein, Gerald G. Krueger, Nicholas J. Lowe. Tazarotene gel, a new retinoid, for topical therapy of psoriasis: Vehicle-controlled study of safety, efficacy, and duration of therapeutic effect. JAAD, 1997, 37(1), 85-92.
48. Michael Bigby. A Randomized Controlled Trial of Methotrexate and Cyclosporine in the Treatment of Psoriasis, Arch Dermatol. 2004;140(3):347-348.
49. L. Naldi, C.E.M. Griffiths. Traditional Therapies in the Management of Moderate to Severe Chronic Plaque Psoriasis: An Assessment of the Benefits and Risks. BJD 2005;152(4):597-615.
50. Colombo. D, Cassano .N, Altomare .G.Psorisis relapse evaluation with week-end Cyclosporine A: Results of a randomized, double-blind, multicentre study. International Journal of immunopathology and pharmacology.2010; 23 (3)999-1008.
51. Sbidian E, Maza A, Montaudié H, Gallini A, Aractingi S, Aubin F, Cribier B, Joly P, Jullien D, Efficacy and safety of oral retinoids in different psoriasis subtypes: a systematic literature review. J Eur Acad Dermatol Venereol. 2011; 25 (2):28-33.