Services on Demand
Journal
Article
Related links
Share
Archivos de Medicina Interna
Print version ISSN 0250-3816On-line version ISSN 1688-423X
Arch. Med Int vol.34 no.2 Montevideo 2012
Trombocitopenias y embarazo
Thrombocytopenias and Pregnancy
Diagnostic dilemmas, rationale for the therapeutic management
Dr. Leonardo Sosa
Profesor Director de Clínica Médica “B”, Facultad de Medicina. UdelaR. Montevideo.
Resumen: Arch Med Interna 2012 - 34(2): 47-56
El hallazgo de una plaquetopenia durante la gestación siempre genera preocupación. Para el clínico es un desafío diagnóstico debido a la multiplicidad de etiologías que se deben considerar. En esta revisión se repasan las distintas causas de trombocitopenia en el embarazo y se mencionan las bases de su manejo terapéutico. Se aborda la definición y posibles causas de la trombocitopenia gestacional así como su significado y manejo clínico. A continuación se describen las complicaciones gestacionales que cursan con trombocitopenia así como las bases de su manejo. De estos cuadros se jerarquizan los estados hipertensivos del embarazo, especialmente la preeclampsia y el HELLP así como las microangiopatías trombóticas del embarazo y el síndrome antifosfolipídico. Posteriormente se reseñan las repercusiones recíprocas del púrpura trombocitopénico inmune y la gestación así como los aspectos relevantes del diagnóstico y la conducta terapéutica cuando está indicada. Se finaliza mencionando causas raras de trombocitopenia durante el embarazo.
Palabras clave: Trombocitopenias, Embarazo, Trombocitopenia gestacional, Estados hipertensivos del embarazo, Púrpura trombocitopénico inmune”, Manejo.
Abstract: Arch Med Interna 2012 - 34(2): 47-56
Finding a reduced platelet count during pregnancy is always a matter of concern. The multiplicity of etiologies that need to be considered poses a diagnostic challenge for the clinician. This paper gives an overview of the different causes of thrombocytopenia in pregnancy and mentions the rationales for its therapeutic management. In addition to the definition, the paper addresses the potential causes of gestational thrombocytopenia, as well as its relevance and clinical management. The paper then describes the pregnancy-induced complications associated with thrombocytopenia and the rationale for their management. Particular emphasis is made on the hypertensive states of pregnancy, especially preeclampsia and HELLP, as well as thrombotic microangiopathies of pregnancy and the antiphospholipid syndrome. The reciprocal impact of immune thrombocytopenic purpura and gestation is discussed, as well as the relevant aspects of diagnosis and the therapies prescribed, when appropriate. The authors finally describe rare causes of thrombocytopenia during pregnancy.
Key words: Thrombocytopenias, Pregnancy, Gestational Thrombocytopenia, Hypertensive States of Pregnancy, Immune Thrombocytopenic Purpura, Management.
INTRODUCCIÓN
Las trombocitopenias durante el embarazo son un problema complejo tanto desde el punto de vista diagnóstico como por la conducta terapéutica que pueden implicar.
El propósito de esta revisión es presentar la información disponible, de un tema que habitualmente se encuentra disperso en varias publicaciones de distintas disciplinas, de una manera unificada y resumida con una visión clínica y un carácter práctico.
Se realizó una revisión bibliográfica descriptiva recurriendo para ello al buscador MEDLINE (NLM) de los EUA y LILACS. También se recurrió a libros de texto y páginas web del tema específico abordado.
Se define trombocitopenia, según algunos autores, la cifra de plaquetas por debajo de 100 × 109/L(1). y para otros por debajo de 150 × 109/L(2). Ha sido clásico manejar esta última cifra debido a que la mayoría de los laboratorios definen el límite inferior como menor de dos desviaciones estándares con respecto a la media de la variación normal. Ahora bien, estas cifras se refieren a población normal no embarazada, por lo que se puede argumentar que la plaquetopenia en el embarazo puede comenzar a partir de cifras inferiores como luego se verá (3).
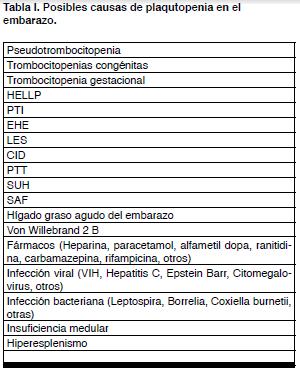
Con el advenimiento de los contadores automáticos de células sanguíneas el hallazgo de plaquetopenia en el curso del embarazo se hizo una consulta muy frecuente a la vez que una situación inquietante por los distintos diagnósticos que puede implicar (ver Tabla I).
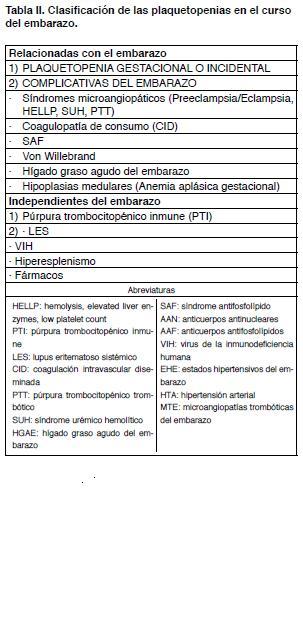
Sin embargo, lo primero que se bebe descartar en el caso que se trate de una trombocitopenia aislada y sin manifestaciones clínicas, es una pseudotrombocitopenia debido a la aglutinación de las plaquetas “in vitro”. Esta situación que se ve en una de cada mil personas normales no tiene significancia clínica y puede excluirse con la observación de una “lámina periférica” (4). Excluido este fenómeno la aparición de trombocitopenia durante el embarazo puede indicar entidades muy diversas. Desde la plaquetopenia gestacional, de curso benigno y sin complicaciones maternas ni fetales, hasta la plaquetopenia del HELLP (acrónimo del inglés: hemolysis, elevated liver enzymes, low platelet count) de curso grave y complicado, pasando por el púrpura trombocitopénico inmune (PTI), enfermedad independiente del embarazo pero que lo puede afectar de múltiples maneras. En la Tabla II se puede ver la clasificación que se seguirá.
PLAQUETAS Y EMBARAZOTrombocitopenia gestacional
A partir del trabajo de Sejeny y col. de 1975 que sugiere disminución del recuento plaquetario durante el curso del embarazo se inicia el estudio de este fenómeno (5,6).
Posteriormente Walleburg y col. en 1978 y Fay y col. en 1983 encuentran que durante el embarazo se destruyen más plaquetas y su volumen medio aumenta conforme avanza la gestación (7,8).
En 1988 Burrows y Kelton estudian 1357 embarazadas normales y encuentran que hay 112 (8.3%) que tienen plaquetopenia leve de entre 97 y 150’109/L. Este grupo no presenta ninguna característica patológica observable y sus neonatos no muestran diferencias significativas en el recuento plaquetario con respecto a los neonatos nacidos de las madres no plaquetopénicas (9) . Concluyen que esta es una forma de plaquetopenia incidental que no produce efectos adversos sobre las gestantes ni sus productos y que no esta justificado realizar intervenciones obstétricas por su causa (9). Entre enero de 1986 y diciembre de 1992 los mismos autores estudiaron prospectivamente 15471 embarazadas y encontraron 1027 trombocitopenias de las cuales el 73.6% eran incidentales (10).
La causa de esta trombocitopenia no es clara. Se ha invocado cierto grado de coagulopatía de consumo compensada durante la gestación, daño endotelial, hemodilución, atrapamiento placentario, aumento de la activación y aclaramiento plaquetario e incluso PTI aún no diagnosticado (11).
El desafío queda planteado cuando la gestante presenta trombocitopenia y hay otros posibles diagnósticos. Otras causas frecuentes de trombocitopenia son los estados hipertensivos del embarazo que explican alrededor del 20 % de estas trombocitopenias. En un 4% se trata de desórdenes inmunes como el PTI o el lupus eritematoso sistémico (LES) entre otros. Causas menos frecuentes incluyen, coagulación intravascular diseminada (CID), púrpura trombocitopénico trombótico (PTT), síndrome urémico hemolítico (SUH), HELLP, hígado graso agudo del embarazo (HGAE) y síndrome antifosfolípido (SAF) (3,10-12).
Obsérvese que la incidencia de la plaquetopenia gestacional hace que sea la causa más frecuente de trombocitopenia durante el embarazo y que supere por lejos a todas las otras causas sumadas.
Asumiendo la existencia de la plaquetopenia incidental o gestacional, se ha buscado el número umbral de plaquetas a partir del cual se deberían investigar otras causas que expliquen la plaquetopenia.
Se ha demostrado que una plaquetopenia por encima de 115 ´ 109/L en gestantes, por otra parte sanas, debe ser considerada segura y no serían necesarias otras investigaciones (11). En la práctica se ha llevado esta cifra umbral a 100‘109/L. Tratándose de una embarazada sin otras alteraciones y sin antecedentes de valor patológico, se considera que tiene una plaquetopenia gestacional de curso benigno, tanto para ella como para el producto de la concepción y sobre la que no se deberían realizar otras intervenciones.
En general, se considera un recuento plaquetario entre 100’109/L y 150’109/L como plaquetopenia leve, entre 50 ´ 109/L y 100’109/L moderada y por debajo de 50’109/L como severa (12).
Sin embargo, el clínico deberá permanecer atento ante una plaquetopenia cualquiera sea su valor. Aún con plaquetopenias leves se deberá considerar el diagnóstico de preeclampsia o HELLP ya que estas entidades pueden en algún momento de la evolución cursar sólo con alteraciones de laboratorio. A su vez, si la plaquetopenia aparece al inicio del embarazo es más probable que se trate de un PTI.
En la evaluación paraclínica, se aconseja buscar proteinuria y elementos de microangiopatía en lámina periférica así como determinación de bilirrubinas y enzimas hepáticas. Otras investigaciones deberán incluir presencia de anticuerpos antinucleares (ANA), complementemia, anticuerpos antifosfolípidos (AAF) así como excluir infección por el virus de la inmunodeficiencia humana (VIH). Si se concluye que se trata de una trombocitopenia gestacional, sólo se realizará observación. Las plaquetas deberán volver a la normalidad alrededor de 6 semanas luego del parto (3). Si esto no se verifica se deberá considerar el diagnóstico de PTI.
Por último, no es raro que algunas de estas pacientes en la evolución terminen de configurar una enfermedad autoinmune, con mayor frecuencia un LES (13).
COMPLICACIONES GESTACIONALES QUE CURSAN CON TROMBOCITOPENIA
Se considerarán agrupadamente las complicaciones hipertensivas del embarazo (preeclampsia severa, eclampsia y HELLP) junto con los trastornos microangiopáticos del embarazo (PTT/SUH) por sus similitudes clínicas así como elementos patogénicos comunes. Luego se repasarán otras complicaciones gestacionales menos frecuentes como el hígado graso agudo del embarazo, el SAF y la enfermedad de von Willebrand 2 B, entre otros.
Estados hipertensivos del embarazo (EHE)
Los estados hipertensivos son la complicación médica más frecuente de la gestación. Se observan entre un 5 y un 10% de todas las gestantes según distintos autores(14). En nuestro medio el Sistema Informático Perinatal (SIP) ha informado una incidencia de 4,5 a 5,3% en los últimos años(15).
Los EHE, pero sobre todo la preeclampsia severa y la eclampsia, contribuyen con una parte importante de las plaquetopenias relacionadas con la gestación. Entre 15 y 50% de las pacientes con preeclampsia desarrollan trombocitopenia en algún momento del su enfermedad, haciendo a la preeclampsia una causa frecuente de trombocitopenia significativa durante el tercer trimestre del embarazo(16). En el estudio prospectivo de Burrows y Kelton ya mencionado los estados hipertensivos y sus complicaciones representaron el 21% de todas las plaquetopenias(10).
Se ha especulado extensamente con el rol de las plaquetas en los EHE. Una hipótesis atractiva ha sido que la preeclampsia está mediada por una interacción alterada entre las plaquetas y el endotelio(17).
Las causas de la trombocitopenia son debatidas pero interviene sin duda, la agregación plaquetaria que está aumentada en las pacientes preeclámpticas (18). El aumento de la agregación podría ser el resultado de vasoespasmo y microangiopatía en el que el daño de las células endoteliales estimula la activación plaquetaria. Un signo indirecto del consumo periférico podría ser el mayor aumento del volumen plaquetario en las pacientes preeclámpticas(17).
Si bien la trombocitopenia no ha podido ser un marcador predictivo útil de preeclampsia, sí se vincula claramente con malos resultados maternos y fetales(18). En cambio, se ha informado que el aumento del volumen plaquetario, puede aparecer hasta una semana antes del desarrollo de preeclampsia en un subgrupo de gestantes hipertensas no proteinúricas(17).
Otro hecho informado reiteradamente es que la severidad de la trombocitopenia aumenta con la aparición o gravedad de las complicaciones preeclámpticas(12,18).
Por lo tanto la trombocitopenia en el contexto de un EHE es siempre un signo de alarma y si esta es menor de 100’109/L es un signo de severidad de la preeclampsia y obliga a considerar fuertemente la interrupción del embarazo(12,19-21).
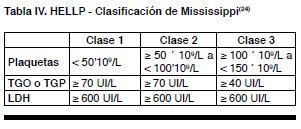
Cuando la paciente, además de la trombocitopenia, presenta evidencias de hemólisis intravascular y disfunción hepática se configura el síndrome conocido como HELLP. Este complica el 10 a 20% de las pacientes con preeclampsia severa(21). Los criterios diagnósticos fueron puestos a punto por el grupo de Sibai aunque la descripción original corresponde a Weinstein en 1982. Es de destacar que otra de las clasificaciones toma en cuenta que, la plaquetopenia de entre 100’109/L y 150’109/L también puede integrar el espectro de esta patología en su forma más leve (Clase 3 de la Clasificación de Mississippi)(22-24). Ver Tablas III y IV.
Desde el punto de vista patogénico el HELLP representa una etapa de daño endotelial avanzado con hemólisis microangiopática y consumo plaquetario.
Es importante tener presente el diagnóstico de HELLP ya que las pacientes pueden presentarse al inicio con cuadros atípicos. Es común que presenten dolor en hipocondrio derecho o epigastrio, vómitos y cefalea. Los días previos pueden haber presentado malestar general que asemeja un cuadro de impregnación viral. Si bien la mayoría tendrán hipertensión arterial (HTA) y proteinuria estos signos pueden faltar o ser leves(22).
Tratándose de un cuadro grave con probable deterioro brusco de las condiciones materno fetales se deberá internar a la paciente en un centro terciario. Se realizará profilaxis de las convulsiones eclámpticas con sulfato de magnesio, se controlará farmacológicamente la HTA - si fuera necesario en forma parenteral- y se considerará iniciar corticoesteroides si el embarazo es menor de 34-35 semanas y las condiciones maternofetales son estables. Caso contrario o si la edad gestacional fuera mayor de 34-35 semanas se deberá interrumpir el embarazo(23,24). Las conductas expectantes o conservadoras son controversiales y siempre requieren un centro terciario bien dotado así como un equipo interdisciplinario con experiencia.
El impacto sobre los resultados perinatales es significativo con al menos 20% de mortalidad perinatal y complicaciones que incluyen entre 15 y 38% de trombocitopenia en el recién nacido(24,25).
Otra complicación, aunque rara de la preeclampsia severa/eclampsia y que puede cursar con plaquetopenia, es la CID(17,18).
El embarazo normal sería una forma leve y compensada de coagulopatía intravascular de consumo. A su vez, en múltiples situaciones patológicas del embarazo como las ya vistas o en el desprendimiento de placenta, la embolia de líquido amniótico o el feto muerto y retenido, se produce formación y destrucción acelerada de fibrina en la microcirculación. Todas estas situaciones tienen en común el extenso daño endotelial o el ingreso al torrente circulatorio de material tromboplastínico(26,27).
Su expresión clínica puede ser muy proteiforme ya que es el producto de una coagulopatía que puede producir extensas hemorragias y también trombosis microvascular que se manifiesta con diferentes grados de isquemia y/o necrosis con disfunción de distintos órganos.
La paraclínica típica mostrará trombocitopenia, alteraciones de la crasis, con prolongación de los test de coagulación así como aumento de los productos de degradación del fibrinógeno y/o D dímeros. A su vez hay caída del fibrinógeno, que en el embarazo normal tiende a subir levemente y presenta un amplio rango de normalidad, lo que puede dificultar su evaluación(28).
El manejo terapéutico se fundamenta en el tratamiento de la causa desencadenante. Esto en general se logra con las medidas de sostén cardiopulmonar y la interrupción del embarazo. Puede ser necesaria la corrección de la coagulopatía con plasma fresco congelado y/o crioprecipitados. La administración de plaquetas sólo se planteará en los casos de plaquetopenias muy severas (menores de 20’109/L) o si hay sangrados clínicamente significativos(28).
Un diagnóstico diferencial del HELLP o la causa de una CID puede ser el Hígado Graso Agudo del Embarazo (HGAE) entidad que también puede cursar con trombocitopenia.
El HGAE es muy poco frecuente con una incidencia de 1/7 000 a 1/16 000 embarazos. La mortalidad materna continúa siendo significativa del orden del 18% y es mayor para el producto de la concepción. Aparece típicamente en el tercer trimestre del embarazo y consiste en una esteatosis microvesicular con falla hepatocítica y encefalopatía(29). Estaría provocado por una alteración en la oxidación intramitocondrial de los ácidos grasos de causa genética(30). El cuadro clínico se caracteriza por nauseas, vómitos, dolor abdominal e ictericia(29,31). Tal vez algunas de las claves para diferenciarlo del HELLP, sea la hipoglicemia así como una hiperbilirrubinemia más pronunciada(30,32). También puede ser de ayuda la disminución de la tasa de protrombina que raramente falta y puede ser pronunciada. Si se presenta la plaquetopenia, en general es moderada, pero suele coincidir con complicaciones hemorrágicas evidentes(24,29,31).
Si bien no se han descrito terapias específicas para el HGAE se acepta que el diagnóstico precoz, la finalización del embarazo así como los cuidados de sostén han mejorado el pronóstico de esta entidad en los últimos años(30,33).
Trastornos microangiopáticos del embarazo
Púrpura trombocitopénico trombótico (PTT)/Síndrome urémico hemolítico (SUH)
Las microangiopatías trombóticas del embarazo (MTE) se caracterizan por trombocitopenia, anemia hemolítica microangiopática y falla multiorgánica. Clásicamente lo integran el PTT y el SUH pero las formas más severas y o complicadas de la preeclampsia pueden ser indistinguibles de estos cuadros(34).
Característicamente el recuento plaquetario está muy disminuido; la mitad tiene menos de 20’109/L y en ocasiones disminuyen de manera aguda(28,34).
Se trata de entidades raras; se observa MTE en uno de cada 25.000 nacimientos. El PPT se ha observado con mayor frecuencia en mujeres. Aunque no son cuadros exclusivos del embarazo, la relación de la gestación y el PTT parece ser clara. Al diagnóstico hasta un 25% están embarazadas o en el puerperio. Se ha sugerido que el aumento fisiológico del factor de von Willebrand (fvW), que se produce en el tercer trimestre del embarazo, explicaría esta vinculación ya que se conoce desde hace años la asociación de las formas multiméricas de dicho factor y el PTT. En condiciones normales los multímeros del fvW aglutinan las plaquetas, acción que es balanceada por una metaloproteasa plasmática (la ADAMS13) que escinde los multímeros y los fragmenta evitando la excesiva agregación plaquetaria. El déficit o la menor actividad de esta enzima, sea adquirido o congénito, está en la base del PTT(34-36). Si bien el SUH es un cuadro muy similar que ha permanecido casi indistinguible del PTT tiene algunas particularidades etiopatogénicas que últimamente lo comienzan a identificar por separado. Se observa más en niños, sobre todo la forma asociada a diarrea(37). Otras formas estarían vinculadas a mutaciones de genes involucrados en la activación de la vía alterna del complemento y en este caso la gestación podría actuar como precipitante(38,39).
Las MTE son cuadros de extrema gravedad que pueden asociar trombos plaquetarios e infartos en órganos como el riñón o el encéfalo y en los que se citan cifras de mortalidad materna y fetal de 40 y 80% respectivamente. Estas cifras podrían ser dramáticamente mejoradas con un diagnóstico oportuno y adecuado tratamiento(27,34). Clínicamente lo que las puede distinguir es la distribución lesional. El PTT es un cuadro más generalizado, en cambio en el SUH el blanco parece ser el riñón. Así, en los casos de SUH el cuadro es similar en lo que se refiere a la trombocitopenia y la anemia hemolítica microangiopática pero predomina la insuficiencia renal y es típico que se presente en el periodo periparto(27,34). Para el PTT, se describe una tríada de anemia hemolítica microangiopática, trombocitopenia y síntomas de disfunción encefálica. En ocasiones agrega fiebre y también disfunción renal. Además pueden sumar leucocitosis e incluso neutrofilia con desviación a la izquierda lo que puede hacer difícil el diagnóstico diferencial con infecciones complicadas(27). Estos elementos raramente se presentan en las complicaciones de los EHE. A su vez, el diagnóstico diferencial con la CID se sustenta en la normalidad de los test de coagulación(34).
Distinguir estos cuadros de la preeclampsia severa/eclampsia y/o el HELLP tiene máxima importancia, desde el momento que el tratamiento de estas complicaciones es básicamente la interrupción del embarazo, en tanto que el PTT se beneficia de plasmaféresis e intercambio plasmático además del uso de esteroides del tipo de la metilprednisolona. En los casos refractarios se han ensayado inmunosupresores(28,34).
En la medida de lo posible se debe evitar la transfusión plaquetaria que se ha asociado a deterioro clínico sin conocerse claramente la razón y se la reservará para casos de sangrado intracraneal documentado(34).
En los casos de SUH además se debe recurrir con frecuencia a la hemodiálisis(34).
Cuando el cuadro PTT/SUH se presenta en el primer trimestre se debe ser agresivo en el tratamiento y si no hay respuesta lo más cauteloso es evacuar el útero. Si el cuadro se presenta en el tercer trimestre pero antes de las 30 semanas la plasmaféresis debe ser el tratamiento primario. Si el dilema es diferenciarlo de las complicaciones severas de los EHE, se debe actuar como si fuera éste el diagnóstico. Por último aquellas pacientes con diagnóstico de preeclampsia severa y/o complicada que no mejoran luego de 48-72 horas de la interrupción del embarazo deben ser evaluadas con alta sospecha de PTT/SUH(34).
Otras causas de trombocitopenia relacionadas con el embarazo
El SAF se caracteriza por la presencia de trombosis arteriales o venosas así como malos resultados obstétricos asociados a los AAF. El mecanismo patogénico por el cual actúan los AAF en el embarazo a nivel placentario incluiría inflamación crónica vellositaria y vasculopatía trombótica decidual(40).
El SAF puede ocurrir en el contexto de una enfermedad autoinmune, con frecuencia LES u otra entidad desencadenante. En este caso se habla de SAF secundario. En otras ocasiones no está vinculado a otra entidad como acontece en la mayoría de los SAF del embarazo (SAFE) y se lo considera primario.
Tanto el SAF como el LES pueden asociar trombocitopenia. En el SAF, la plaquetopenia fue excluida en 1999 como criterio diagnóstico por su inespecificidad(41). Recientemente se propone la denominación trombocitopenia asociada a AAF. Esta asociación podría aumentar el riesgo de trombosis, como se ha demostrado en el PTI; por lo que estos anticuerpos en esta entidad, deben ser investigados y su presencia requiere seguimiento estrecho(42).
Debido al riesgo de preeclampsia, complicaciones obstétricas o enfermedad tromboembólico venosa el manejo del SAFE debe comprender, estrecho seguimiento clínico y paraclínico con monitorización de la presión arterial, proteinuria y seguimiento ecográfico que incluya doppler de las arterias uterina y umbilical(43).
El manejo farmacológico habitual de las pacientes con SAFE durante la gestación incluye ácido acetil salicílico y heparina con el que se ha mejorado la proporción de nacidos vivos. Durante el puerperio está indicada la tromboprofilaxis(43,44).
Otra enfermedad que puede provocar trombocitopenia, incluso severa, en el curso del embarazo, es la enfermedad de von Willebrand en su variedad 2B(45). En este subtipo, puede aparecer o agravarse una plaquetopenia ya existente en el curso del embarazo. Esto es debido a que en la variedad 2 B se asocia un factor de von Willebrand anormal que acelera el consumo de plaquetas por tener una afinidad aumentada a la glucoproteína Ib de estas. La aparición o intensificación de la plaquetopenia en el embarazo se explicaría por el aumento fisiológico del factor de von Willebrand que se verifica durante la gestación a medida que esta avanza(46,47). Esta particularidad se debe tener en cuenta en caso de requerirse tratamiento ya que la administración de sustancias como la desmopresina (1-desamino-8-D-arginina-vasopresina) hacen liberar más factor de von Willebrand anormal y son inefectivas. Por ejemplo, en el caso de sangrado grave, que puede ocurrir sobre todo en el parto o posterior al mismo, el tratamiento ideal será el sustitutivo, incluyendo concentrados de factor VIII que contengan fvW(46,48). También se puede recurrir en forma sintomática a los antifibrinolíticos sintéticos como el ácido epsilon-aminocaproico o el ácido tranexámico. Aunque hay informes muy limitados de su uso durante el embarazo, no se han comunicado efectos adversos maternos o fetales(47,49).
El ácido tranexámico pasa a la leche materna en concentraciones muy bajas (una centésima parte de las concentraciones en sangre materna) y tendría mala absorción digestiva lo que hace poco probable que se deba suspender la lactancia(49,50). Se presume que el ácido epsilon-aminocaproico pasa a la leche materna pero se desconocen sus efectos sobre el neonato(49).
Por último como causas de trombocitopenia vinculadas al embarazo se mencionarán las que se producen en el contexto de una hematopoyesis megaloblástica sobre todo por déficit de ácido fólico y la excepcional anemia aplásica gestacional.
Debido al intenso aumento de los requerimientos de folato durante el embarazo esta carencia es la causa más frecuente de anemia megaloblástica durante la gestación. Se observa sobre todo en mujeres multíparas con breves períodos intergenésicos y de medios socioeconómicos deficitarios. Si bien puede ser una causa de plaquetopenia aislada, en general va acompañada de otras citopenias. El tratamiento será la administración suficiente de ácido fólico.
El embarazo como causa de aplasia medular se discute desde hace más de un siglo. Se sustenta en algunas observaciones de aplasia medular sin otras causas que la justifiquen y remisión luego del parto. Vinculada patogénicamente o no al embarazo, la aplasia se expresa periféricamente por pancitopenia pero interesa remarcar que la trombocitopenia casi siempre es severa y que en la mayoría de las observaciones el soporte hematológico ha debido incluir concentrados plaquetarios habitualmente en el final del embarazo(51). Según la escasa experiencia publicada, la terapia de apoyo transfusional y la antibioticoterapia en general son exitosas. Sin embargo en caso que no hubiera respuesta a la terapia de soporte el dilema sería entre la interrupción del embarazo o el tratamiento inmunosupresor. Esta respuesta se debe dar caso a caso(52).
TROMBOCITOPENIAS INDEPENDIENTES DEL EMBARAZO
Púrpura Trombocitopénico Inmune
Si bien el PTI es una enfermedad independiente del embarazo por su importancia así como por su frecuencia merece una consideración especial.
Su patogenia al igual que fuera del embarazo está vinculada principalmente a la presencia de anticuerpos antiplaquetarios y al aclaramiento de los complejos plaquetas-anticuerpos por parte del sistema fagocítico mononuclear así como una menor producción medular de plaquetas también de causa inmune. Si bien la inmunopatogenia aun no está completamente aclarada entre otros hallazgos se describe un incremento de la relación Th1/Th2(53,54).
Clásicamente se ha dicho que el PTI es más frecuente en mujeres que en hombres y típicamente en edad reproductiva. Si bien recientemente se ha puesto en entredicho esta afirmación, el PTI sigue siendo frecuente durante la gestación(55). Se lo observa en uno a dos de cada 1.000 embarazos y si bien requiere vigilancia, la mayoría de las embarazadas con PTI tendrán un embarazo, parto y neonato sin complicaciones(56). Aun así, permanecen varios tópicos por dilucidar.
Diagnóstico
La mayoría de las pacientes con PTI en el curso del embarazo tienen el antecedente de padecer la enfermedad (57). Pero en algunos casos el diagnóstico se plantea frente al resultado de un recuento rutinario o con menos frecuencia ante el inicio de un síndrome equimótico petequial con trombocitopenia(56).
En los casos de trombocitopenia leve (≥ 100’109/L), de la segunda mitad del embarazo y que permanezcan asintomáticas se deberá pensar que corresponde –como ha sido analizado– a una plaquetopenia gestacional. Un panel de expertos consideró que sería muy improbable un PTI cuando las plaquetas fueran superiores a 70’109/L y cursara el tercer trimestre del embarazo(58). A su vez, cuanto más bajo sea el recuento plaquetario más probabilidades tendrá de ser una trombocitopenia patológica(28). Por otra parte, aun si la trombocitopenia es leve pero aparece al inicio del embarazo, se deberá pensar en PTI(57).
El PTI y la plaquetopenia gestacional pueden ser indistinguibles(56). La determinación de anticuerpos antiplaqueatarios no ha sido de utilidad para realizar esta distinción(59,60). El diagnóstico de PTI será siempre de exclusión y por lo tanto en todos los casos cobra jerarquía una meticulosa historia clínica seguida de un prolijo examen físico además de una valoración paraclínica individualizada.
Efecto del embarazo sobre el PTI
Tratándose de una inmunopatía con incremento de la relación Th1/Th2 se podría especular con una mejoría durante el embarazo a favor del ambiente Th2 reinante durante la gestación(61). A su vez por mecanismos similares a los implicados en la trombocitopenia gestacional podría haber aumento del clearance plaquetario conforme avanza el embarazo. Por otra parte los cambios procoagulantes que se verifican en la gestación podrían disminuir los síntomas hemorragíparos y hacer más tolerable el PTI durante el embarazo(60). Lo cierto es que el efecto neto del embarazo sobre el PTI parece ser nulo y la mayoría de las pacientes lo transcurren sin agravación ni complicaciones(62,63).
Efecto del PTI sobre el embarazo
Globalmente considerado el PTI en la gran mayoría de los casos no afecta el embarazo ni al neonato y raramente se debe desaconsejar la concepción(60,64,65). Sin embargo, se describe una asociación con mayor tasa de partos pretérmino y hasta 4,8% de mortalidad perinatal(66).
Los efectos más importantes del PTI sobre el embarazo están vinculados al parto. Sobre la madre pesa la posibilidad de sangrado sobre todo en los casos que se deban hacer intervenciones como la episiotomía o la propia operación cesárea y el recuento plaquetario sea menor de 50’109/L(56,63). Excepcionalmente se han informado sangrados intracraneales maternos intraparto(67).
Los efectos sobre el neonato están referidos a la posibilidad que este nazca con trombocitopenia dado que los anticuerpos antiplaquetarios –principalmente Inmunoglobulina G (Ig G)– atraviesan la placenta(56,63). Esta complicación se observa entre el 8m9 y el 14,7% con sangrados intracraneales que van desde el 0 al 1,5%(60). La mortalidad fetal se mantiene entre el 0,6 al 2%(68,64).
Por último, un estudio sobre el tratamiento y la calidad de vida de pacientes con PTI revela que 28% de las mujeres habían sido advertidas de no embarazarse y alerta sobre la necesidad de asesoramiento y cuidados adecuados en este grup(69).
Manejo de la madre con PTI
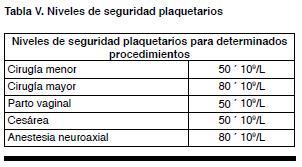
Han sido varios los esfuerzos por consensuar un manejo apropiado para este grupo de pacientes(55,57,60). Con frecuencia al igual que fuera del embarazo, la paciente se encuentra totalmente asintomática y se deben realizar determinados procedimientos que requieren ciertos niveles de seguridad plaquetarios. En la Tabla V se pueden ver estos de acuerdo a la Guía de la British Society for Haematology(68).
¿Cuándo tratar?
La mayoría de las veces no será necesario realizar tratamiento. Una serie de 92 embarazadas con PTI observadas a lo largo de 11 años requirió tratamiento sólo en el 31,1% de los casos(64).
Las indicaciones de tratamiento se pueden resumir en: cuando haya síntomas hemorrágicos, cuando las plaquetas bajen de 20 o 30’109/L o cuando haya que elevar el nivel plaquetario para realizar intervenciones(60).
En los casos asintomáticos y con plaquetopenias mayores de 50’109/L se recomienda no realizar intervenciones terapéuticas y controlar el recuento plaquetario en forma mensual hasta el tercer trimestre en que se realizará cada 2 semanas. El parto deberá ser espontáneo a menos que haya razones obstétricas que indiquen otra conducta(56). El nivel plaquetario aceptable para la operación cesárea es ≥ 50 ´ 109/L. En los casos que se quiera realizar analgesia epidural se deberán obtener recuentos plaquetarios mayores de 75 a 80’109/L que se consideran seguros(56,60,70).
Cuando la plaquetopenia es menor de 50’109/L pero mayor de 20’109/L y la paciente está asintomática, no hay acuerdo general, aunque es frecuente plantear la abstención terapéutica ya que se asume que estas pacientes tolerarán el embarazo sin complicaciones. Otra posibilidad es indicar bajas dosis de prednisona de mantenimiento (55).
Es excepcional que haya un sangrado significativo sin sangrados leves previos, petequias o equimosis (3). La hemorragia guarda más correlación con las manifestaciones purpúricas que con el número de plaquetas.
¿Con qué tratar?
En general los corticoides y la Ig i/v son las terapias de primera línea en el embarazo(60).
Corticoides: se usan en general para las formas severas “bolos” de metilprednisolona y en las formas más leves prednisona. Se trata de fármacos efectivos, con tasas de respuesta de 70 a 80% y de costo accesible pero tienen efectos secundarios importantes destacándose en la gestación el de poder iniciar o agravar un EHE o la aparición de una diabetes gestacional(56,64).
Ig G: si los corticoides son inefectivos o los efectos secundarios son importantes se debe considerar esta terapia(60). Pero la mayor indicación la tienen cuando se requiere rapidez en el ascenso plaquetario. La respuesta en general es dentro de las primeras 6 a 72 horas(62). Habitualmente las plaquetas vuelven a los valores iniciales a las 4 semanas(56). Para algunos autores este sería el tratamiento de primera línea en el embarazo apoyados en los posibles efectos “tóxicos” de los corticoides.
Por ej.: en los casos que se quiera realizar analgesia epidural o una cirugía mayor se podrán hacer altas dosis de Ig G i/v para obtener un recuento seguro mayor de 75 a 80’109/L plaquetas(55,56). Cuando las pacientes tengan un PTI severo, con cifras de plaquetas menores a 20’109/L, se acepta que requerirán cada 10 a 14 días altas dosis de Ig G(28,56).
Ig anti D: con este tratamiento se busca bloquear el sistema fagocítico mononuclear con glóbulos rojos Rh positivos opsonizados. Hay escasa aunque, alentadora experiencia en el embarazo(27,55,71).
Otros inmunosupresores: Azatioprina o Ciclosporina A: Estos se usan en otras patologías durante el embarazo sin riesgo fetal significativo pero inicialmente en el PTI no se recomiendan(60).
Transfusión de plaquetas: se trata de evitar esta medida que sólo es admisible en tratamientos de emergencia. Es un tratamiento con efecto temporario y que además provoca aloinmunización. En sangrados graves que pongan en peligro la vida, como sangrados intracraneanos o por ej. en el desprendimiento placentario, podrá ser necesaria su implementación (28).
Esplenectomía: se plantearía excepcionalmente durante el embarazo cuando fallan los corticoides y las inmunoglobulinas. Si es posible elegir el momento de la cirugía –que puede ser laparoscópica(72)– esta debiera ser en el segundo trimestre. Este periodo evita el riesgo de teratogenicidad y/o aborto del primer trimestre y el agrandamiento uterino del término que perjudica las condiciones técnicas(56,60). Se debe recordar indicar las vacunas antineumocóccica y antimeningocóccica las cuales no están contraindicadas en el embarazo(73-75).
Rituximab: un solo curso de rituximab puede depleccionar en forma prolongada las células B periféricas. El estudio de una cohorte retrospectiva de 231 embarazadas expuestas al rituximab en los 12 meses previos o durante la gestación informó que la mayoría de los nacimientos fueron sin complicaciones y que la tasa de malformaciones congénitas del 2,2% fue similar a la esperada en situaciones normales. Sin embargo, debido a una tasa de parto prematuro de 19% y de pérdidas de embarazo de 21%, mayores a las esperadas; junto con los posibles sesgos de un estudio retrospectivo, hacen que se deba seguir recomendando evitar el embarazo hasta 12 meses luego de la exposición al rituximab. En cambio se sugiere que si la vida de la madre estuviera amenazada los beneficios de esta terapia superarían los riesgos potenciales(76).
Por otra parte hay informes de neonatos, de madres expuestas al rituximab, seguidos durante varios meses con recuentos celulares y títulos de anticuerpos post vacunación que serían adecuados(77).
Agonistas del receptor de trombopoyetina (Eltrombopag y Romiplostim): aún se carece de experiencia con estos dos nuevos agentes. En la embarazada no se recomiendan por desconocerse su potencial teratogenicidad(60,54).
Trombocitopenia neonatal
Debido al pasaje transplacentario de los anticuerpos antiplaquetarios, el neonato puede nacer con trombocitopenia. Esta eventualidad se puede dar incluso si la madre está en remisión o luego de esplenectomía(56).
La trombocitopenia neonatal es transitoria pero, según algunos autores, puede durar hasta tres meses(27). Por otra parte, el momento de menor cantidad de plaquetas se ha informado hasta el cuarto día del posparto(56,60).
La complicación más temida es la hemorragia grave, sobre todo la intracraneana. El temor a esta complicación e informes de mortalidad perinatal de entre 12 y 21% mayoritariamente por hemorragia intracraneana hizo recomendar hace varias décadas la operación cesárea como vía de parto para estas pacientes. Posteriormente varios estudios prospectivos y retrospectivos totalizando 1243 neonatos de madres con PTI encontraron entre un 1 y 5% de trombocitopenia severa (< 20’109/L) y entre 1 y 2% de complicaciones mayores como hemorragia intracraneana(56,60).
Se ha concluido que no hay evidencia de que la cesárea sea más segura para el neonato y por lo tanto la vía de parto debe elegirse en base a consideraciones puramente obstétricas(60).
¿Se puede estimar la trombocitopenia neonatal durante el embarazo?
Algunos autores sostienen que si se pudiera saber que el neonato va a padecer una trombocitopenia severa la vía de parto debería ser por cesárea para evitar el traumatismo del parto(56).
Se ha especulado desde hace mucho tiempo sobre si la cantidad de plaquetas maternas o los niveles de anticuerpos antiplaquetarios o el antecedente de esplenectomía tienen relación con la incidencia o la severidad de la trombocitopenia neonatal. No hay evidencias de que estos parámetros sean útiles para dicho fin(68). En cambio un hijo previo que al nacimiento haya tenido más de 50 mil plaquetas podría predecir que el siguiente neonato no tendría plaquetopenias menores de esta cifra(78).
Otras intervenciones que se han ensayado para determinar la presencia de plaquetopenia en el feto son la cordocentesis y la punción percutánea de cuero cabelludo fetal durante el trabajo de parto. Sin embargo la cordocentesis se complica gravemente en el 1 a 5% es decir tanto o más que la incidencia del sangrado neonatal grave(56,68). En cuanto a la punción de cuero cabelludo es técnicamente difícil, normalmente produce resultados artificiales debido a coagulación por la exposición al vernix caseosa o el líquido amniótico y puede causar hemorragia significativa. Por estas razones, la cordocentesis y la punción de cuero cabelludo fetales han sido abandonadas en el manejo del PTI y deben ser evitadas(56,68,60).
Otras causas de trombocitopenia
El hallazgo de una trombocitopenia tanto fuera y aún más durante el embarazo es de extrema inespecificidad. Se han repasado las etiologías más importantes de plaquetopenias durante la gestación pero aun puede haber otras etiologías que en ocasiones hay que considerar.
No se debe olvidar las trombocitopenias provocadas por infecciones virales entre las que destaca el VIH por su frecuencia e importancia, pero además cabe recordar el citomegalovirus, la hepatitis C o el virus de Epstein Barr entre otros(4).
Particularmente algunas bacterias también se caracterizan por producir plaquetopenia, como por ej. es el caso de Leptospira, Borrelia, Coxiella burnetii o Brucella(79,80-3).
De las vinculadas a fármacos se destaca la producida por heparina sin olvidar que otros fármacos también de amplia utilización en algunas embarazadas como la alfametildopa o el paracetamol pueden provocar trombocitopenia(84,85).
Por último, son causas poco frecuentes el hiperesplenismo que muy raramente coincide con el embarazo pero que puede ser agravado por las condiciones fisiológicas de este estado y la excepcional hemoglobinuria paroxística nocturna, en la que se ha observado que mayoritariamente cursa con plaquetopenia cuando coincide con la gestación(86,87).
Conclusiones
Durante el embarazo una trombocitopenia puede ser explicada en casi el 95% de los casos por una trombocitopenia gestacional o por complicaciones de los estados hipertensivos. Sin embargo, el clínico debe saber leer el contexto, precisar aún más el planteo y ampliar el espectro de posibilidades; sobre todo porque la diferenciación y el correcto diagnóstico pueden llevar a conductas terapéuticas dramáticamente distintas.
BIBLIOGRAFÍA
1. Castillo R, Casals F y Ordinas A. Púrpuras angiopáticas, trombopénicas y trombóticas. In: Sans-Sabrafen, Besses Raebel, Vives Corrons. Hematología Clínica. 4ª ed. Barcelona: Harcourt, 2001; 619-39.
2. Diz-Küçükkaya R, Gushiken FC, López JA. Thrombocytopenia: Overview. In: Williams Hematology. 7th Edition Consultado en: http://www.accessmedicine.com.ezproxy.hsclib.sunysb.edu/content.aspx?aID=2133197
3. Shehata N, Burrows R, Kelton J. Gestational Trombocitopenia. Clin Obstet Gynecol 1999; 42(2): 327-34.
4. Veneri D, Franchini M, Randon F, Nichele I, Pizzolo G, Ambrosetti A. Thrombocytopenias: a clinical point of view. Blood Transfus. 2009; 7(2): 75-85.
5. Sejeny SA, Eastham RD and Baker SR. Platelet counts during normal pregnancy. J Clin Path 1975; 28: 812-3.
6. Fenton V, Saunders K and Cavill I. The platelet count in pregnancy. J Clin Path 1977; 30: 68-9.
7. Wallenburg HC, van Kessel PH. Platelet lifespan in normal pregnancy as determined by a nonradioisotopic technique. Br J Obstet Gynaecol 1978; 85(1): 33-6.
8. Fay RA, Hughes AO, Farron NT. Platelets in pregnancy: hyperdestruction in pregnancy. Obstet Gynecol 1983; 61(2): 238-40.
9. Burrows RF and Kelton JG. Incidentally detected thrombocytopenia in healthy mothers and their infants. N Engl J Med 1988; 319(3): 142-5.
10. Burrows RF, Kelton JG. Fetal thrombocytopenia and its relation to maternal thrombocytopenia. N Engl J Med. 1993; 329(20): 1463-6.
11. Boehlen F, Hohlfeld P, Extermann P, Perneger TV and De Moerloose P. Platelet Count at Term Pregnancy: A Reappraisal of the Threshold. Obstet Gynecol 2000; 95: 29-33.
12. Sullivan CA, Martin JN Jr. Management of the obstetric patient with thrombocytopenia. Clin Obstet Gynecol 1995; 38: 521-34.
13. Dasanu CA, Do C. Moderate cytopenias in asymptomatic individuals: is screening for autoimmune connective tissue diseases warranted? J Postgrad Med. 2011; 57(2): 178-9.
14. Moldenhauer JS, Sibai BM. Hypertensive Disorders of Pregnancy. In: Danforth’s Obstetrics & Gynecology. 9th. ed. Philadelphia: Lippincott Williams & Wilkins; 2003 p. 257-71.
15. Simini F. Sistema Informático Perinatal en el Uruguay: 15 años de datos 1985-1999. Centro Latinoamericano de Perinatología y Desarrollo Humano (CLAP OPS/OMS). Montevideo: Publicación Científica del CLAP 1485; 2001.
16. McCrae KR, Samuels P, Schreiber AD. Pregnancy-associated thrombocytopenia: pathogenesis and management. Blood. 1992; 80(11): 2697-714.
17. Baker PN y Cunningham FG. Anomalías plaquetarias y de la coagulación. In: Chesley. Hipertensión en el embarazo 2º ed., México 2001; 325-47.
18. Hauth JC y Cunningham FG. Preeclampsia-eclampsia. In: Chesley. Hipertensión en el embarazo 2º ed., México 2001; 157-86.
19. ACOG technical bulletin. Hypertension in pregnancy. Number 219-January 1996 (replaces Nº 91, February 1986). Committee on Technical Bulletins of the American College of Obstetricians and Gynecologists. Int J Gynaecol Obstet 1996; 53(2): 175-83.
20. Report of the National High Blood Pressure Education Program Working Group on High Blood Pressure in Pregnancy. Am J Obstet Gynecol 2000; 183: S1-S22.
21. Sibai B, Dekker G, Kupferminc M. Preeclampsia. Lancet 2005; 365: 785-99.
22. Sibai B. Diagnosis, Controversies, and Management of the Syndrome of Hemolysis, Elevated Liver Enzymes, and Low Platelet Count. Obstet Gynecol. 2004; 103(5): 981-91.
23. Barton JR, Sibai BM. Care of the pregnancy complicated by HELLP. Obstet Gynecol Clin N Am 1991; 18(2): 165-79.
24. Haram K, Svendsen E, Abildgaard U. The HELLP syndrome: clinical issues and management. BMC Pregnancy Childbirth. 2009; 9: 8.
25. Gasem T, Al Jama FE, Burshaid S, Rahman J, Al Suleiman SA, Rahman MS. Maternal and fetal outcome of pregnancy complicated by HELLP syndrome. J Matern Fetal Neonatal Med. 2009; 22(12): 1140-3
26. Abella E, Pedro C y Salinas R. Aspectos hematológicos en medicina interna. In: Sans-Sabrafen, Besses Raebel, Vives Corrons. Hematología Clínica. 4ª ed. Barcelona: Harcourt, 2001; 760-82.
27. Ruiz-Argüelles G, Carvajal-Armora F. Aspectos hematológicos del embarazo. In: Temas de Medicina Interna. Problemas Médicos del Embarazo. México: Interamericana-McGraw-Hill, 1995; Vol III(3): 619-31.
28. Samuels P. Trombocitopenia y coagulación intravascular diseminada en el embarazo. In: Foley MR, Strong TH Jr. Cuidados Intensivos en Obstetricia. Manual práctico. Madrid: Panamericana, 1999; 50-66.
29. Fesenmeier MF, Coppage KH, Lambers DS, Barton JR, Sibai BM. Acute fatty liver of pregnancy in 3 tertiary care centres. Am J Obstet Gynecol 2005; 192: 1416-9.
30. Rahman TM and Wendon J. Severe hepatic dysfunction in pregnancy. Q J Med 2002; 95: 343-57.
31. Castro MA, Fassett MJ, Reynolds TB, Shaw KJ, Goodwin TM. Reversible peripartum liver failure: a new perspective on the diagnosis, treatment, and cause of acute fatty liver of pregnancy, based on 28 consecutive cases. Am J Obstet Gynecol. 1999; 181(2): 389-95.
32. Vigil-De Gracia P. Acute Fatty Liver and HELLP Syndrome: Two Distinct Pregnancy Disorders. Obstet Gynecol Surv 2002; 57(4): 191-2.
33. Sawai SK. Hígado graso agudo del embarazo. In: Foley MR, Strong TH Jr. Cuidados Intensivos en Obstetricia. Manual práctico. Madrid: Panamericana, 1999; 216-26.
34. Sean EM, Ware BD. Diagnosis and Management of Thrombotic Microangiopathies During Pregnancy. Clin Obstet Gynecol 1999; 42(2): 360-7.
35. George JN, Sadler JE and Lämmle B. Platelets: Thrombotic Thrombocytopenic Purpura. Hematology 2002; 315-34.
36. Tsai HM. Pathophysiology of thrombotic thrombocytopenic purpura. Int J Hematol. 2010; 91(1): 1-19.
37. Banerjee S. Hemolytic uremic syndrome. Indian Pediatr. 2009; 46(12): 1075-84.
38. Fakhouri F, Roumenina L, Provot F, Sallée M, Caillard S, Couzi L, et al. Pregnancy-associated hemolytic uremic syndrome revisited in the era of complement gene mutations. J Am Soc Nephrol. 2010; 21(5): 859-67.
39. Goodship TH, Kavanagh D. Pulling the trigger in atypical hemolytic uremic syndrome: the role of pregnancy. J Am Soc Nephrol. 2010; 21(5): 731-2.
40. Galindo García CG, Bernárdez Zapata FJ, Hernández Marín I, Ayala AR. Síndrome antifosfolipídico y reproducción humana. Ginecol Obstet Mex 2007; 75: 277-85.
40. Levine JS, Branch DW and Rauch J. The Antiphospholipid Syndrome. N Engl J Med 2002; 346(10): 752-63.
41. Miyakis S, Lockshin D, Atsumi T, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost 2006; 4: 295–306.
42. Di Prima FA, Valenti O, Hyseni E, Giorgio E, Faraci M, Renda E, De Domenico R, Monte S. Antiphospholipid Syndrome during pregnancy: the state of the art. J Prenat Med. 2011; 5(2): 41-53.
43. Mak A, Cheung MW, Cheak AA, Ho RC. Combination of heparin and aspirin is superior to aspirin alone in enhancing live births in patients with recurrent pregnancy loss and positive anti-phospholipid antibodies: a meta-analysis of randomized controlled trials and meta-regression. Rheumatology (Oxford). 2010; 49(2): 281-8.
44. Hepner DL, Tsen LC. Severe thrombocytopenia, type 2B von Willebrand disease and pregnancy. Anesthesiology. 2004; 101(6): 1465-7.
45. Duffy TP. Aspectos hematológicos del embarazo. In: Burrow – Duffy. Complicaciones médicas durante el embarazo. 5ª ed. Buenos Aires. Panamericana. 2001: 87-105.
46. James AH. Von Willebrand Disease. Obstet Gynecol Surv 2006; 61(2): 136-45.
47. Castillo R, Maragall S y Monteagudo J. Hipocoagulabilidades congénitas. Hemofilia, enfermedad de Von Willebrand y procesos afines. In: Sans-Sabrafen, Besses Raebel, Vives Corrons. Hematología Clínica. 4ª ed. Barcelona: Harcourt, 2001; 640-58.
48. Briggs GG, Freeman RK, Yaffe SJ. Drugs in Pregnancy and Lactation. A reference guide to fetal and neonatal risk. 8ª ed. Baltimore, Williams & Wilkins, 2008.
49. Shakur H, Elbourne D, Gülmezoglu M, Alfirevic Z, Ronsmans C, Allen E, Roberts I. The WOMAN Trial (World Maternal Antifibrinolytic Trial): tranexamic acid for the treatment of postpartum haemorrhage: an international randomised, double blind placebo controlled trial. Trials. 2010; 16; 11:40.
50. Kwona JY, Leea Y, Shina JC, Leeb JW, Rhaa JG and Kim SP.Supportive management of pregnancy-associated aplastic anemia. Int J Gynecol Obstet 2006, doi: http://dx.doi.org/10.1016/j.ijgo.2006.07.005
51. Stibbe KJ, Wildschut HI, Lugtenburg PJ. Management of aplastic anemia in a woman during pregnancy: a case report. J Med Case Reports. 2011; 5: 66.
52. Cines DB, Bussel JB, Liebman HA, Luning Prak ET. The ITP syndrome: pathogenic and clinical diversity. Blood. 2009; 113(26): 6511-21.
53. Stasi R. Pathophysiology and therapeutic options in primary immune thrombocytopenia. Blood Transfus. 2011; 9(3): 262-73.
54. Bussel J. Treatment of Immune Thrombocytopenic Purpura in Adults. Semin Hematol 2006; 43(suppl 5): S3-S10.
55. Gill KK and Kelton JG. Management of Idiopathic Thrombocytopenic purpura in Pregnancy. Semin Hematol 2000; 37(3): 275-89.
56. McCrae KR. Thrombocytopenia in pregnancy. Hematology Am Soc Hematol Educ Program. 2010; 2010: 397-402.
57. George JN, Woolf SH, Raskob GE, et al. Idiopathic thrombocytopenic purpura: a practice guideline developed by explicit methods for the American Society of Hematology. Blood. 1996; 88(1): 3-40.
58. Lescale KB, Eddleman KA, Cines DB, Samuels P, Lesser ML, McFarland JG, Bussel JB. Antiplatelet antibody testing in thrombocytopenic pregnant women. Am J Obstet Gynecol. 1996; 174(3): 1014-8.
59. Provan D, Stasi R, Newland AC, et al. International consensus report on the investigation and management of primary immune thrombocytopenia. Blood. 2010;115:168–86.
60. Saito S, Sakai M, Sasaki Y, Tanebe K, Tsuda H, Michimata T. Quantitative analysis of peripheral blood Th0, Th1, Th2 and the Th1:Th2 cell ratio during normal human pregnancy and preeclampsia. Clin Exp Immunol. 1999; 117(3): 550-5.
61. Levy JA and Murphy LD. Thrombocytopenia in pregnancy. J Am Board Fam Pract 2002; 15: 290-7.
62. Bhattacharyya B. Alteraciones plaquetarias durante el embarazo. In: Gleicher. Tratamiento de las complicaciones clínicas del embarazo. 3ª ed. Buenos Aires: Panamericana, 2000; 1379-95.
63. Webert KE, Mittal R, Siguoin C, Heddle NM, Kelton JG. A retrospective 11-year analysis of obstetric patients with idiopathic thromobocytopenic purpura. Blood. 2003;102:4306–11.
64. Ozkan H, Cetinkaya M, Köksal N, Ali R, Güneş AM, Baytan B, Ozkalemkaş F, Ozkocaman V, Ozçelik T, Günay U, Tunali A, Kimya Y, Cengiz C. Neonatal outcomes of pregnancy complicated by idiopathic thrombocytopenic purpura. J Perinatol. 2010; 30(1): 38-44.
65. Belkin A, Levy A, Sheiner E. Perinatal outcomes and complications of pregnancy in women with immune thrombocytopenic purpura. J Matern Fetal Neonatal Med. 2009; 22(11): 1081-5.
66. Pandey M, Saraswat N, Vajifdar H, Chaudhary L. Subdural haematoma in pregnancy-induced idiopathic thrombocytopenia: Conservative management. Indian J Anaesth. 2010; 54(5): 470-1.
67. Guidelines for the investigation and management of idiopathic thrombocytopenic purpura in adults, children and in pregnancy. Brith J Hematol 2003; 120: 574-96.
68. Matzdorff AC, Arnold G, Salama A, Ostermann H, Eberle S, Hummler S. Advances in ITP--therapy and quality of life--a patient survey. PLoS One. 2011; 6(11): e27350.
69. Deruddre S, Peyrouset O, Benhamou D. Anesthetic management of 52 deliveries in parturients with idiopathic thrombocytopenic purpura. J Gynecol Obstet Biol Reprod (Paris). 2007; 36(4): 384-8.
70. Cromwell C, Tarantino M, Aledort LM. Safety of anti-D during pregnancy. Am J Hematol. 2009; 84(4): 261-2.
71. Anglin BV, Rutherford C, Ramus R, Lieser M, Jones DB. Immune thrombocytopenic purpura during pregnancy: laparoscopic treatment. JSLS. 2001; 5(1): 63-7.
72. Bricks LF. Vaccines in pregnancy: a review of their importance in Brazil. Rev Hosp Clin Fac Med Sao Paulo 2003; 58(5): 263-74.
73. CDC. Atkinson WL, Pickering LK, Schwartz B, Weniger BG, Iskander JK, Watson JC. General Recommendations on Immunization. Recommendations of the Advisory Committee on Immunization Practices (ACIP) and the American Academy of Family Physicians (AAFP). MMWR 2002; 51(RR-2): 1-36.
74. Sociedad Española de Higiene y Medicina Preventiva. Grupo de vacunas. Vacuna antimeningocóccica. [En línea]. [Fecha de consulta 17-02-04]. URL disponible en: http://www.mpsp.org/.
75. Chakravarty EF, Murray ER, Kelman A, Farmer P. Pregnancy outcomes after maternal exposure to rituximab. Blood. 2011; 117(5): 1499-506.
76. Klink DT, van Elburg RM, Schreurs MW, van Well GT. Rituximab administration in third trimester of pregnancy suppresses neonatal B-cell development. Clin Dev Immunol. 2008; 2008: 271363.
77. Cristianes GC, Nieuwenhuis HK, Bussel JB. Comparison of platelet counts in first and second newborns of mothers with immune thrombocytopenic purpura. Obstet Gyenecol. 1997; 90(4 Pt 1): 546-52.
78. Davenport A, Rugman FP, Desmond MJ, Ganta R. Is thrombocytopenia seen in patients with leptospirosis immunologically mediated? J Clin Pathol. 1989; 42(4): 439-40.
79. Escudero-Nieto R, Guerrero-Espejo A.Enfermeddes producidas por Borrelia. Enferm Infecc Microbiol Clin. 2005; 23(4): 232-40.
80. Chierakul W, Tientadakul P, Suputtamongkol Y, Wuthiekanun V, Phimda K, Limpaiboon R, et al. Activation of the coagulation cascade in patients with leptospirosis. Clin Infect Dis. 2008; 46(2): 254-60.
81. Roca B. Fiebre Q. An Med Interna (Madrid) 2007; 24: 558-60.
82. Sevinc A, Buyukberber N, Camci C, Buyukberber S, Karsligil T. Thrombocytopenia in brucellosis: case report and literature review. J Natl Med Assoc. 2005; 97(2): 290-3.
84. Warkentin TE, Levine MN, Hirsh J, et al. Heparin-induced thrombocytopenia in patients treated with low-molecular weight heparin or unfractionated heparin. N Engl J Med 1995; 332(20): 1330-5.
85. George JN, Aster RH. Drug-induced thrombocytopenia: pathogenesis, evaluation, and management. Hematology Am Soc Hematol Educ Program. 2009: 153-8.
86. López-Méndez E, Avila-Escobedo L. Pregnancy and portal hypertension a pathology view of physiologic changes. Ann Hepatol. 2006 Jul-Sep;5(3):219-23.
87. de Guibert S, de Latour RP, Varoqueaux N, Labussière H, Rio B, Jaulmes D, Eveillard JR, et al. Paroxysmal nocturnal hemoglobinuria and pregnancy before the eculizumab era: the French experience. Haematologica. 2011; 96(9): 1276-83.