Services on Demand
Journal
Article
Related links
Share
Archivos de Medicina Interna
Print version ISSN 0250-3816On-line version ISSN 1688-423X
Arch. Med Int vol.34 no.2 Montevideo 2012
Articulo original
Tratamiento de la Artritis Reumatoidea con AntiTNF
Experiencia en Uruguay
Treating Rheumatoid Arthritis with Anti-TNF. Experience in Uruguay
Dra. Natalia Piñeiro
Médico Especialista en Medicina Interna. Asistente de Clínica Médica. Facultad de Medicina. UdelaR. Médico Asistente del Fondo Nacional de Recursos. Montevideo.
Dr. Fernando Correa
Médico Especialista en Medicina Internista y Hematología. Profesor Agregado de Clínica Médica. Facultad de Medicina. UdelaR. Médico Asistente del Fondo Nacional de Recursos. Montevideo.
Dra. Alicia Ramagli
Médico Especialista en Medicina Internista y Reumatología. Médico Asesor del Fondo Nacional de Recursos. Montevideo.
Recibido: 09-03-12 - Aceptado: 10-05-12
Trabajo del Fondo Nacional de Recursos
Correspondencia: Dra Natalia Piñeiro. E-mail: npineiro@fnr.gub.uy
Resumen: Arch Med Interna 2012 - 34(2): 38-41
La Artritis Reumatoidea (AR) es una enfermedad sistémica autoinmune, que se asocia a afectación en la calidad de vida y a un incremento de la morbimortalidad. Los tratamientos remisivos de la AR incluyen fármacos antiartríticos modificadores de le enfermedad (FAME) y terapias con biológicos. En marzo 2010 se incorpora a las prestaciones del Fondo Nacional de Recursos (FNR) el tratamiento con Antifactor de necrosis tumoral (Anti-TNF). Se realiza evaluación de la cohorte de pacientes que iniciaron tratamiento antes del 01/05/2011. Objetivos: caracterizar la población y evaluar resultado de la eficacia del tratamiento, según evolución de puntuación de DAS 28. Resultados: se incluyeron 69 pacientes. Las medias de DAS 28 pre y postratamiento evidenciaron una mejoría (p < 0,05). Criterio de mejoría en 76,4% (bajo grado de actividad 37,3% y remisión 14,9%). Efectos adversos en 20 pacientes (en 3 casos motivó suspensión de la terapia). Cambio de droga, principal causa: falla de tratamiento (8/9). Conclusiones: Más de 70% obtiene criterio de mejoría por lo cual los resultados en esta primera evaluación de respuesta pueden calificarse como buenos, aunque deberán monitorizarse en el tiempo.
Palabras clave: Artritis Reumatoidea, AntiTNF, DAS28, Adalimumab, Etanercept, Infliximab.
Abstract: Arch Med Interna 2012 - 34(2): 38-41
Rheumatoid Arthritis (RA) is a systemic autoimmune disease, associated to an impairment of quality of life and increased morbimortality. Remissive therapies of RA include therapies with Disease Modifying Anti Rheumatic Drugs (DMARDs) and Biologic Agents. Therapy with the Anti-Tumor Necrosis Factor (Anti-TNF) was incorporated to the drugs reimbursed by the National Resource Fund (FNR) in March 2010. The study assessed a cohort of patients that started therapy before May 1 2011. Objectives: to characterize the population and to evaluate the efficacy outcomes of therapy, based on the evolution of DAS 28 scores. Results: 69 patients were enrolled. The mean pre and post therapy DAS 28 scores showed improvement (p < 0.05). Improvement criteria in 76.4% (low grade activity 37.3% and remission 14.9%). Adverse effects in 20 patients (in 3 cases it led to discontinuation of therapy). Drug changes, primary cause: treatment failure (8/9). Conclusions: Over 70% achieve improvement criteria; hence, although the results in this first evaluation of the response may be classified as good, they need to be monitored with time.
Keywords: Rheumatoid arthritis, AntiTNF, DAS28, Adalimumab, Etanercept, Infliximab.
Introducción
La artritis reumatoidea (AR) es una enfermedad sistémica autoinmune caracterizada por provocar inflamación crónica, principalmente de las articulaciones, que produce destrucción progresiva con distintos grados de deformidad e incapacidad funcional, a lo cual puede asociar compromiso extraarticular con afección de diversos órganos y sistemas como ojos, pulmones, pleura, corazón, pericardio, piel o vasos sanguíneos. Los signos más característicos, como la deformidad articular, nódulos reumatoides, así como las manifestaciones extraarticulares se ven en etapas avanzadas de la enfermedad. Es una enfermedad dolorosa, incapacitante, que determina disminución de la calidad de vida y de la sobrevida global, con aumento en la morbimortalidad.
Los nuevos criterios diagnósticos propuestos por la ACR (American College of Reumatology) y EULAR (European League Against Rheumatism) se focalizan en identificar los pacientes en sus etapas iniciales(1-3).
Recientemente la AR se ha asociado a aumento de la prevalencia de enfermedad arterial coronaria y se considera factor de riesgo de mortalidad prematura (1).
Epidemiología
La prevalencia e incidencia de AR en Uruguay es desconocida, la prevalencia se estima entre 0,5 y 1% de la población mundial (4-6). Por nuestras características demográficas es esperable que se aproxime a la europea (los últimos estudios en población caucásica la prevalencia se aproxima a la cifra de 0,5%). La incidencia estimada varía entre 20 y 25 nuevos casos por cada 100.000 habitantes por año (4-6). La afección es tres veces más frecuente en el género femenino. La media de edad de aparición suele ocurrir entre los 40 y 50 años, aunque puede observarse a cualquier edad (incluyendo población pediátrica).
Etiopatogenia
Es una enfermedad de etiología desconocida y patogenia autoinmune; los mecanismos lesionales en la AR son complejos. Se plantea que son el resultado que produce un antígeno desencadenante desconocido en un paciente con una base genética predisponente y determina una reacción inmunológica con una reacción inflamatoria cuyo órgano blanco es la sinovia articular.
Terapéutica
Los objetivos terapéuticos actuales incluyen la disminución del dolor, el mantenimiento de la función articular y evitar la progresión de la enfermedad. Para ello se insiste en el diagnóstico precoz y un tratamiento integral con introducción temprana de fármacos antiartríticos modificadores de la enfermedad (FAME).
Los tratamientos farmacológicos disponibles son:
• Tratamientos antiinflamatorios: antiinflamatorios no esteroideos (AINE) y corticoides.
• Tratamientos remisivos de la enfermedad: FAME y terapias con biológicos.
• Terapias biológicas: la acción de estos fármacos está dirigida contra las citoquinas proinflamatorias, la activación de linfocitos T o la depleción de linfocitos B.
• Fármacos anticitoquinas: contra el TNF (antiTNF): etanercept, infliximab y adalimumab.
• Inhibidor de la IL-1: anakinra.
• Anticuerpo monoclonal contra el receptor de la IL-6: tocilizumab
• Modulador de la activación de linfocitos T: Abatacept
• Anticuerpo monoclonal contra linfocitos B: Rituximab
Esquema de tratamiento remisivo en AR
Tratamiento de primera línea: a) tratamiento sintomático: AINEs, corticoides que se utilizan como puente hasta que los FAMEs comienzan a actuar, y b) tratamiento remisivo: el uso de un FAME (de elección metotrexate) y eventualmente asociar un segundo o tercer FAME si la situación clínica lo requiere. Con esta línea de tratamiento se logra el control y manejo de algo más del 80% de los pacientes(7-9).
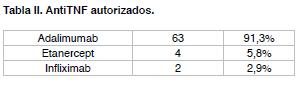
Tratamiento de segunda línea: pacientes (20%) que no se controlan con tratamiento de primera línea, se agrega el uso de un primer agente biológico, aquellos con mayor nivel de evidencia son los antiTNF (adalimumab, infliximab, etanercept)(10,11).
Tratamiento de tercera línea: pacientes con AR activa con respuesta inadecuada o intolerancia a los antiTNF (30 - 40%) se han ensayado otros agentes biológicos: rotación de antiTNF, cambio por Abatacept (no disponible en nuestro medio) o terapia de depleción de linfocitos B con Rituximab(12-17).
En enero 2010 se aprueba la incorporación de Bloqueantes del Factor de Necrosis Tumoral (AntiTNF) a la cobertura del FNR, para el tratamiento de la AR.
Se convoca a Reumatólogo asesor, se elabora marco normativo de cobertura del tratamiento, estableciendo criterios de inclusión, exclusión, requerimientos paraclínicos y evaluación de respuesta con periodicidad preestablecida (cada tres meses)(18).
Definiciones operativas
DAS 28: (Disease Activity Score)
El DAS28 es un índice europeo compuesto, que valora de forma asimétrica los cuatro componentes que lo forman, a través de una fórmula matemática. Las variables incluidas son: NAD (Numero de Articulaciones Dolorosas), NAT (Numero de Articulaciones Tumefactas), EVA (Escala Visual Analógica) y VES (Velocidad de sedimentación).
Se establecen objetivos terapéuticos(7,8) catalogando el grado de respuesta en:
• Ideal: remisión de la enfermedad DAS 28 menor 2.4.
• Deseable: alcanzar grado bajo de actividad con DAS 28 menor a 3.2 o como máximo 5 articulaciones tumefactas y dolorosas.
• Criterio de Mejoría: disminución del DAS 28 de al menos 1,2 puntos sobre el valor basal.
• Mejoría superior al 20% en la EVA global de la enfermedad por el médico.
Objetivos
• General: conocer y caracterizar población incluida.
• Específico: evaluar resultado de la eficacia del tratamiento con antiTNF en AR, según evolución de puntuación de DAS 28.
Material y métodos
Se realizó un estudio de la cohorte de pacientes con AR tratados con antiTNF bajo la cobertura del FNR en el período comprendido desde el inicio de la cobertura en marzo 2010 hasta mayo 2011.
Se analizan variables descriptivas: edad, sexo, procedencia, cobertura asistencial, años de enfermedad, Factor Reumatoideo (FR), Anticuerpos anticitrulinados (AntiCCP), comorbilidades médicas y evolución de DAS 28.
Análisis estadístico: para las variables utilizadas para caracterizar la población, se utilizan como medidas de tendencia central y dispensión medias, medianas, desvío estándar (DS), proporciones y rango. La comparación de medias de DAS 28 para evaluación de respuesta se realizó mediante el test de T para muestras pareadas, previo estudio de normalidad con prueba de Kolmogorov-Smirnov. El procesamiento y análisis estadístico se realizo con el software SPSS versión 11.1. Se estableció como significativo un riesgo alpha menor a 5%.
Fuente de información: base de datos del FNR.
Resultados
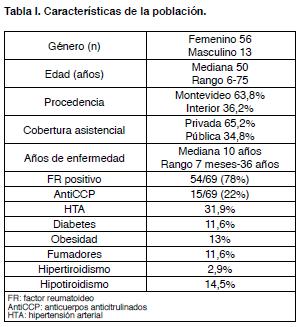
En el período considerado fueron autorizadas 69 solicitudes. En la Tabla I se describen las características de la población.
En cuanto a tratamientos previos, la totalidad de los pacientes recibían AINES, corticoides y al menos un FAME. Dentro de estos el más utilizado es el Metotrexate (97,1%); siendo otros Leflunomida (75,4%); Hidroxicloroquina (62,3%); Sulfasalazina (39,1%). En su mayoría recibían tratamiento combinado, con la asociación de 2 o más drogas (90%).
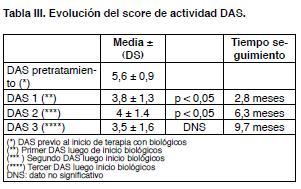
La valoración de DAS 28 pretratamiento mostró una media de 5,6 ± 0,9.
La comparación de medias de DAS 28 pretratamiento con respecto a los de la evolución se describen en la Tabla III.
La comparación de medias de DAS pretratamiento versus DAS 1 y DAS 2 mostró una diferencia estadísticamente significativa (p < 0,05).
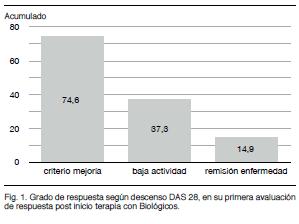
En la Figura 1 se describe el porcentaje de pacientes con remisión de la enfermedad (DAS 28 menor 2,4), con bajo grado de actividad (DAS 28 menor a 3,2); y que cumple con criterio de mejoría (descenso de 1,2 puntos con respecto al basal) acorde a la evaluación del primer DAS post inicio tratamiento. Estos resultados se mantienen en la determinación del DAS 2.
Se objetivaron efectos adversos en 20 pacientes (29%), siendo los más frecuentes los hematológicos e infecciones. Motivaron cambio de conducta en 3 pacientes (4,3%).
La suspensión de la terapia por efectos adversos graves en 3 pacientes (TBC activa, síndrome lupus like, vasculitis).
Se solicitó cambio de antiTNF en 9 pacientes (13%), siendo la principal causa para él la falla de tratamiento (8/9).
Discusión y comentarios
La evaluación del tratamiento con AntiTNF en AR, muestra en cuanto al perfil epidemiológico que se trata de una población adulta, con predominio en sexo femenino acorde a la literatura, con varios años del diagnóstico, portadores de una AR evolucionada en el tiempo. Existe una asimetría en cuanto a su procedencia, siendo principalmente pacientes de Montevideo y predominando la cobertura asistencial privada.
En su mayoría con FR positivo, y con múltiples tratamientos con FAMEs previos. El DAS 28 pretratamiento elevado nos habla de pacientes portadoras de una AR severa y con niveles actividad elevados en la cohorte de pacientes incluidos.
Se observó una población que asocia múltiples comorbilidades que incrementa aun más el riesgo cardiovascular y su morbimortalidad.
De los datos analizados en esta primera evaluación de respuesta surge, según indicador de actividad preestablecido (DAS 28), que más de 70% obtiene criterio de mejoría por lo cual los resultados pueden calificarse como buenos; con un porcentaje no despreciable que logra bajo grado de actividad, e incluso remisión. La comparación de medias de DAS pretratamiento versus DAS 1 y DAS 2 mostró una diferencia estadísticamente significativa. Esto no se objetivó en el DAS 3, probablemente por el escaso numero de pacientes con una tercera determinación, o porque luego de un determinado tiempo la mejoría se estabiliza.
El perfil de seguridad del tratamiento muestra que el seguimiento debe ser estricto dados los efectos adversos potencialmente graves, como los descriptos en la literatura donde las infecciones, y en particular por micobacterias, desórdenes autoinmunes y enfermedades neoplásicas cobran jerarquía(19-25).
Si bien el uso de antiTNF en segunda línea de tratamiento está claramente definido, en nuestro medio aún no se alcanza una cobertura universal y lo esperable es que el número de pacientes continúe en aumento.
Ésta se trató de una valoración inicial, destacando la ausencia de datos previos en nuestro medio, que deberá continuarse evolutivamente.
Conflicto de intereses: los autores declaran no tener conflicto de intereses ni relación con la industria farmacéutica.
Bibliografía
1. Aletaha D, Neogi T, Silman AJ, Funovits J, Felson DT, Bingham CO 3rd, et al. 2010 Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Arthritis Rheum 2010; 62:2569.
2. Aletaha D, Neogi T, Silman AJ, Funovits J, Felson DT, Bingham CO 3rd, et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis 2010; 69:1580.
3. Pincus T, Callahan LF. How many types of patients meet classification criteria for rheumatoid arthritis? J Rheumatol 1994; 21:1385.
4. Myasoedova E, Crowson CS, Kremers HM, Therneau TM, Gabriel SE Is the incidence of rheumatoid arthritis rising?: results from Olmsted County, Minnesota, 1955-2007. Arthritis Rheum 2010; 62:1576.
5. Spector TD. Rheumatoid arthritis. Rheum Dis Clin North Am 1990; 16:513.
6. Peschken CA, Esdaile JM. Rheumatic diseases in North America’s indigenous peoples. Semin Arthritis Rheum 1999; 28:368.
7. Saag KG, Teng GG, Patkar NM, Anuntiyo J, Finney C, Curtis JR,, et al. American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis. Arthritis Rheum 2008; 59:762.
8. Gómez Reino J, Loza E, Andreu J, Balsa A, Batlle E, Canete J. Consenso SER sobre la gestión de riesgo del tratamiento con terapias biológicas en pacientes con enfermedades reumáticas. Reumatol Clin. 2011; 7(5):284-98.
9. O’Dell JR, Haire CE, Erikson N, Drymalski W, Palmer W, Eckhoff PJ et al. Treatment of rheumatoid arthritis with methotrexate alone, sulfasalazine and hydroxychloroquine, or a combination of all three medications. N Engl J Med 1996; 334:1287.
10. O’Dell JR, Leff R, Paulsen G, Haire C, Mallek J, Eckhoff PJ, et al. Treatment of rheumatoid arthritis with methotrexate and hydroxychloroquine, methotrexate and sulfasalazine, or a combination of the three medications: results of a two-year, randomized, double-blind, placebo-controlled trial. Arthritis Rheum 2002; 46:1164.
11. Scott DL, Kingsley GH. Tumor necrosis factor inhibitors for rheumatoid arthritis. N Engl J Med 2006; 355:704.
12. Van Vollenhoven RF, Ernestam S, Geborek P, Petersson IF, Cöster L, Waltbrand E, et al. Addition of infliximab compared with addition of sulfasalazine and hydroxychloroquine to methotrexate in patients with early rheumatoid arthritis (Swefot trial): 1-year results of a randomised trial. Lancet 2009; 374:459.
13. Edwards JC, Szczepanski L, Szechinski J, Filipowicz-Sosnowska A, Emery P, Close DR, et al. Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis. N Engl J Med 2004; 350:2572.
14. Cohen SB, Emery P, Greenwald MW, Dougados M, Furie RA, Genovese MC , et al. Rituximab for rheumatoid arthritis refractory to anti-tumor necrosis factor therapy: Results of a multicenter, randomized, double-blind, placebo-controlled, phase III trial evaluating primary efficacy and safety at twenty-four weeks. Arthritis Rheum 2006; 54:2793.
15. Finckh A, Ciurea A, Brulhart L, Kyburz D, Möller B, Dehler S, et al. B cell depletion may be more effective than switching to an alternative anti-tumor necrosis factor agent in rheumatoid arthritis patients with inadequate response to anti-tumor necrosis factor agents. Arthritis Rheum 2007; 56:1417.
16. Finckh A, Ciurea A, Brulhart L, Möller B, Walker UA, Courvoisier D, et al. Which subgroup of patients with rheumatoid arthritis benefits from switching to rituximab versus alternative anti-tumour necrosis factor (TNF) agents after previous failure of an anti-TNF agent? Ann Rheum Dis 2010; 69:387.
17. Chatzidionysiou K, Carli CC, Van Vollenhoven RF. Rituximab versus anti-TNF in patients who previously failed one or more anti-TNFs in an observational cohort: The SARASTRA study (Abstract). Presented at the 2009 EULAR scientific meeting, Stockholm Sweden.
18. Fondo Nacional de Recursos. Tratamiento de Artritis Reumatoidea con Bloqueantes del Factor de Necrosis Tumoral (Anti - TNF). [en Línea]. [acceso marzo 2012]. Disponible en http://www.fnr.gub.uy/sites/default/files/norm_artiritis_rematoidea_vr1.pdf.
19. Algood HM, Lin PL, Flynn JL. Tumor necrosis factor and chemokine interactions in the formation and maintenance of granulomas in tuberculosis. Clin Infect Dis 2005; 41 Suppl 3:S189.
20. Bartelds GM, Wolbink GJ, Stapel S, Aarden L, Lems WF, Dijkmans BA, et al. High levels of human anti-human antibodies to adalimumab in a patient not responding to adalimumab treatment. Ann Rheum Dis 2006; 65:1249.
21. Bartelds GM, Wijbrandts CA, Nurmohamed MT, Stapel S, Lems WF, Aarden L et al. Clinical response to adalimumab: relationship to anti-adalimumab antibodies and serum adalimumab concentrations in rheumatoid arthritis. Ann Rheum Dis 2007; 66:921.
22. Radstake TR, Svenson M, Eijsbouts AM, van den Hoogen FH, Enevold C, van Riel PL, et al. Formation of antibodies against infliximab and adalimumab strongly correlates with functional drug levels and clinical responses in rheumatoid arthritis. Ann Rheum Dis 2009; 68:1739.
23. Bartelds GM, Krieckaert CL, Nurmohamed MT, van Schouwenburg PA, Lems WF, Twisk JW, et al. Development of antidrug antibodies against adalimumab and association with disease activity and treatment failure during long-term follow-up. JAMA 2011; 305:1460.
24. Smitten AL, Simon TA, Hochberg MC, Suissa S. A meta-analysis of the incidence of malignancy in adult patients with rheumatoid arthritis. Arthritis Res Ther 2008; 10:R45.
25. Instituto de Efectividad Clínica y Sanitaria. Etanercept, Infliximab y Adalimumab en el tratamiento de la Artritis Reumatoide. Documentos de Evaluación de Tecnologías Sanitarias, Informe de Respuesta Rápida N° 148. Buenos Aires, Argentina. Julio 2008. [en Línea]. [acceso marzo 2012]. Disponible en:http://www.iecs.org.ar/iecs-frame-visor-publicaciones.php?cod_publicacion=1000&archivo_pdf