Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Medicina Interna
versión impresa ISSN 0250-3816versión On-line ISSN 1688-423X
Arch. Med Int vol.34 no.1 Montevideo mar. 2012
Primer Consenso Nacional sobre Proteinuria en el diagnóstico y la evaluación de la Enfermedad Renal Crónica en Adultos
First National Consensus on Proteinuria in the Diagnosis and Assessment of Chronic Kidney Disease in Adults
Dra. Emma Schwedt
Dra. María Fernanda Sánchez
Dra. Liliana Gadola
Dr. Pablo Ríos
Walter Alallón
Silvia Altesor
Matilde Alvarez
Silvia Alvarez
Federico Arce
Yanet Baison
Cecilia Baccino
Sylvia Balardini
Noelia Batista
Jimena Blanco
Gustavo Brañas
Noelia Burger Moreira
Laura Cabezas
Gianella Cabrera
Gabriela Campeas
Blanca Ceria
Ma. Alejandra Chichet
Rubén Coitito Rosa
Laura de los Santos
Mariela Decia
Virginia Etchegaray
Dante Farro
Lucía Fernández
María Noel Fernández
Blanca Ferrando
Rosa Ferreiros
Beatriz Fischer
Jaqueline Flores
María Eliset Flores
Ana Paula Galvalisi
Federico García
Natalia García
Silvana Garrone
Emiliana Grasso
Marta Grunvald
Luciana Gualdo
Cora Gulla
Margarita Halty
Lujan Leguizamon
María Noel Leiva
Ana Lopes Soares
Mariana Lopez
Gabriela Mance
Virginia Mansilla
Silvia Marino
Lille Maurin
Elena Mazzilli
Natalia Menéndez
Martín Monteblanco
Virginia Moretti
Gonzalo Moure
María Eugenia Olivera
Gabriela Ortiz
Gonzalo Pacheco
Marianela Pastore
Lorena Peraza Madani
Sandra Petruccelli
Rosana Pirotto
Adriana Pose
Cecilia Ramos
Mónica Revello Bono
Verónica Ríos
Marcelo Risso
Verónica Rivas
Mariella Rizzo
Elsa Romitti De Oliveira
Graciela Rosenzweig
Laura Ruíz Díaz Budes
Gabriela Sánchez
Adriana Santestevan
Eliana Sellanes
Ricardo Silvariño
Beatriz Soares Moreira
Nilka Soares
Fernanda Surroca
Andrés Urrestarazu
María Fernanda Varela
Cristina Verdaguer
Marisa Viera
Mabel Villamil
Ricardo Villar
Lorena Viña
Marcelo Viré
Marcos Vivas
Ronit Wurzel
Laura Yametti
Todos los autores integraron el COMITÉ ORGANIZADOR DEL CONSENSO en representación de:
Comisión Honoraria de Salud Renal de Uruguay,
Laboratorio Clínico del Hospital de Clínicas,
Sociedad Uruguaya de Patología Clínica,
Comité de Estandarización y Control de Calidad,
Sociedad Uruguaya de Nefrología,
Centro de Nefrología del Hospital de Clínicas,
Asociación Bioquímica del Uruguay.
Correspondencia: Dra Emma Carmen Schwedt Celiberti. Programa de Salud Renal. Comisión Honoraria de Salud Renal. Programa de Prevención del Fondo Nacional de Recursos. 18 de Julio 985, Galería Cristal, Pisos 3° y 4°. Teléfono: 598 2901 4091. E-mail: psruruguay2011@gmail.com
Resumen: Arch Med Interna 2012 - 34(1):03-11
Mediante revisión de PubMed y opinión de expertos los autores concluyeron que proteinuria y albuminuria son marcadores de diagnóstico de enfermedad renal crónica (ERC), son indicadores de progresión y por lo tanto un objetivo terapéutico y además son marcadores de riesgo de muerte y enfermedad CV tanto en población general como en pacientes con ERC. Estos resultados se confirmaron utilizando la tira reactiva, el cociente albuminuria/creatininuria (A/C) o el cociente proteinuria/creatininuria (P/C) en muestra de orina con referencia a la proteinuria en orina de 24 hs (gold standard). El índice A/C parece ser el método ideal porque será el más fácil de estandarizar, pero su costo es mayor y el índice P/C es buen predictor a un costo menor. Las tiras reactivas tienen 29% de falsos positivos pero si somos estrictos en la recolección de la muestra de orina y la lectura es automatizada se reduce la posibilidad de error y la variabilidad de resultados. Se establecen por consenso las etapas preanalíticas, analíticas y post-analíticas de la medición de proteinuria y albuminuria en laboratorio para precisar mejor el diagnóstico y evolución de ERC.
Abstract: Arch Med Interna 2012 - 34(1):03-11
Through PubMed review and opinion of experts the authors concluded that proteinuria and albuminuria are diagnostic markers of chronic kidney disease (CKD), are indicators of progression and therefore a therapeutic goal, and are also risk markers of death and CV disease both in the general population and in patients with CKD. These results were confirmed by using the dipstick, proteinuria/creatininuria (P/C) or albuminuria/creatininuria (A/C) ratios in single urine sample with reference to the 24 hours (gold standard) collected urine. The A/C ratio seems to be the ideal method because it will be the easiest to standardize, but their cost is higher, and the P/C ratio is a good predictor at one lower cost. The dipstick test have 29% false positive but if we are strict in collecting the urine sample and the reading is automated it would reduce the possibility of error and the variability of results. Pre-analytical, analytical and post-analytical stages of the proteinuria and albuminuria measurements in laboratory were established by consensus to clarify the diagnosis and evolution of CKD.
Palabras clave: consenso, proteinuria, tiras reactivas de orina, cociente proteinuria/creatininuria.
INTRODUCCIÓN
En los últimos años se ha comprendido mejor el significado de la Enfermedad Renal Crónica (ERC) como marcador de riesgo de Insuficiencia Renal Extrema (IRE), riesgo de muerte y riesgo cardiovascular (CV) para la población general. También se conocen mejor los factores de riesgo de su progresión y las medidas terapéuticas para estabilizar o enlentecer la progresión a IRE.
El diagnóstico de ERC se realiza en base a marcadores de lesión en examen de orina y marcadores de función a través de la creatinina sérica para estimar la tasa de filtrado glomerular (TFG). Hay consenso en la literatura respecto a la creatinina como marcador de función renal para estimar TFG, si bien la cistatina C podría tener ventajas que están en estudio. El Programa de Salud Renal de Uruguay tiene en marcha un programa de estandarización de creatinina para disminuir la variabilidad intra e interlaboratorios y así precisar mejor el diagnóstico y control evolutivo de la ERC.
Sin embargo, hay discrepancias en la literatura respecto a qué determinar, si proteinuria o albuminuria. Si bien se considera que la determinación de proteinuria en orina de 24 hs es el objetivo estándar, la mayoría considera que el cociente albuminuria/creatininuria (A/C) o proteinuria/creatininuria (P/C) tiene una excelente correlación con la cuantificación de 24 hs, proponiendo esta forma práctica de medición aún no generalizada en nuestro medio. También existen controversias en cuanto al valor del examen de orina y las tirillas reactivas y en cuanto a si debe hacerse tamizaje de la ERC y cuál es la población objetivo (poblaciones de riesgo versus población general).
OBJETIVOS
Los objetivos de este trabajo son: a) definir por consenso las indicaciones de determinación de albuminuria y proteinuria y de los cocientes A/C y P/C en el tamizaje, diagnóstico y control evolutivo de la enfermedad renal en adultos, b) definir por consenso el tipo de muestras de orina a utilizar para las determinaciones, la conservación de las mismas, los métodos bioquímicos y las unidades a utilizar para expresar los resultados, y c) difusión del Documento de Consenso.
METODOLOGÍA
Se formó un Comité Organizador con participantes de integrantes de la Comisión Honoraria de Salud Renal en representación del Programa de Salud Renal, la Sociedad Uruguaya de Nefrología, el Centro de Nefrología del Hospital de Clínicas, el Laboratorio Clínico del Hospital de Clínicas, el Comité de Estandarización y Control de Calidad, la Sociedad Uruguaya de Patología Clínica y la Asociación Bioquímica del Uruguay. Se nombraron responsables que hicieron una revisión exhaustiva en la literatura respecto a los objetivos planteados. Se hizo búsqueda, evaluación y síntesis de las evidencias existentes en base a las guías de práctica clínica publicadas, a trabajos seleccionados a través de Pub-Med y a la opinión de expertos de nuestro medio. Se realizaron reuniones ampliadas del Comité Organizador donde se presentaron las guías y trabajos más esclarecedores con lo que se elaboró un documento preliminar de recomendaciones para ser discutidos en Consenso.
En el siguiente trabajo se presentan las evidencias más relevantes que facilitaron la elaboración de un documento de recomendaciones respecto a los objetivos planteados. El Consenso se realizó en Montevideo, el 3 de septiembre de 2011, y contó con 92 concurrentes que hicieron valiosos aportes al documento final, que es presentado para su difusión.
SIGNIFICADO DE LA ERC
Criterios actuales de definición y clasificación de la ERC
La historia de la ERC cambió después de la definición operacional de la National Kidney Foundation (NKF)-Kidney Disease Outcomes Quality Initiative (K/DOQI)(1) basada en:
• Presencia de marcadores de lesión cualquiera sea la función renal: la Albuminuria / Proteinuria han sido los más utilizados, pero puede ser la presencia de otros marcadores como glóbulos rojos, cilindros, etc.
• Filtrado glomerular < 60 ml/min/1,73 m2
• Alteraciones morfológicas en estudios por imágenes
Estas alteraciones deben ser persistentes por más de 3 meses para hacer el diagnóstico de ERC.
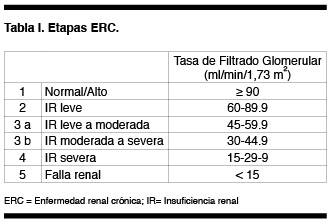
Las etapas de la ERC se establecieron según rangos de tasa de filtrado glomerular (TFG) en 5 estadios como se ve en la Tabla I. El estadio 3 posteriormente se divide en 2 subgrupos debido a diferencia de riesgo entre ambos. Además se recomendaron una serie de medidas o planes de acción según etapa, para detener o enlentecer la progresión de la enfermedad renal y reconocer más precozmente las complicaciones de la insuficiencia renal sin olvidar el cuidado de la enfermedad CV (1).
Esta definición ha estado en discusión, porque se ha visto que muchos añosos que ingresan a control sólo por caída del FG, están estables y no evolucionan a IRE, sobre todo si la TFG es mayor de 45 ml/min.
ERC como marcador de riesgo de muerte y riesgo de eventos CV
Go et al.(2) encuentran que la tasa de muerte estandarizada a edad aumenta a medida que cae la TFG en la población general, sobre todo a partir de lo que sería un estadio 3 b (TFG < 45 ml/min) en que es de 4,76/100 pacientes-año y aumenta a 14,1 si el FG < 15 ml/min. El mismo autor señala que el riesgo de eventos CV aumenta también a partir de una TGF < 60 ml/min, duplicándose a partir de 30-44 ml/min y es más de 3 veces si es < 15 ml/min. No es nuestro objetivo analizar este tema en profundidad, pero se ha demostrado que la enfermedad renal es un factor de riesgo independiente de mortalidad en la población general y en poblaciones de riesgo tanto se considere la disminución de la TFG como la presencia y rango de albuminuria-proteinuria como veremos (3-4).
PROTEINURIA Y ALBUMINURIA COMO MARCADORES DE RIESGO RENAL
La proteinuria-albuminuria son los marcadores de lesión renal más utilizados y universalmente aceptados. En más de 100.000 japoneses de Okinawa(5), chequeados con tirilla de orina entre 1983-1984 y controlados a los 17 años se vio que la incidencia de pacientes con IRE que requieren tratamientos sustitutivos de la función renal aumenta ya desde la aparición de trazas de proteinuria, siendo máxima de 15% si la proteinuria en tira de orina ≥ 3 +. La incidencia acumulada por 100.000 pacientes/año fue notoriamente mayor a mayor proteinuria y el riesgo de IRE ajustado a edad, hematuria, presión arterial y al índice de masa corporal en hombres fue de 1,77 (IC 95%: 1.13-2,78) para proteinuria trazas (±) y en mujeres si bien no fue significativo el riesgo para trazas, lo es a partir de proteinuria 1+: 2,42 (IC 95%: 1,91-3,06). No es despreciable el número de pacientes que podrían estar en rango de microalbuminuria detectados por la tirilla reactiva.
En el estudio PREVEND(5), el porcentaje de nuevos individuos con insuficiencia renal de la población general que desarrollan estadio 3 de ERC o empeoran ERC aumenta en forma progresiva según rangos de albuminuria, cuantificada mediante el cociente A/C en orina de 24 hs (considerado el gold standard) luego de 4,2 meses de seguimiento. El porcentaje es > 25% si la A/C > 300 mg/g.
Albuminuria como marcador de riesgo cardiovascular
Los mismos investigadores del grupo PREVEND ya habían publicado en 2002, que los rangos bajos de albuminuria predicen mortalidad global y CV en la población general. La relación entre excreción de albúmina y riesgo CV es continua y el riesgo ya es alto con valores menores de 30 mg/g, que es valor que se ha definido para considerar riesgo de IRE. Este punto de corte es arbitrario y se discute si no debería ser menor e incluso si no habría que considerar valores según edad y sexo. La mayoría de los autores consideran oportuno informar los valores encontrados de acuerdo a la sensibilidad de la técnica(7).
Proteinuria y albuminuria como marcadores de riesgo progresivo de IRE y como objetivo terapéutico
En un trabajo cooperativo italiano de 1996(8), que estudió el valor de la proteinuria y la presión arterial en la progresión de la insuficiencia renal podemos ver que el rango de proteinuria se correlaciona con una más rápida evolución a IRE si la proteinuria está entre 1 y 3 g respecto a < 1 g/día y aún más rápido si era > 3 g/día respecto a 1-3 g/d. Este y muchos otros trabajos posteriores nos muestran también que la presencia de albuminuria o proteinuria es un objetivo de tratamiento(9) y las drogas que bloquean el SRA como anti-proteinúricas son las de elección tanto en nefropatía diabética como no diabética(10-13).
Destacamos el trabajo de Atkins et al. del Grupo Colaborativo de Estudio(14), en diabéticos tipo 2 con nefropatía diabética clínica, que sólo logran una reducción significativa de la proteinuria con irbesartan comparado al grupo de tratados con amlodipina y al grupo de los que recibieron placebo. Si bien este trabajo es uno de los muchos que nos muestran el beneficio del bloqueo del sistema renina angiotensina para disminuir la proteinuria, la disminución de la proteinuria debe ser mayor de 50% para ser realmente efectiva (para evitar duplicar la creatinina o llegar a IRE). Esto es importante, porque para cumplir nuestro objetivo de retardar la progresión de la nefropatía tenemos que tener más precisión en la cuantificación de la proteinuria.
Riesgo de Mortalidad global y CV, de ERC progresiva, de IRE y de IRA
KDIGO realizó un estudio colaborativo para examinar la relación entre FG estimado y albuminuria, con mortalidad y evolución renal. Fueron incluidos en metaanálisis 45 cohortes que totalizaban 1.555.332 participantes ya sea de población general, de poblaciones de alto riesgo y con enfermedad renal. El mayor riego de mortalidad global, mortalidad CV, inicio de tratamiento sustitutivo, Injuria renal aguda (IRA) y progresión de la ERC se asoció con FG estimado menor 60 ml/min y mayores niveles de proteinuria(15).
En base a este estudio, se mantiene la actual definición de ERC basada en rangos de TFG con subdivisión del estadio 3 en 3a y 3b y se agregan estadios según rango de albuminuria expresada como cociente A/C mg/g: óptimo y normal alto, alto y muy alto y nefrótico. Esto permite elaborar una tabla de estadios y de riesgo de menor a mayor (verde, amarillo, naranja, rojo, rojo vinoso), teniendo en cuanta ambos marcadores de ERC(15), lo cual tiene valor desde el punto de vista pronóstico. El riesgo ya es alto con rangos de microalbuminuria (Tabla II).
¿Es la presencia de microalbuminuria un marcador relevante de enfermedad renal?
Las opiniones están divididas. R Glassock (16) señala que sólo en diabéticos tipo 1 microalbuminuria es la forma “específica” de ERC (nefropatía diabética incipiente). Microalbuminuria define un proceso dinámico con frecuentes regresiones espontáneas, pero también hay factores extra-renales que pueden influenciar la albuminuria como son la obesidad, edad, sexo, inflamación distante y drogas. En diabéticos tipo 2 su presencia no es constante y 1/3 de los diabéticos llegan a diálisis sin microalbuminuria. Por otra parte, se ha demostrado que la microalbuminuria es útil en predecir evolución renal en pacientes con ERC ya establecida, si TFG < 45-50 ml/min y en < 65 años es marcador de curso progresivo. Es controvertido si la microalbuminuria aislada (sin caída del FG, sin otras anomalías del sedimento o anomalías morfológicas renales) debe ser vista como enfermedad renal; por el contrario, según Glassock debería ser vista principalmente como un biomarcador de injuria endotelial difusa y carga ateroesclerótica. Se prefiere hablar de albuminuria de rango bajo pues la molécula de albúmina es la misma y no de menor tamaño.
CONTROVERSIAS
¿Qué medir y cómo cuantificar: ¿albuminuria o proteinuria?
Desde hace años se han planteado controversias respecto a qué se debe medir si proteinuria o albuminuria. Si se mide sólo de albuminuria, hay otras muchas proteínas que se pueden perder por la orina y desde hace tiempo se tenía la idea de que la proteinuria no es solamente un “problema” de filtración glomerular sino que puede haber una alteración en la reabsorción tubular. También desde hace tiempo se sabe que la pérdida de proteínas por orina se puede asociar a una afectación global del individuo y no hay que asociar solamente a lesión renal(17).
En la década del 90 un problema importante que se señalaba era la variabilidad de resultados según los métodos utilizados para cuantificar proteínas. Imai(18) evaluó la media de proteinuria en 12 muestras de orina con 7 métodos diferentes utilizando tres materiales estándares (albúmina sérica bovina, albúmina sérica humana y suero). Gran variabilidad utilizando ácido sulfosalicílico o ácido tricloroacético y menos variabilidad con cloruro de bencetonio y rojo de pirogalol.
Hace 5 años, de Jong y Curhan(19) plantean una serie de interrogantes respecto al tamizaje, monitoreo y tratamiento de la albuminuria que son muchas de los problemas que estamos tratando de entender y resolver en el momento actual.
Cuando Houlihan et al.(20) publican el trabajo del cociente A/C en muestra de orina como test de tamizaje de ERC en 2002, ya señalan sus limitaciones. En una población australiana (173 hombres y 141 mujeres) realizan el cociente A/C en comparación a la determinación de albuminuria en orina de 24 hs como referencia. Encuentran excelente sensibilidad (95,7% Hombres- 93,3% Mujeres) y buena especificidad (82,7% Hombres-80,2% Mujeres), pero señalan un porcentaje no despreciable de falsos positivos (17,3% Hombres-19,8% Mujeres). De todos modos, el método ha sido repetido por otros investigadores y se ha llegado a la conclusión de que el cociente A/C en muestra de orina tienen una excelente correlación con la albuminuria en orina de 24 hs.
En 2010, Lambers et al. (21) presentan los resultados de un reanálisis del grupo RENAAL en 701 pacientes diabéticos 2 tratados con Losartán. Compararon las diferentes medidas de proteinuria (cociente A/C en 1° orina de la mañana, albuminuria en orina de 24 hs y proteinuria en orina de 24 hs), para predecir eventos renales. Como eventos (N = 202) estudian la duplicación de la creatinina y la IRE. Se encontró un riesgo aumentado con todas las formas recolección de la orina, pero el cociente A/C en 1ª orina de la mañana fue significativamente superior para predecir eventos mediante el estudio del área bajo la curva ROC (0,82 versus 0,78 para albuminuria de 24 hs y 0,78 para proteinuria de 24 hs).
La gran mayoría de las Guías de Práctica Clínica (22) han adoptado esta forma de cuantificar la albuminuria no sólo como test de tamizaje, sino también para el seguimiento de un paciente con nefropatía tenga albuminuria de rango bajo o alto.
En 2007, Konta et al.(23) en 2.351 individuos de la población de Takahata, Japón, valoran la capacidad de la proteinuria trazas de la tira de orina como indicador de microalbuminuria y estudian tira de orina versus cociente A/C en 1ª orina de la mañana. La sensibilidad fue baja pero la especificidad y el valor predictivo negativo altos. Pero vieron que el valor predictivo positivo aumentaba notoriamente en poblaciones de riesgo como hipertensos y diabéticos, y también en > 60 años. Sin embargo, la mayoría de los investigadores sólo recalcan de este estudio que la tasa de falsos positivos es de 29%, mayor a lo encontrado con el cociente A/C.
Este año, Shona Methven et al. presentan 2 trabajos que vale la pena considerar. Evalúan la excreción urinaria de albúmina y la de proteínas totales como predictores de evolución en pacientes con ERC (mortalidad global, duplicación de creatinina e inicio de reemplazo renal). El estudio es hecho en 5.586 pacientes de Escocia(24) con ERC y 3.5 años de seguimiento, de los cuales 1/3 tenían proteinuria (-), 1/3 microalbuminuria, 1/3 macroproteinuria. Evaluaron niveles de cociente A/C y cociente P/C en muestra de orina, albuminuria en orina de 24 hs y proteinuria en orina de 24 horas. Mediante el estudio del área bajo la curva ROC no encontraron diferencias significativas entre los métodos como predictores. Por otro lado, en un estudio retrospectivo(25), en la misma población evaluando el riesgo de los mismo eventos, mediante el cociente P/C identificaron un 16% de pacientes de alto riesgo que no fueron identificados por el cociente A/C.
Por último, otro trabajo a considerar, es el de White SL et al.(26) que evalúa la seguridad diagnóstica de la tirilla de orina para detección de albuminuria en la población general versus el cociente A/C en una muestra de orina, en 2 puntos de corte: ≥ 30 mg/g o ≥ 300 mg/g. El estudio se realizó entre pacientes del estudio AUSDIAB: 10.219 tenían A/C < 30 mg/g (93,4%), 643 (5,8%) tenía entre 30-300 mg/g y 91 (0,8%) tenían ≥ 300 mg/g.
La tirilla ≥ 1+ identificó A/C ≥ 30 mg/g con una Sensibilidad de 57,8% (95% IC 54,1% -61,4%) y una Especificidad 95,4% (95% IC 95%- 95,8%). La tirilla ≥ 1+ identificó A/C ≥ 300 mg/g con una Sensibilidad 98,9% (99% IC 92,1%-100%) y una Especificidad 92,6% (99% IC 92%-93,3%).
La tirilla trazas o mayor identificó A/C ≥30 mg/g con una Sensibilidad 69,4% (95% IC 65,9%-72,7%) y una Especificidad 86.8% (95% IC 86,1%-87,4%). La tirilla trazas o mayor identificó A/C ≥ 300 mg/g con una Sensibilidad 100% (99% IC 94,3%-100%) y una Especificidad 83,7% (99% IC 82,8%-84,6%).
Para ambos puntos de corte, se destaca el alto valor predictivo negativo: Tirilla (-): VPN 97,6% para A/C ≥ 30 mg/g; Tirilla (-): VPN 100% para A/C ≥ 300 mg/g.
ERC COMO PROBLEMA DE SALUD PÚBLICA
La ERC es hoy considerada un problema de salud pública que requiere un plan de acción que podemos resumir en:
Realizar tamizaje: con lo que establecemos un Diagnóstico Presuntivo que tiene como objetivo la captación precoz de pacientes, pues el tratamiento instituido ha demostrado que logra estabilizar la progresión de la enfermedad. Los marcadores para tamizaje deben ser económicos y validados. Si bien ninguno es perfecto los internacionalmente aceptados son:
a. como Marcador de Función: creatinina plasmática para estimar TFG.
b. como Marcadores de Lesión: Proteinuria y Albuminuria en muestra de orina (tirilla de orina o cociente P/C-A/C).
Población objetivo: se recomienda tamizaje dirigido población de alto riesgo por ser coste-efectivo, pero otros plantean que habría que realizar la determinación de albuminuria en población general.
Diagnóstico positivo: debe hacerse mediante cuantificación con cociente P/C-A/C en muestra de orina, requiriéndose 2 de 3 determinaciones positivas y TFG estimada, los que deben ser persistentes por 3 o más meses.
Monitoreo de evolución: requiere cuantificación rápida y confiable con cociente P/C-A/C en muestra de orina y determinación de creatinina sérica.
INVESTIGACIÓN DE LA PRESENCIA ANORMAL DE PROTEÍNAS EN LA ORINA POR EL LABORATORIO DE PATOLOGÍA CLÍNICA
En condiciones normales existe una excreción mínima de proteínas en la orina, de 150 a 300 mg en 24 hs, según distintos autores. Dichas proteínas están representadas por proteínas de origen plasmático, en 60%, de las cuales la mayoría es albúmina, y por proteínas que provienen del tracto urinario, en 40%, entre las que predomina la proteína de Tamm-Horsfall.
La presencia anormal de proteínas en la orina puede ser abordada desde el Laboratorio Clínico, bajo 3 enfoques:
• Investigación de la proteinuria total
• Investigación de proteínas individuales, fundamentalmente albúmina
• Investigación de la proteinuria de Bence Jones
Nos abocaremos a los dos primeros, dado los objetivos de este trabajo.
Como todo examen de laboratorio, la medición de la proteinuria total y de la albuminuria conlleva una etapa pre-analítica, una etapa analítica y una etapa post-analítica, las que analizaremos a continuación.
Etapa preanalítica
Elección del tipo de muestra de orina
Para seleccionar el tipo de muestra se deben conocer los factores pre-analíticos que influyen en la determinación de estos analitos (27). Estos son:
- Ayuno, ya que la ingesta proteica es un factor determinante de la excreción de proteínas.
- Estado de hidratación, que determina orinas concentradas o diluidas alterando la concentración final de estos analitos.
- Ejercicio, que se asocia a una excreción aumentada de proteínas en la orina.
- Postura, debido a la existencia de una proteinuria ligada al ortostatismo.
Todos estos factores determinan la existencia de un ritmo circadiano en la excreción urinaria de estos analitos, que les confiere una alta variabilidad biológica intraindividual, lo cual sugiere en primera instancia que la muestra de orina de 24 horas sería la muestra ideal. Sin embargo, y debido a las conocidas dificultades en la obtención de este tipo de muestras, que causan mucha inexactitud en los resultados obtenidos, se recomienda el empleo de la muestra de orina aislada, refiriendo la concentración de proteinuria o albuminuria a la de la creatininuria para que el grado de concentración o dilución de la muestra de orina no altere la concentración final de los analitos en estudio. Se prefiere, a su vez, la primera orina de la mañana frente a la muestra obtenida al azar, para minimizar así el efecto de la ingesta, el ejercicio y la postura.
De esta forma se ha determinado que las muestras de orina aislada presentan la menor variabilidad biológica intra-individual cuando el resultado se expresa como índice. Este, sin embargo, sigue siendo elevado, próximo al 40%(28).
Los índices P/C y A/C han demostrado una alta correlación y en algunos estudios un alto grado de concordancia (acuerdo) con las determinaciones en orina de 24 horas, siempre y cuando la velocidad de filtrado glomerular sea constante(29). Sin embargo, para valores altos en la excreción de proteinuria dicha correlación disminuye(21,27,30,31).
Por su parte, estos índices también han demostrado un buen desempeño clínico en lo que se refiere al diagnóstico y la monitorización de la enfermedad renal crónica como hemos visto, así como un alto valor como predictores de empeoramiento de la enfermedad.
Condiciones para la recolección de la muestra
Otros factores preanalíticos que alteran los resultados y deben evitarse en el momento de la obtención de la muestra de orina, son: fiebre, infección urinaria, menstruación, hematuria.
Conservación de las muestras de orina
Las muestras de orina deben procesarse en un plazo no mayor a 2 horas desde su obtención a temperatura ambiente. En caso de retrasarse su procesamiento deben refrigerase entre 2 y 8°C por un tiempo no mayor a 7 días. Para plazos mayores deben conservarse en un freezer a temperaturas inferiores a -70°C(22,27,32,33). Previo a su procesamiento todas las muestras de orina deben centrifugarse para evitar cualquier indicio de turbidez capaz de alterar los resultados.
ETAPA ANALÍTICA
Medición de la proteinuria total
Existen métodos semicuantitativos y métodos cuantitativos.
Métodos semicuantitativos o de tamizaje
Están representados por las tiras reactivas de orina. Las mismas consisten en un soporte de celulosa que contiene diferentes áreas de reacción representadas por reactivos de química seca. En el caso de la proteinuria, estas contienen un indicador de pH (por ejemplo, azul de tetrabromofenol) tamponado a un pH ácido que vira de color debido a la presencia de proteínas y su carga neta negativa a dicho pH. Es lo que se conoce como principio del error en los indicadores de pH por la presencia de proteínas.
El color se lee al cabo de 60 segundos y si bien la lectura puede ser visual, se recomienda el empleo de refractómetros para agregar precisión a la medida. El resultado se expresa en cruces y siempre todo resultado positivo debe ser confirmado mediante cuantificación empleando cualquiera de los métodos que detallaremos a continuación. El límite de detección es de 0,15 a 0,30 g/L. Las tiras de orina presentan tanto falsos negativos como falsos positivos.
Métodos cuantitativos
Si bien se han desarrollado una gran variedad de métodos para la cuantificación de proteínas, muchos de ellos ya se han abandonado por la inexactitud e imprecisión en los resultados que brindaban.
Actualmente los métodos recomendados pertenecen a dos grandes grupos: los métodos de tinción-fijación y los métodos de precipitación. Nos referiremos a 2 de los métodos más empleados en nuestro medio y a nivel internacional, representantes de cada uno de estos dos grupos.
Rojo de Pirogalol. Es un método de tinción-fijación, en el cual el compuesto rojo de pirogalol-molibdato se uno en medio ácido a las proteínas presentes en la muestra desarrollando un complejo coloreado que se mide fotométricamente a 600 nm, extrapolándose la concentración de proteínas presentes en la muestra mediante una curva de calibración. Este método si bien manual en su origen, es pasible de automatización. Presenta una alta sensibilidad analítica, baja imprecisión y una especificidad analítica que lo hace más sensible a la detección de albúmina en comparación con las globulinas(34).
Cloruro de Bencetonio. Es un método de precipitación, en el que las proteínas al unirse a este agente en un medio alcalino, precipitan generando una turbidez que es medida en un turbidímetro(35). También es un método automatizado, con alta sensibilidad analítica (similar al anterior), baja imprecisión y nuevamente una especificidad analítica mayor por la albúmina que por las globulinas.
Ambos métodos son de uso corriente en los laboratorios de rutina empleándose para su calibración estándares comerciales de variada constitución; algunos contiene albumina solamente, otros una combinación de albúmina y globulinas, en general de origen humano. Estos estándares tienen valores asignados trazables al material de referencia SRM 927d del Instituto Nacional de Estándares y Tecnología de EE.UU. (NIST), que consiste en una solución de albúmina bovina(36). La presencia de hemoglobina o antibióticos puede interferir con ambos métodos(37,38).
Es claro que hasta el momento no se ha desarrollado ni un material ni un método de referencia para este analito y que las dificultades para ello son muy importantes.
Medición de la albuminuria
Métodos semicuantitativos
Están representados por las tiras reactivas, de las que existen 2 tipos: las que miden albuminuria y creatininuria e informan el índice, y las que solamente miden albuminuria. Ambos tipos de tira presentan una elevada sensibilidad y especificidad analítica, pero debido a que ofrecen una estimación semicuantitativa deberían reservarse para aquellos medios que no cuenten con métodos cuantitativos.
Métodos cuantitativos
Están representados por inmunoensayos con lectura turbidimétrica o nefelométrica. En ambos casos la albúmina es reconocida y fijada por anticuerpos de tipo monoclonal o policlonal, dirigidos contra distintos epitopes de su molécula. Debido a su alta antigenicidad los diferentes métodos existentes en plaza pueden mostrar una considerable disparidad en los resultados arrojados. De cualquier forma, son métodos de gran sensibilidad y especificidad analítica y muy baja imprecisión.
Buscando la armonización de los resultados entre los diferentes laboratorios se están llevando a cabo distintos proyectos a nivel mundial que pretenden la estandarización de estos métodos con el desarrollo de un método y un material de referencia.
Actualmente los calibradores o estándares que se emplean son trazables a un material de referencia de proteínas séricas, conocido como ERM-DA 470k, del Instituto de Mediciones y Métodos de Referencia de Bélgica (IRMM)(39).
ETAPA POSANALÍTICA
Diferentes sociedades científicas y organizaciones han presentado guías y consensos donde figuran variados intervalos de referencia y unidades de medida para estos analitos, como se aprecia en trabajos seleccionados(22, 27, 32,40).
Debido a la alta variabilidad biológica intraindividual de estos analitos y la baja imprecisión de los métodos recomendados, es dicha variabilidad la que debe tenerse en cuenta a la hora de determinar el valor del mínimo cambio significativo, el cual por todo lo analizado no debe ser menor a 40%”.
ENCUESTAS DE LOS MÉTODOS UTILIZADOS EN NUESTRO PAÍS PARA LA DOSIFICACIÓN DE PROTEINURIA
Se analizan los métodos utilizados por los participantes del Programa de Evaluación Externa de Calidad (CECC), correspondientes al Subprograma Orina, en el período octubre de 2005 a marzo de 2011(41).
En octubre de 2005 se enviaron soluciones de orina sintética preparadas a partir de albúmina humana. Los valores de referencia se determinaron por el método de Kjeldahl.
En 2005, se observó una sobrevaloración de la proteinuria (medias de consenso mayores que los valores de referencia) dado que la mayoría de los participantes usaban el método del ácido sulfosalicílico (85%), el cual sobrevalora la albúmina.
En el año 2006 se realizó otro envío, y en esta oportunidad la orina sintética estaba preparada a partir de suero humano libre de enfermedades trasmisibles. Esto se debió a que se tenía conocimiento de la práctica común de utilizar suero como calibrador, y se deseaba conocer el comportamiento de los métodos. Los valores de referencia se determinaron por el mismo método que el año anterior.
En 2006 las medias de consenso se acercaron más a los valores de referencia dado que hubo una evolución metodológica hacia el uso del método de Rojo de Pirogalol (35%), una disminución de la adherencia al método del ácido sulfosalicílico (50%) y a la utilización de soluciones de suero humano en la preparación de la orina sintética. En este año, aparece en el escenario el método de cloruro de bencetonio. Es de destacar que tanto el método de Rojo de Pirogalol como el de cloruro de bencetonio son automatizados, mientras que el del ácido sulfosalilcílico es manual.
En el año 2008 se realizaron dos entregas del Subprograma Orina: la primera contenía una encuesta sobre métodos de dosificación de proteinuria y calibradores utilizados. Y la segunda contenía una solución de orina sintética preparada a partir de albúmina humana comercial. Los resultados de la primera entrega mostraron que aproximadamente un 15% de participantes utilizaba un calibrador preparado en el laboratorio, mientras que un 83% utilizaba calibradores comerciales.
Respecto a la metodología, el método del cloruro de bencetonio tenía un 35% de adherentes, al igual que el método del Rojo de Pirogalol, que estaba en ese orden, mientras que el método del ácido sulfosalicilíco disminuyó a un 29% en cuanto al número de adherentes, continuando la tendencia que se venía observando.
En el 2010 se envió una solución de orina sintética preparada con albúmina humana comercial, lo mismo que en 2011. En 2011 el 56,5% de los laboratorios utiliza rojo de pirogalol, 36,2% cloruro de bencetonio, 2,9% ácido sulfosalicílico, 2,9% biuret, 1,4% no informa.
Se destaca que entre los años 2005 y 2011 se observa una evolución metodológica hacia métodos automatizados, acompañada de una disminución sostenida de los coeficientes inter-laboratoriales. De la misma forma, en el período considerado, el método del ácido sulfosalicílico presentó la mayor dispersión de valores (34% en 2008), lo que era de esperar, ya que se trata de un método manual. El método del cloruro de bencetonio presentó la menor dispersión de valores (8,6% en 2010 y 10,4% en 2011) y junto con el rojo de pirogalol son los más recomendados en la literatura.
CONCLUSIONES DE LA REUNIÓN DE CONSENSO
RECOMENDACIONES
Consideraciones Preanalíticas
Se recomienda emplear la primer orina de la mañana para la detección y la monitorización de proteinuria o albuminuria. Es la muestra con menor variabilidad biológica que mejor se correlaciona con la excreción de proteína o albúmina en orina de 24 hs. Una muestra aleatoria será aceptada sólo en situaciones de urgencia.
Los factores pre-analíticos que influyen en la determinación de albumina o proteínas en orina son:
- Estado de hidratación, que determina orinas concentradas o diluidas alterando la concentración final de estos analitos.
- Ejercicio, que se asocia a una excreción aumentada de proteínas en la orina.
- Postura, debido a la existencia de una proteinuria ligada al ortostatismo.
- Sobrecarga proteica que es un factor determinante de la excreción de proteínas.
La muestra de orina debe procesarse en un plazo no mayor a 2 hrs desde su obtención. Si esto no es posible, se podrá conservar durante 7 días a temperaturas entre 2 y 8°C previa centrifugación. No se recomienda conservar a -20ºC. Para plazos mayores se recomienda mantener la muestra a temperaturas inferiores a -70°C.
En la solicitud médica al Laboratorio del estudio de proteinuria o albuminuria, se recomienda utilizar los siguientes términos:
- Cociente Proteinuria/Creatininuria (P/C).
- Cociente Albuminuria/Creatininuria (A/C).
- Proteinuria de 24 horas.
Según la evolución del paciente y por razones de protocolo, queda a criterio del médico tratante si debe solicitar la determinación de proteinuria en orina de 24 horas y será informada en g/día o g/24hs.
Consideraciones Analíticas
Examen de orina y cociente P/C
En el tamizaje de proteinuria en población de riesgo no diabética, se recomienda el empleo de la tira reactiva para examen de orina, debido a su alto valor predictivo negativo.
Se recomienda el uso de equipos de lectura automatizada para la tira reactiva porque reduce la posibilidad de error y la variabilidad en la interpretación de los resultados.
Con el empleo de la tira reactiva para orina, debe considerarse positivo cualquier resultado diferente de negativo para proteinuria.
Todo resultado positivo en la tira de orina, siempre debe confirmarse mediante medida cuantitativa de la concentración según las técnicas recomendadas.
La dosificación de proteinuria se deberá realizar empleando métodos de tinción-fijación o turbidimétricos, de ser posible de forma automatizada.
En el examen de orina la proteinuria se informará en g/L.
Para confirmar el diagnóstico y/o monitorizar la Enfermedad Renal Crónica se recomienda utilizar el COCIENTE P/C, la concentración de proteína deberá ser referida a la concentración de creatinina (g de proteína /g de creatinina).
El Cociente P/C se correlaciona con la excreción diaria de proteína y evita las dificultades y los errores de la recolección de orina de 24 horas.
El Cociente P/C minimiza el efecto del variable grado de hidratación, que determina que la concentración de proteína en g/L sea difícil de interpretar.
Cociente Albuminuria/Creatininuria
En el tamizaje de nefropatía diabética incipiente, se recomienda la cuantificación del Cociente A/C.
Para descartar la presencia de concentraciones elevadas de albúmina, se puede utilizar la tira reactiva de orina.
Si la proteinuria es negativa o contiene indicios (+/-), se procederá a la cuantificación del Cociente A/C.
Si la proteinuria por la tira reactiva es ≥ 1+ , se procederá de acuerdo con la recomendación 1.7. En caso que el Cociente P/C sea < 0,20 g/g se realizará el Cociente A/C.
Se recomienda realizar la cuantificación de albúmina en orina empleando técnicas de inmunoturbidimetría o nefelometría.
El empleo de tiras reactivas para el Cociente A/C debería reservarse para aquellos laboratorios que no dispongan de métodos para su cuantificación.
Consideraciones posanalíticas
Los términos microalbuminuria y macroalbumiuria deben abandonarse y sustituirse por el de albuminuria.
Se recomienda expresar los resultados en las siguientes unidades:
- Cociente P/C: g de proteína /g de creatinina
- Cociente A/C: mg de albumina/g de creatinina
- Proteinuria en 24 hs: g/24 hs
Se recomienda emplear los siguientes valores de referencia:
- Cociente P/C: < 0,20 g/g
- Cociente A/C: < 30 mg/g
- Proteinuria en 24 hs: < 0,30 g/24 hs
Se recomienda que en el informe de resultado el Laboratorio Clínico comunique:
• Método utilizado para la cuantificación.
• Si la orina presenta hematuria.
Cuando las tiras para medición de Cociente A/C sean utilizadas deberá aclararse en el informe del resultado el método empleado y si el cociente está por encima del rango de referencia, sugerir su cuantificación por un método inmunoquímico.
El cálculo del Cociente P/C partiendo de proteinuria expresada en g/l y creatininuria en mg/dl es:
(Proteinuria (g/l)/Creatininuria (mg/dl)) x 100 = Cociente P/C
BIBLIOGRAFÍA
1. K/DOQI. Clinical Practice Guidelines for Chronic Kidney Disease. Evaluation, classification, and stratification. National Kidney Foundation. Am J Kidney Disease 2002; 39 (Suppl 1): S1-S266.
2. Go AS, Chertow GM, Fan D, McCulloch CE, Hsu C-Y. Chronic Kidney Disease and the Risks of Death, Cardiovascular events, and Hospitalization. N Eng J Med 2004; 351: 1296-1305.
3. Chronic Kidney Disease prognosis consortium. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts. A collaborative meta-analysis. Lancet 2010; 375: 2073-81.
4. Gansevoort RT, Matsushita K, van der Velde M,
5. Iseki K, Ikemiya Y, Iseki C, Takishita S. Proteinuria and the risk of developing end-stage renal disease. Kidney Int 2003; 63: 1468-78.
6. Verhave JC, Gansevoort RT, Hillege HL, Bakker JL, De Zeeuw D, De Jong PE et al, for the PREVEND Study Group. An elevated urinary albumin excretion predicts de novo development of renal function impairment in the general population. Kidney Int 2004; 66 (suppl 92): S18-21.
7. Hillege, HL, Fidler V, Diercks GFH, van Gilst WH, De Zeeue D, Van Veldhuisen DJ, et al.. For the Prevention of Renal and Vascular End Stage Disease (PREVEND) Study Group. Urinary albumin excretion predicts cardiovascular and non-cardiovascular mortality. Circulation 2002; 106: 1777-82.
8. Locatelli F, Marcelli D, Cornelli M, Alberti D, Graziani G, Buccianti G, et al, and the Northern Italian Cooperative Study Group. Nephrol Dial Transplant 1996; 11: 461-467.
9. De Zeeuw D. Albuminuria, not only a cardiovascular risk marker, but also a target for treatment. Kidney Int 2004; 66(Suppl 92): S2-6.
10. GISEN, Gruppo Italiano di Studi Epidemiologici in Nefrologia. Randomized placebo-controlled trial of effect of ramipril on decline in glomerular filtration rate and risk of terminal renal failure in proteinuria, non-diabetic nephropathy. Lancet 1997; 349: 1857-1863.
11. Ruggenenti P, Perna A, Gherardi G, Gaspari F, Benini R, Remuzzi G. Renal function and requirement for dialysis in chronic nephropathy patients on long-term ramipril: REIN follow-up trial. Gruppo Italiano di Studi Epidemiologici in Nefrologia (GISEN). Ramipril Efficacy in Nephropathy. Lancet 1998; 352: 1252-1256.
12. Ruggenenti P, Perna A, Gherardi G, Garini G, Zoccali C, Salvadori M, et al. Renoprotective properties of ACE-inhibition in non-diabetic nephropathies with non-nephrotic proteinuria. Lancet 1999; 354: 359-365.
13. Brenner BM, Cooper ME, de Zeeuw D, Keane WF, Mitch WE, Parving HH, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345: 861-869.
14. Atkins RC, Briganti EM, Lewis JB, Hunsicker LG, Braden G, Champion de Crespigny PJ, et al. Proteinuria reduction and progression to renal failure in patients with type 2 diabetes mellitus and overt nephropathy. The Collaborative Study Group. Am J Kidney Dis 2004: 45 (2): 281-87.
15. Levey AS, de Jong PE, Coresh J, El Nahas M, Astor BC, Matsushita K, et al. The definition, classification, and prognosis of chronic kidney disease: a KDIGO Controversies Conference report. Kidney Int 2011; 80: 17-28.
16. Glassock RJ. Is the presence of microalbuminuria a relevant marker of kidney disease? Curr Hypertens Rep 2010; 12: 364-368.
17. David A. Rytand. The significance of “albuminuria” (Proteinuria).
18. Imai N. Standardizing Assays of Total Protein in Urine. Clin Chem 1986; 32, 1995.
19. De Jong PE, Curhan GC. Screening, Monitoring, and Treatment of Albuminuria: Public Health Perspectives. J Am Soc Nephrol 2006; 17: 2120-26.
20. Houlihan CA, Tsalamandris C, Akdeniz A, Jerumes G. Albumin to creatinine ratio. A screening test with limitations. Am J Kidney Dis 2002; 39 (6): 1183-89.
21. Lambers Heerspink HJ, Gansevoort RT, Brenner BM, Cooper ME, Parving HE, Shahinfar S, et al. Comparison of different measures of urinary protein excretion for prediction of renal events. J Am Soc Nephrol 2010; 21: 1355-60.
22. Miller WG, Bruns DE, Hortin GL, Sandberg S, Aakre KM, McQueen MJ, et al, on behalf of the National Kidney Disease Education Program-IFCC Working Group on Standardization of Albumin in urine. Current issues in measurement and reporting of urinary albumin excretion. Clin Chem 2009; 55 (1): 24-38.
23. Konta T, Hao Z, Takasaki S, Abiko H, Ishikawa M, Takahashi T, et al. Clinical utility of trace proteinuria for microalbuminuria screening in the general population. Clin Exp Nephrol 2007, 11(1):51-55.
24. Methven S, MacGregor MS, Traynor JP, Hair MD, O’Reilly DSJ, Deighan CJ. Comparison of urinary albumin and urinary total protein as predictors of patient outcomes in CKD. Am J Kidney Dis 2011; 57 (1): 21-28.
25. Methven S, Traynor JP, Hair MD, O’Reilly DSJ, Deighan CJ. Stratifying risk in chronic kidney disease: an observational study of
26. White SL, Yu R, Craig JC, Polkinghome KR, Atkins RC, Chadban SJ. Diagnostic Accuracy of urine dipsticks for detection of albuminuria in the general community. Am J Kidney Dis 2011; 58 (1): 19-28.
27. Price CP, Newall RG, Boyd JC. Use of Protein: Creatinine ratio measurements on random urine samples for prediction of significant proteinuria: A systematic review. Clin Chem 2005; 51 (9): 1577-1586.
28. Ricos C, Alvarez V, Cava F, García-Lario JV, Hernández A, Jiménez CV, et al. Current databases on biologic variation: pros, cons and progress. Scand J Clin Lab Invest 1999; 59: 491-500.
29. Ginsberg JH, Chan BS, Matarese RA, Garella S. Use of single voided urine samples to estimate quantitative proteinuria. New Engl J Med 1983; 309: 1543-1546.
30. Côté AM, Brown MA, Lam E, von Dadelszen, Firoz T, Liston RM, Magee LA. Diagnostic accuracy of urinary spot protein:creatinine ratio for proteinuria in hypertensive pregnant women: systematic review. BMJ 2008; 336 (7651): 1003-1006.
31. Hörbe Antunes VV, Veríssimo Veronese FJ, Morales JV. Diagnostic accuracy of the protein/creatinine ratio in urine samples to estimate 24-h proteinuria in patients with primary glomerulopathies: a longitudinal study. Nephrol Dial Transplant 2008; 23: 2242-2246.
32. Montañes Bermudez R, Gracia García S, Pérez Surribas D, Martínez Castelao A, Bover Sanjuán J. Documento de Consenso. Recomendaciones sobre la valoración de la proteinuria en el diagnóstico y seguimiento de la enfermedad renal crónica. Nefrología 2011; 31 (3): 331-345.
33. Martin H. Laboratory measurement of urine albumin and urine total protein in screening for proteinuria in chronic kidney disease. Clin Biochem Rev 2011; 32: 97-102.
34. Watanabe N, Kamel S, Ohkubo A, Yamanaka M, Ohsawa S, Makino K, Tokuda K. Urinary protein as measured with a Pyrogallol Red-Molybdate Complex, Manually and in a
35. Iwata J, Nishikaze O. New micro-turbidimetric method for determination of protein in cerebrospinal fluid and urine. Clin Chem 1979; 25 (7): 1317-1319.
36. NIST Standard Reference Materials [sede web]. National Institute of standards and technology. [acceso: 8 de diciembre de 2011] Disponible: http://srdata.nist.gov/gateway/gateway?keyword=protein.
37. Fatma Meriç Y, Doğan Y. Effect of addition of hemolysate on urine and cerebrospinal fluid assays for protein. Clin Chem 2006; 52: 152-153.
38. Marshall T, Williams KM. Total protein determinations in Urine: aminoglycoside interference. Clin Chem 2003; 49 (1). 202-203.
39. Emons H. Institute for Reference Materials and Measurements. [acceso: 7 diciembre de 2011 Disponible: https://irmm.jrc.ec.europa.eu/html/reference_materials_catalogue/catalogue/attachements/ERM-DA470k_cert.pdf.
40. Lamb EJ, MacKenzie F, Stevens P. How should proteinuria be detected and measured?. Ann Clin Biochem 2009; 46 205-217.
41. Comité de Estandarización y Control de Calidad (CECC). [acceso: 8 de diciembre de 2011] Disponible: www.ceccuruguay.edu.uy.