Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Medicina Interna
versión impresa ISSN 0250-3816versión On-line ISSN 1688-423X
Arch. Med Int vol.33 supl.2 Montevideo jul. 2011
Trombofilia y embarazo
Síndrome antifosfolipídico del embarazo
Dra. Mariana Stevenazzi
El SAF, descrito por Hughes en 1983, es la trombofilia adquirida más frecuente. Puede ser primario (idiopático) o secundario (en el 95% de los casos a LES). El SAFE es causa de importantes problemas para el binomio materno-fetal: trombosis materna, RCIU, abortos recurrentes entre otros. Se postula también como causa probable de infertilidad. La importancia en el conocimiento de esta patología radica en la posibilidad de prevención de las complicaciones con el tratamiento (trombosis y abortos recurrentes, fundamentalmente).
Aún hay puntos controversiales y dificultades con respecto al SAFE. Es difícil definir la relación causa-efecto dada la patogenia multifactorial. Se plantean además de los efectos en relación con los factores de la coagulación (protrombóticos), efecto contra la Anexina V y activación del complemento como factores etiológicos para la falla de implantación y PRE. Se discute también el variable potencial trombogénico de los diferentes anticuerpos en relación a la clínica así como la presencia de anticuerpos antifosfolipídicos (APAs) en mujeres sanas. Por otra parte siempre deben excluirse otras causas de mala historia obstétrica en relación a mal control de enfermedades coexistentes (HTA, enfermedad renal crónica, LES, diabetes).
Cuándo debemos sospechar un SAF
Frente a la ocurrencia de trombosis inexplicadas, alteraciones del embarazo vinculables, trombocitopenia inexplicada, alargamiento del tiempo de protrombina o aPTT, livedo reticularis, u otras alteraciones relacionadas a SAF (nefrológicas, neurológicas, cardíacas, entre otras).
Recomendación de screening de APAs según la ACCP’08, COGA (Colegio Americano de Ginecólogos y Obstetras), grupo CLATH’08, entre otros (Guías Italianas, Británicas, entre otras):
- Frente a historia médica u obstétrica sugestiva de SAF.
- PRE (3 o más AE < de 10 semanas) o Pérdida Fetal Tardía (PFT) (AE > 10 semanas) - ACCP: (IA), pretérminos < 34 semanas en relación a Pre-E severa o Eclampsia, RCIU (2C) o insuficiencia placentaria documentada (Eco doppler, Non Stress Test/NST). (Algunos consideran PRE 2 o más AE < 10 semanas). (1-5)
Definición de SAFE
Se define SAFE según los criterios de Sapporo (1999) y revisados en Sydney 2006 (Miyakis et al), debiendo estar presente 1 criterio clínico más 1 de laboratorio. (6,7)
Criterios clínicos: uno o más episodios de trombosis venosa, arterial y/o de pequeño vaso (imagen o evidencia histológica) en cualquier órgano o tejido y/o morbilidad del embarazo: una o más muertes fetales > 10 semanas de feto morfológicamente normal; uno o más pretérminos < de 34 semanas secundario a: Pre-E severa o Eclampsia (de acuerdo a la definición estándar) o insuficiencia placentaria (RCIU < p5 por ECO), oligohidramnios, hipoxemia fetal, sugeridos por Ecodoppler o NST, de fetos morfológicamente normales; tres o más abortos espontáneos consecutivos inexplicados < de 10 semanas (excluidas otras causas: cromosómicas maternas o paternas, y anatómicas o endócrinas maternas).
Criterios de laboratorio: presencia de APAs en dos o más ocasiones, con una diferencia de 12 semanas como mínimo, según criterios de la Sociedad Internacional de Trombosis y Hemostasis (ISTH) ‘05: ACA (anticuerpos anticardiolipinas): isotipos IgG o IgM > de 40U GPL o MPL o > de percentil 99. Anti ß2 GPI (anti beta 2 glicoproteína I) IgG o IgM > percentil 99. AL (anticoagulante lúpico) positivo.
El punto de corte y el requisito de dos o más determinaciones es importante para descartar falsos positivos, los cuales pueden ser a bajo título y transitorios vinculados a fármacos e infecciones, etc. El estudio de otros Ac que pueden estar presentes en el SAF pero menos frecuentes y de dudosa sensibilidad y especificidad (antiAnexina V, antifosfatidilinositol, antiprotrombina, etc.) aún no han sido avalados, si bien están en desarrollo importantes estudios de investigación. Así como el isotipo IgA de los APAs.
Test para APAs: ELISA (para ACA y anti ß2GPI) y LA Test para AL. (aPTT-adecuado a la detección de AL); Test de Veneno de Víbora de Russell diluido (dVVRT). (8)
Evidencia sobre manifestaciones clínicas en SAFE
Hay clara evidencia en cuanto al riesgo de trombosis en relación a SAFE, si bien es variable. La mayoría son venosos. Este riesgo aumenta aun más si se asocia a TH. Con respecto a las manifestaciones obstétricas hay evidencia de asociación con: Pre-E precoz y severa (ACA: OR 2,72 y AL: OR 1,45) (9); RCIU, se vio un aumento en la frecuencia 30% vs 10% en población control (AL positivo 12% vs AL- 2%) (10); PFT, se vio una fuerte asociación y mayor riesgo de recurrencia (AL OR 13, ACA IgG OR 3,6 e IgM OR 5,6) (11) y con AE < 10 semanas, si bien hay datos controversiales (unos a favor y otros en contra) (12-14).
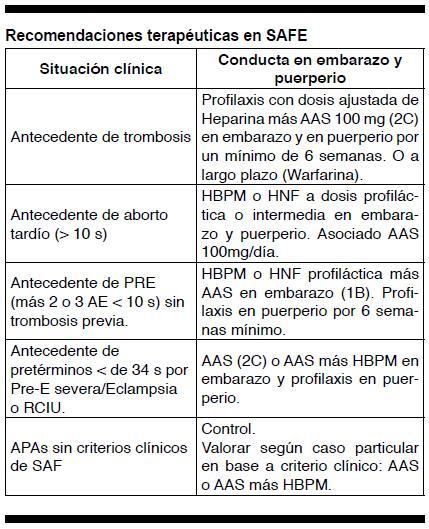
Tratamiento
La meta es: prevenir complicaciones (morbimortalidad) materno-fetales (trombosis maternas y prevenir complicaciones obstétricas). El tratamiento siempre debe ser individualizado según cada caso particular.
Hay diferentes fármacos que se han utilizado y estudiado para el tratamiento del SAFE(15). El ácido acetil salicílico (AAS) tiene un efecto beneficioso demostrado para prevención de pérdidas fetales, con tasa de Nacidos Vivos (NV) variable de hasta más de un 72% según reportes. Se recomienda a dosis bajas (50 a 100 mg/día) y debería suspenderse a las 35 semanas de gestación (16). Las heparinas (no fraccionadas -HNF, o de bajo peso molecular- HBPM) han sido estudiadas también en varios trabajos. Hay evidencia sobre el beneficio de su uso por sus efectos antitrombóticos conocidos, antiinflamatorios y por inhibición del complemento; ya sea asociada a AAS o no (tasas de NV 70 a 80%) (17-21). Se recomiendan las HBPM por tener igual eficacia que las HNF y menos efectos secundarios (menos osteoporosis, menor incidencia de trombocitopenia inducida por heparina-HIT). Los GC (glucocorticoides) no se recomiendan. La Gama Globulina Hiperinmune (IVIG) tiene un lugar sobre todo para casos refractarios o vinculados a plaquetopenia autoinmune. La tasa de NV en un trabajo que comparo IGIV fue de 57% vs. 84% para el grupo que recibió HBPM más AAS (15). La Hidroxicloroquina se reserva para las pacientes portadoras de LES, en las cuales tiene un beneficio sobre la evolución de la enfermedad y efecto antiplaquetario. Es segura en el embarazo. En estudio su uso para SAFE primario. Las Estatinas si bien tienen un rol antiinflamatorio y antitrombótico se contraindican en el embarazo.
Se recomienda monitorear cifras plaquetarias durante el uso de heparinas y de indicarse AAS en puerperio el consentimiento del Neonatólogo.
Conclusiones
Según la revisiones bibliográficas revisadas se concluye que son necesarios estudios de buena calidad estadística para claras recomendaciones en SAFE. Existiendo aún puntos controversiales.
Palabras clave: Embarazo; Trombofilia.
Keywords: Pregnancy; Thrombophilia.
Bibliografía
1. ACOG. Practice Bulletin. Antiphospholipid síndrome. Obstet. Gynecol. 2005; 106:1113.
2. Bates SM, Greer IA, Pabinger I, Sofaer S, Hirsh J; American College of Chest Physicians. Venous Thromboembolism,thrombophilia, antithrombotic therapy and pregnancy: American College of Chest Physicians Evidence-Based Clinical Preactice Guidelines (8th Edition). Chest. 2008 Jun;133(6 Suppl):844S-886S.
3. Otero, Ana María; Sarto, Adriana; Amigo, Mary Carmen; Mijares, Mercedes; Amante de Guggiari, Paula; De Lisa, Elena; Chumpitaz, Gloria; Meschengieser, Susana. Trombofilia y embarazo: consenso del Grupo CLAHT. Arch. Med. Interna (Montevideo);30(2/3):59-63, set. 2008.
4. Lussana F, Dentali F, Abbate R, d’Aloja E, D’Angelo A, De Stefano V, Faioni EM, Grandone E, Legnani C, Martinelli I, Simioni P, Tormene D, Italian Society for Haemostasis and Thrombosis. Screening for thrombophilia and antithrombotic prophylaxis in pregnancy: Guidelines of the Italian Society for Haemostasis and Thrombosis (SISET). Thromb Res. 2009 Nov;124(5):e19-25.
5. Royal College of Obstetricians and Gynaecologists. Guídeline N° 17, revisal May 2003.
6. Wilson WA, Gharavi AE, Koike T, Lockshin MD, Branch DW, Piette JC, Brey R, Derksen R, Harris EN, Hughes GR, Triplett DA, Khamashta MA. International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome: report of an international workshop. Arthritis Rheum. 1999 Jul;42(7):1309-11.
7 Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, Derksen RH, DE Groot PG, Koike T, Meroni PL, Reber G, Shoenfeld Y, Tincani A, Vlachoyiannopoulos PG, Krilis SA. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome. J Thromb Haematol 2006; 4(2):295-306.
8 Reber G, Tincani A, Sanmarco M, de Moerloose P, Boffa MC; Standardization group of the European Forum on Antiphospholipid Antibodies. Proposals for the measurement of anti-beta2-glycoprotein I antibodies. Standardization group of the European Forum on Antiphospholipid Antibodies. J Thromb Haemost. 2004 Oct; 2(10):1860-2.
9 Robertson L, Wu O, Langhorne P, Twaddle S, Clark P, Lowe GD, Walker ID, Greaves M, Brenkel I, Regan L, Greer IA; Thrombosis Risk and Economic Assessment of Thrombophilia Screening (TREATS) Study. Thrombophilia in pregnancy: a systematic review. Br J Haematol 2006 Jan;132(2):171-96.
10 Yasuda M, Takakuwa K, Tokunaga A, Tanaka K. Prospective studies of the association between anticardiolipin antibody and outcome of pregnancy. Obstet Gynecol 1995 Oct;86(4 Pt 1):555-9.
11. Opatrny L, David M, Kahn SR, Shrier I, Rey E. Association between antiphospholipid antibodies and recurrent fetal loss in women without autoimmune disease. A metanalysis. J. Reumathol. 2006. J Rheumatol. 2006 Nov;33(11):2214-21.
12. Roqué H, Paidas MJ, Funai EF, Kuczynski E, Lockwood CJ. Thrombophilias are not associates with early pregnancy loss. Thromb Haemost 2004 Feb; 91(2):290-5.
13. Oshiro BT, Silver RM, Scott JR, Yu H, Branch DW. Antiphospholipid antibodies and fetal death. Obstet. Gynecol. 1996; 87 (4): 489-93.
14. Cowchock FS, Reece EA, Balaban D, Branch DW, Plouffe L. Repeated fetal losses associated with antiphospholipid antibodies: a collaborative randomized trial comparing prednisone with low dose heparin treatment. Am J Obstet Gynecol 1992 May;166(5):1318-23.
15. Triolo G, Ferrante A, Ciccia F, Accardo-Palumbo A, Perino A, Castelli A, Giarratano A, Licata G. Randomized study of subcutaneous LMWH plus aspirin versus IVIG in the treatment of recurrent fetal loss associated with antiphospholipid antibodies. Arthritis Rheum 2003 Mar;48(3):728-31.
16. Pattison NS, Chamley LW, Birdsall M, Zanderigo AM, Liddell HS, McDougall J. Does aspirin have a role in improving pregnancy outcome foor women with antiphospholipid syndrome? A randomized controlled trial. Am J Obstet Gynecol 2002;183:1008-1012.
17. Empson M, Empson M, Lassere M, Craig JC, Scott JR. Systematic review of therapeutic trials. Recurrent pregnancy loss with antiphospholipid antibody. Obstet Gynecol 2002 Jan; 99(1): 135-144.
18. Rai R, Cohen H, Dave M, Regan L. Randomized controlled trial of aspirin and aspirin plus heparin in pregnant women with recurrent miscarriage associated with phospholpid antibodies. BMJ 1997 Jan 25;314(7076):253-7.
19. Kutteh WH.A clinical trial for the treatment of antiphospholipid antibody-associated recurrent pregnancy loss with lower dose heparin and aspirin. Am J Obstet Gynecol 1996 May;174(5):1584-9.
20. Noble LS, Kutteh WH, Lashey N, Franklin RD, Herrada J. Antiphospholipid antibodies associated with recurrent pregnancy loss: prospective, multicenter, controlled pilot study comparing treatment with LMWH versus HUF. Fertil Steril 2005; 83(3):684-690.
21. Farquharson RG, Quenby S, Greaves M. Antiphospholipid síndrome in pregnancy: a randomized controlled trial of treatment. Obstet Gynecol 2002 Sep;100(3):408-13.