Services on Demand
Journal
Article
Related links
Share
Archivos de Medicina Interna
Print version ISSN 0250-3816On-line version ISSN 1688-423X
Arch. Med Int vol.33 no.2 Montevideo 2011
Actualización
Impacto del tabaquismo y del humo de segunda mano en la salud cardiovascular
Impact of smoking and second hand smoke on cardiovascular health
Dr. Edgardo Sandoya
Resumen:
El tabaquismo constituye la principal causa evitable de muerte y enfermedad. Quienes fuman tienen mayor incidencia de enfermedades cardiovasculares debido a que el cigarrillo favorece el desarrollo de la ateroesclerosis y altera la provisión de oxígeno a los tejidos. Estos fenómenos se traducen en mayor incidencia de infarto agudo de miocardio, muerte súbita, angina de pecho, accidente cerebrovascular, aneurisma de aorta y arteriopatía en los fumadores. Entre quienes fuman también hay mayor incidencia de infarto luego de una angioplastia, mayor mortalidad del accidente cerebrovascular, mayor expansión del aneurisma aórtico y mayor tasa de falla del bypass fémoro-poplíteo.
La exposición pasiva al humo de tabaco de segunda mano aumenta el riesgo de enfermedad coronaria, accidente cerebrovascular e infarto de miocardio. El estrés oxidativo, la estimulación adrenérgica, la disfunción autonómica y el aumento de monóxido de carbono que ocurren al exponerse al humo de segunda mano pueden desencadenar, en tan sólo 30 minutos, un evento coronario agudo. El Convenio Marco de Control del Tabaco de OMS es la herramienta de Salud Pública que enfrenta la epidemia de tabaquismo; estas acciones deben ser complementadas por los clínicos, brindando los cuidados que ayuden a sus pacientes fumadores a controlar la adicción para de esa forma reducir su riesgo cardiovascular.
Palabras clave: tabaquismo, ateroesclerosis, enfermedades cardiovasculares, contaminación por humo de tabaco
Summary:
Smoking is the leading avoidable cause of morbi-mortality. Smokers have a greater incidence of cardiovascular disease because cigarettes favor the development of atherosclerosis and disrupt oxygen delivery to tissues. These phenomena translate into a higher incidence of acute myocardial infarction, sudden death, angina, stroke, aneurism of the aorta and arterial disease among smokers. Smokers also have a higher incidence of infarction following angioplasty, a greater stroke-induced mortality, greater expansion of aortic aneurisms and more failures of femoro-popliteal bypass. Second-hand smoking increases the risk of coronary artery disease, stroke and myocardial infarction. Oxidative stress, adrenergic stimulation, autonomic dysfunction and the increase of carbon monoxide that take place when an individual is exposed to second hand smoke may trigger an acute coronary event in just 30 minutes. The United Nations Framework Convention for Tobacco Control is a public health tool designed to approach the tobacco epidemic; its actions must be complemented by clinicians, who should provide the type of care that may help their smoking patients to curb their addiction and hence reduce cardiovascular risk.
Keywords: smoking, atherosclerosis, cardiovascular diseases, tobacco smoke pollution
INTRODUCCIÓN
En setiembre de 2011 la ONU realizará la primera Reunión de Alto Nivel sobre Enfermedades no Transmisibles, con el objetivo de generar un movimiento mundial contra la muerte prematura y la morbilidad evitable, debidas a cardiopatía, ataque cerebral, cáncer, diabetes y enfermedad respiratoria crónica. Se ha acordado que la prioridad más urgente en tal sentido es el control del tabaco, proponiendo como meta para 2040 un mundo en que menos de 5% de las personas lo consuman(1). Se entiende que la implementación de las medidas del Convenio Marco de Control de Tabaco de OMS(2) tendrá rápido efecto en la salud y beneficios económicos asociados, dado que la reducción de la exposición al humo de tabaco directo y de segunda mano reduce rápidamente la carga de enfermedades cardiovasculares y, por lo tanto, los gastos de salud(3,4). El impacto de estas medidas puede llegar a ser muy importante, tal como sucedió en Gran Bretaña, donde entre 1981 y 2000 la mortalidad coronaria se redujo 62% en hombres y 45% en mujeres, explicando las medidas destinadas al control del tabaco el 48% del total de esa reducción(5).
Los daños derivados del tabaco son múltiples, y afectan tanto a quienes lo consumen como a quienes se hallan expuestos de forma pasiva al humo de segunda mano (HSM). En la presente revisión se analizan los efectos cardiovasculares a nivel de los mecanismos básicos y de los efectos clínicos tanto del consumo de tabaco como del HSM.
EFECTOS DEL CONSUMO DE TABACO
El tabaquismo afecta al aparato cardiovascular a través de dos mecanismos principales: favoreciendo el desarrollo de la ateroesclerosis y alterando el balance entre la demanda y la provisión de oxígeno. La desestabilización y complicación de la placa ateroesclerótica está asociada con cambios trombóticos e inflamatorios en los que el tabaquismo tiene un papel determinante(6). A ello se asocian la disfunción endotelial y alteraciones oxidativas, los que junto a los anteriores favorecen el desarrollo de la ateroesclerosis (Tabla I)(7).
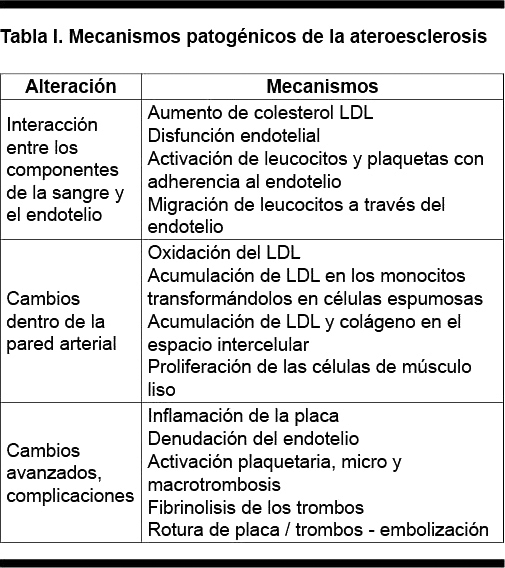
Disfunción endotelial
La disfunción endotelial tiene un papel central en la etapa inicial de la ateroesclerosis, asociándose al aumento de la adhesión al endotelio de los monocitos circulantes y de los linfocitos T, así como su posterior migración hacia la íntima. Estas células, en presencia de LDL oxidado se transforman en células espumosas y se acumulan en la íntima, constituyendo un elemento clave en las primeras fases de la ateroesclerosis. El endotelio regula el tono vascular mediante la liberación de óxido nítrico y de vasoconstrictores por lo que, cuando el endotelio está dañado, la variabilidad del diámetro a los estímulos se halla afectada(8). La tomografía por emisión de positrones muestra que en fumadores no existe aumento del flujo coronario en respuesta a un test presor, lo que se normaliza después de administrar L-agrinina, un precursor del óxido nítrico(9). En fumadores sanos jóvenes y de mediana edad existe una reducción de la vasodilatación endotelio-dependiente, la que depende de la magnitud del consumo de tabaco: mayor reducción a más paquetes-año de exposición, fenómeno éste que parece ser reversible(10).
Aumento de la trombogénesis
La relación existente entre el consumo de tabaco y los cambios en los vasos que llevan a la trombosis se conocen desde hace tiempo(11). El aumento de trombogénesis se produce porque el factor tisular tiene una expresión aumentada en las placas ateroescleróticas, lo que hace que los fumadores tengan niveles de factor tisular más elevado que los no fumadores(12). El análisis de arterias patológicas provenientes de cirugía muestra que las placas de los fumadores están más complicadas por trombosis que las de los no fumadores(13). En las fases avanzadas de la ateroesclerosis, la interacción coagulación-fibrinolisis requiere de un delicado balance para mantener la placa estable, así como un flujo sanguíneo adecuado. Este balance entre formación y disolución de coágulos depende de interacciones complejas, que involucran a todos los componentes de la interfase sangre-pared arterial, particularmente las células endoteliales y las plaquetas. Cuando éste es alterado, puede ocurrir trombosis patológica, que lleva a la oclusión vascular, que termina en infarto. La evidencia sugiere que este estado protrombótico del tabaquismo puede ser el factor más importante en la historia natural de la aterosclerosis, y probablemente sea el principal factor subyacente que asocia el tabaquismo con la muerte súbita(14). El tabaquismo tiene efectos directos en las plaquetas promoviendo su activación y adhesión, efecto éste que no es prevenido por aspirina(15,16). En fumadores con enfermedad coronaria la sangre obtenida cinco minutos después de fumar dos cigarrillos exhibe un aumento de la trombicidad y la agregación plaquetaria, comparada con las observadas en sangre obtenida cinco minutos antes de fumar(17). Además de aumento de la tombogenia, los fumadores tienen alterada la actividad fibrinolítica, con una reducción en la capacidad para liberar t-PA con relación a la de los no fumadores, lo que puede ser crítico en la fase aguda de una trombosis coronaria(18).
Aumento de la respuesta inflamatoria
Hoy se sabe que la inflamación tiene un papel central en la patogénesis de la aterosclerosis(19). El tabaquismo determina una respuesta inflamatoria pulmonar y una respuesta inflamatoria sistémica, que se manifiesta por ascenso de la concentración de glóbulos blancos(20,21). Los leucocitos expuestos al humo de cigarrillo presentan un aumento de su respuesta quimiotáctica, así como de su agregabilidad y de la expresión de los receptores de adhesión(22). Un metaanálisis encontró que un aumento de 2.800 leucocitos dentro del rango normal de glóbulos blancos se asocia con un incremento del riesgo relativo de 140% de desarrollar enfermedad coronaria(23). Existe una relación dosis-respuesta de este incremento con la cantidad fumada, los años de tabaquismo y el tiempo transcurrido desde la cesación del consumo(24).
El tabaquismo también se asocia a aumento de la proteína C reactiva, la que se halla asociada con riesgo de coronariopatía, ataque cerebral y arteriopatía periférica(25,26).
Alteraciones oxidativas
El aumento de los fenómenos oxidativos provocados por el tabaquismo se ha comprobado midiendo los niveles de F2-isoprostano circulante, un indicador de la peroxidación, lo que refleja la modificación oxidativa de importantes moléculas en vivo(27), la que desaparece casi completamente luego de pocas semanas de cesación(28). Diversos estudios han sugerido un sinergismo entre tabaquismo e hipercolesterolemia, planteando la posibilidad de que el tabaquismo potencie la disfunción endotelial aumentando la oxidación del colesterol LDL(29).
Efectos sobre la provisión tisular de oxígeno
Además de los efectos aterogénicos ya vistos, los componentes del humo pueden tener efectos adversos en relación con la demanda y provisión de oxígeno, aumentado el riesgo de isquemia. Fumar induce la liberación de catecolaminas, lo que determina aumento de la frecuencia y de la contractilidad cardíaca en reposo y aumento en el tono vascular(16). No obstante, los fumadores tienen una respuesta de frecuencia en el ejercicio por debajo de lo esperado(30), hecho que se asocia a riesgo aumentado de muerte, infarto y arritmias(31). El fumar determina una inmediata constricción proximal y distal de las arterias coronarias, tal como ha sido observado por ecografía intracoronaria, efecto que parece ser mediado por el aumento en catecolaminas, asociado al tabaquismo(32).
El tabaquismo también impacta a través del monóxido de carbono, que pasa desde los alvéolos a la sangre y se une a la hemoglobina del eritrocito, formando carboxihemoglobina, la que tiene menor capacidad de transportar oxígeno. Esto puede llevar a eritrocitosis, la que junto a la hiperfibrinogenemia del fumador incrementan la viscosidad sanguínea, aumentando el riesgo de trombosis y comprometiendo físicamente la microcirculación(33). El compromiso de la microcirculación asociada al aumento de leucocitos reduce la capacidad de la sangre de llevar oxígeno al corazón y a los tejidos periféricos, lo que puede llevar a un disbalance entre la necesidad y la provisión de oxígeno(6).
EFECTOS CLÍNICOS DEL TABAQUISMO
Manifestaciones subclínicas
El espesor íntima-media carotídea, un marcador de ateroesclerosis subclínica, muestra un incremento en fumadores, observándose un efecto dosis-respuesta(34). En jóvenes existe aterosclerosis subclínica vinculada al tabaquismo(35), como mostró el estudio de Bogalusa, entre 93 jóvenes fallecidos de causa traumática a una edad media de 21 años, donde los fumadores presentaban placas fibrosas en la aorta y estrías grasas en los vasos coronarios(36). Estudios con tomografía multicorte han encontrado que el antecedente de tabaquismo se asocia con mayor presencia de calcio coronario(37). El tabaquismo determina aumento de rigidez arterial, un indicador de enfermedad arterial, observándose además que ella se incrementa inmediatamente después de fumar un cigarrillo(38,39). Se ha comprobado este aumento de la rigidez arterial en jóvenes con menos de 10 años de tabaquismo(40).
Manifestaciones clínicas
El tabaquismo afecta diferentes sectores, determinando aumento del desarrollo de enfermedad coronaria, cerebrovascular, aneurisma de aorta abdominal y arteriopatía periférica (Tabla II).
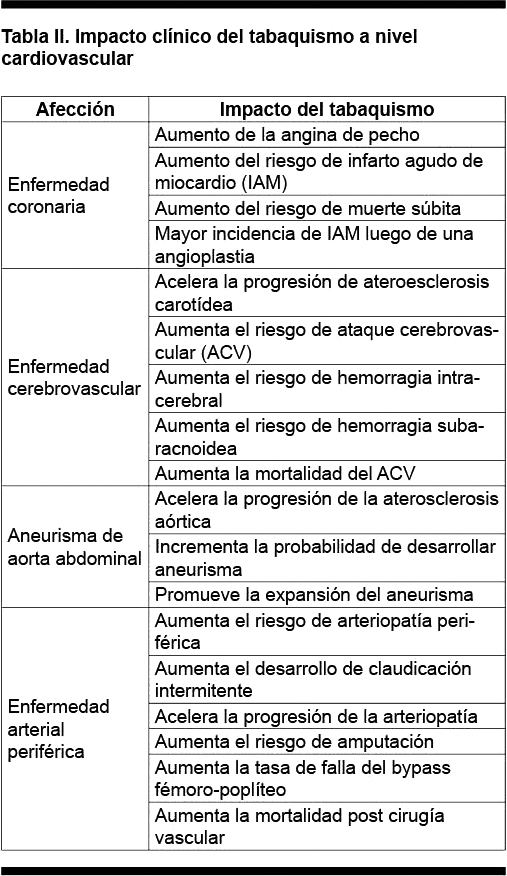
Enfermedad coronaria
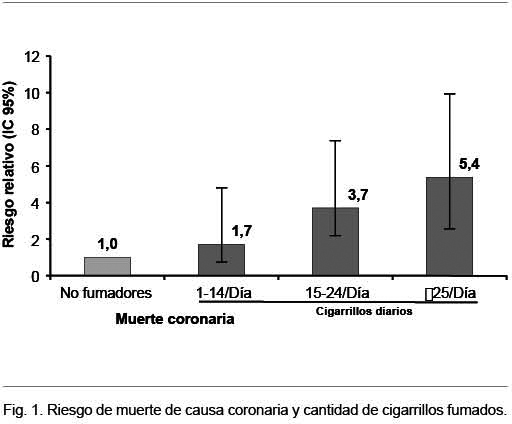
La mortalidad de causa coronaria aumenta en función de la cantidad de cigarrillos fumados a partir de fumar un cigarrillo diario, como mostró un estudio que incluyó 119.404 fumadores, inicialmente sin enfermedad coronaria, lo que muestra que no existe un nivel seguro de tabaquismo (Figura 1).
Globalmente el tabaquismo fue responsable de la mitad de los eventos coronarios, siendo el riesgo atribuible al tabaquismo mayor en quienes tenían otros factores de riesgo(41).
Cuando se evaluaron las lesiones coronarias mediante coronariografía cuantitativa seriada, se observó que en los fumadores se acelera el desarrollo de nuevas lesiones(42). Ser fumador se asocia a también a un aumento del riesgo relativo de la incidencia de angina de pecho (RR 3,6)(43). El estudio InterHeart, desarrollado en 52 países de todo el mundo, confirmó que el uso de tabaco es una causa mayor evitable de enfermedad cardiovascular(44).
El estudio demostró que fumar se asociaba a mayor riesgo de IAM (odds ratio [OR] 2,95, IC 95% 2,77 a 3,14) con relación a quienes nunca fumaron. El riesgo se redujo a los 3 años de cesación del tabaquismo, (OR 1,87; IC 95% 1,55 a 2,24), existiendo riesgo residual hasta 20 o más años después de la cesación (OR 1,22; IC 95% 1,09 a 1,37). Los hombres jóvenes tuvieron el riesgo poblacional atribuible más elevado (58,3%; IC 95% 55,0 a 61,6) y el más bajo se observó en las mujeres añosas (6,2%; IC 95% 4,1 a 9,2). La rama latinoamericana de este estudio mostró que el riesgo se incrementa de forma lineal con mayor consumo diario.45 Mientras los tabaquistas en cesación de esta región tienen un riesgo (OR) de 1,53 (IC 95% 1,28 a 1,84) con relación a los no fumadores, en los fumadores de menos de 20 cigarrillos diarios el mismo aumenta a (OR 2,46; IC 95% 1,96 a 3,10) y en los fumadores de 20 o más el mismo se incrementa 9 veces (OR 9,07; IC 95% 6,75 a 12,19)
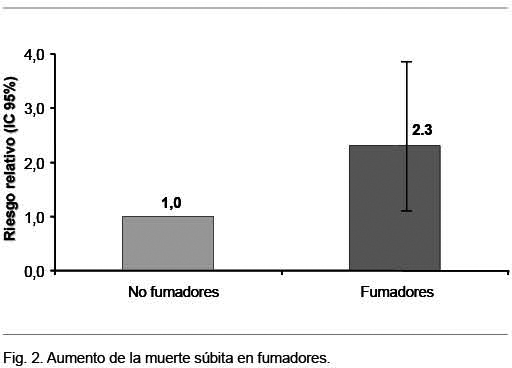
Muerte súbita
El riesgo de muerte súbita se ve aumentado por el tabaquismo(46), causando adhesividad plaquetaria y liberación de catecolaminas, llevando a la trombosis aguda y arritmias ventriculares. Los fumadores que mueren súbitamente tienen más trombosis aguda que placas estables, mientras que los no fumadores que mueren de igual manera tienen más placas estables(14).
En pacientes con angioplastia se comprobó que el tabaquismo aumenta el riesgo relativo de muerte (RR 1,76; IC 95% 1,37 a 2,26) y de infarto con onda Q (RR 2,08 IC 95% 1,16 a 3,72) con relación a los no fumadores. La cesación de tabaquismo antes o después del procedimiento redujo dicho riesgo(47).
Enfermedad cerebrovascular
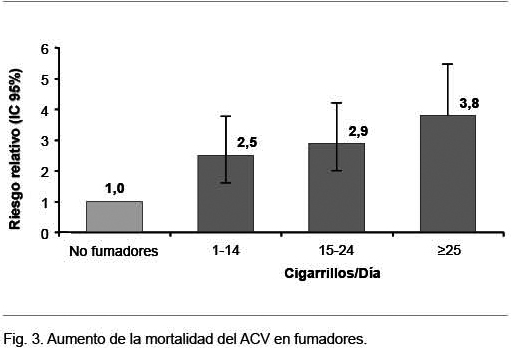
Un metaanálisis mostró que el cigarrillo aumenta el riesgo de ACV en 50%, con impacto diferente de acuerdo a su subtipo: RR 1,9 para el ACV isquémico y RR 2,9 para la hemorragia subaracnoidea(48). En un estudio realizado en 360.000 individuos, los fumadores tuvieron un riesgo relativo de 2,5 de muerte por ACV durante un seguimiento a 10 años, con clara relación consumo-riesgo, que aumenta en la medida en que aumenta el número de cigarrillos diarios. Además el tabaquismo aumenta la mortalidad del ACV. Un estudio escocés realizado en 7.052 hombres y 8.354 mujeres de 45 a 64 años mostró, al cabo de 20 años, que el tabaquismo se asoció directamente con el aumento de mortalidad por esta causa (Figura 3)(49)
El tabaquismo contribuye entre 12 y 14% a todas las muertes por ACV. Es efecto del tabaco potencia los efectos de los otros factores de riesgo de ACV, aumentado el riesgo de ateroesclerosis y también actúa de forma aguda por sus efectos en la formación de trombos(50).
El riesgo de hemorragia subaracnoidea es mayor comparado con otros tipo de ACV; en el estudio MRFIT, el RR relacionado al tabaquismo para ACV no hemorrágico fue 2,1, mientras que el RR de hemorragia subaracnoidea fue 3,0(51). El daño acumulativo en la elástica, especialmente en hipertensos, promueve dilataciones aneurismáticas vasculares, en la cuales el impacto de la onda de pulso puede desencadenar un evento hemorrágico.
La aterosclerosis carotídea aumenta su progresividad cuando se fuma, tal como fue demostrado en un estudio realizado en 10.914 individuos en los que se determinó el espesor de la íntima-media. El tabaquismo se asoció a un 50% en la progresión de la ateroesclerosis, el que fue mayor en sujetos con diabetes e hipertensión. Haber fumado y estar en cesación se asoció a un 25% de incremento en el espesor. También se comprobó que cuantos más paquetes-año de exposición existieron la progresión fue más rápida (p<0,001)(52).
El tabaquismo determina aumento del riesgo de ACV fatal y no fatal también en mujeres. Datos del Nurses Healh Study (118,539 mujeres de 30 a 55 años sin enfermedad coronaria ni ACV seguidas 8 años) muestran asociación positiva con el riesgo de ACV, pues quienes fumaban 1 a 14 cigarrillos diarios tuvieron un RR de 2,2 (IC 95% 1,5 a 3,3), mientras que aquellas que fumaban 25 o más cigarrillos por día tenían un RR de 3,7 (IC 95% 2,7 a 5,1). Para las mujeres de este último grupo el RR de hemorragia subaracnoidea fue 9,8 (IC 95% 5,3 a 17,9), comparado con el de las no fumadoras(53).
El tabaquismo aumenta el riesgo de ACV hemorrágico. Un estudio prospectivo mostró que las fumadoras de 1 a 14 cigarrillos diarios tenían un RR de 1,93 (IC 95% CI 0,75 a 5,02) de ACV hemorrágico total, 2,15 (IC 95% 0,62 a 7,43) de hemorragia intracerebral y 1,70 (IC 95% 0,38 a 7,60) de hemorragia subaracnoidea. Las fumadoras de ≥ 15 cigarrillos diarios tuvieron RR de 3,29 (IC 95% 1,72 a 6,29) de ACV hemorrágico, 2,67 (IC 95% 1,04 a 6,90) de hemorragia intracerebral y 4,02 (IC 95% 1,63 a 9,89) de hemorragia subaracnoidea comparado a las no fumadoras(54).
Aneurisma de aorta abdominal
En fumadores el riesgo de aneurisma de aorta abdominal vinculado al tabaquismo es mayor que el asociado a la enfermedad coronaria y cerebrovascular: siendo 2,5 veces mayor que con la enfermedad coronaria (IC 95% 2,2 a 2,8) y 3,5 (IC 95% 2,4 a 5.3) con la cerebrovascular(55). En el aumento del riesgo de aneurisma de aorta abdominal es más significativa la asociación entre el nivel de exposición que su duración(56).
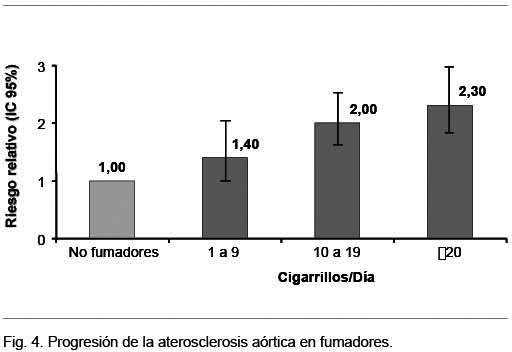
El tabaquismo aumenta la progresión de la ateroesclerosis aórtica. Un estudio realizado en 758 mujeres de 45 a 64 años mostró que después de 9 años de seguimiento las fumadoras tuvieron un incremento en el desarrollo de aterosclerosis, siendo el riesgo relativo de 1,4 (IC 95% 1,0 a 2,0) entre quienes fumaban entre 1 a 9 cigarrillos diarios, de 2,0 (IC 95% 1,6 a 2,5) entre quienes fumaban 10 a 19, y de 2,3 (IC 95% 1,8 a 3,0) entre quienes fumaban más de esa cantidad, después de ajustar por edad y otros factores de riesgo (Figura 4). Entre los fumadores en cesación, el riesgo se redujo, pero se siguió observando un riesgo mayor 5 a 10 años después de ello: 1,6; IC 95% 1,1 a 2,2)(57).
El desarrollo de aneurisma de aorta abdominal se ve aumentado en los fumadores; un estudio realizado en 1.743 pacientes monitorizando el diámetro del aneurisma de la aorta abdominal mediante ecografía mostró un crecimiento de 2,6 (-1,0 a 6,1) mm/año. La tasa de crecimiento fue mayor entre fumadores que en no fumadores (p<0,001). Ningún otro factor (incluyendo lípidos y presión arterial) se asoció con el crecimiento del aneurisma(58).
Arteriopatía periférica
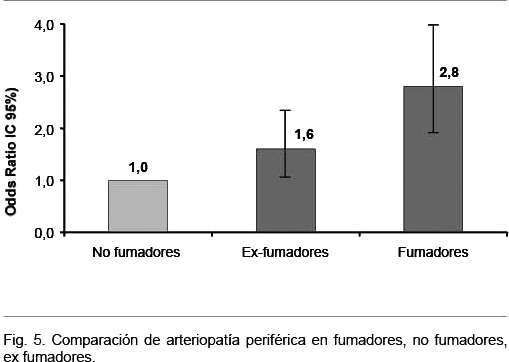
La arteriopatía periférica a menudo se manifiesta tardíamente, cuando aparece claudicación intermitente. Esta enfermedad tiene al tabaquismo como el principal elemento de riesgo para su progresión, tal como mostró un estudio realizado en sujetos asintomáticos en 18 centros de atención primaria de Holanda. El riesgo de desarrollar claudicación intermitente se multiplica cuatro veces en relación a los no fumadores: OR 4,1 IC 95% 2,3 a 7,9), con un riesgo que aumenta a medida que aumenta la intensidad de tabaquismo(59) (Figura 5).
Los síntomas de enfermedad vascular periférica ocurren una década antes en los fumadores que en los no fumadores, existiendo el doble de amputaciones de miembros inferiores en fumadores en relación a los no fumadores(60). La mortalidad a 5 años de los pacientes con arteriopatía periférica que siguen fumando es de 40% a 50%(61). El riesgo de enfermedad vascular periférica de los fumadores es mayor que el riesgo de desarrollar enfermedad coronaria a 5 años (3,9% versus 1,7%)(62).
Un metaanálisis mostró que el tabaquismo aumenta la posibilidad de falla del bypass arterial de miembros inferiores (OR 3,09; IC 95% 2,34 a 4,08), existiendo una clara relación dosis-respuesta. La cesación de tabaquismo, aun después de la cirugía, hace que el porcentaje de permeabilidad vascular mejore hasta llegar a ser como el de los no fumadores(63). El tabaquismo además aumenta la mortalidad postoperatoria luego de cirugía vascular a nivel carotideo, de reparación de aneurisma aórtico y de bypass de miembros inferiores(64).
EFECTOS DEL HUMO DE SEGUNDA MANO
Desde hace más de 20 se comenzó a acumular evidencia acerca de los efectos del HSM sobre el sistema cardiovascular, y actualmente se conoce que los mismos son casi tan importantes como los que afectan al fumador(65). Los efectos deletéreos del HSM se transmiten a través de micropartículas que transportan los más de 5.000
componentes tóxicos del humo de cigarrillo, menores de 2,5 micras (PM2,5), las que dado su pequeño tamaño1 al ser inhaladas penetran profundamente en los
pulmones, llegando a los aproximadamente 200 m2 de tejido alveolar(66).
El HSM tiene una corriente central de humo y otra lateral; esta última emerge del extremo del cigarrillo y constituye el 85% del total, mientras que la central, que ha sido inhalada y exhalada por el fumador, es responsable del 15% restante. La concentración de las numerosas toxinas aumenta hasta 100 veces en la corriente lateral con respecto a la central, lo que se debería a la mayor concentración de PM2,5 en la corriente lateral(66).
El impacto del HSM a nivel de aparato cardiovascular se produce a través de una serie de mecanismos, los que se presentan en la Tabla III.
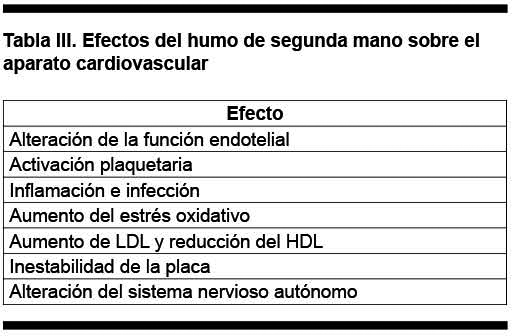
Alteración de la función endotelial
El HSM altera la función endotelial lo que se evidencia al cabo de 15-30 minutos y se produce por su efecto sobre la vasodilatación endotelio-dependiente(67,68). La exposición de 30 minutos al HSM (como la que ocurría en un bar antes de la prohibición de fumar), deteriora la vasodilatación endotelio–dependiente en los no fumadores al igual que ocurre en los fumadores(65). La exposición por 20 minutos al HSM además se asocia con aumento del nivel circulante de las carcasas de células endoteliales, un indicador de daño(69). Estudios experimentales muestran que la exposición al HSM hace que las células tengan vacuolas anormales y grupos de microtúbulos dañados. Además hay disrupción de los complejos de unión entre células adyacentes y elevación de la superficie de las células endoteliales, lo cual lleva a aumento de la permeabilidad vascular y la ateroesclerosis.
Además de causar daño endotelial, el tabaquismo pasivo altera el sistema de reparación del mismo, lo que incrementa la patología arterial(70).
Cuando termina la exposición de largo tiempo al HSM la dilatación endotelio-dependiente mejora, observándose mejoría al año, la que se incremente a los dos años, a pesar de lo cual persiste un deterioro en relación a la que presentan quienes no estuvieron expuestos(71).
Activación plaquetaria
La exposición al HSM activa las plaquetas aumentando la probabilidad de formación de trombos(72). Estas plaquetas activadas pueden, además, dañar el endotelio coronario y facilitar el desarrollo y progresión de las lesiones aterosecleróticas(73-74).
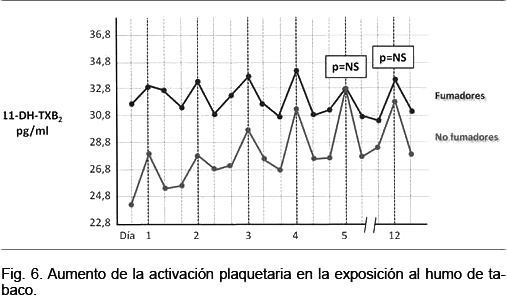
La activación plaquetaria medida a partir de la concentración de tromboxano está aumentada en los fumadores pasivos, llegando a alcanzar los niveles observados en los fumadores(75). En una investigación, individuos sanos fumadores y sanos no fumadores fueron expuestos al humo de tabaco durante 60 minutos, en una habitación de 18 m2 durante 5 días consecutivos y una vez más el día 12 (Figura 6).
Antes de la exposición los niveles de tromboxano (11-DH-TXB2) fueron más elevados en fumadores que en no fumadores; luego de estar expuestos 60 minutos al HSM, el aumento de la activación fue mayor entre los no fumadores que en los fumadores. Al cabo de 5 días de exposición, y a los 12 días, la activación plaquetaria observada fue similar en fumadores y no fumadores, es decir que la exposición repetida de los no fumadores a HSM hace que sus plaquetas tengan un nivel de activación similar al de los fumadores.
El aumento de la activación plaquetaria se asocia con mayor riesgo de enfermedad coronaria(76).
Inflamación, oxidación, lípidos
Como vimos antes, la inflamación tiene un rol central en la patogénesis de la aterosclerosis(19), siendo la misma un precursor de la placa aterosclerótica(77). Los adultos y niños expuestos al HSM tienen niveles elevados de marcadores inflamatorios (leucocitos, proteína C-reactiva, homocisteina y fibrinógeno)(78,79). La exposición al HSM produce estrés oxidativo(80) porque, además de los oxidantes contenidos en el humo de cigarrillo, también estimula la liberación de radicales libres a partir de los neutrófilos activados. Mientras que los fumadores parecen adaptarse a este estrés, lo que se traduce en niveles elevados de enzimas antioxidantes(81), en los no fumadores esta adapatación no existiría, por lo que el HSM daña el mecanismo antioxidante(82). En presencia de radicales libres y estrés oxidativo aumentado, el LDL se convierte a LDL oxidado, lo que determina multitud de efectos en la pared arterial. A nivel experimental, aun breves exposiciones al HSM aumentan significativamente la acumulación de lípidos en la pared arteria-l(83). La aceleración en el desarrollo de la aterosclerosis no sólo obedece a la alteración del LDL, sino que también es favorecida por el descenso del HDL(84). Este descenso del HDL ocurre tanto ante la exposición crónica al HSM como luego de la exposición aguda(85).
Inestabilidad de la placa
Los fumadores pasivos tienen mayor cantidad de lesiones coronarias que quienes no lo son; un estudio chino realizado en esposas de fumadores encontró mayor número de lesiones coronarias a mayor cantidad de años fumados por los esposos(86).
El HSM aumenta la secreción de metaloproteinasas por parte de las células endoteliales y del músculo liso. Estas enzimas degradantes contribuyen a debilitar la pared arterial, lo que puede llevar a la desestabilización y la ruptura de las placas ateroescleróticas(87,88).
Impacto sobre el sistema nervioso autónomo
El tabaquismo pasivo estimula la actividad nerviosa simpática e inhibe los aferentes vagales al corazón(89), lo que se comprobó analizando de la variabilidad de la frecuencia cardíaca, la cual brinda información acerca de la propensión a desarrollar arritmias malignas y muerte cardiovascular. La exposición al HSM reduce la variabilidad de la frecuencia cardíaca, lo que se comprobó al exponer a no fumadores al área de fumadores de un aeropuerto(90). Dos horas de exposición la HSM redujeron 12% la variabilidad de la frecuencia cardíaca, algo asociado a aumento de la fibrilación y la taquicardia ventricular después de un IAM o en la insuficiencia cardíaca. En las dos horas siguientes a la exposición al HSM la variabilidad volvió a sus niveles basales. La reducción en la variabilidad es probable que esté mediada por las PM2,5 que determinan reducción del input parasimpático al corazón promoviendo arritmias fatales(91).
EFECTOS CLÍNICOS DEL HUMO DE SEGUNDA MANO
El HSM aumenta la rigidez arterial antes de que se produzcan manifestaciones clínicas(92); pero si se mantiene la exposición, al aumento de la rigidez se asocia aumento de la presión arterial sistólica(93).
Enfermedad coronaria
La exposición al HSM aumenta el riesgo de enfermedad coronaria; una investigación realizada durante 20 años mostró que el tabaquismo pasivo aumenta el riesgo de enfermedad coronaria en 45% (IC 95% 10-200%), pero este aumento, dependiendo del nivel de exposición al HSM puede llegar hasta el 57% (IC 95% 8-228%)(94). De acuerdo a un metaanálisis que incluyó a los 29 estudios epidemiológicos válidos, mostró que no fumadores expuestos al HSM tienen un aumento de la enfermedad coronaria de 31% (IC 95 21-41)(65).
ACV
Se ha encontrado asociación entre la exposición al HSM y el riesgo de ACV: OR 1,82, IC 95% 1,34-2,49) luego de ajustar por factores confundentes(95).
Un estudio llevado a cabo en 19.000 no fumadores de EEUU seguidos durante 12 años mostró aumento del ACV entre las mujeres: OR 1,24 (IC 95% 1,03 a 1,40)(96).
Efectos agudos
Estudios observacionales de Oceanía y Argentina sugirieron que el HSM aumentaba la incidencia de IAM entre los expuestos(97,98).
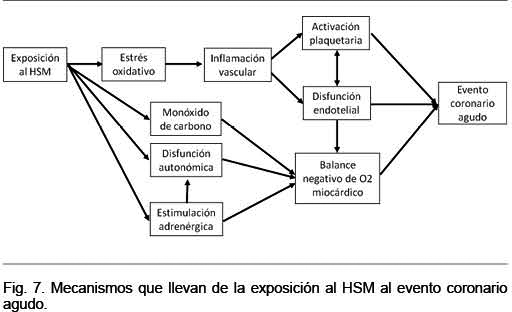
Como vimos la exposición al HSM determina estrés oxidativo, estimulación adrenérgica, disfunción autonómica y aumento de la concentración de monóxido de carbono. Todo ello puede desencadenar el IAM de acuerdo al proceso que se ilustra en la Figura 7(99).
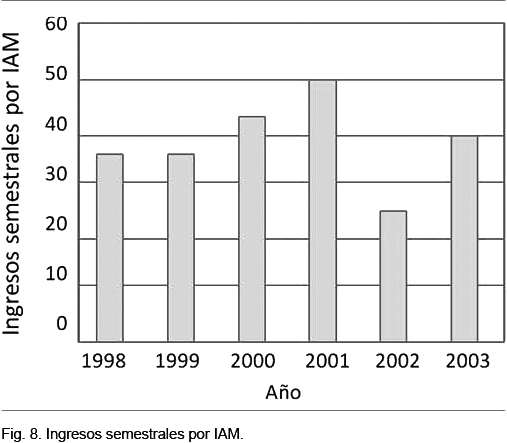
Una observación realizada en la ciudad de Helena (Montana, EE.UU.) planteó la hipótesis que la prohibición de fumar en espacios cerrados se asociaba a la reducción de los IAM. En el único hospital de esta ciudad se observó, que en los 6 meses que siguieron a la entrada en vigor de la ordenanza, en junio de 2002, se redujeron los ingresos por IAM (Figura 8). En diciembre de 2002 la prohibición de fumar fue levantada, y en los 6 meses siguientes los ingresos volvieron a aumentar.
Luego de este estudio se realizaron diversas investigaciones similares en diferentes partes del mundo, y un metaanálisis de todas ellos mostró reducción del IAM luego de la prohibición de fumar en espacios cerrados(100), algo que también comprobamos en nuestro país(101).
El HSM también hace al miocardio más susceptible de desarrollar aumentar el tamaño de la necrosis, observándose en estudios experimentales que, a mayor exposición, el tamaño del IAM podrá ser hasta dos veces mayor que en los no expuestos(102).
CONCLUSIÓN
El consumo de tabaco es la principal causa evitable de muerte y enfermedad a escala mundial. Su consumo favorece el desarrollo de la ateroesclerosis y altera la provisión de oxígeno a los tejidos, lo que se traduce en aumento de angina de pecho, IAM, muerte súbita, ACV, aneurisma de aorta abdominal y arteriopatía.
El tabaquismo pasivo se asocia a riesgo aumentado de enfermedad coronaria, de ACV y de IAM, evento este que puede desencadenarse con una exposición de tan solo 30 minutos al HSM.
El Convenio Marco de Control del Tabaco de OMS es la herramienta que se dio la comunidad internacional para enfrentar la epidemia de tabaquismo, hallándose en diferentes grados de implementación en todo el mundo, con Uruguay ocupando una posición de liderazgo.
Paralelamente a los esfuerzos desde la salud pública, es necesario que los profesionales sanitarios ayuden a sus pacientes fumadores a controlar su adicción al cigarrillo, para lo cual deben perfeccionar sus competencias(103). El manejo del tabaquismo, al igual de lo que sucede con todas las afecciones crónicas, depende de manejar técnicas de comunicación, de negociación y de modificación de la conducta, más que del conocimiento científico. El apoyo brindado en cada consulta, junto a la concurrencia a clínicas especializadas en cesación de tabaquismo, hacen que muchos de nuestros pacientes puedan librarse de la adicción al tabaco, el único producto de consumo humano que mata al 50% de sus consumidores.
Bibliografía
1. Beaglehole R, Bonita R, Horton R, Adams C, Alleyne G, Asaria P et al. Priority actions for the non-communicable disease crisis. Lancet 2011 Published Online April 6, 2011 DOI:10.1016/S0140-6736(11)60393-0
2. Declaración de Punta del Este sobre la aplicación del Convenio Marco de la OMS para el Control del Tabaco. Disponible en http:// www.msp.gub.uy/uc_4649_1.html. Accedida el 21/03/2011
3. Lightwood JM, Glantz SA. Short-term economic and health benefits of smoking cessation: myocardial infarction and stroke. Circulation 1997;96:1089–96
4. Sims M, Maxwell R, Bauld L, Gilmore A. Short term impact of smoke-free legislation in England: retrospective analysis of hospital admissions for myocardial infarction. Br Med J 2010;340: c2161.
5. Unal B, Critchley JA, Capewell S. Explaining the Decline in Coronary Heart Disease Mortality in England and Wales Between 1981 and 2000. Circulation 2004;109:1101-07
6. U.S. Department of Health and Human Services. The Health Consequences of Smoking: A Report of the Surgeon General. Atlanta, GA: U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Center for Chronic Disease Prevention and Health Promotion, Office on Smoking and Health, 2004
7. Barua RS, Ambrose JA, Eales-Reynolds LJ, DeVoe MC, Saha DC. Dysfunctional Endothelial Nitric Oxide Biosynthesis in Healthy Smokers With Impaired Endothelium-Dependent Vasodilatation. Circulation 2001; 104:1905-10
8. Robin J, Kharbanda R, Mclean P, Campbell R, Vallance P. Protease-Activated Receptor 2–Mediated Vasodilatation in Humans In Vivo: Role of Nitric Oxide and Prostanoids. Circulation 2003;107:954-95
9. Campisi R, Czernin J, Schoder H, Sayre JW, Schelbert HR. L-arginine normalizes coronary vasomotion in long-term smokers. Circulation 1999;99:491-7
10. Celermajer DS, Sorensen KE. Cigarette smoking is associated with dose-related and poten-tially reversible impairment of endothelium-dependent dilation in healthy young adults. Circu-lation 1993;88:2149-55
11. Miller GJ, Bauer KA, Cooper JA, Rosenberg RD. Acti-vation of the coagulant pathway in cigarette smok-ers. Thrombosis and Haemostasis 1998;79:549-53
12. Lavi S, Prasad A, Lerman A. Smoking Is Associated With Epicardial Coronary Endothelial Dysfunction and Elevated White Blood Cell Count in Patients With Chest Pain and Early Coronary Artery Disease. Circulation. 2007;115:2621-7
13. Spagnoli LG, Mauriello A, Palmieri G, Taurino M. Relationships between risk factors and morphological patterns of human ca-rotid atherosclerotic plaques: a multivariate dis-criminant analysis. Atherosclerosis 1994;108:39-60
14. Burke AP, Virmani R. Coronary risk factors and plaque mor-phology in men with coronary disease who died suddenly. New Engl J Med 1997; 336:1276-82
15. Lakier JB. Smoking and cardiovascular disease. Am J Med 1992;93(1A):8S-12S
16. Davis JW. Smoking-induced changes in endo-thelium and platelets are not affected by hydroxy-ethylrutosides. Br J Exp Path 1986;67:765-71
17. Hung J. Cigarette smoking acutely increases platelet thrombus forma-tion in patients with coronary disease taking aspirin. Circulation 1995;92:2432-6
18. Newby DE, McLeod AL, Uren AG, Flint L, Ludlam CA, Webb DJ et al. Impaired coro-nary tissue plasminogen activator release is associ-ated with coronary atherosclerosis and cigarette smoking: direct link between endothelial dysfunc-tion and atherothrombosis. Circulation 2001;103: 1936-41
19. Ros R. Atherosclerosis-an inflammatory disease. N Engl J Med 1999;340:115-26
20. Zeiher AM. Long-term Cigarette Smoking Impairs Endothelium-Dependent Coronary Arterial Vasodilator Function. Circulation 1995;92:1094-100
21. Stewart RA, Heritier SR, Simes RJ, Nestel PJ, West MJ, Colquhoun DM et al. Long-Term Intervention With Pravastatin in Ischemic Disease (LIPID) Study Investigators. White blood cell count predicts reduction in coronary heart disease mortality with pravastatin. Circulation 2005;111:1756-62
22. Lehr HA. Adhesion-promoting effects of cigarette smoke on leukocytes and endothelial cells. Ann New York Academy of Sciences 1993;686:112-9
23. Nieto FJ. Leukocyte count correlates in middle-aged adults: the Atherosclerosis Risk in Communities (ARIC) Study. Am J Epidemiol 1992;136: 525-37
24. Danesh J, Collins R, Appleby P, Peto R. Association of fibrinogen, C-reactive protein, albumin, or leuko-cyte count with coronary heart disease: meta--analysis of prospective studies. JAMA 1998;279:1477–82
25. Ridker PM. High-sensitivity C-reactive protein: poten-tial adjunct for global risk assessment in the primary prevention of cardiovascular disease. Circulation 2001;103:1813-8
26. Ridker PM, Cushman M, Stampfer MJ, Tracy RP, Hennekens CH. Inflammation, aspirin, and the risk of cardiovascular disease in apparently healthy men. N Engl J Med 1997;336: 973–9
27. Morrow JD, Frei B, Longmire AW, Gaziano JM, Lynch SM, Shyr Y, Strauss WE, Oates JA, Roberts LJ 2nd. Increase in Circulating Products of Lipid Peroxidation (F2-Isoprostanes) in Smokers — Smoking as a Cause of Oxidative Damage. N Engl J Med.1995;332:1198-1203
28. Oguogho A, Lupattelli G, Palumbo B, Sinzinger H. Isoprostanes quickly normalize after quitting ciga-rette smoking in healthy adults. VASA 2000;29:103–5
29. Heitzer T, Yla-Herttuala S, Luoma J, Kurz S, Munzel T, Just H, Olschewski M, Drexler H. Cigarette smok-ing potentiates endothelial dysfunction of forearm resistance vessels in patients with hypercholester-olemia: role of oxidized LDL. Circulation 1996; 93:1346–53
30. Srivastava R, Blackstone EH, Lauer MS. Association of smoking with abnormal exercise heart rate re-sponses and long-term prognosis in a healthy, popu-lation-based cohort. American Journal of Medicine 2000;109:20–6
31. Lauer MS, Francis GS, Okin PM, Pashkow FJ, Snader CE, Marwick TH. Impaired chronotropic response to exercise stress testing as a predictor of mortality. JAMA 1999;281:524–9
32. Quillen JE, Rossen JD, Oskarsson HJ, Minor RL Jr, Lopez AG, Winniford MD. Acute effect of cigarette smoking on the coronary circulation: constriction of epicardial and resistance vessels. J Amer Coll Cardiol 1993;22:642–7
33. Rampling MW. Clotting factors and rheology: mecha-nisms of damage and intervention. In: Poulter N, Sever P, Thom S, editors. Cardiovascular Disease: Risk Factors and Intervention. Oxford: Radcliffe Medical Press, 1993:201–13
34. Howard G, Wagenknecht LE, Burke GL, Diez-Roux A, Evans GW, McGovern P, Nieto FJ, Tell GS. Cigarette smoking and progression of atherosclerosis: the Atherosclerosis Risk in Communities (ARIC) Study. JAMA 1998;279:119-24
35. Zieske A. Smoking and atherosclerosis in youth. Atherosclerosis 1999;144:403-8
36. AD-Wong ND, Kouwabunpat D, Vo AN, Detrano RC, Eisenberg H, Goel M, Tobis JM. Coronary calcium and atherosclerosis by ultrafast computed tomog-raphy in asymptomatic men and women: relation to age and risk factors. Am Heart J 1994;127:422–30
37. Berenson GS, Srinivasan SR, Bao W, Newman WP 3rd. Association between mul-tiple cardiovascular risk factors and atherosclero-sis in children and young adults: the Bogalusa Heart Study. N Engl J Med1998;338:1650-6
38. Li H, Srinivasan RS, Berenson GS. Comparison of measures of pulsatile arterial function between asymptomatic younger adult smokers and former smokers: the Bogalusa Heart Study. Am J Hypertens. 2006;19:897-901
39. Mahmud A, Feely J. Effect of smoking on arterial stiffness and pulse pressure amplification. Hypertension. 2003;41:183-7
40. Binder S.Chronic smoking and its effect on arterial stiffness. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2008;152:299-302
41. Willett WC, Gree A, Stampfer MJ, Speizer FE, Colditz GA, Rosner B, Monson RR, Staton W, Henneekens CH. Relative and absolute excess risks of coronary heart disease among women who smoke cigarettes. N Engl J Med 1987;317:1303-9
42. Waters D, Lespérance J, Gladstone P, Boccuzzi SJ,Cook T, Hudgin R, Krip G, Higginson L. Effects of cigarette smoking on the angiographic evolution of coronary atherosclerosis. A Canadian Coronary Atherosclerosis Intervention Trial (CCAIT) Substudy. CCAIT Study Group. Circulation. 1996;94:614-21
43. Burns DM. Epidemiology of smoking-induced cardiovascular disease. Prog Cardiovasc Dis 2003;46:11-29
44. Teo KK, Ounpuu S, Hawken S, Pandey MR, Valentin V, Hunt D,Diaz R,Rashed W, Freeman R, Jiang L, Zhang X, Yusuf S; INTERHEART Study Investigators. Tobacco use and risk of myocardial infarction in 52 countries in the INTERHEART study: a case-control study. Lancet 2006;368:647-58
45. Lanas F, Avezum A, Yusuf S; INTERHEART Investigators in Latin America. Risk factors for acute myocardial infarction in Latin America: the INTERHEART Latin American study. Circulation 2007;115:1067-74
46. Wannamethee G, Shaper AG, Macfarlane PW. Risk factors for sudden cardiac death in middle-aged British men. Circulation 1995;91:1749-56
47. Hasdai D, Garratt KN, Grill DE, Lerman A, Holmes DR Jr. Effect of Smoking Status on the Long-Term Outcome after Successful Percutaneous Coronary Revascularization. N Engl J Med 1997;336:755-61
48. Shinton R, Beevers G. Meta-analysis of relation be-tween cigarette smoking and stroke. BMJ 1989;298:789–94
49. Hart CL, Hole DJ. Risk factors and 20-year stroke mortality in men and women in the Renfrew/Paisley study in Scotland. Stroke 1999;30:1999-2007
50. Goldstein LB, Adams R, Alberts MJ, Appel LJ, et al. Primary prevention of ischemic stroke: a guideline from the American Heart Association/American Stroke Association Stroke Council. Stroke 2006;37:1583-1633
51. Neaton JD, Wentworth DN, Cutler J, Stamler J, Kuller L. Risk factors for death from different types of stroke: Multiple Risk Factor Intervention Trial Re-search Group. Annals of Epidemiology 1993;3: 493–9
52. Howard G, Tell GS. Cigarette smoking and progression of atherosclerosis: The Atherosclerosis Risk in Communities (ARIC) Study. JAMA 1998 14;279:119-24
53. Colditz GA, Willett WC, Rosner B, Speizer FE, Hennekens CH. Cigarette smoking and risk of stroke in middle-aged women. N Engl J Med 1988;318:937-41
54. Kurth T, Kase CS, Berger K, Gaziano JM, Cook NR, Buring JE. Smoking and risk of hemorrhagic stroke in women. Stroke 2003;34:2792-5
55. Lederle FA. Smokers’ relative risk for aortic aneurysm compared with other smoking-related diseases: a systematic review. J Vasc Surg 2003;38:329-34
56. Vardulaki KA. Quantifying the risks of hypertension, age, sex and smoking in patients with abdominal aortic aneurysm. Br J Surg 2000;87:195-200
57. Witteman JC. Cigarette smoking and the development and progression of aortic atherosclerosis. A 9-year population-based follow-up study in women. Circulation 1993;88:2156-62
58. Brady AR, UK Small Aneurysm Trial Participants. Circulation 2004;110:16-21
59. Hooi JD et al. Risk factors and cardiovascular diseases associated with asymptomatic peripheral arterial occlusive disease. The Limburg PAOD Study. Peripheral Arterial Occlusive Disease. Scand J Prim Health Care 1998;16:177-82
60. Bendermacher BL, Willigendael EM, Teijink JA. Medical management of peripheral arterial disease. J Thromb Haemost 2005;3:1628-37
61. Kannel WB, Shurtleff D. The Framingham Study. Cigarettes and the development of intermittent claudication. Geriatrics 1973;28:61-8
62. Price JF, Mowbray PI. Relationship between smoking and cardiovascular risk factors in the development of peripheral arterial disease and coronary artery disease: Edinburgh Artery Study. Eur Heart J 1999;20:344-53
63. Willigendael EM, Teijink JA, Bartelink MLPrins MH. Smoking and the patency of lower extremity bypass grafts: a meta-analysis. J Vasc Surg 2005;42:67-74
64. Kazmers A. Late survival after vascular surgery. J Surg Res 2002;105:109-14
65. Barnoya J, Glantz S. Cardiovascular Effects of Secondhand Smoke. Circulation 2005;111;2684-98
66. Kritz H, Schmid P, Sinzinger H. Passive smoking and cardiovascular risk. Arch Intern Med 1995;155:1942–8
67. Glantz S, Parmley W. Even a little secondhand smoke is dangerous. JAMA 2001;286:462–3
68. Kato M, Roberts-Thomson P, Phillips BG, Narkiewicz K, Haynes WG et al. The effects of short-term passive smoke exposure on endothelium-dependent and independent vasodilation. J Hypertens 1999;17:1395–1401
69. Wells AJ. Passive smoking as a cause of heart disease. J Am Coll Cardiol 1994;24:546 –54
70. Lee TY, Gotlieb AI. Microfilaments and microtubules maintain endotelial integrity. Microsc Res Tech 2003;60:115–27
71. Raitakari OT, Adams MR, McCredie RJ, Griffiths KA, Celermajer DS. Arterial endothelial dysfunction related to passive smoking is potentially reversible in healthy young adults. Ann Intern Med 1999;130:578 –81
72. Pittilo RM, Mackie IJ, Rowles PM, Machine SJ, Woolf N. Effects of cigarette smoking on the ultrastructure of rat thoracic aorta and its ability to produce prostacyclin. Thromb Haemost 1982;48:173–6
73. Steinberg D, Parthasarathy S, Carew TE, Khoo JC, Witztum JL. Beyond cholesterol: modifications of low-density lipoprotein that increase its atherogenicity. New Engl J Med 1989;320:915–24
74. Davis JW, Shelton L, Watanabe IS, Arnold J. Passive smoking affects endothelium and platelets. Arch Int Med 1989;149:386–9
75. Schmid P, Karanikas G, Kritz H, Pirich C, Stamatopoulos Y, Peskar B et al. Passive smoking and platelet thromboxane. Thromb Res 1996;81:451–60
76. Elwood PC, Renaud S, Sharp DS, Beswick AD, O’Brien JR, Yarnell JWG. Ischemic heart disease and platelet aggregation: the Caerphilly Collaborative Heart Disease Study. Circulation 1991;83:38–44
77. Shima M, Adachi M. Effects of environmental tobacco smoke on serum levels of acute phase proteins in schoolchildren. Prev Med 1996;25:617–24
78. Nakata A, Tanigawa T, Araki S, Sakurai S, Iso H. Lymphocyte subpopulations among passive smokers. JAMA 2004;291:1699–700
79. Panagiotakos DB, Pitsavos C, Chrysohoou C, Skoumas J, Masoura C, Toutouzas P, Stefanadis C. Effect of exposure to secondhand smoke on markers of inflammation: the ATTICA Study. Am J Med 2004;116:145–50
80. Visioli F, Galli C, Plasmati E, Viappiani S, Hernandez A, Colombo C, Sala A. Olive phenol hydroxytyrosol prevents passive smoking-induced oxidative stress. Circulation 2000;102:2169–71
81. McCusker K, Hoidal J. Selective increase of antioxidant enzyme activity in the alveolar macrophages from cigarette smokers and smoke-exposed hamsters. Am Rev Respir Dis 1990;141:678–82
82. Otsuka R, Watanabe H, Hirata K, Tokai K, Muro T, Yoshiyama M, Takeuchi K, Yoshikawa J. Acute effects of passive smoking on the coronary circulation in healthy young adults. JAMA 2001;286:436–41
83. Roberts KA, Rezai AA, Pinkerton KE, Rutledge JC. Effect of environmental tobacco smoke on LDL accumulation in the artery wall. Circulation 1996;94:2248–53
84. Mizoue T, Ueda R, Hino Y, Yoshimura T. Workplace exposure to environmental tobacco smoke and high density lipoprotein colesterol among nonsmokers. Am J Epidemiol 1999;150:1068–72
85. Moffatt RJ, Chelland SA, Pecott DL, Stamford BA. Acute exposure to environmental tobacco smoke reduces HDL-C and HDL2-C. Prev Med 2004;38:637-41
86. He Y, Lam T, Li LS, Du R, Jia G, Huang J, Zheng J. The number of stenotic coronary arteries is associated with the amount of passive smoking exposure. Atherosclerosis 1996;127:229–38
87. Szmitko PE, Wang C-H, Weisel RD, de Almeida JR, Anderson TJ, Verma S. New markers of inflammation and endothelial cell activation: part I. Circulation 2003;108:1917–23
88. Galis ZS, Khatri JJ. Matrix metalloproteinases in vascular remodeling and atherogenesis: the good, the bad, and the ugly. Circ Res 2002;90:251–62
89. Hausberg M, Mark AL, Winniford MD, Brown RE, Somers VK. Sympathetic and vascular effects of short-term passive smoke exposure in healthy nonsmokers. Circulation 1997;96:282–7
90. Pope CA, Eatough DJ, Gold DR, Pang Y, Nielsen KR, Nath P et al. Acute exposure to environmental tobacco smoke and heart rate variability. Environ Health Perspect 2001;109:711–6
91. Brook RD, Franklin B, Cascio W, Hong Y, Howard G, Lipsett M et al. Air pollution and cardiovascular disease: a statement for healthcare professionals from the Expert Panel on Population and Prevention Science of the American Heart Association. Circulation 2004;109:2655–71
92. Mack WJ, Islam T, Lee Z, Selzer RH, Hodis HN. Environmental tobacco smoke and carotid arterial stiffness. Prev Med 2003;37:148–54
93. Mahmud A, Feely J. Effects of passive smoking on blood pressure and aortic pressure waveform in healthy young adults: influence of gender. Br J Clin Pharmacol 2004;57:37– 43
94. Whincup PH, Gilg JA, Emberson JR, Jarvis MJ, Feyerabend C, Bryant A et al. Passive smoking and risk of coronary heart disease and stroke: prospective study with cotinine measurement. BMJ 2004;329:200–5
95. Bonita R, Duncan J, Truelsen T, Jackson RT, Beaglehole R. Passive smoking as well as active smoking increases the risk of acute stroke. Tobacco Control 1999;8:156–60
96. Sandler DP, Comstock GW, Helsing KJ, Shore DL. Deaths from all causes in non-smokers who lived with smokers. Am J Public Health 1989;79:163–7
97. McElduff P, Dobson AJ, Jackson R, Beaglehole R, Heller RF, Lay-Yee R. Coronary events and exposure to environmental tobacco smoke: a case–control study from Australia & New Zealand. Tob Control 1998;7:41–6
98. Ciruzzi M, Pramparo P, Esteban O, Rozlosnik J, Tartaglione J, Abecasis B et al. Case–control study of passive smoking at home and risk of acute myocardial infarction. Argentine FRICAS. J Am Coll Cardiol 1998;31:797–803
99. Raupach T, Schafer K, Stavros K, Andreas S. Secondhand smoke as an acute threat for the cardiovascular system: a change in paradigm. Eur Heart J 2006:27,386–92
100. Lightwood J, Glantz S. Declines in Acute Myocardial Infarction After Smoke-Free Laws and Individual Risk Attributable to Secondhand Smoke. Circulation 2009;120:1373-9
101. Sandoya E, Sebrié E, Bianco E, Araújo O, Correa A, Davyt O et al. Impacto de la prohibición de fumar en espacios cerrados sobre los ingresos por infarto agudo de miocardio en Uruguay. Rev Med Urug 2010;26:206-15
102. Zhu BQ, Sun YP, Sievers RE, Glantz SA, Parmley WW, Wolfe CL. Exposure to environmental tobacco smoke increases myocardial infarct size in rats. Circulation 1994;89:1282–90
103. Natero V, Araújo O, Aguayo R, Díaz Arnesto O, Sandoya E en nombre de los redactores de la guía de prevención cardiovascular. Guía Práctica de Prevención Cardiovascular. Rev Urug Cardiol 2009;24:43-83.
1 Nótese que el diámetro de un cabello es de unas 60 micras, siendo las partículas del humo de tabaco menores de 2,5 micras.