Services on Demand
Journal
Article
Related links
Share
Archivos de Medicina Interna
Print version ISSN 0250-3816On-line version ISSN 1688-423X
Arch. Med Int vol.32 no.2-3 Montevideo June 2010
Consenso
Convergencias, divergencias, variabilidad, puntos de corte e indicación de la glucemia de ayuno, la hemoglobina glucosilada e insulinemia
Convergences, divergences, variability, cutting points and indication of fasting blood sugar levels, glycosilated hemoglobin and insulinemia
Sociedad de Diabetología y Nutrición del Uruguay
Coordinadores:
Dra. Raquel Traverso (Uru)
Dr. Gustavo Frechtel (Arg)
Dra. Laura Coppes
Dra. Isabel Costa
Dra. Cristina Ferrand
Dr. Juan José Fraschini
Dra. Patricia Gaione
Dra. Virginia García
Dr. Gerardo Javiel
Dra. Ana María Jorge
Dra. Cecilia Pachiotti
Dra. Andrea Peloche
Dr. Enzo Pereyra
Dra. Maria José Ruffinatti
Dra. Raquel Traverso
Dr. Victor Commendatore
Dra. Norma Ferrari
Dr. Gustavo Frechtel
Dra. María Amelia Linari
Dra. María del Carmen Maselli
Dr. Héctor Mazzei
Dra. Carla Musso
Dr. Félix M. Puchulu
Dr. Oscar Rebolledo
Dr. Martín Rodríguez
Dr. Nelson Rodríguez Pappini
Dra. Martha Sereday
Dra. Mercedes Traversa
Dra. Raquel Urdaneta
Palabras Clave: Diabetes tipo 2, Glicemia de ayuno, Hemoglobina glucosilada, Insulinemia.
Keywords: Type 2 diabetes, Fasting blood sugar levels, Glycosilated hemoglobin, Insulinemia.
Introducción
Se realizaron desde entonces 4 encuentros donde se discutieron y consensuaron los siguientes temas, que posteriormente serian publicados:
- 1980 Clasificación y diagnostico de la diabetes Mellitus
- 1983 Normas de seguimiento en el paciente diabético. Coordinado por Dr. Saúl Senderey en la ciudad de Chascomus.
- 1985 Educación del paciente diabético y su familia. Coordinado por Dr. Juan Jose Glagliardino en la ciudad de Colonia. Culminando en 1986 en la ciudad de La Plata
- 1988 Atención primaria en diabetes. Coordinado por los Drs. Roberto Estrade y Saúl Senderey, en Colonia.
Es así que con el espíritu de retomar estas instancias de discusión e intercambio científico y de estrechar lazos de fraternidad, integrantes de la Sociedad Argentina de Diabetes y de la Sociedad de Diabetologia y Nutrición del Uruguay realizamos este año las 5 Jornadas Rioplatenses en la ciudad de Colonia. El tema elegido en esta oportunidad fue: “Convergencias, divergencias, variabilidad, puntos de corte e indicación de la glucemia de ayuno, la hemoglobina glicosilada e insulinemia”.
Ya que estos temas han generado gran debate a nivel mundial y que han salido nuevas recomendaciones internacionales al respecto, es que sentimos la necesidad de tomar una posición, basada en evidencia científica y que pueda ser adaptada a la realidad de nuestros países. Con el objetivo de difundir un documento que sea de utilidad para médicos generalistas y especialistas en su práctica clínica y autoridades nacionales en el campo de la Salud Pública
Ambas Sociedades reconocen la dificultad de establecer recomendaciones sobre variables implicadas en forma directa en el diagnóstico y control de una patología como la diabetes, cuyas alteraciones metabólicas se producen en una forma continua. De todas maneras reconocemos la importancia de establecer en forma consensuada estas recomendaciones a modo de referencia, que deberán ser aplicadas en forma individual teniendo en cuenta el contexto clínico de cada paciente.
Después de 22 años de interrupción de las Jornadas Rioplatenses de Diabetes, esperamos que este reencuentro en la ciudad de Colonia, sirva como punto de comienzo para que estas reuniones tengan continuidad en el futuro.
Agradecemos especialmente a los laboratorios patrocinantes de ambos países, ya que sin su apoyo estas jornadas no hubieran sido posibles.
OBJETIVOS
Se confeccionará un documento que servirá para establecer recomendaciones sobre el uso y la prescripción en los pacientes. El mencionado podrá ser utilizado por entidades gubernamentales (nacionales, provinciales, regionales), sistemas, organizaciones de salud, etc.
METODOLOGÍA
FUNCIONES
Función de los Coordinadores Generales
Organizarán la distribución de los grupos y entregarán las normativas a los responsables de cada grupo.
Junto con los coordinadores de cada mesa elaborarán la escritura final de las recomendaciones en acuerdo con el resto de los concurrentes a las jornadas.
Serán los responsables de la publicación de la guías y de su difusión en cada uno de los correspondientes países.
Función de los Coordinadores de grupo
Acordar la metodología y funcionamiento de cada mesa junto a su par del país vecino; comunicárselo luego a los integrantes de la mesa que conducirán. Ocuparse que todos los integrantes tengan la información o el acceso a la información necesaria. Coordinar el intercambio de opiniones y discusiones. Elaborar el material para una puesta en común o presentación plenaria el segundo día de la jornada. Presentar un resumen de las conclusiones luego de la jornada a los coordinadores generales.
Función de los integrantes de los grupos
Una vez obtenida la bibliografía, analizar la misma, incluir otras fuentes de información si lo consideran necesario. Participar de las discusiones e intercambio de datos con el fin de ayudar al responsable de cada grupo a elaborar el documento perteneciente al tema de discusión. Posteriormente participar hacia el final del evento en la discusión general en reunión plenaria.
INTEGRANTES
Módulo 1: Glucemia en ayunas, categorías de alto riesgo y diagnóstico de diabetes.
Coordinadores: Dra. Martha Sereday y Andrea Peloche.
Integrantes: Dres. Gustavo Frechtel, Víctor Commendatore, Nelson Rodriguez Pappini, LauraCoppes, Enzo Pereira, Ma. José Ruffinatti, Juan José Fraschini.
Módulo 2: Hemoglobina glucosilada A1c.
Coordinadores: Dra. Mercedes Traversa y Virginia García.
Integrantes: Dres. Dres. Patricia Gaione, Gerardo Javiel, Isabel Costa, Raquel Traverso, Norma Ferrari, Raquel Urdaneta, Héctor Mazzei, Félix M. Puchulu, Oscar Rebolledo
Módulo 3: Insulinemia.
Coordinador: Dr. Martín Rodríguez.
Integrantes Dres.: Carla Musso, María del Carmen Maselli, Alicia García, María Amelia Linari, Rosario Bueno, Cristina Ferrand, Cecilia Pacchiotti, Ana María Jorge.
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Módulo 1: Glucemia en ayunas, categorías de alto riesgo y diagnóstico de diabetes
Coordinadoras:
Dras. Martha Sereday y Andrea Peloche
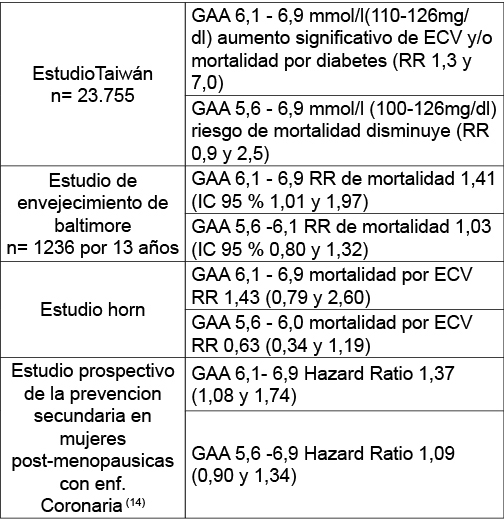
a. Cambio en la prevalencia atribuible a una eventual reducción del punto de corte para GAA de 110 a 100 mg/dl (6,1 a 5,6 mmol/l).
b. Riesgo Relativo de los desenlaces con-siderados relevantes para la categoría 100-110 mg/dl (5,6-6,1 mmol/l)j respecto de valores inferiores a 100 mg/dl (5,6 mmol/l).
c. Riesgo Atribuible para cada desenlace, considerado como la diferencia entre el riesgo absoluto de evento en personas expuestas a glucemias de ayunas ubi-cadas entre 100 y 110 (5,6 y 6,1 mmol/l), respecto de los valores inferiores a tal categoría. Estos valores se contrastaron con los obtenidos en diversos estudios para la categoría glucemia de ayunas > 110 mg/dl (> 6,1 mmol/l).
Definiciones y criterios diagnósticos de diabetes
En la GAA se verifica una progresiva disminución de la sensibilidad hepática a la insulina, una disfunción y una disminución de la masa de células beta. Aunque estos mecanismos aparecen
Las dificultades para determinar un punto de corte radican en que la glucemia es una variable continua sin un umbral franco de alteración.
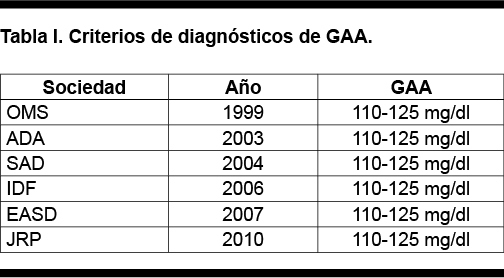
En 1999, el comité de expertos de la ADA introdujo una nueva categoría denominada glucemia de ayuno alterada (GAA) (Tabla I), con valores de glucosa en plasma venoso ≥ a 110mg/dl, basándose en el nivel donde se pierde la primera fase de secreción de insulina en respuesta a glucosa intravenosa y se asocia con el aumento del riesgo de desarrollar diabetes y sus complicaciones micro y macrovasculares. (7)
La GAA no debe ser considerada como una entidad clínica sino como un factor de riesgo para diabetes, y para enfermedad cardiovascular. Además, si bien la diabetes es precedida por un estado de prediabetes, los individuos en esta situación clínica no siempre evolucionan a diabetes (solo 7-12%) (5,10).
Por este motivo nosotros aceptamos el término “categorías de alto riesgo para diabetes” como lo rectifica la ADA en junio 2009, publicado en enero 2010.
Pero en 2003 la ADA propuso descender el punto de corte de la glucemia en ayunas (GA) a 100 mg/dl porque consideró que ése es el valor a partir del cual se incrementa el riesgo de efectos adversos clínicos y metabólicos.
Este descenso del punto de corte para definir GAA se justificó para asegurar que la prevalencia de este trastorno fuera similar al de la Tolerancia alterada a la glucosa (TAG) y además estuvo basado en el análisis con curvas ROC de los estudios en Indios Pima, Mauritius, San Antonio y Hoorn que indica que un punto de corte de 97-99 mg/dl determinaba una mejor combinación de sensibilidad y especificidad para predecir DM en un período de 5 años (cercano a 100%).
Sin embargo existe una diferencia en la actual incidencia de DM con diferentes niveles de glucosa plasmática en ayunas.
¿Cómo se modifica la prevalencia de la glucemia de ayunas alterada (GAA) si se utiliza el criterio de ADA 2003? (100mg/dl)
La prevalencia de GAA se multiplicaría entre 3 y 4 veces con un aumento significativo de glucemias de ayuno alteradas provocando un gran impacto sobre los individuos y sobre los sistemas de salud, por el incremento de los costos (7).
Dinamarca pasaría de una prevalencia de 11,8 a 37,6%, India de 10,6 a 37,6%, Estados Unidos de 9,5 a 28,5%, Montevideo de 2,8 a 8,2%.
Por ello la OMS y la IDF consideraron que el punto de corte para glucemia en ayunas normal se debía mantener en ≤ 110 mg/dl. Esta decisión se basó en la falta de evidencia consistente y específica que bajar el punto de corte disminuya la progresión a DM, la mortalidad por dicha causa, la enfermedad cardiovascular (ECV) y las complicaciones microvasculares(7,8).
Las personas con GA debajo de 100, tienen un perfil de riesgo CV más favorable pero solamente la mitad del riesgo de desarrollar DM, comparados con aquellos por encima del valor de corte de la OMS(7).
La Asociación Europea para el Estudio de la diabetes (EASD), si bien considera el punto de corte de 110 mg/dl, plantean que se deben considerar 3 situaciones en las que se lo podría descender a 100 mg/dl (9):
a. la composición de género, dado que la prevalencia de diabetes y de GAA, es mayor en varones que en mujeres, siendo la prevalencia de TGA mayor en mujeres;
b. los individuos con elementos del síndrome metabólico;
c. pacientes con ECV.
Por lo todo lo expuesto, el Grupo de Expertos recomienda el punto de corte de glucemia de ayuno en 110 mg/dl, definiendo la Categoría de Alto Riesgo de Diabetes con glucemias entre 110 mg/dl a 125 mg/dl.
Bibliografía
1. Clinical Practice Recommendations Categories of increased risk for diabetes. Diabetes Care 2010; 33 Supplement 1:S 66-67.
2. Beth Dawson-Saunders, Robert G.Trapp Bioestadìstica Medica. Ed Manual Moderno 1993 Medición de la exactitud de procedimientos para diagnòstico pg 267 Curvas ROC pg 277.
3. Borthery AL et al The ROC curve in the evaluation of fasting capillary blood glucose as a screening test for diabetes and IGT Diabetes Care 2002;17: 1269-1272.
4. Canadian Diabetes Association 2008 Clinical Practice Guidelines for the Prevention and Management of Diabetes in
5. Diagnosis and Classification of Diabetes Mellitus American Diabetes Association S62 Diabetes Care, Volume 33, Supplement 1, January 2010.
6. National Evidence Based Guidelines for the Management´, Case Detection and Primary Prevention of Type 2 Diabetes Guideline for Type 2 Diabetes – Diabetes
7. World Health Organization. Screening for Type 2 Diabetes. Report of a World Health Organization and International Diabetes Federation meeting.WHO/NMH/MNC/03.1 Geneva: WHO Department of Noncommunicable Disease Management, 2003.
8. IDF Clinical Guidelines Task Force. Guía global para la diabetes tipo 2. Bruselas: Federación Internacional de Diabetes, 2006.
9. Guías de práctica clínica sobre diabetes, prediabetes y enfermedades cardiovasculares. Grupo de Trabajo sobre Diabetes y Enfermedades Cardiovasculares de la Sociedad Europea de Cardiología (ESC) y de la Sociedad Europea para el Estudio de la Diabetes (EASD) Rev Esp Cardiol. 2007;60(5):525.
10. Standards of Medical Care in Diabetes—2010 American Diabetes Association Diabetes Care, Volume 33, Supplement 1, January 2010 S11.
11. ACE/AACE Consensus Statemen Diagnosis and Management of Prediabetes in the Continuum of Hyperglycemia; ENDOCRINE PRACTICE Vol 14 No. 7 October 2008 933.
12. Faerch, K et al.PATHOFYSIOLOGY AND AETILOGY OF IMPAIRED fasting glycemia and impaires glucose tolerance: does it matter for prevention and treatment of type 2 diabetes? Diabetología, 2009; 52:1714-1723.
13. Gagliardino JJ, de Sereday M González C, Domínguez JM, Mazza CM, en representación de los integrantes del Comité de Expertos de la Sociedad Argentina de Diabetes (SAD) Consenso sobre Criterio Diagnóstico de la Glucemia de Ayunas Alterada,SAD Rev. Soc. Arg. de Diabetes. 2007:41(3);95-104
14. The threshold for diagnosing impaired fasting glucose: a position statement by the European Diabetes Epidemiology Group On behalf of EDEG, N. G. Forouhi1, B. Balkau2, K. Borch-Johnsen3, J. Dekker4, C. Glumer3, Q. Qiao5, A. Spijkerman4, R. Stolk6, A. Tabac7 and N. J. Wareham1 Received: 14 December 2005 Accepted: 16 December 2005 Published online: 9 March 2006. Google10.1007/s00125-006-0189-4.
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Módulo 2: Hemoglobina glucosilada A1c
Coordinadoras:
Dras. Mercedes Traversa y Virginia García
Variabilidad analítica
Métodos para la determinación de HbA1c
Con el objeto de establecer criterios relacionados con el informe de HbA1c en el ambiente clínico, la International Federation for Clinical Chemistry and Medicine Laboratory (IFCC) organizó una reunión con la Asociación Americana de Diabetes (ADA), la Asociación Europea par el Estudio de la Diabetes (EASD) y la Federación Internacional de Diabetes (IDF) que dio por resultado tres recomendaciones5 :
El sistema IFCC representa la única referencia válida para implementar la estandarización de la medición de HbA1c.
Con la finalidad de lograr una suave transición a las nuevas unidades SI, los resultados deben expresarse tanto en las unidades SI (mmol/mol) como en las unidades derivadas regionales o nacionales, utilizando la “ecuación maestra” correspondiente a cada caso; para la National Glycohemoglobin Standarization Program (NGSP), los resultados se expresan en porcentaje.
Con el objeto de ayudar a la interpretación de los resultados de la HbA1c se sugirió el cálculo del valor derivado promedio de glucosa (eAG), pero sólo luego de la apropiada validación de las ecuaciones que permitan dicho cálculo.
Más recientemente, la IFCC organizó una reunión con los fabricantes de los métodos para determinación de HbA1c para definir los requerimientos para implementar las Declaraciones de Consenso recomendadas y el plazo para su implementación, llegando a las siguientes conclusiones6
Todos los fabricantes deben implementar mundialmente ensayos para HbA1c que den resultados trazables al sistema de referencia de la IFCC
La fecha tope para implementar la trazabilidad al sistema de referencia de la IFCC es el 31 de diciembre de 2009; y
Todos los instrumentos vendidos luego del 1 de enero de 2011 deberán informar los resultados tanto en las unidades SI (mmol/mol), como en las unidades NGSP (%).
Limitaciones potenciales de la determinación de la HbA1c
Para el monitoreo del control glucémico: es crítica la reproducibilidad; al utilizar puntos de corte fijos (< 7,0: buen control) se requiere que no tenga sesgo.
Para el cálculo de la estimación de la glucemia promedio (eAG): pequeños errores producen grandes cambios inesperados en la eAG; es de destacar que el aumento de 0,1% de la HbA1c representa un cambio aproximado de 3 mg/dl en la eAG.
Para el diagnóstico de diabetes: al utilizar puntos fijos (> 6.5%: diabetes) se requiere particular atención al efecto del sesgo sobre la certeza del diagnóstico.
Definición del analito
El sistema de referencia está basado en la HbA1c que es el componente de la hemoglobina glucosilada presente en la sangre humana, y que bioquímicamente está caracterizada por el resultado de la fijación irreversible de restos glucosilo al aminoácido N-terminal de la cadena β de la hemoglobina durante su exposición continua a la glucosa.
Valores de referencia
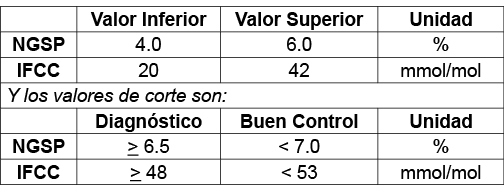
Debido a su alta especificidad el nuevo sistema de referencia produce valores de HbA1c menores que los obtenidos habitualmente para los métodos basados en la aplicación de otros estándares.
Así, los valores de corte establecidos serán:
Expresados en las unidades adecuadas, los valores de referencia son:
Métodos de rutina
A continuación se enumeran los métodos utilizados para la determinación de hemoglobina glicosilada:
Ácido Tiobarbitúrico
Columna Cromatográfica (macro)
Columna Cromatográfica (micro)
Cromatografía Líquida de Alta Presión (HPLC, método de referencia del NGSP)
Cromatografía Líquida Rápida para Proteínas (FPLC)
Electroforesis (electro-endósmosis)
Electroforesis (Isoelectroenfoque)
Cromatografía de Afinidad
Métodos Inmunoturbidimétricos
Métodos Enzimáticos
Métodos POC (Point-of-Care)
Conclusión
Costos
Se presentaron datos comparativos de costos en Uruguay entre glucemia plasmática y HbA1c, resultando la segunda alrededor de 10 veces más costosa que la primera. Se midió en el sector público y en el sector privado, tomando como referencia la Unidad de Valor Relativo que incluye costos globales y no solamente de técnicas de laboratorio.
En la bibliografía revisada 2 se concluye que:
La determinación de la HbA1c no es factible de realizar en muchas partes del mundo.
Este es un problema importante en países de ingresos bajos o medios. Su incorporación como test diagnóstico en estos casos no es posible.
Estos países tienen que contar con la opción de continuar con los criterios diagnósticos habituales, hasta que esta alternativa sea accesible y viable.
Variabilidad clínica
- Factores que modifican su determinación 7-16
- Valores falsamente elevados: uremia (HbA1c carbamilada), componentes glicados lábiles, productos de Schiff, hipertrigliceridemia, hiperbilirrubinemia, adicción a opiodes, alcoholismo, altas dosis de AAS, deficiencia de hierro.
- Valores falsamente bajos: disminución de la vida media del eritrocito, transfusiones de glóbulos rojos, embarazo, flebotomías, anemia hemolítica, Vitaminas C y E.
En el caso de las hemoglobinopatías, si están correctamente diagnosticadas, se pueden utilizar métodos de determinación alternativos, que no se sean influidos por estas alteraciones. Contar con técnicas diversas para contemplar estas situaciones resulta más costoso.
- Etnia y HbA1c
Diversos trabajos9 muestran que la DM diagnosticada por PTOG en personas con HbA1c ≥ 6,5% presentó diferencias en distintas etnias.
- Edad y HbA1c
Existen evidencias a favor y en contra de la correlación entre edad y HbA1c, algunos trabajos muestran una correlación positiva con incremento anual de la HbA1c con la edad. Otros, en cambio, señalan las discordancias en grupos etarios de adultos mayores entre la HbA1c y los criterios convencionales de diagnóstico de DM.
Estudio comparativo entre glucemia y HbA1c para diagnóstico
Glucemia de ayuno
Ventajas: ya establecida como método diagnóstico mide la molécula responsable de las complicaciones de la diabetes no influida por factores no glucémicos: existen pequeñas diferencias entre laboratorios y su determinación es más accesible a nivel mundial.
Desventajas: requiere ayuno y procesamiento rápido de la muestra puede requerir la realización posterior de una prueba de tolerancia oral a la glucosa (PTOG), un único valor tiene mayor variabilidad que la HbA1c: la PTOG no se puede realiza en pacientes con cirugía gástrica.
Hemoglobina glucosilada A1c4
Ventajas: es útil para el monitoreo del diabético conocido no requiere de ayuno previo, se mantiene más estable en la muestra, refleja semanas o meses de control, tiene variabilidad individual más baja.
Desventajas: las interferencias ya enumeradas previamente, falta de estandarización de los diversos métodos, acceso restringido en muchas áreas geográficas, marcador indirecto de hiperglucemia.
Controversias en cuanto a la utilidad diagnóstica y puntos de corte de la HbA1c 17
Posición de AACE/ACE (American Association of Clinical Endocrinologists/American College of Endocrinology Statement): se acepta el uso de la HbA1c como opción para diagnóstico con las siguientes recomendaciones:
De ser posible utilizar los métodos tradicionales de diagnóstico.
No se recomienda la HbA1c para diagnóstico de Diabetes tipo 1 ni para Diabetes Gestacional.
Se señalan las posible causas de error por interferencias (ya señaladas)
Se insiste en la necesidad de usar métodos de laboratorio validados y estandarizados.
No respalda el uso de HbA1c para diagnóstico de prediabetes, ni en población de riesgo.
Si se dispone de HbA1c con valores entre 5,5 y 6,4% como screening, se debe completar con glucemia en ayunas o PTOG.
Los puntos de corte de HbA1c y su comparación con la glucemia en ayunas, en adultos mayores de 20 años, muestra áreas de superposición de glucemias normales con HbA1c alterada.
En población de adultos mayores la HbA1c tendría sensibilidad limitada que puede resultar en demoras en el diagnóstico de DM2.
Recomendación
El uso de la HbA1c para el diagnóstico de diabetes no se recomienda en nuestros países hasta que no se cuente con una metodología adecuadamente estandarizada y de fácil acceso.
Bibliografía
2. Nathan D., et al.: The International Expert Committee (2009) International Expert Committee report on the role of the HbA1c assay in the diagnosis of diabetes. Diabetes Care, 2009; 32:1327-1334.
3. Borch-Johnsen K, Colagiuri S.: Diagnosing diabetes, time for a change? Diabetologia, 2009; 52: 2247-250.
4. Kilpatrick E., Bloomgarden Z., Zimmet P.: Is haemoglobin A1c a step forward for diagnosing diabetes? BMJ 2009;339:b4432.
5. Jeppsson, J.O.; Kobold, U.; Barr, J.; Finke, A.; Hoelzel, W.; Hoshino, T.; Miedema, K.; Mosca, A.; Mauri, P.; Paroni, R.; Thienpont, L.; Umemoto, M. y Weykamp, C. Approved IFCC referente Method for the Measurement of HbA1c in Human Blood. Clin Chem Lab Med 2002; 40(1):78-89.
6. Implementation of standarization of hemoglobin A1c measurement: condensed summary of the meeting with manufacturers held in
7. Simon D. et al. Reproducibility of HbA1c in a Healthy Adult Population. Diabetes Care 1999; 22 (8):1361-63.
8. Factors that interfere with GHB (HbA1c) Test Results UPDATED 8/09, disponible en: www.ngsp.org.
9. Alegría MS.:Long-term glycemic control measurements in diabetic patients receiving hemodialysis. Am J Kidney Dis 2002; 39:297-307.
10. Roberts WL, Safa-Pour S, De BK, Rohlfing CL, Weykamp CW, Little RR.: Effects of hemoglobin C and S traits on glycohemoglobin measurements by eleven methods. Clin Chem. 2005; 51:776-778.
11. Schnedl W et al.: Evaluation of hemoglobin A1c determination methods in patients with hemoglobinopathies. Diabetes Care 2000; 23:339-344.
12. Christensen D. et al.: Moving to an HbA1c based diagnosis of diabetes has a different impact on prevalence in different ethnic groups: Diabetes Care 2010; 33:580-582.
13. Wiener K, Roberts N.B.: Age does not influence levels of HbA1c in normal subject. QJM 1999; 92:169-173.
15. Selvin E. et al: Elevated A1c in adults without a history if Diabetes in US. Diabetes Care 2009; 32 (5): 828-833.
16. Kramer C. The Rancho Bernardo Study. Diab. Care 2010; 33 (1): 101-103.
17. American Association of Clinical Endocrinologists/American College of Endocrinology Statement on the use of Hemoglobin A1c for de diagnosis of Diabetes. Endocrine Practice March/April 2010; 16 (2).
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Módulo 3: Insulinemia
Coordinador: Dr. Martín Rodríguez
Temas desarrollados
En Síndrome de Ovario Poliquístico
En Pediatría
En Riesgo Cardiovascular
En Obesidad y categorías de alto riesgo como GAA y TGA
Laboratorio en Insulinemia e resistencia a la insulina (IR)
La medición de la sensibilidad a la insulina y de su secreción son actualmente hechas sólo con propósitos de investigación y sus resultados son comparables sólo entre los individuos en dichos estudios. No hay aplicación clínica actual de estas mediciones. De hecho, no hay criterios por los cuales una persona pueda ser clasificada como insulino sensible o resistente, o de tener leve, moderada o severa disminución de la secreción de insulina. En teoría, en la práctica clínica conocer la sensibilidad y secreción de insulina, podría ser útil:
1. En categorías de alto riesgo como GAA o TGA en la selección de pacientes para una prevención intensificada y,
2. En pacientes diabéticos en la elección de la terapia inicial apuntando a mejorar la sensibilidad o la secreción. Sin embargo, estos son objetivos para el futuro sin una actual aplicación clínica.
En Síndrome de Ovario Poliquístico (SOP)
¿Cuál es el rol de la Hiperinsulinemia/Insulinorresistencia (HI/IR) en la fisiopatología del SOP? SOP es la más frecuente enfermedad endócrina (5-10%) en la mujer premenopáusica. HI/IR se ve en > 50% de los SOP con el consiguiente aumento de riesgo de ECV y DM2. Impacto de la HI/IR en: a. Ovario: alteración de la esteroideogénesis con hiperandrogenismo y anovulación, b. Endometrio: disregulación del estroma endometrial y c. IFG1: disminución de IGFBP1 con aumento IGF1 libre.
¿La determinación de HI/IR es necesaria en el diagnóstico y la valoración del SOP? No, los criterios diagnósticos son los siguientes: Criterios NIH (1990) a. Hiperandrogenismo y/o hiperandogenemia, y b. Oligoanovulación. Criterios Rotterdam (2003) 2 de 3: a. Hiperandrogenismo clínico y/o laboratorio, b. Oligoanovulación, c. Ovarios poliquísticos. Criterios AES (2006): a. Hiperandrogenismo clínico y/o de laboratorio + 1 de los siguientes: b. Anovulación, c. Ovarios poliquísticos.
¿Cómo valorar el Riesgo Cardiometabólico Global (RCG) en el SOP? Continuo screening para alteraciones metabólicas en forma sistemática: peso, talla, IMC, circunferencia de cintura, sedentarismo, tabaquismo, presión arterial y laboratorio: glucemia en ayunas, triglicéridos, colesterol total, HDL-C y LDL-C. En caso de SOP con glucemia en ayunas normal + obesidad (IMC > 30 kg/m2), realizar Test de Tolerancia Oral a la Glucosa.
¿Cómo tratar el RCG en el SOP? a. Modificaciones del estilo de vida: Actividad física y Dieta, b. Tratamiento farmacológico de los FR según estratificación del riesgo cardiovascular.
La anovulación puede mejorar con insulinosensibilizadores Con metformina el ciclo menstrual y anovulación mejoran un 70% sin el requisito previo de valorar insulinemia ni HOMA. Si bien algunos autores consideran útil la valoración de la IR en SOP, no hay actualmente tests validados para determinar IR en población general.
Bibliografía
1. Staten M, Stern M, Miller W et al. Insulin Assay Standardization. Leading to measures sensitivity and secretion for practical clinical care. INSULIN STANDARDIZATION WORKGROUP. Diabetes Care 2010; 33:205-206.
2. A. B. Motta. Report of the international symposium: polycystic ovary syndrome: first Latin-American consensus. Int J Clin Pract 2010; 64: 544-557.
3. T M Calogero Amato, A Galluzzo, S Finocchiaro, A Criscimanna, C Giordanohe. The evaluation of metabolic parameters and insulin sensitivity for a more robust diagnosis of the polycystic ovary syndrome. Cl Endoc 2008; 69: 52–60.
4. D. Dewailly, S. Hieronimus, P. Mirakian, J.-N. Hugues. Consensus of the French Endocrine Society on Female Hyperandrogenism. Polycystic ovary syndrome (PCOS) Le syndrome des ovaries polymicrokystiques. Ann d’Endoc 2010; 71: 8–13.
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
En Pediatría
Utilidad en Estudios Clínicos y Epidemiológicos
En pediatría la determinación de insulina está sesgada por el hiperinsulinismo fisiológico de la adolescencia, determinado por el índice de Tanner (II-V) y sexo, siendo mayor en las niñas. La variación de índice HOMA en este grupo etario (11-17.9 años) está dada por la variabilidad de la insulina en ayunas y no de la glucemia. Pese a las variaciones de la insulina en los diferentes estadios puberales, en la actualidad hay numerosos trabajos de investigación que muestran una alta correlación entre el índice HOMA y la resistencia a la insulina cuando se compara con los resultados del clamp euglucémico hiperisulinico (Caprio y col 2004; Arslanian y col 2004 ), relacionándose los valores de HOMA con el estadío puberal (Invitti y col 2006)
En estudios de investigación la hiperinsulinemia en el niño resultó ser un predictor de SM y enfermedad cardiovascular en la edad adulta (Finns Study). En este estudio se demostró la asociación de hiperinsulinemia con hipertrigliceridemia en el seguimiento longitudinal de los niños hasta la adultez. La insulina en ayunas y HOMA IR demostraron ser útiles para el diagnóstico de IR en la edad pediátrica, y tuvo mayor valor predictivo si se asociaban otros factores de riesgo (HDL bajo, HTA, hipertrigliceridemia y obesidad)
Si bien hay limitaciones en la edad pediátrica, numerosos trabajos han propuesto puntos de corte de acuerdo a las diferentes etapas para el prepúber, en la pubertad media y post puberal (Viner y col). En estudios poblacionales como el de Bogalusa o el NHANES III, se han construido curvas de percentilos de insulina. Sin embargo mientras avanzan los conocimientos para las determinaciones en los diferentes grupos étnicos, es importante complementar los datos derivados de la insulina (los diferentes índices HOMA-QUICKI), tener en cuenta parámetros clínicos y de laboratorio que permitan confirmar las IR por el riesgo cardiovascular que implica.
Como parámetros clínicos, la circunferencia de cintura (CC), el IMC y el Índice cintura/talla no difieren en su capacidad para identificar adolescentes con factores de riesgo cardiometabólico. La circunferencia de cintura requiere de tablas de referencia, ya ampliamente utilizadas en pediatría, siendo importante determinar la técnica de medición de la cintura para utilizar la tabla adecuada (Freedman DS, Taylor RW). El índice Cintura/Talla no difiere en especificidad y sensibilidad de los otros parámetros antropométricos (CC e IMC), pero el mismo es de fácil aplicación en la práctica clínica al no requerir tablas de referencia y ser independiente de edad, sexo, estadio puberal y etnia. Según criterios de IDF 2007 la CC es el parámetro clínico más sencillo y práctico y correlaciona mejor que el IMC con masa grasa abdominal. El índice TG/HDL-c tiene la ventaja de ser metodológicamente sencillo y económico, e independiente de la etapa puberal.
Posición de las diferentes Guías Internacionales
No existe hasta la fecha recomendaciones específicas de ISPAD/IDF con respecto a insulinemia y HOMA en pediatría. Ante el diagnóstico de diabetes establecida, dosar insulinemia en ayunas podría ser útil en algunas circunstancias, para diferenciar tipos de diabetes. (ISPAD).
Bibliografía
1. García Cuarteroa B, C. G. Índice HOMA y QUICKI, insulina y péptido C en niños sanos. Puntos de corte de riesgo cardiovascular. An Pediatr 2007; 66 (5):481-90.
2. de Almeida C A N, 1. A. Determination of glycemia and insulinemia and the homeostasis model assesment (HOMA) in schoolchildren and adolescents with normal body mass index. Jornal de pediatria 2008; 84 (2): 136-140.
3. Craig M, Hattersley A, Donaghue K. Definition, epidemiology and classification of diabetes in children and adolescetns. Pediatric Diabetes 2009; 10 (12): 3-12.
4. Harald Sourij, I. S. Insulin Resistance as a Risk Factor for Carotid Atherosclerosis: A Comparison of de Homeostasis Model Assesment and the short Insuline Tolerance Test. Stroke 2008; 39:1349-1351.
5. Invitti C, Maffeis C, Gilardini L. (2006). Metabolic syndrome in obese Caucasian children: prevalence using WHO-derived criteria and association with nontraditional cardiovascular risk factorsMetabolic syndrome and nontraditional CVD risk factors in obese children. Int J Obes 2006; 30: 627-633.
6. Katzmarzyk P, Sathanur R. Body Mass Index, Waist Circumference, and Clustering of Cardiovascular Disease Risk Factors in a Biracial Sample of Children and Adolescents. Pediatrics 2004; 114 (2):198-205.
7. Valeria Hirschler, M. A. Comparison of Different Anthropometric Indices for Identifying Insuline Resistance in Scoolchildren. DIABETES TECHNOLOGY & THERAPEUTICS 2009; 11 (9): 615-621.
8. Viner R, Segal T.Prevalence of insuline resistance syndrome in obesity. Arch Dis Child 2005; 90 (1):10-14.
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
En Riesgo Cardiovascular
Laakso y col. fue el primero en demostrar que la IR, medida por la técnica del clamp, está asociada con aterosclerosis carotidea. Algunos estudios han demostrado que la hiperinsulinemia basal o post carga han sido asociadas con un aumento del espesor de la íntima carotídea (IMT). Otros no encuentran esta asociación positiva.
Un meta-análisis reciente de 19 estudios desarrollados en población occidental, que evaluaron los niveles circulantes de tres marcadores de la insulina y el riesgo de cardiopatía coronaria (IAM no fatal y muerte por coronaria) puso en evidencia que el Odds Ratio para ECV fue 1.12 (IC 0.98-1.28) para insulinemia basal (14 estudios, 2649 eventos), 1.35 (IC 1.14-1.60) para insulinemia post carga(8 estudios, 1980 eventos) y de 2.23 (IC 1.65-3.00) para el incremento de pro insulina (3 estudios, 413 eventos). Estos resultados mostraron una menor asociación con el riesgo CV que lo esperado, según estudios previos. Según este meta-análisis, los niveles de pro-insulina, podrían tener mayor asociación con el riesgo de enfermedad coronaria, pero es necesario contar con un mayor número de estudios y eventos.
Un marcador de riesgo para ser incorporado a la práctica clínica debería ser de fácil medición, costo efectivo y que incremente la capacidad de identificar individuos con RCV más allá de los FRCV tradicionales.
En algunas Guías de Práctica Clínica se nombran numerosos marcadores biológicos asociados con riesgo cardiometabólico, entre ellos la insulinemia de ayunas y la proinsulina (también apo B, adiponectina, leptina, ácidos grasos libres, homocisteina, PAI-1, fibrinógeno, ALT como marcador de hígado graso, proteína C-reactiva, citoquinas inflamatorias (IL-6), contenido de grasa miocelular o hepática por resonancia magnética espectroscópica y microalbuminuria. Sin embargo la evidencia de que provean una indicación de riesgo metabólico más allá de las medidas de rutina es limitada, razón por la cual las guías de prevención primaria no recomiendan su determinación rutinaria para evaluar el riesgo cardiometabólico metabólico.
Se debe demostrar si la adición de estos marcadores incrementa el valor predictivo de los FRCV convencionales.
Es un hecho que la hiperinsulinemia predice la diabetes, la dislipidemia, y en menor medida, la hipertensión arterial, y es un predictor independiente, si bien débil, de ECV. La medición directa de resistencia a la insulina (por la técnica de clamp de glucosa) es demasiado compleja para su uso en la práctica clínica. El uso de los niveles de insulina plasmática en ayunas como sustituto de la resistencia a la insulina introduce confusión, debido a la diferente fisiología por parte de la hiperinsulinemia y la resistencia a la insulina así como una pobre estandarización de los métodos en los diferentes estudios.
La Guía Práctica Clínica - AACE 2008 indica que la insulinemia basal y 2 hs. post carga no son recomendadas para evaluar ECV ya que el grado de evidencia es bajo y la fuerza de recomendación es débil. Las guías EASD, Canadienses y ALAD no mencionan el dosaje de insulinemia en la evaluación del riesgo cardiometabólico.
Bibliografía
1. Despres JP, B Enoit, T L amarche, et al. Hyperinsulinemia as an independent risk factor for ischemic heart disease. N Engl J Med 1996; 334:952-957.
2. N Sarwar, N Sattar, J Danesh et al. Circulating concentrations of insulin markers and coronary heart disease: a quantitative review of 19 Western prospective studies. Eur Heart J 2007; 28: 2491-2497.
3. The Cardiovascualr Risk in Young Finns Study Group. Conventional Cardiovascualr Risk Factors and Metabolic Syndrome in Predicting Carotid Intima-Media Thickness Progression in Young Adults. Circulation 2009; 120:229-236.
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
En Obesidad y Categorías de alto riesgo (GAA y TGA)
La grasa visceral tiene características metabólicas más lipolítica y más resistente a los efectos antilipolíticos de la insulina. El hígado recibe una mayor cantidad de ácidos grasos libres proveniente de la grasa visceral, un menor aclaramiento hepático de la insulina y consecuentemente se produce la hiperinsulinemia.
La resistencia a la insulina y/o la hiperinsulinemia son sólo marcadores que se relacionan con el riesgo de aparición de DM2. Los rangos de referencia que diferencian a los sujetos con sensibilidad normal a la insulina de los insulinorresistentes muestran una gran superposición de valores, no habiendo acuerdo en la literatura. Existe gran variabilidad de valores provenientes del uso de distintas metodologías de laboratorio. La determinación aislada de insulinemia posee un escaso valor en la predicción de diabetes tipo2. Dada la reconocida relación entre los índices antropométricos y las cifras de insulinemia basal, resulta más útil y práctico estudiar los primeros como indicadores del grado de IR.
En pacientes con GAA y TGA no hay ningún fundamento para realizar seguimiento con medición de glucosa de sangre capilar, HbA1c, insulina plasmática o medición de péptido C. El seguimiento requiere una prueba de tolerancia de la glucosa oral (P75) que inicialmente se realizará anualmente y se puede repetir a intervalos de 1 a 3 años (Australian Diabetes Society 2007). En aquellos pacientes con TGA y/o glucemia alterada en ayunas debe indicarse consejos de cambio de vida (similar al DPP: disminución del peso 5-10% y actividad física 30 min/día). Frente al fracaso, luego de 6 meses, podría considerarse el uso de metformina en la prevención de DM si son menores de 60 años, IMC ≥ 35 Kg x m², FRCV y riesgo de DM2 (Consensus Statement Diabetes Care. 2007).
Bibliografía
1. M. Moreno González. Departamento de Nutrición, Diabetes y Metabolismo RESISTENCIA INSULINICA Y OBESIDAD Boletín Escuela de Medicina. Pontificia Universidad Católica de Chile. 1997; 26:21-25.
2. González Suárez, Arranz Calzado. Secreción de insulina y sensibilidad a la insulina durante la prueba de tolerancia a la glucosa oral, en sujetos con tolerancia normal Rev Cubana Endocrinol 2000;11(1):23-30.
3. Luquez, De Loredo, Madoery, Luquez (h),Senestrari. Sindrome metabolico: prevalencia en dos comunidades de Córdoba de acuerdo a definiciones de ATP III y OMS.
4. Lobo, Preiti, Marti, Urdaneta, Iturrospe. Insulinoresitencia y su variancia explicada por el Sindrome Metabólico ATP III. Revista Actualización en Nutrición. Volumen 7. N1 Buenos Aires. Abril 2006.
5. Múscolo1, D’Ambrosio2, Mónica Núñez, Lastretti1,Doallo, Palma1, Sijerkovich,García1, Wikinski5, Brites. Síndrome metabólico en mujeres obesas. Evaluación de biomarcadores de resistencia insulínica y lipoproteicos. Acta Bioquím Clín Latinoam Buenos Aires.2004; 38 (4): 481-8.
6. Components of the “Metabolic Syndrome” and Incidence of Type 2 Diabetes Robert L. Hanson, Giuseppina Imperatore, Peter H. Bennett, and William Diabetes. American Diabetes Association, Inc. 2002;51(10).
7. Stephen M Twigg, Maarten C Kamp, Timothy M Davis, Elizabeth K Neylon and Jeffrey R Flackmja. Prediabetes: a position statement from the Australian Diabetes. Society and Australian Diabetes Educators Association 2007; 186(9):461-465.
8. Standards of Medical Care in Diabetes - 2010. American Diabetes Association. Diabetes Care 2010; 33 (Supl 1):512-561.
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Pruebas bioquímicas más utilizadas para la valoración de IR
Insulinemia en ayunas
Insulinemia basal y postprandial
PTOG con determinación de insulina
Clamp euglucémico hiperinsulinémico
Índices: -HOMA -QUICKI
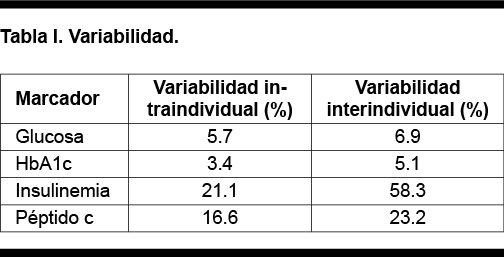
El nivel de insulinemia está determinado por su secreción y por la sensibilidad tisular a la misma. Existen dificultades en establecer un adecuado intervalo de referencia, entre otras cosas por la falta de estandarización y la alta variabilidad biológica. Frente a glucosa la insulinemia tiene una variabilidad intraindividual 4 veces mayor e interindividual casi de 10 veces mayor (Tabla I).
La insulinemia postprandial no aportaría mayor información que la determinación simple de insulinemia basal. La PTOG con determinación de insulina tiene como desventajas su íntima relación glucosa-insulina, requiere una reserva de insulina endógena y posee un alto coeficiente de variación intraindividual.
El Clamp euglucémico hiperinsulinémico es el método de referencia para medir IR. Mide in vivo la captación total de glucosa ante un estímulo con insulina (idea de sensibilidad tisular a la misma). Tiene como desventajas la necesidad de un equipamiento costoso y su técnica es laboriosa e incómoda para el paciente.
El HOMA (Homeostatic Model Assessment) es un modelo estructural computarizado que utiliza una Ecuación central: HOMA IR= Ins ay (mU/mL) X Glu ay (mmol/L) / 22.5. Requiere de 3 muestras separadas cada una por 5 minutos. Existen distintas versiones del HOMA. Sus principales limitaciones son la suposición en el modelo de que la sensibilidad insulínica en el hígado es equivalente a la de tejidos periféricos y presenta un alto coeficiente de variación (hasta 31%) por falta de especificidad del método.
QUICKI: (Cuantitative Insulin Sensibility Check Index) 1/ log Ins + log Glu. La correlación de este con otros métodos que evalúan insulinosensibilidad es débil cuando los niveles de insulina son bajos.
Distintas entidades científicas como ADA, EASD, y CDC se encuentran trabajando en la estandarización de los ensayos para determinación de insulina. En 2007 se establecieron nuevas unidades para insulina y la misma representa ser el candidato a método de referencia. La estandarización en los resultados de los ensayos para determinar insulinemia requerirá de esfuerzo en lograr trazabilidad con el nuevo método de referencia calibrado con insulina humana recombinante pura (Insulin Assay Standardization Diabetes Care Vol 33 Nº1, 2010).