INTRODUCCIÓN
Durante la cirugía de trasplante hepático (TH) se pueden presentar diversas complicaciones, mayoritariamente en el momento de la reperfusión del órgano implantado. Las complicaciones generan alta incidencia de morbimortalidad intra y postoperatoria.
La ecocardiografía transesofágica (ETE) junto a un análisis clínico integral del paciente ayuda al anestesiólogo a determinar la causa de la inestabilidad hemodinámica y a realizar diagnósticos diferenciales como tromboembolismo, hipovolemia e isquemia miocárdica, entre otras, durante las fases agudas del trasplante por lo que su uso debe ser considerado en toda cirugía de trasplante de hígado.
DESARROLLO DE LOS CASOS CLÍNICOS:
Presentamos cuatro pacientes que luego de la reperfusión del órgano presentaron inestabilidad hemodinámica severa. Se colocó ETE para determinar la causa y guiar el tratamiento.
Caso 1
Paciente de sexo masculino de 43 años con enfermedad hepática terminal por hemocromatosis, con un MELD de 30 (MELD, por sus iniciales en inglés Model for End-stage Liver Disease, modelo para la enfermedad hepática terminal). Presenta antecedentes de trombosis de vena porta diagnosticado en el preoperatorio por tomografía computada, en 3 cortes. Figura 1: Trombosis portal grado I (extensión menor al 50%, clasificación de Yerdel y Mc Master)1.
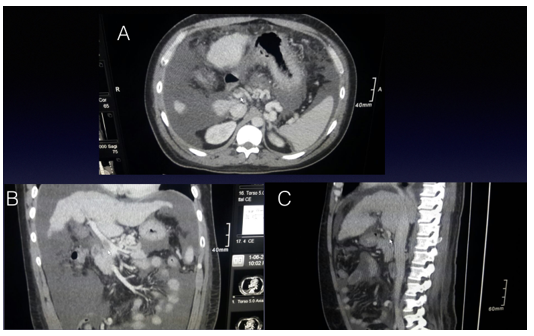
Figura 1: Imágenes de Tomografía Computada, cortes: A-axial, B-coronal y C-sagital de tomografía computada, flecha identifica vena porta con contraste denso con una hipodensidad en su interior que corresponde a trombo.
Durante el intraoperatorio, posterior al desclampeo, el paciente sufre descompensación hemodinámica aguda, con severa hipotensión y bradicardia extrema. En ese momento no se presentaban alteraciones metabólicas significativas en los estudios de laboratorio. Se comenzó con maniobras de reanimación cardiopulmonar avanzadas y se colocó ETE mediante el cual se pudo determinar la causa: trombosis masiva intracardiaca (TIC). En las siguientes imágenes se puede observar un trombo proveniente de vena cava inferior y además un cable de marcapaso situado en aurícula derecha. Figura 2.
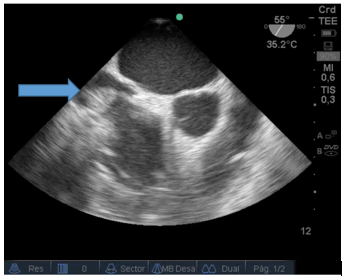
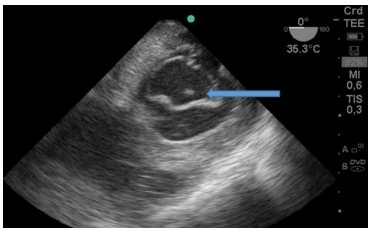
Figura 2: Vista a 55 grados medio-esofágica: Imagen hiperdensa (flecha) de un gran trombo ingresando desde la vena cava inferior hacia la aurícula derecha
En la Figura 3:, se observa trombo cruzando por el foramen oval del tabique interauricular y trombosis en aurícula izquierda (AI).
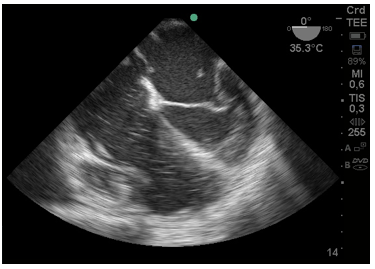
Figura 3: Imagen de 4 cámaras donde se ve trombo en aurícula izquierda y otro pasando desde la aurícula derecha por el foramen oval. Cavidades derechas aumentadas de tamaño.
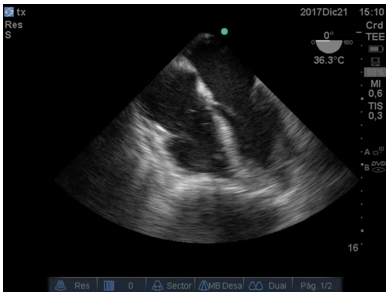
En la Figura 4:, se observa un trombo a nivel de la válvula mitral en condiciones de migrar hacia el ventrículo Izquierdo.
Caso 2.
Paciente de 39 años con diagnóstico de insuficiencia hepática aguda (falla hepática fulminante) por virus A (HAV), por lo que se coloca en lista de emergencia para trasplante hepático. Presenta MELD de 24 y encefalopatía hepática G2, que evoluciona con aumentos progresivos de creatinina y anemia. El día previo al trasplante presenta fallo renal agudo con SIRS (síndrome de respuesta inflamatoria sistémica) que evoluciona a sepsis. Se decide no realizar hemodiálisis convencional por inestabilidad hemodinámica, presentándose a la cirugía de trasplante en anuria y con diagnóstico de shock séptico.
La cirugía se desarrolla sin incidentes y luego del desclampeo se produce hipotensión severa y paro cardíaco. Se coloca ETE que no muestra signos de enfermedad cardíaca, el ventrículo derecho era normal y los vasos hepáticos tenían adecuada perfusión. Figura 5. Se obtienen resultados de laboratorio que muestran severa e hiperkalemia (K plasmático de 7 mEq/L). Se inicia tratamiento con bicarbonato y cloruro de calcio.
Caso 3.
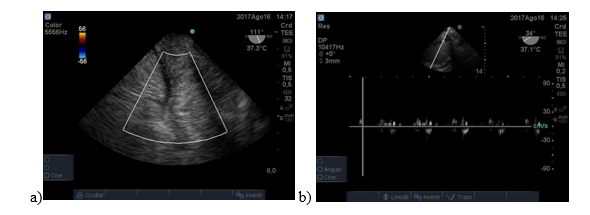
Paciente de 66 años con diagnóstico de cirrosis por hepatitis C y hepatocarcinoma asociado y tratado con embolización 3 meses antes. Post desclampeo presenta descompensación hemodinámica y sangrado. A través de la ETE se fue guiando la reposición de volumen y el estudio del hígado demostró defectos severos en la perfusión hepática.Figura 6: a y b
Caso 4.
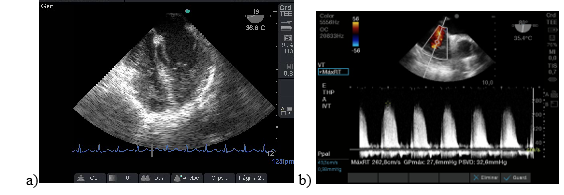
Paciente de 26 años que se realizó trasplante hepático con donante vivo con antecedentes de colitis ulcerosa y colangitis esclerosante y desnutrición. El ETE realizado luego del desclampeo reveló insuficiencia cardíaca derecha, ventrículo derecho aumentado de tamaño e hipertensión pulmonar. Figura 7: a y b
Discusión
La reperfusión es uno de los momentos más críticos durante la cirugía de TH, el cual representa un período de elevada mortalidad2. La tríada, hipotensión de reperfusión secundaria a la liberación de sangre proveniente del órgano hipotérmico que provoca acidosis e hipercalemia debido a la solución de preservación, coagulación alterada por enfermedad hepática terminal (EHT)
La presencia de un catéter en la arteria pulmonar, como una fuente física para la inserción de trombos3, son las circunstancias que al momento de la reperfusión favorecen la formación de TIC.
El paciente con EHT tiene una marcada deficiencia en la producción de factores de coagulación debido al hígado enfermo, que se encuentra en un estado precario entre sus procoagulantes, anticoagulantes y sistema fibrinolítico lo cual lleva a un completo disbalance en todo su sistema de coagulación.
Con respecto al monitoreo hemodinámico, los métodos disponibles para valorar el gasto cardíaco durante la cirugía de TH son cateterización de arteria pulmonar y monitorización con dispositivos volumétricos (PiCCO / EV-1000). Durante la aparición de TIC puede observase alteración hemodinámica repentina, hipoxia, aumento de la presión venosa central, aumento o disminución de las presiones pulmonares y arteriales; sin embargo, es la visualización con ETE es la que permite, en tiempo real, realizar un diagnóstico preciso de TIC. ETE no es utilizado de rutina en América Latina, en cirugía de trasplantes; si bien en la actualidad se considera un reconocido y esencial monitor, con una sensibilidad del 80% y una especificidad del 100% para el diagnóstico de trombos4.
Una vez que se detectan TIC, el tratamiento se centra principalmente en intensificar el soporte cardiovascular mediante drogas inotrópicas y vasoactivas para mantener una presión arterial adecuada, y luego, en discusión con el equipo de trasplante quirúrgico, administrar heparina endovenosa, para ayudar a atenuar el crecimiento del coágulo5. O administrar activador del plasminógeno tisular (tPA) como postulan otros autores6, para lograr el alivio temporal de la carga de coágulos en el sistema cardiovascular.
La importancia de ETE en estos casos radica no solo en confirmar un diagnóstico, sino también como una herramienta importante para demostrar la resolución de los trombos, en respuesta a un tratamiento.
Por otro lado, si bien es un procedimiento invasivo, la seguridad y eficacia de ETE en pacientes con EHT y varices esofágicas se ha establecido con bajas tasas de complicaciones directamente relacionadas a la inserción y manipulación de la sonda7.
En 2003 se redactó la actualización de la guía ACC / AHA / ASE para la aplicación clínica de ecocardiografía8 y en el año 2010, las pautas de ASA / SCA para el uso de ETE perioperatoria9, las cuales recomiendan el uso de ETE en cirugías asociadas con grandes cambios de volumen y cambios hemodinámicos significativos; El TH entra en estas dos categorías.
Los pacientes sometidos a TH son especialmente vulnerables a hipotensión secundaria debido a fallo o disfunción de ventrículo derecho y cambios en la presión de arteria pulmonar, por lo tanto, ETE es una herramienta importante de monitoreo durante el TH10. También ayuda a identificar casos de obstrucción dinámica de flujo al tracto de salida del ventrículo izquierdo11. ETE mejora la monitorización de la volemia y la función miocárdica, ambos aspectos vitales durante el manejo de pacientes sometidos TH.
Con las imágenes ecocardiográficas podemos determinar si el paciente tiene foramen oval permeable. Recordemos que entre el 25 al 30% de los pacientes adultos tienen foramen oval permeable.
En numerosos estudios se ha demostrado que la creatinina y/o urea plasmática previas al trasplante constituyen parámetros con alto valor predictivo en relación con la supervivencia postrasplante. El aumento de dichos parámetros en el preoperatorio se asocia con supervivencia postquirúrgico de 15-20% inferior respecto a aquellos con valores normales12. Una de las recomendaciones actuales es realizar el trasplante hepático lo más precozmente posible, antes del desarrollo de insuficiencia renal, por ejemplo, mediante trasplante hepático con donante vivo.
Durante el período intraoperatorio, son frecuentes importantes cambios hemodinámicos y hemorragias asociados a las distintas fases del TH, que en ocasiones condicionan hipotensión arterial que puede llevar a una hipoperfusión renal durante la intervención. El clampaje de la vena porta, de la arteria hepática y de la vena cava inferior durante la fase anhepática interrumpe el retorno venoso a las extremidades inferiores y al lecho esplácnico, resultando en un descenso en el gasto cardíaco, en la presión arterial, elevación de las resistencias vasculares sistémicas y reducción en la perfusión de órganos vitales, resultando en enfermedad severa cardiovascular o miocardiopatía, con hipoperfusión renal y potencial lesión isquémica13. La monitorización con ETE puede ayudar a identificar cualquiera de estas situaciones, guiando la terapéutica ayudando en la rápida toma de decisiones.
Como el mejor tratamiento es la prevención, identificar los factores de riesgo y aquellos pacientes que tengan mayores probabilidades de sufrir complicaciones intraoperatorias junto a la utilización de ETE desde el comienzo de la cirugía, nos ayudaría a prevenir, identificar y tratar las complicaciones durante TH.
Discusión
Los pacientes sometidos a TH tienen alta incidencia de complicaciones cardiovasculares. Aquellos con fallo renal preoperatorio necesitan una optimización de su medio interno previo a la cirugía. Los que poseen factores predictivos asociados a TIC (como trombosis venosa, hemodiálisis preoperatoria, historia de correcciones quirúrgicas de hemorragias gastrointestinales o alteraciones de la coagulación que evidencien estado hipercoagulable), deben alertar al equipo de trasplante sobre un paciente de alto riesgo para trombosis. La trombosis venosa portal (TVP) es una complicación de la EHT, con una incidencia entre el 1% y 16% entre los pacientes con cirrosis14) . Esta condición genera dificultades técnicas durante el TH, por lo cual debe ser realizada por un equipo quirúrgico experto para reestablecer un flujo portal adecuado al nuevo injerto. La TVP es un factor más de riesgo de complicaciones intra y postoperatorias, pero susceptible de ser tratada previo o durante el trasplante15.
Durante el TH el uso de ETE no debe centrarse solo en el corazón. El flujo sanguíneo y la permeabilidad de la anastomosis hepática pueden analizarse adecuadamente con este monitor16.
El uso intraoperatorio de ETE juega un papel vital en el diagnóstico de las diversas patologías que ocurren durante TH, colaborando con el anestesiólogo en la elección del tratamiento correcto durante un compromiso hemodinámico intraoperatorio inesperado.
ETE proporciona una visualización rápida de la función cardíaca, el estado de volumen, la contractilidad general y el movimiento de las paredes regionales, como así también nos permite descartar embolia , derrame pericárdico y pulmonar17.
Los pacientes cirróticos tienen un mayor riesgo de tener falla del VD, por lo que la reposición agresiva de líquidos o la transfusión de sangre o el aumento del flujo sanguíneo hacia el corazón derecho en la reperfusión puede causar sobrecarga de volumen y precipitar edema pulmonar debido a enfermedad cardíaca oculta18. En estas circunstancias, ETE permite observar las cámaras derechas del corazón, lo que permite en tiempo real el diagnóstico de falla del ventrículo derecho (debido a embolia o sobrecarga), hipertensión pulmonar o
incluso una precarga reducida. La disfunción ventricular derecha e izquierda puede ser exacerbada durante el trasplante.
La colocación de ETE19 desde el inicio de la cirugía puede contribuir a cambiar el pronóstico, diagnosticando precozmente trombosis, hipovolemia, hipertensión pulmonar, permitiendo instaurar un tratamiento precoz, entender la causa de la descompensación y evitar la muerte del paciente.