INTRODUCCIÓN
La ecocardiografía transesofágica intraoperatoria (ETE), ha sido ampliamente utilizada en cirugía cardiovascular, desde las primeras publicaciones en 1997, donde todavía era prematuro recomendar el uso de ETE, como monitor de rutina(1), su utilidad comienza a ser protagonista a partir del año 1999, con la aparición de las primeras guías(2). En el año 2000, se establece como un monitor que debería ser utilizado de rutina(3) y desde 2005, se determina que ETE es un componente vital del manejo perioperatorio de toda cirugía cardíaca(4). En 2009, se estableció en un estudio de más de 1000 pacientes, que ETE no sólo era un componente vital sino, que provee valiosa información para reducir las complicaciones quirúrgica e influye en la toma de decisiones durante una gran variedad de cirugías cardíacas y de la aorta toráxica(5) .
Aunque el equipo quirúrgico puede visualizar la anormalidad valvular anatómicamente, ETE, proporciona una valoración en tiempo real de la fisiopatología valvular; es útil para guiar los procedimientos quirúrgicos de reparación y mejorar sus resultados. ETE, es en la actualidad un monitor clase I, en cirugía de plástica mitral y clase II, en reemplazo valvular(6). La sonda de ETE (Figura1), que avanzando por el esófago llega a medioesofágico(7), mira a la válvula mitral desde un lugar privilegiado, a través de la aurícula izquierda.
ANATOMÍA DE LA VÁLVULA MITRAL
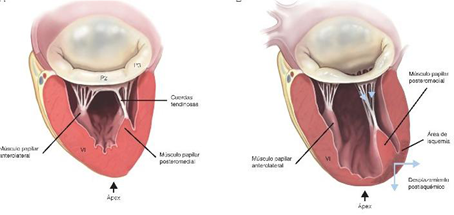
Es la única válvula cardíaca bivalva, formada por las valvas anterior y posterior, separadas por sus respectivas comisuras y ancladas en sus bases, al tejido fibromuscular del anillo y en sus bordes libres al aparato subvalvular mediante las cuerdas tendinosas. Necesita para un adecuado funcionamiento, la integridad de todos los elementos que componen el denominado “aparato mitral”: el ventrículo izquierdo y los músculos papilares, las cuerdas tendinosas, el anillo mitral y los velos mitrales(8).
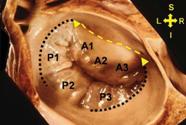
La válvula mitral (Figura2), está compuesta por los velos anterior y posterior, de aproximadamente 1 mm de espesor. El velo posterior, se adhiere al anillo fibromuscular mitral en la base, ocupando 2/3 del mismo y tiene forma cuadrangular. Está dividido por 2 hendiduras bien definidas en 3 festones denominados 1, 2 y 3 de anterior a posterior. El velo anterior en forma semilunar, se adhiere al tercio restante del anillo mitral y está en continuidad con el velo no coronario aórtico, también se divide en 3 festones que se corresponden con los festones 1, 2 y 3 del velo posterior.
Figura 2: imagen a 0° transgástrica, eje corto basal de la válvula mitral cerrada y abierta con sus 2 valvas (anterior y posterior) y sus correspondientes 3 velos .
Las comisuras son los puntos donde se unen ambos velos en el anillo. La comisura anterolateral a nivel de A1 y P1, cercana a la orejuela izquierda y la posteromedial a nivel de A3 y P3, cercana a la válvula tricúspide.
El anillo mitral es oval con forma de silla de montar. Es el punto de unión entre el ventrículo izquierdo y la aurícula izquierda y sirve de anclaje a los velos mitrales. La parte anterior, está unida al trígono fibroso y está más desarrollada que la parte posterior. Se considera dilatado cuando mide más de 3.5cm. La imagen ideal para medir el anillo es la medioesofágica 2 cámaras entre 40°- 60° (imagen bicomisural).(Figura3)
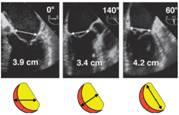
Figura 3 medición del anillo mitral desde las imágenes medio esofágicas de 2 cámaras a 0° y 60° y en la imagen central 3 cámaras a 140°
Las cuerdas tendinosas se originan en los músculos papilares y se insertan en el borde libre de los velos; las cuerdas secundarias en la cara ventricular del cuerpo de los velos y las terciarias en la cara ventricular de la base de ambos velos.(Figura 4)
Los músculos papilares son 2, el anterolateral, que recibe doble irrigación (de las arterias circunfleja y descendente anterior, mientras el músculo póstero medial es irrigado por una sola arteria (la coronaria derecha o la circunfleja).
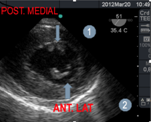
Figura 4: imagen a 51° transgástrica mediopapilar, músculos papilares anterolateral(1) y posteromedia(2).
La arteria coronaria izquierda luego de su nacimiento se bifurca (Figura 5) en las arterias descendente anterior que va hacia adelante y la circunfleja que rodea a la comisura anterolateral de la válvula mitral y que puede ser ligada durante la anuloplastia o el reemplazo valvular.
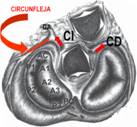
Figura 5 Esquema de la válvula mitral en relación a las demás válvulas cardíacas y la relación con la arteria circunfleja que luego de su bifurcación de la coronaria izquierda rodea la comisura anterolateral mitral
Finalmente el tamaño y la forma del ventrículo izquierdo impactan en la función de la válvula mitral(9).(Figura 6) Cuando el ventrículo se dilata se torna más esférico, los músculos papilares se desplazan apicalmente, limitando así el cierre correcto de la válvula(10).
EVALUACIÓN CON ETE
Aunque en la mayor parte de los casos la anatomía y la severidad de la lesión ha sido establecida previamente, el quirófano nos ofrece una última oportunidad para evaluar el mecanismo, severidad y lesiones asociadas. Y de esta manera contribuir con el cirujano a planificar la mejor estrategia quirúrgica.
El análisis anatómico ecocardiográfico, se realiza con 2 D, y se basa en la adquisición de distintos planos que nos permitan observar el anillo, los velos y las comisuras en varias proyecciones.(Figura 7) Siguiendo un protocolo de 8 planos, que incluye 3 planos a nivel medio esofágico a 0° superior, donde se visualiza A1 y P1 además de la aorta y la orejuela, medio donde se ve A2 y P2, e inferior, casi llegando al seno coronario donde se encuentra A3 y P3. Luego entre 60° y 90°, a nivel del plano comisural, se ve P1, A2 y P3. Entre 80° y 100° en el plano de 2 cámaras, obtenemos la visión de A1, A2 y P3; con pequeños giros desde este lugar, podemos analizar todo el velo posterior y A2 y A3. Por último en esófago medio, el plano de 120° permite evaluar A2 y P2.(11)
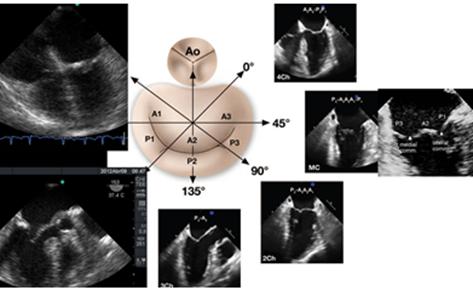
Figura 7 Esquema de VM e imágenes de 4, 3 y 2 cámaras para comprender los distintos segmentos observados de las valvas mitrales, según el ángulo de visualización.
La imagen que nos permite ver integralmente ambas valvas y sus respectivos segmentos es la vista transgástrica a 0° (Figura 8) y la que nos facilita el estudio anatómico del aparato subvalvular y los músculos papilares es la transgástrica entre 80°-130°
El análisis del flujo que cruza la válvula, lo estudiamos con Doppler Pulsado, Doppler Color y Doppler continuo(12).
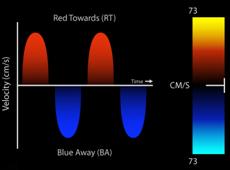
Por convención , el doppler espectral resultante muestra la velocidad en el eje de la Y y el tiempo en el eje X. El flujo que se dirige hacia el transductor, aparece por encima de la línea de base, mientras que el flujo que se aleja, se encuentra por debajo de la línea de base. El Doppler Color, (Figura 9) es una variedad de Pulsado que utiliza una escala de colores, representada, en el flujo laminar, con rojo (flujo que se acerca al transductor) y con azul el que se aleja. Cuando el flujo se hace turbulento, debido a una alteración funcional de la válvula, aparecen los colores amarillo y verde, reflejo de un aumento en la velocidad de la sangre al cruzar una válvula patológica anatómica o funcionalmente(13). (Figura 10)(Figura11)
Rojo positivo y laminar, se acerca a imagen transgástrica (140°), tracto salida transductor. Azul negativo, se aleja el transductor del ventrículo derecho (TSVD).
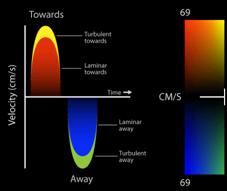
Figura 10 cuando la velocidad es elevada por flujo turbulento aparecen los colores amarillo y verde.
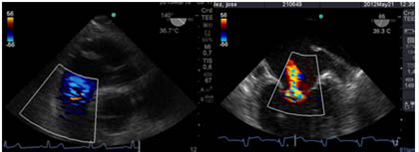
Figura 11: Izquierda: flujo turbulento por insuficiencia pulmonar leve. (TG profunda TSVD). Derecha: imagen a 66° medioesofágico 2 cámaras flujo turbulento por insuficiencia mitral moderada.
Con doppler pulsado (en imágenes medioesofágicas de 4 y 2 cámaras) podemos analizar la característica del flujo que atraviesa la válvula y podemos valorar integralmente la diástole cardíaca izquierda(14). Luego de un tiempo normal de relajación isovolumétrica (TRIV) cuyo valor normal es de 150 a 240m/s, es el tiempo de comienzo de la díastole fisiológica, es decir de la relajación ventricular, donde la válvula aórtica ya se cerró y aún no se abrió la mitral. Cuando se abre la válvula mitral se genera la onda E ,de llenado temprano, cuyo valor normal es entre 50 y 80cm/seg. Luego las presiones entre la aurícula y el ventrículo se igualan, deja de pasar sangre,este periodo se llama Diastasis. (Figura 12) Para finalmente la aurícula izquierda en su función de bomba generar la diástole tardía a través de la onda A.
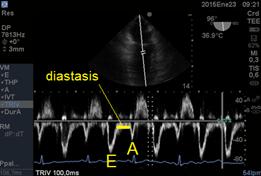
Figura 12: imagen de 2 cámaras medioesofágico (96°) con Doppler Pulsado onda E llenado diastólico rápido, diastasis y onda A de llenado lento por contracción auricular.
Al finalizar la cirugía, el análisis ecocardiográfico se enfocará en la búsqueda de insuficiencia residual si se realizó plástica, o de documentar el correcto funcionamiento de la válvula mecánica o biológica, en caso de reemplazo. Con ETE, valoraremos la función ventricular sistólica y diastólica post CEC(15) y también la presencia de SAM(16) (motilidad sistólica anterior) de la válvula mitral con obstrucción al tracto de salida del VI, posible complicación de la reparación mitral(17). Por último, analizar la motilidad de las paredes ventriculares, sobre todo el territorio irrigado por la arteria circunfleja(18).
INSUFICIENCIA MITRAL
Ésta es tal vez la patología donde ETE, tiene un impacto más profundo(19). Es muy importante reconocer la causa de la insuficiencia mitral (IM), ya que, cuando la IM severa lleva al paciente al quirófano y según el mecanismo de la lesión, el paciente puede ser beneficiado con plástica mitral(20).
Con eco 2 D y Doppler,(21) podemos observar alteraciones fisiopatológicas como el prolapso con ruptura de cuerdas tendíneas. Las anormalidades morfológicas nos muestran la localización de la lesión (si es central, lateral o media). Por lo general, la extensión del segmento patológico se correlaciona con la severidad de la IM. En la enfermedad degenerativa mitral (degeneración mixomatosa), se afectan todos los componentes del aparato mitral.(21) El anillo se dilata, las valvas son redundantes y las cuerdas tendíneas elongadas.
Según la etiología la IM, se clasifica en orgánica (lesión de la válvula), o funcional (cuando el problema está en el ventrículo izquierdo o en los músculos papilares).
En nuestro país, la causa más frecuente de IM orgánica, es la valvulopatía degenerativa, seguida de la reumática y por endocarditis.
La IM funcional, se ve en pacientes con infarto y con miocardiopatías isquémica o dilatada. Acá la relación entre anatomía y función es más compleja, la dilatación global o regional del ventrículo izquierdo desplaza los músculos papilares inferior y lateralmente, traccionando así las cuerdas tendinosas, y éstas a las valvas, dando una morfología en tienda de campaña (“tenting”), dando como resultado final cierre incompleto e IM.
Mecanismo de la IM según la clasificación de Carpentier´s(21):
Clase 1: con motilidad normal de los velos y se debe a por ejemplo dilatación del anillo por una miocardiopatía dilatada(Figura 13), o perforación de los velos en endocarditis.
Clase2: excesiva motilidad, causada por prolapso(Figura 14) o ruptura de cuerda tendínea. Ecocardiográficamente es prolapso cuando la válvula sobrepasa el plano mitral más de 2mm.
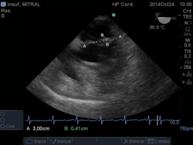
Figura 14 imagen de 4 cámaras medioesofágico a 0° , prolapso válvula mitral mayor a 0.2cm por encima del plano del anillo mitral.
Clase 3: motilidad restringida , cusada por enfermedad degenerativa o mixomatosa de la válvula o el aparato subvalvular mitral.
Valoración con ETE(21): Luego de la inducción anestésica colocamos la sonda y comenzamos a realizar una valoración completa del corazón logrando las 28 imágenes recomendadas por las guías actuales para realizar un exámen completo(22), luego valoramos la morfología y función de la válvula mitral en 2D desde medioesofágico 4,3 y 2 cámaras, y transgástrico a 0° y 90°. El principal objetivo, es corroborar los hallazgos preoperatorios y realizar un completo exámen cardiovascular, para documentar el estado cardíaco basal, funciones sistólicas(21) y diastólica(22), presión de arteria pulmonar, estado de la función cardíaca derecha y analizar las otras válvulas cardíacas en busca de anomalías no detectadas en el preoperatorio.
Luego con Doppler Color, analizamos la dirección del chorro regurgitante que es opuesta a la valva comprometida, el tamaño del jet regurgitante y su relación con el área de la aurícula izquierda (AI). Debemos tener en cuenta que el mapeo color del chorro regurgitante está influenciado por parámetros del ecógrafo: ganancia, PRF, límite de Nyquist, y por parámetros fisiológicos: presión arterial, volemia.
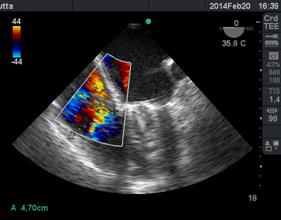
Otro factor que afecta el tamaño del chorro es la dirección de éste, los centrales en la aurícula aparecen más grandes con Doppler Color, que aquellos excéntricos que corren sobre la pared auricular, generando un efecto coanda (Figura 15), con un volumen regurgitante muy similar y que por su sola presencia le confiere severidad.
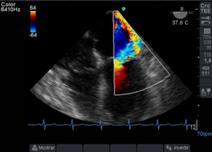
Figura 15 imagen de 4 cámaras medioesofágico con insuficiencia mitral severa, observada con Doppler color (escala 64) con efecto “coanda”, reflujo hacia la pared de AI.
Clasificamos la IM en leve si el área del jet es < 4cm2, o <20% del área de la AI; moderado de 4-8cm2 y severo mayor de 8cm2.
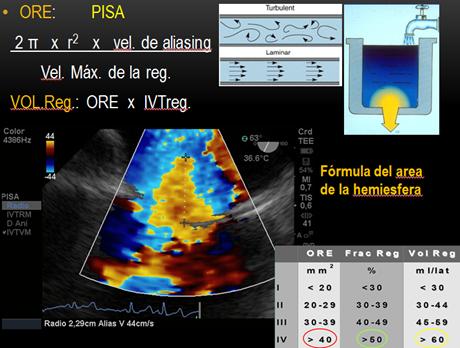
Analizamos la vena contracta (el orificio fisiológico de la regurgitación, es el cuello o la parte más estrecha del jet distal al orificio regurgitante), IM leve < a 3mm y severa mayor a 7mm. Luego el orificio regurgitante efectivo y el volumen regurgitante por los métodos de convergencia del flujo o área de la superficie de isovelocidad proximal (PISA) y de cuantificación(21) PISA(22) se basa en un principio hidráulico, donde la sangre que se aproxima a un orificio circular va formando capas concéntricas de isovelocidad creciente y superficie decreciente. En condiciones ideales, en un orificio circular pequeño sobre una superficie plana, estos contornos de isovelocidades tienen una forma hemiesférica. Por el principio de continuidad, el flujo en cada uno de estos contornos es igual, y a su vez igual al flujo a través del orificio valvular. Si podemos calcular el área de cualquiera de estos contornos y estimar su velocidad podemos calcular el flujo (flujo=Area x velocidad) (Figura16). Si la forma de los contornos de isovelocidad es hemiesférica entonces:
La velocidad de la hemiesfera, la obtenemos del mapa color donde ocurre el primer aliasing.
Ajustamos la velocidad de aliasing, para poder ver la hemiesfera circular y asumiendo que el máximo radio de esa hemiesfera coincide con la máxima velocidad de la IM, se puede calcular el orificio regurgitante efectivo con la siguiente fórmula:
Donde Va es la velocidad de aliasing y la Vreg pico, es la velocidad pico de la IM tomada con Doppler continuo. Y cuando ORE es mayor de 0.4 cm2 es IM severa y ORE menor de 0.2 cm2 es leve.
A partir del ORE calculamos el Volumen Regurgitante (VR):
Donde IVT, es integral velocidad tiempo en este caso del jet regurgitante. VR, mayor de 60ml y de 30ml es grave para las IM orgánicas y funcionales respectivamente.
MÉTODO VOLUMÉTRICO
Cuando la VM es insuficiente, tiene más flujo que las otras válvulas, ya que en cada latido tiene que pasar a través de ella el volumen sistólico efectivo más el volumen que se escapó por la insuficiencia en el latido anterior. Ese exceso de flujo, permite cuantificar la insuficiencia. El volumen total se puede calcular como el flujo por la válvula enferma. El flujo efectivo o volumen latido, se calcula como el flujo por una válvula sana. El volumen regurgitante (VR) es la diferencia de esos volúmenes, total y efectivo.
Para obtener los volumenenes debemos medir los anillos de la VM y del tracto de salida del VI, donde la mitad del diámetro es el radio, para luego medir el IVT (es la sangre que pasa por esa válvula).
Con Doppler Pulsado calculamos el volumen latido (VL):
Donde TSVI=tracto de salida de ventrículo izquierdo y ATSVI=es el área transversal del TSVI. En ausencia de insuficiencias izquierdas el VL debe ser igual tanto a nivel del TRSVI como en el anillo mitral. En caso de IM, el volumen latido mitral será mayor que el aórtico y la diferencia con éste último, el volumen regurgitante.
El exámen se completa cuando analizamos la repercusión del jet regurgitante hacia las venas pulmonares. Cuando la insuficiencia es severa, se observa una S invertida (Figura 17) en venas pulmonares(21). Recordemos que todo lo que le ocurre al corazón izquierdo repercute en las venas pulmonares y por lo tanto analizar el flujo con Doppler Pulsado, nos ayuda a comprender no solo la severidad de la IM sino también, analizando la relación de las ondas S , D y Auricular podremos comprender la función diastólica izquierda.
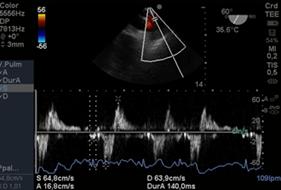
Figura 17 Izquierda:imagen de Vena Pulmonar Superior Izquierda con Doppler Pulsado con inversión de onda s, en Insuficiencia Mitral Severa. Derecha: post reparación mitral: onda S positiva, normal, ante la ausencia de insuficiencia mitral severa
Onda E del anillo mitral (Figura 18): cuando la IM es severa hay hiperflujo generando una onda por encima de 1.5cm/s.
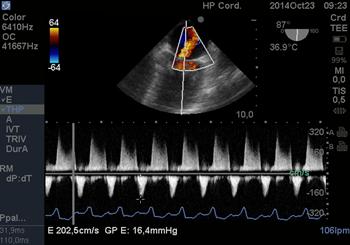
Figura 18 imagen medioesofágica de 2 cámaras a 87° con gradienteelevado, onda E mitral de 2m por IM severa holosistólica (Doppler Continuo).
En la valoración post circulación extracorpórea (CEC) luego de plástica mitral, debemos lograr estabilidad hemodinámica y adecuada presión arterial para poder valorar si existe IM residual . Se acepta que la IM sea leve, de lo contrario se vuelve a CEC hasta una definitiva reparación o recambio valvular.
La intervención quirúrgica de IM primaria consistirá en una plástica mitral si se puede lograr una reparación exitosa y duradera. El éxito de la reparación es documentado con ETE y dependerá de la morfología de la VM y de la experiencia quirúrgica.
En la IM se debe informar:
a)Etiología
b)Severidad de la insuficiencia
c)Dimensiones y Función del Ventrículo Izquierdo
d)Enfermedad de otras válvulas
e)Posibilidad de Cirugía conservadora
Resumiendo, en las siguiente tablas se pueden apreciar los distintos métodos que existen para estudiar en forma completa el grado de patología Mitral y su repercusión hemodinámica. (Tabla1)(Tabla2) (Tabla3).
| Area del jet de insuficiencia | Dependiente de carga. Jet contral o Excéntrico (efecto Coanda). Ajustar: | Ganancia color y Profundidad |
| PISA | ORE= Radio PISA2 ( escala color 40, pre- 2 sión arterial normal) |
| % área de Jet/área de AI | Inexacto, no se ve toda la AI |
| Fujo en venas pulmonares | Con Doppler pulsado S/D/Au |
Tabla 1: Métodos directos de valoración de la IM
| LEVE | MODERADO | SEVERO | |
| Area Jet (cm2) | <4 | 4-8 | 8 |
| Vena Contracta (mm) | <0.3 | 0.33-0.69 | >0.7 |
| Onda E llenado mitral | E> 1.5 m/s | ||
| ORE | <0.2 cm2 | 0.2-0.39 cm2 | >0.4 cm2 |
| VR | <30 ml | 30-59 ml | >60 ml |
Tabla 2: Criterios de severidad de IM
ESTENOSIS MITRAL
La principal causa es la enfermedad reumática. Otras causas incluyen la congénita, mixomas de gran crecimiento pueden presentarse como estenosis mitral (EM), vegetaciones por endocarditis y por último la enfermedad degenerativa frecuente en pacientes añosos(31).
En la anatomía patológica de la válvula se puede ver el engrosamiento y calcificación de los velos, se fusionan las comisuras y las cuerdas tendinosas, dando disminución efectiva del orificio valvular y un aspecto en “boca de pescado”.
La EM lleva con el tiempo a la elevación de las presiones de la aurícula izquierda (AI), hipertensión arterial pulmonar, disfunción del ventrículo derecho y de la válvula tricúspide (con o sin compromiso reumático). La elevación crónica de la presión de AI, produce dilatación auricular, flujos de sangre disminuidos (contraste espontáneo o humo) y la formación de trombos.
Exámen con ETE:
El tamaño de la aurícula izquierda (Figura 19) lo conocemos por la valoración ecocardigráfica del preoperatorio,(32) ya que la proximidad de la sonda a la AI nos impide incluir la imagen de la aurícula en su totalidad. Si podemos medir el diámetro anteroposterior el cual normalmente mide hasta 45mm, y excluir la presencia de trombos.
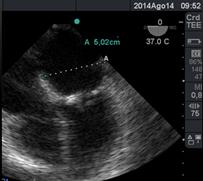
Figura 19 en imagen de 4 cámaras a 0° medición de AI en su diámetro antero-posterior 5.02cm por agrandamiento de AI.
El eje corto transgástrico basal 0° nos permite una visión del orificio anatómico para realizar la planimetría directa de la válvula. (Figura 20) Este método permite realizar mediciones en pacientes con fibrilación auricular y lesiones regurgitantes asociadas. Cuando el área es < o = de 1.5cm2 la estenosis se considera severa(33).
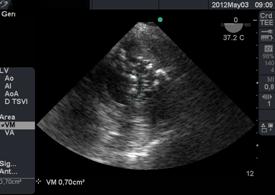
Figura 20 imagen transgástrica a 0° medición por planimetría de VM , estenosis severa (menor a 1cm2)
Luego de valorar el daño valvular en 2D,utilizamos el Doppler para estudiar los gradientes transvalvulares máximos(34). Usando la ecuación de Bernoulli es posible determinar los gradientes transvalvulares como una medida de la severidad de la lesión. El gradiente de presión diastólica se mide con Doppler Continuo el “gradiente medio” es el que mejor expresa la gravedad de la enfermedad: leve < de 5mmHg, medio de 5 a 10 severo gradiente medio >de 10mmHg.
La cuantificación del área valvular se realiza por planimetría directa o por el Tiempo de Hemipresión(THP). Este método desarrollado por la Dra. Hatle , establece que el tiempo de caída de la presión diastólica pico a la mitad de su valor inicial, está inversamente relacionado con el área valvular mitral (AVM) :
AVM=220/THP (donde 220 es una constante empírica).(35)(36)
El tiempo de hemipresión (THP), (Figura 21) también está relacionado con el gradiente inicial y la compliance ventricular. Su medición es confiable, sencilla y rápida.
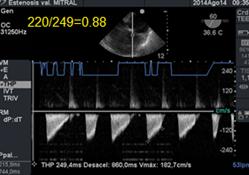
Figura 22 con Doppler Continuo medición y cálculo del área mitral a través del tiempo de hemipresión. Estenosis severa.
Otras técnicas para el cálculo del AVM incluyen la ecuación de continuidad y la aceleración proximal, son menos populares por ser más complejas.
La historia natural de la enfermedad conduce a una disfunción de ventrículo izquierdo (VI) a causa de una restricción funcional causada por la unión del VI a un aparato valvular engrosado e inmóvil. La aurícula izquierda se agranda, se puede ver humo, hiperecogenicidad por ectasia sanguínea (Figura 22), lo que conlleva mayor riesgo de formación de trombos, con ETE los trombos en el apéndice auricular izquierda se pueden detectar y planificar así el cierre quirúrgico de la orejuela
La disfunción ventricular derecha (VD), puede estar presente y puede indicar mal pronóstico, es importante en el examen ecocardiográfico(37) inicial, documentar no sólo el grado de hipertensión pulmonar sino también la función sistólica del VD (a través de TAPSE y s´tisular).(38) (39) La medición de la presión sistólica de la arteria pulmonar (PSAP) se realiza a través de la medición de la presión sistólica del VD medida con Doppler Continuo, en el reflujo tricuspídeo (desde la vista ecocardiográfica bicava modificada entre 50° y 70°)(Figura 23); a lo que sumamos la presión de aurícula, presión venosa central (PVC): (40)(41)
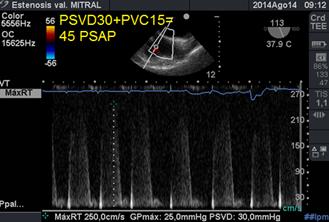
Figura 23 imagen bicava modificada: medición de la presión sistólica de arteria pulmonarcon Doppler continuo en reflujo tricuspídeo.
En EM se debe informar:
- Aspecto de la válvula
- Severidad de la lesión
- Presiones de cavidades derechas y función del Ventrículo Derecho
- Enfermedad de otras válvulas
- Tamaño de la AI. Presencia de trombos en AI y orejuela.
En las siguientes tablas se abarcan los métodos integrales de estudio de Estenosis Mitral (Tabla 4) y criterios de severidad (Tabla 5).
| Tamaño de Aurícula Izquierda | Díametro anteroposterior > 45 mm Excluir trombos |
| Planimetría valvular | Transgástrico 0° eje corto basal |
| Tiempo de Hemipresión | Con Doppler transvalvular |
| Gradiente medio Diastólico | En fibrilación auricular (FA) promedio de 5 latidos |
| Presión Sistólica de Arteria Pulmonar | PAPsistólica= 4 x (Velocidad del reflujo tricuspídeo)2 + PVC |
Tabla 4: Métodos de valoración
| NORMAL=4-6cm2 | LEVE | MODERADA | SEVERA |
|---|---|---|---|
| AVM (cm2) | >1.5 | 1-1.5 | <1 |
| Gradiente Medio Diastólico mmHg | <5 | 5-10 | >10 |
| PAPsistólica mmHg | < 30 | 30-50 | >50 |
| THP (mseg) | <150 | 150-200 | >220 |
Tabla 5: Criterios de severidad de la EM Abreviaturas: AVM: área válvula mitral ; PAP: presión arteria pulmonar; THP:tiempo de hemipresión; PVC: presión venosa central.
OTRAS UTILIDADES DE ETE
El cirujano accede a la VM por una incisión longitudinal en la pared derecha de la aurícula izquierda, por detrás del septum interauricular , incisión que se extiende desde el techo hacia el piso de la aurícula. Este es el abordaje más común cuando la aurícula izquierda se encuentra agrandada (más de 5 cm). Si no fuera así, o cuando se interviene por toracotomía mínima, el abordaje puede realizarse a través de la aurícula derecha con sección del septum interauricular.
Valoración del tabique interauricular post inducción en búsqueda de Forámen Oval (Figura 24) permeable a través de la prueba de las burbujas.
Figura 24 imagen 4 cámaras medioesofágico a 0° opacificación de cavidades derechas, sin pasaje de burbujas hacia la AI: ausencia de Forámen Oval permeable.
O de comunicación interauricular (CIA) (Figura 25), sobre todo cuando la técnica quirúrgica empleó el abordaje transeptal para la plástica o el recambio valvular(42).
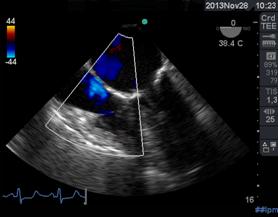
Figura 25 Izquierda: medioesofágica 4 cámaras con Doppler Color flujo laminar sin CIA preoperatorio. Derecha: 4 cámaras post operatorio CIA. Doppler Color flujo turbulento
Análisis de la AI y la orejuela (Figura 26), para observar por 2D la ausencia de trombos. Si quedan dudas analizamos con Doppler, primero color, y luego la velocidad de ese flujo con Pulsado donde una velocidad mayor de 20 cm/s garantizan un adecuado flujo sanguíneo (Figura 27), una orejuela libre de trombos.(43).
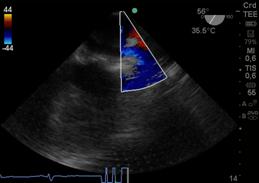
Figura 26 Izquierda: 2 cámaras ME Doppler Color Flujo en orejuela AI. Derecha: Doppler Pulsado en orejuela AI flujo normal velocidad de 60cm/s
Figura 27 Izquierda: trombo en valva anterior de VM.Derecha: con Doppler Pulsado orejuela AI ausencia de flujo baja velocidad:15cm/s.
No olvidar de mirar las otras válvulas ya que a veces el completo tratamiento quirúrgico implique la plástica o el recambio de por ejemplo la válvula tricúspide.(44) (Figura 28)Cuando el anillo mide más de 4cm está inicado su tratamiento:
El reemplazo valvular puede corresponder a válvula mecánica (Figura 29) o biológica (Figura 30). Luego de CEC valoraremos la presencia de jets centrales normales y la ausencia de pérdidas periprotésicas, y medimos su gradiente medio.(45)
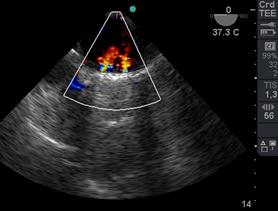
Figura 29 4 cámaras ME Doppler Color 2 jets leves, centrales y normales de regurgitación mitral luego de reemplazocon válvula mecánica. Imagen de VM mecánica bivalva.
En el examen completo de ETE, no debemos olvidar de observar los pulmones,(46) en búsqueda de posibles derrames pleurales (Figura 31) que pueden ocurrir, en pacientes que ingresan por insuficiencia cardíaca descompensada, y donde su drenaje contribuye indudablemente a la recuperción integral cardio-pulmonar.
Figura 31 imagen de aorta toráxica en eje corto a 0° y debajo se observa imagen hipogénica correspondiente a derrame pleural izquierdo.
Los tumores (Figura 32)como los mixomas, cuando alcanzan gran tamaño se comportan como los grandes imitadores de enfermedades valvulares y cómo en este caso se comporta como EM.
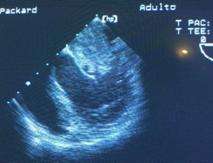
Figura 32 Izquierda: ME 4 cámaras tumor. Derecha: tumor mixoma auricualar izquierdo entrando al VI en diástole.
Finalmente, la ecocardiografía (Figura 33) 3D proporciona imágenes de alta resolución, observando la VM dede la aurícula izquierda reflejando la misma visión que tiene el cirujano luego de la atriotomía izquierda. (47)
CONCLUSIÓN
La ETE, es un excelente monitor, imprescindible, para valorar la correcta reparación de la VM. Puede esclarecer la lesión valvular, el grado de afectación, y su mecanismo.
La reparación de la VM siempre es preferible al recambio valvular, debido a una menor mortalidad operatoria y evitar así las complicaciones inherentes a las válvulas protésicas que tienen a largo plazo.
Como anestesiólogos contamos con un gran monitor, pudiendo ver en tiempo real y en forma integral el corazón y los pulmones. Como parte del equipo quirúrgico podemos contribuir en mejorar los resultados quirúrgicos.