Introducción
La resección de lesiones en áreas elocuentes del cerebro representa un desafío clínico para cirujanos y anestesiólogos. En muchos casos se obtienen mejores resultados cuando la resección se realiza con el paciente despierto dado que esto permite la monitorización neurológica continua, aumentando así las posibilidades de una resección completa y minimizando las secuelas neurológicas.
Existen varias técnicas anestésicas para este tipo de procedimiento que van desde la resección en un paciente con períodos de despertar intraoperatorio hasta la realización de la resección en un paciente despierto durante todo el procedimiento. Lamentablemente, este procedimiento no siempre es bien tolerado, requiere un paciente colaborador y el éxito del procedimiento depende del trabajo equipo.
El rol del anestesiólogo es garantizar la cooperación del paciente, asegurar su confort sin interferir con la monitorización neurofisiológica intraoperatoria y lograr un adecuado control de la hemodinamia cerebral y sistémica. Muchas drogas son utilizadas para lograr la sedación en estos pacientes, como combinaciones de benzodiacepinas con opioides mayores, opioides con droperidol (neuroleptoanestesia) y más recientemente la infusión continua de propofol con o sin el agregado de opioides como fentanilo, alfentanilo o remifentanilo. Desde hace un tiempo disponemos en nuestro medio de la Dexmedetomidina, que parecería cumplir con los requerimientos anestésicos de este tipo de procedimiento. Se trata de un agonista-α2 altamente selectivo, con propiedades ansiolíticas, analgésicas, amnésicas, sin efecto depresor ventilatorio.
El objetivo del presente trabajo es, a partir de un caso clínico, discutir las propiedades y la utilidad de la Dexmedetomidina en la neurocirugía en la cual el paciente es sometido a un período de despertar intraoperatorio.
Caso Clínico
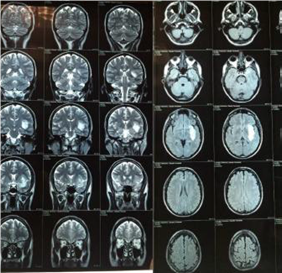
Paciente de sexo masculino, 58 años, 180 cm de altura, peso de 78 Kg, coordinado para resección de lesión temporoinsular izquierda (Figura 1).
Diestro. Neurocirujano plantea realizar la craneotomía con el paciente despierto por la localización del tumor, la cual el paciente entiende y acepta.
Antecedentes personales de hipertensión arterial, bien controlada, en tratamiento con Telmisartán. Alérgico a Ketoprofeno y Acido Acetilsalicílico.
Se planificó una técnica dormido-despierto-dormido mediante la realización de una anestesia intravenosa total. Para tal objetivo se utilizó la infusión continua controlada por objetivos de Propofol y Remifentanilo, con el agregado de una infusión continua de dexmedetomidina.
La monitorización fue la estándar según ASA, agregándose la monitorización de la profundidad anestésica mediante el empleo de Nindex. Colocamos un vía venosa periférica Nº16 G en el miembro superior izquierdo. Premedicamos al paciente con 200 mcg de fentanilo y se procedió a la inducción, la cual se realizó con la infusión de Propofol a sitio efecto de 3,5 mcg/ml y Remifentanilo 7 ng/ml. Alcanzado el valor de 50 en Nindex se administró 30 mg de Rocuronio y procedió a la inserción de una máscara laríngea Nº4 Supreme®. Para el mantenimiento anestésico se disminuyó el Propofol y el Remifentanilo a 2 mcg/ml y 4 mcg/ml respectivamente, y comenzó la infusión de Dexmedetomidina a 0,2 mcg/kg/hora, sin la administración de dosis carga de esta última. Postinducción se realizó una vía arterial radial izquierda y una vía venosa central yugular interna derecha ecoguiada.
Como profilaxis de náuseas y vómitos utilizamos Dexametasona (8mg) y Ondansetrón (8 mg). Como anticonvulsivo administramos Levetiracetam (500 mg).
En el intraoperatorio presentó bradicardia sinusal de 40 lpm, sin repercusión hemodinámica, que revirtió con Atropina 0,6 mg iv. Previo a la incisión quirúrgica, se infiltró el cuero cabelludo con Bupivacaína al 0,125% con Adrenalina (1:200.000) y se bloquearon los nervios: Cigomático-temporal, Supratroclear, Auriculotemporal, Auricular Mayor, Occipital Mayor y Menor. Luego de esto se colocó el cabezal de Mayfield.
Se efectuó la craneotomía con el paciente dormido, seguido de la infiltración de la duramadre con Bupivacaína al 0,125% con Adrenalina (1:200.000) y posterior apertura. Lograda la exposición quirúrgica se suspendió la infusión de propofol y remifentanilo, pasando a la etapa de despertar. Se mantuvo la infusión de Dexmedetomidina a 0,2 mcg/kg/hora. Constatada la ventilación espontánea y que respondiera correctamente órdenes, se retiró la máscara laríngea. Se aportó oxígeno suplementario con una cánula nasal con un flujo de 3 l/min.
Con el paciente despierto, el neurofisiólogo estuvo a cargo de las pruebas de repetición y conocimiento durante la resección. El paciente toleró bien el procedimiento, colaboró con las pruebas (Figura 2).
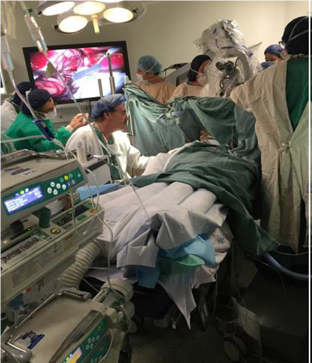
Figura 2: Disposición del paciente, con médico neurofisiólogo realizando test con paciente despierto, mientras se delimita el área a resecar.
La hemodinamia se mantuvo estable así como la ventilación espontánea. Durante la resección el paciente refirió dolor cervical vinculado a la rotación extrema de la cabeza y requirió analgesia complementaria, administrándose 50 mcg de fentanilo.
La resección estuvo limitada por fallas en las pruebas neurofisiológicas efectuadas. Se reinstaló infusión de propofol y remifentanilo con inserción de máscara laríngea para el cierre. El block quirúrgico disponía de material para manejo de una eventual dificultad en el manejo de la vía aérea, contando con un videolaringoscopio AirTraq.
Finalizada la cirugía, el despertar anestésico fue sin incidentes. La duración total del procedimiento fue de cuatro horas y media. El paciente fue trasladado a CTI por parte del equipo anestésico, despierto, estable y colaborador.
Discusión
La resección en el área elocuente del cerebro, con el paciente despierto fue exitosa y esta técnica permitió identificar la extensión del área a escindir. En este paciente la utilización de Dexmedetomidina permitió brindar condiciones aceptables para poder cumplir con los objetivos anestésicos-quirúrgicos planteados.
Existen diversos procedimientos neuroquirúrgicos que requieren la cooperación del paciente, siendo conveniente realizarlos con el paciente despierto. Las resecciones de tumores localizados próximos a áreas motoras o del habla, lesiones vasculares que irrigan áreas elocuentes, biopsia estereotáxica, electrocorticografía para localizar focos epileptógenos y estimulación cerebral profunda en la enfermedad de Parkinson, son algunos de los procedimientos que pueden requerir alguna técnica de despertar intraoperatorio.
El beneficio mayor de realizarlo con el paciente despierto es que permite ajustar la resección para maximizar el tamaño de la misma y minimizar el daño neurológico. Sacko y col, incluyeron 575 pacientes y compararon la tasa de resección macroscópica total y los déficits neurológicos postquirúrgicos entre pacientes despiertos y pacientes con anestesia general sometidos a craneotomía. La craneotomía en el paciente despierto se asoció con una tasa más elevada de resección total macroscópica en el área elocuente (37 vs. 14%, p<0,05), menos déficits neurológicos permanentes (4,6 vs. 16%, p<0,001) y menos déficits neurológicos postquirúrgicos (3,3 vs. 58%, p<0,001).1 A su vez, estos pacientes presentan: mejor estabilidad hemodinámica durante el procedimiento, menor requerimientos de vasopresores, menor uso de antihipertensivos en el postoperatorio, menor uso de analgésicos y menor incidencia de náuseas y vómitos.2 El tiempo de permanencia en recuperación postanestésica es similar en ambos grupos, pero la estadía en el CTI y hospitalaria es menor, con menor consumo de recursos.3 Cabe mencionar que los agentes anestésicos afectan considerablemente la electrocorticografía intraquirúrgica y la craneotomía en el paciente despierto está indicada para minimizar la interferencia farmacológica con los registros. Los agentes elegidos deben tener los menores efectos posibles sobre la supresión o la hiperactivación.4
El despertar intraoperatorio plantea diversas dificultades dado que desde el punto de vista anestesiológico debemos lograr el confort y la cooperación del paciente con mínimas alteraciones hemodinámicas y ventilatorias, prevenir o tratar convulsiones y realizar profilaxis de náuseas y vómitos, utilizando drogas que no alteren el trazado electroencefalográfico. Plantea tres dificultades: proveer una transición rápida y suave de la profundidad de la anestesia en respuesta a las distintas etapas de la cirugía; mantener una función cerebral, hemodinámica y cardiopulmonar estable; y manejar las crisis en un paciente despierto con el cráneo abierto.
Se han descrito varias técnicas anestésicas para dicho fin: vigilancia anestésica monitorizada, sedación consciente, paciente dormido-despierto (asleep-awake), dormido-despierto-dormido (asleep-awake-asleep), sin que ninguna haya demostrado superioridad. Para lograr tal fin, contamos con varias drogas que permiten producir anestesia general y luego un despertar confortable que asegure la colaboración del paciente. Las drogas más utilizadas son: propofol, opiáceos (remifentanilo y fentanilo) y actualmente la dexmedetomidina.
La infusión de propofol con un opioide suplementario es la opción más comúnmente utilizada para la craneotomía en el paciente despierto, ya sea en la técnica dormido-despierto como en la dormido-despierto-dormido. Manninen y col realizaron un estudio con 50 pacientes valorando el uso de propofol con infusión intermitente de fentanilo versus propofol con infusión continua de remifentanilo en pacientes sometidos a craneotomía despierto. No hubo diferencias en el nivel de sedación, analgesia, estabilidad hemodinámica ni respiratoria en ambos grupos y la satisfacción de los pacientes fue similar. Concluyen que la combinación propofol-remifentanilo sería una alternativa adecuada a propofol-fentanilo, con el beneficio potencial de ser mejor titulado.5 A dosis bajas de Remifentanilo (≤ 0,1 mcg/Kg/min), no afecta la electrocorticografía incluso si se mantiene durante el despertar.6) Cuando comparamos diferentes tipos de opioides como Fentanilo, Alfentanilo, o Sufentanilo, no existe diferencia significativa con respecto a la condición operatoria, la electrocorticografía o las pruebas de estimulación.7
La Dexmedetomidina, por sus propiedades farmacocinéticas y farmacodinámicas ha adquirido protagonismo en este tipo de cirugía, en muchos casos desplazando el uso de la combinación de propofol con remifentanilo. Algunos autores plantean que esta droga parecería ser la ideal para la craneotomía despierto.8 Es una droga agonista-α2 altamente selectivo con propiedades sedantes, ansiolítica y analgésica, sin depresión de la ventilación y efectos dosis dependientes. Ha demostrado brindar buena condiciones de sedación y analgesia sin la presencia significativa de depresión respiratoria, descenso de la PaO2 o aumento del CO2. Los efectos cerebrales son consistentes con un perfil neurofisiológico deseable que incluye características neuroprotectoras.9 Su efecto primario es la inhibición de la liberación de noradrenalina, causando la inhibición excitatoria del sistema nervioso central. Actúa a nivel subcortical, sin involucrar los receptores GABA, por lo que no afecta la esfera cognitiva, no genera desinhibición, produciendo un sueño que asemeja al fisiológico y sin interferir en la monitorización neurofisiológica, permitiendo el mapeo cortical.10 Esta droga no suprime la actividad epileptiforme y puede ser utilizada en pacientes para cirugía de epilepsia y tampoco afecta el registro de los microelectrodos para estimulación cerebral profunda en la cirugía de Parkinson.11)(12 Los pacientes se mantienen somnolientos sin signos de agitación o confusión y la infusión de dosis bajas produce sedación que puede ser fácilmente revertida con la estimulación verbal. Cuando se utiliza el BIS para monitorización de la profundidad anestésica, sus valores disminuyen con la infusión de Dexmedetomidina, pero retorna a valores basales luego de la estimulación verbal. Generalmente es utilizada con una dosis carga de 0,5-1 mcg/Kg/h por 20 minutos seguido de una infusión continua de 0,1-0,7 mcg/Kg/h. Durante el mapeo cortical la infusión se mantiene entre 0,1-0,2 mcg/Kg/h, como se realizó en este paciente.
La craneotomía despierto no está libre de complicaciones, apareciendo en el 16,5% de los pacientes, en el 6,4% no se puede completar el procedimiento. La principal causa de falla es la aparición de convulsiones y la pérdida de cooperación del paciente.(13)(14 Es importante optimizar la posición del paciente y lograr el acceso a la vía aérea. Varios autores plantean la utilización de la máscara laríngea para control de la vía aérea, con o sin ventilación espontánea, como se utilizó en este paciente. 15)(17 La ventaja de los distintos tipos de máscara laríngea radica en la facilidad de colocación sin la necesidad de la extensión de la cabeza. Es importante disponer en block quirúrgico de material para intubación difícil, en especial fibrobroncoscopio o algún tipo de video laringoscopio. La obstrucción de la vía aérea puede ocurrir hasta en el 20% de los pacientes, por lo que esta técnica está contraindicada en los pacientes que presentan un Síndrome de Apnea Obstructiva del Sueño. 18 Otra complicación que puede llevar a la falla del procedimiento, ya que aumenta la presión intracraneana, genera disconfort y agitación, es la presencia de náuseas y vómitos, por lo que es importante realizar la profilaxis de estos. Muchas veces no son fácilmente controlados cuando dependen de la apertura dural o de la tracción de los vasos cerebrales. El exceso de sedación puede provocar apnea, hipoxemia, hipercapnia y edema cerebral, mientras que la sedación inadecuada puede traducirse en agitación, hipertensión arterial y taquicardia. Este paciente presentó una de las complicaciones más frecuentes que es el dolor a nivel cervical, que revirtió con la administración de fentanilo. Otra opción terapéutica es el uso de los AINEs que en este paciente estaban contraindicados por el antecedente de hipersensibilidad.
Conclusiones
El éxito de la craneotomía despierto se basa no sólo en el equipo quirúrgico, la monitorización neurológica, el equipo anestésico y la elección de drogas, sino también en la adecuada selección del paciente y colaboración durante el procedimiento.
Varias drogas de uso corriente en anestesiología han demostrado poder lograr óptimas condiciones para realizar este procedimiento. Recientemente la incorporación de la Dexmedetomidina ha permitido mejorar la satisfacción de los pacientes durante la etapa de despertar, así como las condiciones quirúrgicas con mínimas interferencia en la monitorización neurofisiológica.