Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Anestesia Analgesia Reanimación
versión On-line ISSN 1688-1273
Anest Analg Reanim vol.27 no.2 Montevideo dic. 2014
Nuevos anticoagulantes y anestesia regional
Cátedra y Departamento de Anestesiología.
Facultad de Medicina. Escuela de Post-graduados. Universidad de la República. Uruguay.
Dr. Gabriel Cabrera Jorajuria1. Dr. Alejandro Morales1.
Contacto: cabrera.jorajuria@gmail.comTrabajo recibido: 7 de julio de 2014.
Trabajo aceptado: 20 de agosto de 2014.
Índice:
1. Resumen.
2. Introducción.
3. Fisiología de la Hemostásis.
4. Fisiopatología de la trombosis.
5. Base científica de las recomendaciones.
6. Nuevos anticoagulantes.
1) Inhibidores directos del factor Xa.
A) Rivaroxaban.
B) Apixaban.
2) Inhibidores directos de la trombina.
A) Dabigatrán etexilate.
3) Agentes parenterales (argatroban, desirudin y lepirudin).
7. Monitoreo de la anticoagulación con los nuevos anticoagulantes orales.
8. Interrupción temporaria antes de una cirugía y anestesia neuroaxial.
9. Reversión de los nuevos anticoagulantes y tratamiento de hemorragias agudas.
10. Conclusiones.
11. Bibliografía.
-
Resumen.
En los últimos años se ha producido un incremento de la práctica de la anestesia regional en pacientes que reciben fármacos que afectan el sistema fisiológico de la coagulación.
La posibilidad de producirse un hematoma espinal, luego de una punción neuroaxial, en este tipo de pacientes, intranquiliza al médico anestesista. Por lo tanto, es indispensable que el médico anestesista conozca los mecanismos de acción de los diferentes anticoagulantes, sus propiedades farmacológicas y farmacocinéticas para poder así definir el intervalo entre la administración de los fármacos anticoagulantes y el bloqueo neuroaxial, la retirada del catéter y el reinicio de la anticoagulación permitiendo asociar la anestesia regional y la anticoagulación de forma segura para el paciente1.
Este trabajo tiene como objetivo principal realizar una revisión de los nuevos fármacos anticoagulantes y analizar las recomendaciones existentes como para poder hacer un uso racional y seguro en nuestra práctica diaria.
Palabras clave: Anticoagulantes. Anestesia de conducción.
Abstract
New anticoagulants and regional anesthesia
In recent years there has been an increase in the practice of regional anesthesia in patients receiving drugs affecting the physiological coagulation system.
The possibility of a spinal hematoma occurs after neuraxial puncture in these patients, uneasy the anesthesiologist. Therefore, it is essential that the anesthesiologist know the mechanism of action of different anticoagulants, their pharmacological and pharmacokinetic properties to well define the interval between administration of anticoagulants and neuraxial blockade, catheter removal and resetting anticoagulation allowing associate regional anesthesia and anticoagulation safely for patient1.
This work has as main objective to carry out a review of the new anticoagulant drugs and analyze existing recommendations as to make rational and safe use in our daily practice.
Key words: Anticoagulants. Anesthesia, Conduction
-
Introducción
La anticoagulación se utiliza en distintos ámbitos clínicos, incluyendo la trombosis venosa profunda (TVP) peri-operatoria, la profilaxis y la prevención de accidentes cerebro-vasculares en pacientes que sufren fibrilación auricular (FA). La heparina no fraccionada, la heparina de bajo peso molecular y los antagonistas de la vitamina k tales como la warfarina, son las más utilizadas pero presentan desventajas.
Aunque no existe un anticoagulante “ideal”, un anticoagulante óptimo debe ser, además de eficaz y seguro, de administración oral; no debe requerir monitorización diaria, debe tener un efecto anticoagulante predecible, ser de rápido inicio y corta duración de acción y tener la posibilidad de reversión 2.
Solo unos pocos anticoagulantes son plenamente reversibles, incluida la heparina no fraccionada con protamina y los antagonistas de la vitamina k con concentrados de complejo de protrombina de cuatro componentes.
Los nuevos anticoagulantes orales incluyen el inhibidor directo de la trombina de nombre dabigatrán etexilato (pradaxa, Boehringer- Ingelheim Pharma Gmbh, Ingelheim Rhein, compañías que producen el fármaco) y el inhibidor de factor Xa directo, rivaroxabán (xarelto, Johnson y Johnson/Bayer, compañías que producen el fármaco) y apixaban (eliquis, Bristol Myers Squibb/Pfizer, compañías que producen el fármaco)3. Algunas de las ventajas de estos nuevos agentes son su relativamente rápido inicio y corta duración de acción y su efecto de anticoagulación predecible que permite no requerir de una monitorización diaria de la coagulación. Sin embargo, puede ser importante que se realice un seguimiento clínico en algunas situaciones clínicas, especialmente cuando se necesita una evaluación del estado de anticoagulación.
Como los nuevos anticoagulantes orales están sustituyendo cada vez más a los viejos agentes parenterales y a los antagonistas de la vitamina k en la práctica clínica, es importante considerar que los pacientes que son tratados con estos agentes estarán expuestos a diferentes situaciones clínicas (hemorragias espontáneas y peri-operatorias, sobredosis, trauma y cirugía electiva o de emergencia) que requieren intervención. También existe una preocupación creciente sobre cómo tratar a los pacientes bajo estos agentes terapéuticos luego de un trauma o en el ámbito peri-operatorio.
-
Fisiología de la Hemostasis
Para poder entender el mecanismo de acción de los fármacos anticoagulantes es prioritario el conocimiento de la fisiología de la hemostasis y los nuevos conceptos que actualmente se vienen introduciendo.
La hemostasis se inicia cuando el colágeno subendotelial es expuesto al vaso sanguíneo. Este mecanismo consta de 4 fases:
-
Vasoconstricción localizada en el área afectada.
-
Formación de un trombo de plaquetas en la superficie vascular lesionada.
-
Formación de fibrina que refuerza el trombo plaquetario.
-
Fibrinólisis.
1. Inmediatamente después de la lesión vascular se produce vasoconstricción, permitiendo la reducción del flujo sanguíneo, estasis circulatoria favoreciendo la formación del trombo plaquetario.
2. En la formación del trombo plaquetario se distinguen dos procesos: la adhesión plaquetaria al subendotelio y la agregación plaquetaria a las plaquetas ya adheridas al subendotelio.
Adhesión plaquetaria: como consecuencia de la lesión vascular, las plaquetas se adhieren a las estructuras subendoteliales que han quedado expuestas, cambian de forma (discoidea a esférica) y emiten seudópodos logrando una máxima adherencia, iniciando el trombo plaquetario4.
Agregación plaquetaria: una vez adheridas, las plaquetas son activadas por una serie de reacciones bioquímicas complejas, en la cual el calcio tiene un papel fundamental, que terminan dando por resultado la liberación de gránulos. Estos gránulos contienen adenosin difosfato (ADP), factor de agregación plaquetaria (FAP) y tromboxano A2 (TX2) que produce una mayor estimulación de la adhesión y agregación plaquetaria generándose el trombo plaquetario4.
3. La formación de fibrina (coagulación plasmática) consiste en el pasaje de fibrinógeno a fibrina, reacción catalizada por la trombina (enzima formada a partir de la activación de la protrombina).
Actualmente el modelo celular viene sustituyendo al modelo clásico de coagulación (cascada intrínseca y extrínseca) ubicando a las plaquetas activadas en el centro de atención, lo cual parece ser una aproximación mas fidedigna de lo que ocurre “in vivo” 5.
Este modelo celular es un mejor método para entender las complejas interacciones entre: los factores anti y pro coagulantes, el rol fundamental del factor tisular y la interacción vascular-hemostasis6.
También se destaca el importante rol que juega la trombina en la coagulación, siendo esta la llave para entender porque cualquier estrategia de anticoagulación exitosa depende en la inhibición de dicho factor7.
El modelo celular comprende tres etapas: Iniciación, amplificación, propagación.
Iniciación: Frente a un daño endotelial queda expuesto el factor tisular que interacciona con las células transportadoras del factor tisular (monocito). Estas células transportan y presentan el factor tisular a su ligando, factor VII, activándolo, quien posteriormente produce la activación de los factores IX y X. La activación del factor IX y X crea una pequeña cantidad de trombina (factor II) a partir de protrombina en la superficie plaquetaria4.
Amplificación: Esta etapa se produce en la superficie de la plaqueta activada. La trombina, una vez generada, produce un feed-back positivo activando más factor V, VIII y plaquetas, acelerando y amplificando la generación de trombina4.
Propagación: La trombina produce la activación del factor VIII que junto con la activación del factor IX lleva a una explosión en la producción de trombina
La continua generación y activación de la trombina produce un mayor feed-back positivo permitiendo la transformación de fibrinógeno en fibrina y la concreción de un coagulo estable4.
4. Fibrinólisis: destrucción de la fibrina formada durante la coagulación. La fibrina es digerida gracias a la acción de la plasmina que es formada a partir de su precursor inactivo en el plasma denominado plasminógeno. Esta activación del plasminógeno a plasmina se puede lograr de dos modos: vía “intrínseca”, iniciada con el complejo de contacto y vía “extrínseca”, mediante el activador tisular del plasminógeno y la uroquinasa.
El activador tisular del plasminógeno, liberado por las células endoteliales, es el principal activador fisiológico del plasminógeno. Es poco potente cuando esta libre en plasma; pero posee una gran afinidad por la fibrina; en su presencia, la activación del plasminógeno se acelera intensamente, lo que favorece la lisis local de la fibrina sin que se produzca una fibrinólisis generalizada4.
-
Fisiopatología de la trombosis.
La hiper coagulabilidad y la consiguiente formación del trombo, resulta de una ruptura en este equilibrio, que se inclina a la formación del coagulo8.
En la actualidad, la trombosis arterial o venosa, junto a los procesos embólicos, que pueden aparecer como complicación de una trombosis, son una de las causas más importantes de enfermedad y muerte4.
En 1856 Virchow planteó que la triada formada por las estructuras vasculares (lesión en la pared del vaso), el flujo sanguíneo (estasis sanguínea) y los factores de la coagulación (hiper coagulabilidad) tenía gran importancia en la patogenia de la trombosis. La interacción de estos tres factores son los que condicionan la aparición de una trombosis en el compartimiento vascular4.
En la trombosis arterial la alteración de la pared vascular y la activación plaquetaria desempeña el papel más importante.
En la trombosis venosa, la estasis circulatoria y las alteraciones de los mecanismos de la hemostasis son los factores con mayor importancia patogénica. El trombo venoso es rico en fibrina y hematíes.
Es así que en los pacientes recién operados, coincide la estasis de la sangre en las venas de los miembros inferiores por la inmovilización en cama, con la entrada al torrente circulatorio de gran cantidad de sustancias extrañas, procedentes de la absorción de tejidos necrosados en el acto quirúrgico, con capacidad para activar los factores de la coagulación.
A esto se suma, en las intervenciones de las extremidades inferiores, la lesión de la pared de los vasos4.
La tromboembolia pulmonar es la complicación más grave de la trombosis venosa profunda. El 90-95% de las tromboembolias pulmonares son causadas por trombosis venosa profunda. Es por esta razón que la tromboembolia pulmonar no se puede entender como una enfermedad independiente de la trombosis venosa profunda por lo que se la denomina actualmente enfermedad tromboembólica venosa4.
Son numerosas las situaciones que predisponen a la trombosis venosa profunda.
Factores de riesgo para la trombosis venosa profunda.
-
Cirugía
-
Trauma mayor o de extremidad inferior
-
Inmovilidad, paresia de miembros inferiores
-
Cáncer
-
Terapia oncológica (hormonal, quimioterapia, inhibidores de la angiogénesis, radioterapia)
-
Compresión venosa (tumoral, hematoma)
-
Enfermedad tromboembólica previa
-
Añosos
-
Embarazo y periodo postparto
-
Anticonceptivos orales o terapia de remplazo hormonal
-
Moduladores selectivos de los receptores de estrógeno
-
Agentes estimulantes de la eritropoyesis
-
Enfermedad médica aguda
-
Síndrome nefrótico
-
Desordenes mieloproliferativos
-
Hemoglobinuria paroxística nocturna
-
Obesidad
-
Cateterización venosa central
-
Trombofilia adquirida o hereditaria
Pero no todas atañen el mismo riesgo ni tampoco la misma capacidad embolígena.
Es así que el riesgo de trombosis venosa profunda asociado al procedimiento quirúrgico en pacientes que no reciben tromboprofilaxis es menor al 10% en cirugía menor; del 10 al 40% en la mayoría de las cirugías generales, cirugía ginecológica o urológica abierta y del 40 al 80% en cirugía ortopédica mayor (de cadera y/o rodilla) y trauma mayor6, 7,8,9.
La embolia pulmonar ocurre en el 1,7% de los pacientes sin tromboprofilaxis vs. el 0,9% de los pacientes con tromboprofilaxis. De todos los casos de embolia pulmonar aproximadamente el 10% fueron fatales6.
Casi todos los pacientes hospitalizados tienen por lo menos un factor de riesgo para enfermedad tromboembólica; aproximadamente 40% tienen 3 o más factores de riesgo. Consecuentemente casi todos los pacientes son candidatos para tromboprofilaxis9.
-
Base Científica de las Recomendaciones
Todas las guías y artículos incluidos en este trabajo destacan que sus recomendaciones actuales no se encuentran basadas en estudios prospectivos randomizados ni en meta-análisis (que son el mayor nivel de evidencia); sino en reporte de casos clínicos, en la farmacocinética de cada agente, en series epidemiológicas y opiniones de expertos9,10,12,13. La razón de esto es obvia, ya que se evita la realización de técnicas regionales en pacientes con riesgo aumentado de hematoma espinal12.
Por otro lado, la introducción de los nuevos fármacos anticoagulantes a la práctica clínica y la escasa literatura en cuanto a su asociación con anestesia regional solo ha permitido basar estas recomendaciones en la farmacocinética individual de cada agente9,10,14.
Estas recomendaciones buscan un balance entre la prevención de una enfermedad tromboembólica (al suspender la tromboprofolaxis) y el riesgo de un sangrado mayor o de un hematoma espinal. Este balance no solo dependerá de la farmacocinética de cada agente; sino del tipo de cirugía, de las características de cada paciente y de la asociación de otros fármacos que puedan modificar la hemostasis14.
Este riesgo se puede minimizar iniciando la tromboprofilaxis en el postoperatorio. Cuanto más alejado se encuentre el inicio de la tromboprofilaxis de la inserción de la aguja o el catéter menor será el riesgo de hematoma espinal14.
Generalmente la tromboprofilaxis se inicia en el preoperatorio. Esta práctica habitual se basa en la creencia de que la formación del trombo sucede en el intraoperatorio y el paciente debe de estar protegido durante ese periodo. La evidencia para esta práctica es débil10.Un meta-análisis que evaluó el inicio de la tromboprofilaxis con heparina de bajo peso molecular 12 horas previo a la cirugía vs. el inicio en el postoperatoria demostró que no se reducía el riesgo de TVP13. Es por esto que un inicio postoperatorio de estas drogas, en pacientes en los cuales se realizará una anestesia regional, sería ventajoso13. Otras de las estrategias utilizadas para minimizar el riesgo de hematoma espinal es restringir la colocación de la aguja o el catéter y su retiro, en el periodo cuando la concentración plasmática del fármaco anticoagulante se encuentre en el nivel más bajo posible9,10,14. Se sugiere que haya transcurrido al menos dos vidas medias, momento en el cual la actividad de la droga es del 25%14. Con un intervalo más prolongado, la concentración plasmática se reduce muy poco, ya que la eliminación se enlentece a partir de ese punto. A pesar de que esta aproximación no garantiza niveles plasmáticos extremadamente bajos de acción anticoagulante, se sugiere que este intervalo de tiempo permite un adecuado balance entre el riesgo de sangrado espinal y el riesgo de trombosis venosa profunda14.
Para el reinicio de la anticoagulación deberán transcurrir 8 hs. entre la retirada del catéter y la máxima actividad anticoagulante (T. máx.) Esto se basa en que se requiere 8 horas en producirse un coagulo estable14. Lo expuesto no quiere decir que se debe esperar 8 hs. en cada paciente, independientemente del fármaco anticoagulante, para reiniciar la tromboprofilaxis, ya que el tiempo en alcanzar el (T. máx.) varía entre los distintos anticoagulantes. En la práctica cuanto mayor sea el (T. máx.) menor será el retraso. Por ejemplo, si el (T. máx.) es de 4 hs. (como en la heparina de bajo peso molecular) el reinicio será a las 4 hs. de retirado el catéter; pero si es el (T. máx.) es de 1 hora el reinicio será a la 7 hs de retirado el catéter14.
Todas las guías resaltan la importancia de una adecuada historia clínica buscando historia de sangrado, seguida de un examen físico exhaustivo en busca de signos que nos hablen de alguna alteración de la coagulación (hematoma, petequias).
Además, el estudio cuidadoso de la historia clínica se realizará valorando el cese de la tromboprofilaxis (si lo tuviese) y la asociación de otros fármacos que pudieran modificar la hemosatasis (AINES, aspirina, fármacos antiagregantes plaquetarios, anticoagulantes orales y dextrán).
Las guías también resaltan el valor del seguimiento postoperatorio, destacando que no solo nos tenemos que enfocar en la prevención del hematoma espinal sino también en el rápido diagnóstico y tratamiento con el fin de optimizar el resultado del potencial daño neurológico.
Esto se puede lograr realizando exámenes neurológicos seriados, utilizando la mínima concentración posible de anestésico local, lo cual favorecerá la detección temprana del hematoma espinal, permitiendo un drenaje temprano de éste.
-
Nuevos anticoagulantes
Dado las limitaciones de la heparina (desarrollo de trombocitopenia, administración parenteral exclusiva) y de la warfarina (respuesta variable, prolongado efecto anticoagulante) en los últimos años se han desarrollado nuevos anticoagulantes.
Estos nuevos agentes buscan actuar sobre un único factor de la coagulación y por lo tanto tener una respuesta más predecible8.
Muchos de estos agentes tienen una vida media prolongada y es difícil revertir su acción si no es con la administración de componentes de la sangre9.
Dentro de los anticoagulantes orales que han tenido mayor desarrollo en la clínica destacamos los inhibidores directos del factor Xa (rivaroxaban y apixaban) y los inhibidores directos de la trombina (dabigatran) 6.
-
Rivaroxabán
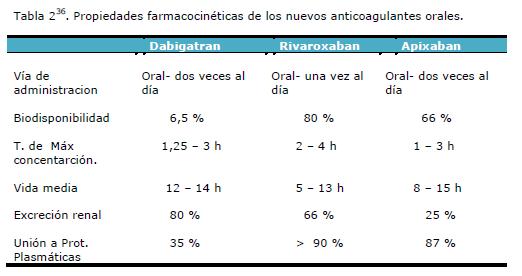
Rivaroxabán es un fármaco de administración oral, potente inhibidor directo del factor Xa 10.000 veces más selectivo por el factor Xa que otras proteasas. Tiene una buena biodisponibilidad (80%). La concentración plasmática máxima se alcanza al cabo de 2 a 4 horas luego de la administración del mismo en voluntarios sanos y de 11 a 14 horas en pacientes mayores15. No requiere de la antitrombina como cofactor. Otra diferencia es su capacidad de inhibir, no solo el factor Xa libre en plasma, sino también el factor Xa unido al coagulo y el unido al complejo protrombina otorgándole una mayor potencia anticoagulante6.
Esta inhibición selectiva del factor Xa se espera que evite la explosión amplificada en la generación de trombina que ocurre durante el estado de hipercoagulabilidad que sucede después de la cirugía de remplazo de rodilla14. Después de su administración, el máximo efecto inhibidor ocurre 1- 4 hs y esta inhibición se mantiene por 12 hs9. Su eliminación es a través del riñón (1/3) y el hígado (2/3) siendo su acumulación menor en comparación con el resto de los agentes que tienen eliminación exclusivamente renal (de importancia para los pacientes con alteraciones renales). La vida media de eliminación es de 5 - 9 horas y no se prolonga en pacientes que tienen insuficiencia renal moderada10. Requiere ajustes de la dosis en pacientes con insuficiencia hepática moderada (Child-Pugh B) y se contraindica en pacientes con insuficiencia hepática severa9. Por tanto la eliminación del rivaroxabán en pacientes con insuficiencia renal se reduce en alguna medida, pero el principal modo de eliminación se realiza mediante mecanismos no renales.
Es imprescindible aclarar que aunque algunos estudios indiquen que aproximadamente el 67% del rivaroxabán se elimina por el riñón, ese total de la eliminación renal representa un 33% de la droga activa y un 33% del rivaroxabán inactivo, lo que no es clínicamente importante. Por consiguiente, dos tercios del rivaroxabán activo se eliminan por mecanismos no renales. Según un estudio farmacocinético, 10 mg de rivaroxabán administrados una vez al día ofrece la mayor eficacia mientras evita complicaciones hemorrágicas. En comparación con la enoxaparina, el rivaroxaban fue superior para prevenir la TVP sintomática y asintomática10. En estos estudios9, se observa un riesgo similar de sangrado entre las dos drogas.
Dada su prolongada vida media se administra una dosis diaria vía oral.
Los primeros 10 mg se administran 6 - 8 hs después de la cirugía10.
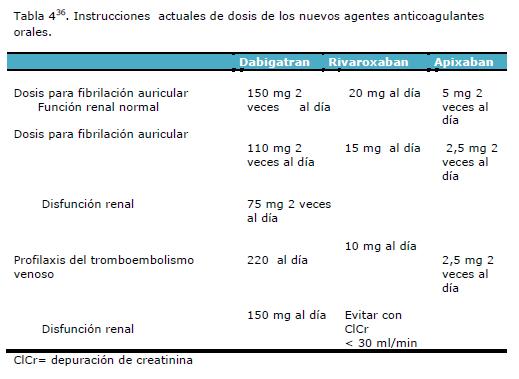
La dosis recomendada de rivaroxabán en pacientes con fibrilación auricular es de 20 mg diarios, aunque se recomienda una dosis reducida de 15 mg en pacientes con depuración de creatinina de 30 ml/min16. Debido a la alta unión a proteínas plasmáticas (90%) el rivaroxabán no se elimina con hemodiálisis17. El rivaroxabán está aprobado en los Estados Unidos, Canadá y Europa para tratar la profilaxis del tromboembolismo venoso luego de una cirugía de reemplazo total de cadera o de rodilla y para la prevención de accidentes cerebro-vasculares en pacientes con fibrilación auricular no valvular.
En las pruebas realizadas para regulación de la coagulación en cirugía ortopédica para prevenir la trombosis venosa profunda y embolia pulmonar (RECORD, por su sigla en inglés) se probó que la administración de 10 mg diarios de rivaroxabán supera la administración de 30 mg dos veces al día y 40 mg una vez al día de enoxaparina para la prevención del tromboembolismo venoso luego de una cirugía de reemplazo total de cadera o rodilla, respectivamente, sin aumentar significativamente la tasa de riesgo de hemorragia grave18,19,20.
En cuanto a la prevención de accidentes cerebro-vasculares, el estudio publicado por Patel et. al21. dónde se administró aleatoriamente (en forma de doble ciego) 20 mg diarios de rivaroxabán (15 mg diarios a aquellos con depuración de creatinina de 15 - 50 ml/min) a 14.264 pacientes con fibrilación auricular en comparación con warfarina en dosis ajustada, se comprobó que rivaroxabán no es menos eficaz que la warfarina, sin presentar una gran diferencia en cuanto a hemorragias graves21.
En pacientes con síndrome coronario agudo, un estudio publicado por Mega et. al. comparó al rivaroxabán, 2,5 mg o 5 mg diarios, con un placebo en pacientes que estaban siendo además medicados con aspirina o tienopiridina (generalmente clopidogrel). Aunque el régimen dosis de 2,5 mg representó una reducción significativa en la mortalidad cardiovascular y por otras causas (también llevó a más hemorragias), la administración de alimentos y fármacos de Estados Unidos expidió una carta de respuesta completa y pidió información adicional22.
Una de sus desventajas es que no dispone de un antídoto específico que antagonice el efecto del rivaroxaban, ni tampoco se puede eliminar a través de la diálisis10.
A pesar de que no exista reportes de hematomas espinales, dada la poca experiencia que se tiene en el empleo de rivaroxaban en combinación con bloqueo neuroaxial, la Sociedad Americana de Anestesia Regional recomiendan evitar las técnicas neuroaxiales en pacientes que van a recibir rivaroxaban9.
Por otro lado las guías Europeas proponen los siguientes intervalos de tiempo para la realización de bloqueos regionales:
Entre una dosis de rivaroxaban y la retirada del catéter deben transcurrir al menos 18 – 20 hs. y desde la retirada a la siguiente dosis hay que esperar al menos 6 horas, si la punción fue traumática diferir la dosis 24 horas9. Es de suma importancia la monitorización neurológica10.
- Apixaban
El apixaban es otro inhibidor directo del factor Xa oral que tiene una buena biodisponibilidad (80%), está altamente unido a las proteínas, su concentración plasmática máxima se alcanza al cabo de 2 o 3 horas luego de la administración del mismo y tiene pocas interacciones con otros medicamentos. Posee múltiples vías de eliminación: 25% excreción renal y 75% por metabolismo hepático y excreción intestinal10. La vida media en personas sanas es de 8 a 15 horas15
Según estudios farmacocinéticos, la dosis recomendada de apixaban para pacientes con profilaxis del tromboembolismo venoso, es de 2,5 mg dos veces al díaF23. En los pacientes a quienes se les administró 2,5 mg de apixaban dos veces al día para tratar la profilaxis del tromboembolismo venoso, el riesgo de hemorragia grave no estuvo influenciado por la función renal24. Además, en la prueba apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation (ARISTOTLE), se evaluó el apixaban en dosis de 5 mg dos veces al día para prevenir accidentes cerebro-vasculares siendo excluidos únicamente aquellos pacientes que tenían depuración de creatinina de 25 ml/min. Por estas razones, no se recomienda ajustar la dosis en pacientes con leve (depuración de creatinina de 30-50 ml/min) o moderada (depuración de creatinina de 30-50 ml/min) insuficiencia renal.
El apixaban se aprobó en Canadá y Europa, como profilaxis del tromboembolismo venoso luego de una cirugía de reemplazo total de cadera o de rodilla con base en los resultados de las pruebas ADVANCE25,26. Actualmente el apixaban está siendo analizado por la Administración de Alimentos y Fármacos de los Estados Unidos para esta indicación.
En la prueba ARISTOTLE, el apixaban resultó superior a la warfarina en dosis ajustada en la prevención de accidentes cerebro-vasculares y embolismo sistémico, con un descenso en las complicaciones por hemorragia y una mortalidad más baja27. El estudio AVERROES es digno de destaque ya que es la única prueba que compara uno de los nuevos anticoagulantes orales (en este caso 5 mg de apixaban dos veces al día) con la aspirina (81- 325 mg) para la prevención de accidentes cerebro-vasculares en pacientes con fibrilación auricular28. Aunque se esperaba que la aspirina confiriera un riesgo de accidente cerebro-vascular menor, lo sorprendente, quizás, es que este tratamiento no generó más hemorragias que la aspirina.
No existe una conducta anestésica para su manejo en relación con el bloqueo neuroaxial. A pesar de esto, la Sociedad Europea de Anestesia, tomando en cuenta su farmacocinética (dos vidas media) propone un intervalo de 26 - 30 hs. entre la última dosis (2,5 mg) y el retiro del catéter, sugiriendo la omisión de una dosis para lograr este objetivo. Después de retirado el catéter, la siguiente dosis de apixaban se podría dar a las 4 - 6 hs10.
Dada la poca experiencia que se tiene en el empleo de apixaban en combinación con bloqueo neuroaxial, se recomienda extremar las precauciones en esta situación y valorar riesgo beneficio de esta técnica10.
2) Inhibidores directos de la trombina.
A diferencia de las heparinas (que inhiben la trombina libre en plasma), los inhibidores directos de la trombina inhiben tanto la trombina libre como la unida a la fibrina evitando un mayor crecimiento del trombo10. Además inhibe de forma indirecta la activación de cofactores V, VII, y XIII así como la activación de las plaquetas mediadas por la trombina evitando la propagación de la coagualción10.
No existe un antídoto específico pero desirudin, lepirudins y argatroban pueden ser eliminados por diálisis10.
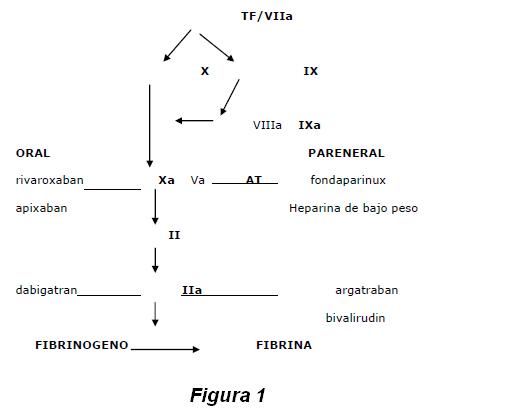
Figura 1. Lugares de efecto de los agentes anticoagulantes. Los nuevos agentes anticoagulantes orales inhiben uno o dos de los mayores objetivos en la cascada de coagulación. El rivaroxabán y el apixaban inhiben directamente al factor Xa y el dabigratán inhibe directamente a la trombina. Los anticoagulantes parenterales que inhiben al factor Xa son la heparina de bajo peso molecular (LMWH, por su sigla en inglés) y el fondiparinux por la unión dependiente a la antitrombina. Los inhibidores parenterales directos de la trombina incluyen en argatrobán, la bivalirudina y la desidurina que a su vez inhibe directamente a la trombina independiente de antitrombina.
-
Dabigatran etexilate
Aprobado para su uso oral en la prevención de TVP en cirugía de coordinación para remplazo de cadera y rodilla10.
Es una prodroga que es metabolizada por estearasas plasmáticas a su metabolito activo, dabigatran10.
Después de su administración oral, posee una biodisponibilidad del 5% y la concentración plasmática se incrementa rápidamente alcanzando su máximo después de 2- 4 hs14. La vida media de 8 hs. después de una única dosis y hasta 17 hs después de múltiples dosis. 80% de la droga se elimina de forma incambiada por el riñón; por lo que está contraindicada en pacientes con insuficiencia renal por la posibilidad de acumulación9.
A pesar de que prolonga el tiempo de tromboplastina parcial activado, este efecto no es lineal y alcanza una meseta a altas dosis. El tiempo de coagulación y el tiempo de trombina serian particularmente más específicos para su monitorización, con una curva dosis respuesta lineal, pudiéndose usar como marcador de inhibición de la trombina9.
La primera dosis es de 140 mg vía oral 1 - 4 hs en el postoperatorio seguido de 220 mg los días subsecuentes10.
Los estudios que existen en cuanto al dabigatran y bloqueo neuroaxial, recomiendan que el catéter se retire en el postoperatorio inmediato (4 - 6 horas) previo a la primera dosis. No existen estudios de utilización concomitante de dabigatran y catéteres peridurales dejados en forma permanente10.
La Sociedad Americana de Anestesia Regional recomienda evitar las técnicas neuroaxiales en pacientes que van a recibir dabigatran9, e incluso se desaconseja la utilización de dabigatran cuando se haya realizado un bloqueo neuroaxial con las consecuencias médicos legales que puede atraer en caso de que se produzca un hematoma9.
A pesar de lo dicho en el párrafo anterior, en la literatura encontramos un acercamiento al manejo de este fármaco y la anestesia regional basado en su propiedad farmacocinética. Se sugiere un proceder similar a él de fondoparinux: retirar el catéter peridural 36 hs. después de la última dosis (dos vidas medias) y su reinicio 12 hs. después de retirado el catéter. Por lo tanto se requiere una ventana libre del fármaco de al menos 48 hs. que se logra, en la práctica, evitando una dosis14.
3) Agentes parenterales (argatroban, desirudin y lepirudin)
Argatroban:
Anticoagulante que ha sido aprobado como alternativa para los pacientes que tiene riesgo o han desarrollado trombocitopenia inducida por heparina (TIH) y que serán sometidos a una intervención coronaria percutánea13.
Se administra de forma intravenosa, con una vida media de 40 min7.
Se metaboliza en el hígado, con eliminación biliar siendo una indicación de su uso los pacientes con insuficiencia renal. También, esta forma de eliminación, los hace recomendables para el tratamiento de los pacientes con TIH tipo II ya que la gran mayoría de ellos tienen afectación renal10.
La dosis intravenosa es de 0,5 - 2 ug/kg/min que se ajusta para obtener un tiempo de tromboplastina parcial activado 1,5 a 3 veces el normal7.
Toma solo 2 - 4 hs. la normalización del tiempo de tromboplastina parcial activado después de suspender la infusión de argatroban gracias a su corta vida media10.
Desirudin y lepirudin
Desirudin está aprobado para ser utilizado en Europa y ahora en Estados Unidos como prevención de la trombosis venosa profunda en cirugía de coordinación para remplazo de cadera y rodilla, de forma subcutánea, dos veces por día, siendo la primera dosis administrada previo a la cirugía7. También está indicada para tromboprofilaxis en pacientes que sufren TIH10.
Lepirudin está aprobado en pacientes con síndrome de TIH tipo II7.
Puede ser monitorizado con el tiempo de tromboplastina parcial activado10.
Después de una inyección subcutánea de desirudin alcanza su máxima concentración plasmática a las 2 hs10.
El tiempo de tromboplastina parcial activado permanece prolongado 8 hs. después de su administración subcutánea. La vida media de eliminación es de 2 - 3 hs., su principal vía de eliminación es la renal y esta marcadamente prolongada en pacientes con falla renal10.
Los principales problemas que se observan con el lepirudin es: la falta de antídoto, el efecto exagerado en pacientes con insuficiencia renal y el desarrollo de una respuesta inmune (Ig G) a sus componentes7. Después de varios días de tratamiento con lepirudin se ha observado la formación de anticuerpos en el 40% de los pacientes, retrasando su eliminación dando como resultado una acción impredecible10.
La Sociedad Americana de Anestesia Regional contraindica la realización de bloqueos en pacientes que se encuentran recibiendo estos tipos de fármacos. Esto se debe a la poca información que existe en cuanto a su uso junto con la anestesia regional y porque la mayoría de los pacientes que requieren estos fármacos, son portadores de TIH, requiriendo dosis de anticoagulación no siendo candidatos para la realización de un bloqueo neuroaxial. También destaca la existencia de informes de hematoma intracraneal espontaneo con estos fármacos9.
Por otro lado la Sociedad Europea de Anestesiología recomienda esperar 8 -10 hs. y si es posible mas, entre la administración de estos agentes y la punción neuroaxial y se recomienda monitorizar con tiempo de tromboplastina parcial activado previo a la punción. Esto se aplica a pacientes con función renal normal y sin la formación de anticuerpos10.
A pesar de que existen casos de administración de desirudin inmediatamente después de una punción neuroaxial, esto no se recomienda dado la farmacocinética del agente. Un retraso de 2 - 4 hs. después de la anestesia neuroaxial es lo que se sugiere10.
-
Monitoreo de la anticoagulación con los nuevos anticoagulantes orales.
Aunque no se requieren pruebas diarias de laboratorio para el tratamiento con los nuevos anticoagulantes orales, excepto por el monitoreo periódico de la función renal (especialmente en pacientes con insuficiencia renal persistente), se deben indicar pruebas del funcionamiento de la coagulación para cualquier paciente anticoagulado que presente una hemorragia aguda, sospecha de sobredosis, o requiera una cirugía de emergencia. Debido al efecto del dabigatrán en la conversión del fibrinogeno a fibrina mediada por la trombina, muchos de los parámetros de las pruebas de rutina se prolongarán excepto por el tiempo de protrombina. El efecto máximo del dabigatrán en los parámetros de coagulación sucede al mismo tiempo que la concentración plasmática pico. Por esta razón, para poder interpretar las pruebas se necesita una demora entre la última dosis administrada de dabigatrán y el momento de tomar la muestra de sangre. Los efectos del dabigatrán pueden medirse mejor usando el tiempo de trombina o el tiempo de trombina diluido, disponible como prueba de Hemoclot29. Otras pruebas que fueron estudiadas incluyen el tiempo de coagulación con Ecarina30, pero esta prueba no está ampliamente disponible. El tiempo de trombina provee un cálculo directo de la actividad de la trombina y aumenta linealmente con la concentración creciente de dabigatrán. Sin embargo, la experiencia con esta prueba indica que es demasiado sensible a los niveles de dabigatrán y por consiguiente, el tiempo de trombina puede prolongarse en el marco del efecto del dabigatrán clínicamente insignificante27. La prueba de Hemoclot tiene mejor correlación lineal con los niveles plasmáticos del dabigatrán y es, probablemente, el método más confiable para medir el efecto anticoagulante del dabigatrán. En la prueba de tiempo de coagulación con Ecarina, la protrombina es convertida en mezotrombina, un intermediario entre la protrombina y la trombina, por la Ecarina de veneno de serpiente. El dabigatrán inhibe directamente a este intermediario, mezotrombina, en forma dosis-dependiente; sin embargo, esta prueba no se utiliza con frecuencia30. También puede utilizarse una prueba disponible más universal que es la del tiempo parcial de tromboplastina activada. Sin embargo, la relación entre la concentración de dabigatrán y el tiempo parcial de tromboplastina es curvilínea, lo que resulta en la disminución de la precisión de la prueba ya que la concentración plasmática de dabigatrán aumenta y pueden presentarse variaciones de medición dentro de la prueba. No obstante, el tiempo parcial de tromboplastina es una alternativa razonable si otras pruebas no están disponibles y un tiempo parcial de tromboplastina normal probablemente mostrará la ausencia del efecto anticoagulante de importancia clínica.
El rivaroxabán y el apixaban inhiben directamente al factor Xa, que forma un complejo con el factor Va y es independiente de la antitrombina. El rivaroxabán causa una prolongación del tiempo de protrombina, aunque puede haber variantes considerables dentro de la prueba en dichas mediciones; y tiene menos efecto en el tiempo parcial de tromboplastina. Sin embargo, estas pruebas no son útiles para medir los efectos fármacodinámicos de los inhibidores orales de los factores Xa31. Recientemente, se desarrolló una prueba específica para los inhibidores orales de los factores Xa que es diferente a la prueba anti Xa usada para monitorear la herapina de bajo peso molecular y puede ser un método óptimo para determinar cuál es el efecto de el rivaroxabán. De todos modos se necesita realizar más estudios32,33.
El rivaroxabán produce prolongación de los parámetros de coagulación dependiente de la concentración en el tromboelastómetro, incluyendo el tiempo R y K sin modificaciones importantes de amplitud máxima, por lo que la prueba no es útil para análisis de rutina. Hasta ahora, la falta de pruebas inmediatas disponibles para medir el grado de coagulación sigue siendo una preocupación considerable, especialmente ante una hemorragia que amenace la vida del paciente donde puede ser necesario un monitoreo de los puntos de cuidado o una prueba de laboratorio rápida.
-
Interrupción temporaria antes de una cirugía y anestesia neuroaxial.
Antes de interrumpir cualquier medicación anticoagulante, debe medirse el riesgo de hemorragia ante el riesgo de trombosis. En el caso del dabigatrán, que se elimina principalmente por mecanismos renales, el momento de la interrupción debe basarse en la depuración de creatinina del paciente y el riesgo de hemorragia asociado con este procedimiento (tabla 1.)34-36. La insuficiencia renal puede ser menos importante en pacientes que toman rivaroxabán, en los que la disminución de la depuración de creatinina parece tener un efecto limitado en la vida media de la droga.

El grupo de trabajo en hemostasia perioperatoria y el grupo francés de estudio de la trombosis y la hemostasia publicaron recomendaciones sobre el tratamiento perioperatorio con los nuevos anticoagulantes orales,37,38.
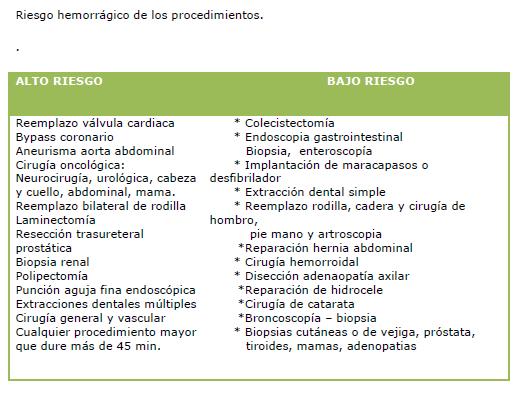
Para cirugías programadas y procedimientos invasivos con poco riesgo de hemorragia recomiendan su interrupción 24 horas (2 vidas medias) antes del procedimiento y reiniciar el tratamiento 24 horas después del procedimiento.
En casos de cirugía programada o procedimientos invasivos con riesgo moderado o alto de hemorragia, se recomienda interrumpir el uso del fármaco 5 días antes de la cirugía y el tratamiento debe ser retomado según el riesgo de hemorragia.
Para los pacientes con mayor riesgo de sufrir trombosis, se debe comenzar un tratamiento con heparina no fraccionada o heparina de bajo peso molecular en dosis curativa 12 horas después de haber suministrado la última dosis de anticoagulantes orales.
Aunque estas recomendaciones parezcan fáciles de seguir y sensatas, se necesitan realizar estudios prospectivos sobre la eficacia y seguridad de estos fármacos. También deben realizarse otros protocolos de procedimiento perioperatorio para pacientes que se tratan con estos nuevos anticoagulantes orales que requieran una cirugía o intervención invasiva.
La seguridad de la anestesia neuroaxial para pacientes tratados con los nuevos anticoagulantes orales estará basada en las propiedades farmacocinéticas de los anticoagulantes (Tabla 2)36.Se debe tener en consideración cuando se coloca un catéter y en menor medida, cuando se extrae éste. Se debe monitorear a estos pacientes para verificar si aparecen signos de hematomas en las primeras horas luego de que se quite el catéter.
En la (tabla 3)36 se muestran las recomendaciones específicas para el tratamiento de estos agentes para la profilaxis del tromboembolismo venoso en el marco de una anestesia peridural o raquidea.
Se sugiere esperar que pasen dos vidas medias antes de extraer un catéter, cuando ya solo queda activo un 25% de la droga. Esperar por un intervalo mayor solamente reducirá algo de la concentración de la droga ya que la eliminación se enlentece luego de este punto39. El riesgo de actividad anticoagulante residual y de hematoma neuroaxial debe medirse ante el riesgo de trombosis venosa profunda. Sin embargo, los autores sugieren que la anticoagulación debe recomenzar 8 horas menos el tiempo para alcanzar la actividad máxima (T max) basándose en el argumento de que toma 8 horas para formar un coagulo estable y permitir que se alcance el pico de anticoagulación39. No obstante, puede haber variación entre el tiempo que se necesita para alcanzar un lecho vascular seco, especialmente luego de una cirugía ortopédica u oncológica importante y puede necesitarse más tiempo en caso de riesgo de hemorragia comparado con riesgo de trombosis venosa profunda 38
Las recomendaciones sobre el uso de los nuevos anticoagulantes orales en el marco de la anestesia neuroaxial fueron propuestas por Llau40, basándose en las instrucciones de dosis ya existentes y las propiedades farmacocinéticas de cada droga (Tabla 3) 36
Un estudio reciente41 evaluó las tasas de hemorragia desde los 7 días previos y hasta 30 días luego de procedimientos invasivos en pacientes a los que se les administraba dabigatrán. Basado en 4.591 pacientes que tuvieron una primera interrupción del tratamiento para someterse a una cirugía electiva o un procedimiento invasivo, al 24,7% de los pacientes se les administraban 110 mg de dabigatrán, al 25,4% se les administraban 150 mg de dabigatrán y al 25,9% se le administraba warfarina. Los procedimientos fueron los siguientes: Inserción de marcapasos o desfibrilador (10,3%), procedimiento dental (10%), procedimiento de diagnóstico (10%), extracción de cataratas (9,3%), colonoscopia (8,6%) y remplazo de articulaciones (6,2%). La última dosis de dabigatrán fue suministrada con una media de 40 horas (rango: 35-85) antes de la intervención, en comparación con una media de 114 horas (rango: 87-144) para la última dosis de warfarina previa a la intervención. No se encontró una diferencia significativa en las tasas de hemorragia peri procedimental grave entre los pacientes que recibieron 110 mg de dabigatrán (3,8%) o 150 mg de dabigatrán (5,1%) o warfarina (4,6%). El riesgo relativo de hemorragia grave con 110 mg de dabigatrán ante el riesgo con warfarina fue de 0,83 (95% CI, 0.59 – 1.17; P = 0.28), y con 150 mg de dabigatrán ante la warfarina fue de 1,09 (95% CI, 0.80–1.49; P = 0.58). Entre los pacientes sometidos a una cirugía de urgencia, la hemorragia se presentó en 17,8% de los tratados con 110 mg de dabigatrán, 17,7% de los tratados con 150 mg de dabigatrán y 21,6% de los tratados con warfarina. No hay información publicada sobre los resultados perioperatorios en pacientes que recibieran rivaroxabán o apixaban y necesitaran someterse a una cirugía electiva o de emergencia.
-
Reversión de los nuevos anticoagulantes y tratamiento de hemorragias agudas.
En pacientes con hemorragia o que requieren una cirugía de emergencia, con frecuencia es necesario revertir inmediatamente los efectos del anticoagulante. Las instrucciones actuales de dosis de los nuevos agentes anticoagulantes están en la (tabla 4)36.
Aunque el tratamiento con cualquier agente anticoagulante en pacientes con hemorragia es un verdadero desafío, es importante destacar que la warfarina y otros antagonistas de la vitamina k no son fáciles de revertir con las terapias disponibles, tales como la vitamina k y/o el plasma fresco congelado. Los concentrados de complejo de protrombina de cuatro componentes son los preferidos actualmente42,43.
Revertir el anticoagulante oral y brindar una buena atención son las consideraciones más importantes y generalmente son suficientes si la hemorragia no es grave o si la cirugía se puede retrasar41. Sin embargo, cuando el paciente presenta un episodio de hemorragia severa que esté relacionada con estos agentes y/o se requiere cirugía urgente, se deben tomar otras medidas.
Para cualquier evento de hemorragia significativo, las medidas iniciales deben incluir la reanimación con fluidos y/o con concentrado de glóbulos rojos y una tentativa de control hemostático local.
Si se sospecha que la causa es la sobredosis de algún anticoagulante, el carbón activado puede ser efectivo para prevenir la absorción adicional de la droga cuando se administró de una a dos horas antes de la ingestión42. El carbón activado no se ha usado en el ámbito clínico y es limitado por su poca probabilidad de uso y la incapacidad de ser usado en un ámbito perioperatorio. La hemodiálisis o hemoperfusión es otra opción potencial para revertir los efectos de los anticoagulantes. El rivaroxabán y el apixaban están demasiado ligados a las proteínas como para ser eliminados mediante estos métodos, pero el dabigatrán es un candidato apropiado para este tipo de terapias.
Desafortunadamente, no será posible que se aplique cualquiera de estos procedimientos en pacientes con hemorragia que estén en shock. Por ello, se debe optar por el uso de agentes procoagulantes en caso de una hemorragia que amenace la vida del paciente. No obstante, a diferencia de cuando se usa plasma fresco congelado o concentrado de complejo de protrombina de cuatro componentes para sustituir los factores II, IV, IX y X que escasean en pacientes tratados con warfarina, la efectividad de dichas terapias de remplazo de factores de coagulación pueden ser limitada en pacientes tratados con los nuevos anticoagulantes orales que no guardan deficiencias de los factores de coagulación y en los que existe un inhibidor del factor coagulante en desarrollo. Se debe discutir, entonces, que proveer niveles supra fisiológicos de factores de coagulación puede no ser eficaz en el marco del efecto de un inhibidor en desarrollo relacionado con los nuevos anticoagulantes orales. Por otra parte, dichos factores de coagulación pueden oprimir tal efecto inhibidor en desarrollo y en caso de hemorragia severa, puede reemplazar a los factores de coagulación que están en escasez debido al consumo.
Aunque el plasma fresco congelado se administra comúnmente para un control inicial de una hemorragia en pacientes anticoagulados, su uso como agente reversible de los nuevos anticoagulantes orales no ha sido estudiado en humanos. La evidencia es insuficiente para recomendar su uso43.
El factor VII activado recombinante (rFVIIa, por su sigla en inglés) se usa cada vez más de una manera “fuera de lo indicado” como un hemostático universal y como un agente de reversión. Sin embargo, no se ha estudiado en humanos su utilización como reversión de los nuevos anticoagulantes orales y los estudios en animales están inconclusos. El balance riesgo-beneficio del rFVIIa debe ser medido cuidadosamente ya que el rFVIIa se asocia con un riesgo incrementado de trombosis arterial en pacientes mayores. A diferencia de otros agentes procoagulantes, los PCCs de cuatro factores se han estudiado como agentes potenciales de reversión en humanos44.
En una prueba pequeña, aleatoria, doble ciega y controlada con placebo, se les suministró a 12 hombres sanos 150 mg de dabigatrán dos veces al día o 20 mg de rivaroxabán (supraterapéutico) dos veces al día por dos días y medio y consecuentemente o un bolo de 50 UI/kg de un PCC de cuatro factores o solución salina43. Luego de un período de suspendido, se les administró el otro anticoagulante respectivamente y el proceso se repitió. La incorporación del PCC revirtió completamente tanto el tiempo de prolongación de la protrombina como el potencial de inhibición de la trombina endógena que se asocia con el rivaroxabán, pero este estudio solo evaluó con parámetros de laboratorio y no se vieron resultados de hemorragia en los voluntarios. Sin embargo, las prolongaciones asociadas con el dabigatrán en las pruebas de coagulación y la demora de acreditación del tiempo de trombina endógena no se corrigieron con la administración del PCC45.
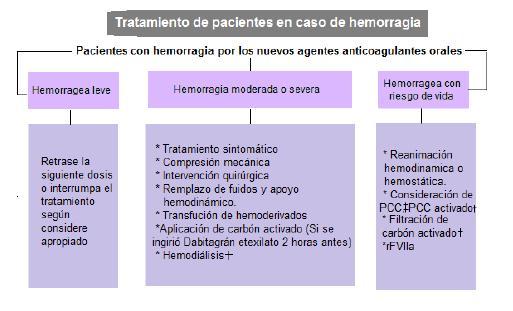
Figura 236. Estrategias de tratamiento de hemorragias en pacientes a los que se les administraron los nuevos agentes anticoagulantes orales. En caso de hemorragia leve, se debe considerar el retraso o interrumpir la siguiente dosis. Los nuevos agentes, incluyendo el dabigatran, el rivaroxaban y el apixaban, aprobado recientemente, tienen una vida media relativamente corta, por lo que interrumpir el fármaco en pacientes con función renal normal, permite disminuir el efecto anticoagulante rápidamente en comparación con la warfarina. En pacientes con hemorragia de moderada a severa se deben considerar los abordajes terapéuticos estándar, incluyendo atención y cuidados que incluyen la reanimación con líquidos, apoyo hemodinámico o la terapia vasoactiva, transfusión de sangre como se muestra en las pruebas e identificación de la fuente de sangrado que pueda requerir cirugía u otra acción. Si los agentes fueron administrados dentro de las dos horas de asimilación del fármaco, entonces se debe considerar la aplicación de carbón activado. En cuanto al dabigatran, la hemodiálisis puede quitar hasta el 60% de la droga luego de varias horas de diálisis y debe de considerarse para pacientes con deterioro de su función renal que estén sangrando y tengan la depuración alterada. El apixaban y el rivaroxaban están ligados altamente a las proteínas y no serán depurados mediante hemodiálisis. Sin embargo el acceso de urgencia a hemodiálisis requiere acceso vascular con un catéter de gran tamaño que puede suponer un riesgo adicional para el paciente anticoagulado. En pacientes cuya hemorragia les supone un peligro de muerte, se debe considerar la reanimación hemodinámica o hemostática, con una terapia similar a la de un paciente traumatico, incluyendo el uso de protocolo de transfusión masiva. Con base en información actual, como se menciono en el artículo el uso de los concentrados de protombina tanto de tres como de cuatro factores deben de ser considerados, dependiendo de su disponibilidad, ya que han demostrado revertir al menos parcialmente el efecto anticoagulante de los nuevos agentes. En pacientes hipertensos es improbable que la hemodiálisis sea tolerada por lo que se deben de considerar métodos alternativos para la hemofiltración de ser necesario.
-
Conclusiones.
Decidir realizar un bloqueo regional en pacientes que reciben algún tipo de fármaco anticoagulante es un desafío a los conocimientos del anestesiólogo. Ambas, la anestesia regional como la anticoagulación peroperatoria, han aumentado considerablemente sus indicaciones, por lo tanto, para no correr un riesgo de sangrado inesperado debemos ajustarnos a un margen de seguridad adecuado que nos permita asociar ambas técnicas.
La introducción de los nuevos fármacos anticoagulantes a la práctica clínica y la escasa literatura en cuanto a su asociación con anestesia regional, solo permite basar las recomendaciones de su uso en la farmacocinética individual de cada fármaco.
Muchos de estos agentes tienen una vida media prolongada y es difícil revertir su acción si no es con la administración de componentes de la sangre. Dentro de ellos se destacan los anticoagulantes orales, inhibidores directos del factor Xa (rivaroxaban y apixaban) y los inhibidores directos de la trombina (dabigatran), que por su fácil administración y sus potenciales efectos han crecido en popularidad.
Por lo tanto, para estos fármacos, tener presente el tiempo de máxima acción y la vida media. La terapia anticoagulante debe ser detenida respetando por lo menos dos vidas medias del agente antes de realizar una punción o retirar un catéter y el reinicio de la anticoagulación por lo menos 8 horas después de la maniobra.
Todo paciente que se realice una anestesia regional con algún grado de anticoagulación requiere monitorización neurológica cuidadosa y continua, pues el reconocimiento temprano de algún tipo de déficit neurológico permite actuar tempranamente con finalidad de minimizar el posible daño.
Agradecimiento
Al Prof. Dr. Victor Bouchacourt por su apoyo desinteresado en proporcionarnos las herramientas para elaborar esta revisión y analizar críticamente los diferentes artículos para desarrollar este trabajo.
A los integrantes de la cátedra de Hematología del Hospital de Clínicas, por su tiempo en revisar este trabajo y ayudarnos en la realización del mismo.
-
Bibliografía:
-
Bouchacourt V. Anticoagulantes y anestesia regional. Anest Analg Reanim 2001; 17 (1): 37-45.
-
Eikelboom JW, Weitz JI: New anticoagulants. Circulation 2010; 121:1523–32.
-
Levy JH, Key NS, Azran MS: Novel oral anticoagulants: Implications in the perioperative setting. Anesthesiology 2010; 113:726–45.
-
Reverter Calatayud JC, Castillo R. Enfermedades de la hemostasis. En: Farreras-Rozman. Medicina Interna. Madrid: Elsevier; 2008. Vol II. Cap. 210.
-
Hoffman M. A cell-based model of coagulation and the role of factor VIIa. Blood Rev 2003;17(Suppl 1):S1–5.
-
Levy JH, Key NS, Azran MS, Novel Oral Anticoagulants. REVIEW ARTICLE Anesthesiology. 2010; 113:726 – 45.
-
Stone ME, Shore-Lesserson L., Present and future anticoagulants. Ad Anesth 2011; 24: 29–66.
-
Beard D., Gwinnutt C. Anticoagulation – an overview. Anaesthesia tutorial of the weeek [online]. Julio 2009; 1: 1-9. [ Consultado: 11 de mayo 2014]. Disponible en: http://www.frca.co.uk/Documents/143%20Anticoagulation%20-%20an%20overview.pdf
-
Horlocker TT, Wedel DJ, Rowlingson JC, Enneking FK, Kopp SL, Benzon HT, Brown DL, et.al. Regional Anesthesia in the Patient Receiving Antithrombotic or Thrombolytic Therapy American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Third Edition) Reg Anesth Pain Med 2010; 35: 64-101.
-
Gogarten W, Vandermeulen E, Van Aken H, Kozek S, Llau JV and Samama SM. Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology. Eur J Anaesthesiol 2010;27:999 – 1015.1
-
Chelly JE, and Schilling D, Pharm D, Thromboprophylaxis and Peripheral Nerve Blocks in Patients Undergoing Joint Arthroplasty. J Arthr 2008; 23: 350-4.
-
David L. Brown: Anestesia raquídea, epidural y caudal. En: Miller RD. Miller anestesia. 7ª ed. Madrid: Elsevier;2010. Cap. 41. p: 1377.
-
Strebel N, Prins M, Agnelli G, Bu ̈ller HR. Preoperative or postoperative start of prophylaxis for venous thromboembolism with low-molecular- weight heparin in elective hip surgery? Arch Intern Med 2002; 162:1451 – 6.
-
Rosencher N, Bonnet MP, Sessler DI.: Selected new antithrombotic agents and neuraxial anaesthesia for major orthopaedic surgery: management strategies. Anaesthesia 2007; 62: 1154–60.
-
Eriksson BI, Quinlan DJ, Weitz JI: Comparative pharmacodynamics and pharmacokinetics of oral direct thrombin and factor Xa inhibitors in development. Clin Pharmacokinet 2009; 48:1–22.
-
Eriksson BI, Borris LC, Dahl OE, Haas S, Huisman MV, et al. : ODIXa-HIP Study Investigators: A once-daily, oral, direct Factor Xa inhibitor, rivaroxaban (BAY 59-7939), for thromboprophylaxis after total hip replacement Circulation 2006; 114:2374–8.
-
Fox KA, Piccini JP, Wojdyla D, Becker RC, et. al. Prevention of stroke and systemic embolism with rivaroxaban compared with warfarin in patients withnon-valvular atrial fibrillation and moderate renal impairment. Eur Heart J 2011; 32:2387–94.
-
Eriksson BI, Borris LC, Friedman RJ, Haas S, et.al. RECORD1 Study Group: Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. N Engl J Med 2008; 358:2765–75.
-
Kakkar AK, Brenner B, Dahl OE, Eriksson BI, et.al. ; RECORD2 Investigators: Extended duration rivaroxaban versus shortterm enoxaparin for the prevention of venous thromboembolism after total hip arthroplasty: A double-blind, randomized controlled trial. Lancet 2008; 372:31–9.
-
Lassen MR, Ageno W, Borris LC, Lieberman JR, Rosencher N,et.al.; RECORD3 Investigators: Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty. N Engl J Med 2008; 358:2776–86.
-
Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE,et.al. ; ROCKET AF Investigators: Rivaroxaban versus warfarin innonvalvular atrial fibrillation. N Engl J Med 2011; 365:883–91.
-
Mega JL, Braunwald E, Wiviott SD, Bassand JP,et. el. ; ATLAS ACS 2–TIMI 51 Investigators: Rivaroxaban in patients with a recent acute coronary syndrome. N Engl J Med 2012; 366:9–19.
-
Leil TA, Feng Y, Zhang L, Paccaly A, Mohan P, Pfister M: Quantification of apixaban’s therapeutic utility in prevention of venous thromboembolism: Selection of phase III trial dose. Clin Pharmacol Ther 2010; 88:375–82.
-
DeLoughery TG: Practical aspects of the oral new anticoagulants. Am J Hematol 2011; 86:586–90.
-
Lassen MR, Raskob GE, Gallus A, Pineo G, Chen D, Hornick P; ADVANCE-2 investigators: Apixaban versus enoxaparin for thromboprophylaxis after knee replacement (ADVANCE-2): A randomised double-blind trial. Lancet 2010; 375:807–15.
-
Lassen MR, Gallus A, Raskob GE, Pineo G, Chen D, Ramirez LM; ADVANCE-3 Investigators: Apixaban versus enoxaparin for thromboprophylaxis after hip replacement. N Engl J Med 2010; 363:2487–98.
-
Granger CB, Alexander JH, McMurray JJ, Lopes RD,et. al. ; ARISTOTLE Committees and Investigators: Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365:981–92.
-
Connolly SJ, Eikelboom J, Joyner C, Diener HC,et. al.; AVERROES Steering Committee and Investigators: Apixaban in patients with atrial fibrillation. N Engl J Med 2011; 364:806–17.
-
Stangier J, Feuring M: Using the HEMOCLOT direct thrombin inhibitor assay to determine plasma concentrations of dabigatran. Blood Coagul Fibrinolysis 2012; 23:138–43.
-
Stangier J, Rathgen K, Stähle H, Gansser D, Roth W: The pharmacokinetics, pharmacodynamics and tolerability of dabigatran etexilate, a new oral direct thrombin inhibitor, in healthy male subjects. Br J Clin Pharmacol 2007; 64:292–303.
-
Samama MM, Martinoli JL, LeFlem L, Guinet C, Plu-Bureau G, Depasse F, Perzborn E: Assessment of laboratory assays to measure rivaroxaban–an oral, direct factor Xa inhibitor. Thromb Haemost 2010; 103:815–25.
-
Favaloro EJ, Lippi G, Koutts J: Laboratory testing of anticoagulants: The present and the future. Pathology 2011; 43:682–92.
-
Samama MM, Amiral J, Guinet C, Perzborn E, Depasse F: An optimised, rapid chromogenic assay, specific for measuringdirect factor Xa inhibitors (rivaroxaban) in plasma. Thromb Haemost 2010; 104:1078-9.
-
Stangier J, Rathgen K, Stähle H, Mazur D: Influence of renal impairment on the pharmacokinetics and pharmacodynamics of oral dabigatran etexilate: An open-label, parallel-group, single-centre study. Clin Pharmacokinet 2010; 49:259–68.
-
Huisman MV, Lip GY, Diener HC, Brueckmann M, van Ryn J, Clemens A: Dabigatran etexilate for stroke prevention in patients with atrial fibrillation: Resolving uncertainties in routine practice. Thromb Haemost 2012; 107:838–47.
-
Levy et. Al. Managing New Oral Anticoagulantsin the Perioperative and Intensive Care Unit Setting. Anesthesiology: 2013; 118: 1466 – 74.
-
Gogarten W, Vandermeulen E, Van Aken H, Kozek S, Llau JV, Samama CM; European Scoeity of Anaesthesiology: Regional anaesthesia and antithrombotic agents: Recommendations of the European Society of Anaesthesiology. Eur J Anaesthesiol 2010; 27:999–1015.
-
Sié P, Samama CM, Godier A, Rosencher N, et.al.; Working Group on Perioperative Haemostasis; French Study Group on Thrombosis and Haemostasis: Surgery and invasive procedures in patients on long-term treatment with direct oral anticoagulants: Thrombin or factor- Xa inhibitors. Recommendations of the Working Group on Perioperative Haemostasis and the French Study Group on Thrombosis and Haemostasis. Arch Cardiovasc Dis 2011; 104:669–76.
-
Rosencher N, Bonnet MP, Sessler DI: Selected new antithrombotic agents and neuraxial anaesthesia for major orthopaedic surgery: Management strategies. Anaesthesia 2007; 62:1154–60.
-
Llau JV, Ferrandis R: New anticoagulants and regional anesthesia. Curr Op Anaesthesiol 2009; 22: 661–6.
-
Healey JS, Eikelboom J, Douketis J, Wallentin L,et.al.; RE-LY Investigators: Periprocedural bleeding and thromboembolic events with dabigatran compared with warfarin: Results from the Randomized Evaluation of Long-Term Anticoagulation Therapy (RE-LY) randomized trial. Circulation 2012; 126:343–8.
-
Garcia D: Rethinking warfarin reversal. Blood 2010;116:675–6.
-
Levy JH, Tanaka KA, Dietrich W: Perioperative hemostatic management of patients treated with vitamin K antagonists. Anesthesiology 2008; 109:918–26.
-
Eerenberg ES, Kamphuisen PW, Sijpkens MK, Meijers JC,et.al : Reversal of rivaroxaban and dabigatran by prothrombin complex concentrate: A randomized, placebocontrolled, crossover study in healthy subjects. Circulation 2011; 124:1573–9.
-
Marlu R, Hodaj E, Paris A,et.al.: Effect of non-specific reversal agents on anticoagulant activity of dabigatran and rivaroxaban: A randomized crossover ex vivo study in healthy volunteers. Thromb Haemost 2012; 108:217–24.

Según riesgo trombótico considerar iniciar HBPM a las 12 hs de la última dosis de rivaroxaban.
A pesar de que no exista reportes de hematomas espinales, dada la poca experiencia que se tiene en el empleo de rivaroxaban en combinación con bloqueo neuroaxial, la Sociedad Americana de Anestesia Regional recomiendan evitar las técnicas neuroaxiales en pacientes que van a recibir rivaroxaban.
Por otro lado las guías Europeas proponen los siguientes intervalos de tiempo para la realización de bloqueos regionales:
Entre una dosis de rivaroxaban y la retirada del catéter deben transcurrir al menos 18 – 20 hs. y desde la retirada a la siguiente dosis hay que esperar al menos 6 horas, si la punción fue traumática diferir la dosis 24 horas.
Es de suma importancia la monitorización neurológica.
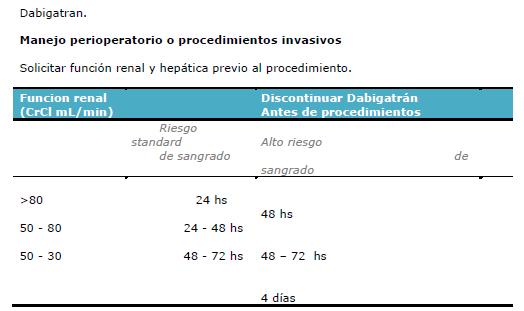
Los estudios que existen en cuanto al dabigatran y bloqueo neuroaxial, recomiendan que el catéter se retire en el postoperatorio inmediato (4 - 6 horas) previo a la primera dosis. No existen estudios de utilización concomitante de dabigatran y catéteres peridurales dejados en forma permanente.
La Sociedad Americana de Anestesia Regional recomienda evitar las técnicas neuroaxiales en pacientes que van a recibir dabigatran, e incluso se desaconseja la utilización de dabigatran cuando se haya realizado un bloqueo neuroaxial con las consecuencias médicos legales que puede atraer en caso de que se produzca un hematoma.
A pesar de lo dicho en el párrafo anterior, en la literatura encontramos un acercamiento al manejo de este fármaco y la anestesia regional basado en su propiedad farmacocinética.
Se sugiere un proceder similar a él de fondoparinux: retirar el catéter peridural 36 hs. después de la última dosis (dos vidas medias) y su reinicio 12 hs. después de retirado el catéter. Por lo tanto se requiere una ventana libre del fármaco de al menos 48 hs. que se logra, en la práctica, evitando una dosis
Dr. Cabrera G. Dr. Morales A. Página 12