Services on Demand
Journal
Article
Related links
Share
Anestesia Analgesia Reanimación
On-line version ISSN 1688-1273
Anest Analg Reanim vol.26 no.2 Montevideo Dec. 2013
HIPOPOGONADISMO EN PACIENTE TRATADO CON MORFINA INTRATECAL POR BOMBA DE INFUSIÓN IMPLANTADA.
Dres. SANTIAGO AYALA *, ANA PENA †, JAVIER PIETROPINTO ‡,
WALTER AYALA §.
* Asistente. Departamento y Cátedra de Anestesiología. Facultad de Medicina. Universidad de la República. Uruguay.
Servicio de Anestesiología. Hospital Británico. Uruguay.
† Médica Endocrinóloga. Hospital Británico. Uruguay
‡ Médico Internista. Hospital Británico. Uruguay.
§ Ex Profesor. Departamento y Cátedra de Anestesiología. Facultad de Medicina.
Universidad de la República. Uruguay.
Unidad de Tratamiento del Dolor. Hospital Británico. Uruguay.
Correspondencia: Dr. Santiago Ayala.
Dirección: Avda. Centenario 2751/1001. Montevideo. Uruguay.
Correo electrónico: ayalapastorino@gmail.com
RESUMEN:
Se comunica un caso de hipogonadismo en un paciente en tratamiento crónico con morfina intratecal por bomba de infusión implantada. Los trastornos de la función sexual orientaron al diagnóstico de hipogonadismo, que se confirmó por el descenso de los valores sanguíneos de testosterona total y libre encontrados.
Se considera que el hipogonadismo es consecuencia del tratamiento prolongado con morfina y se discuten otras posibles causas de hipogonadismo.
Se describen los efectos del déficit de testosterona y la respuesta a su reposición. Luego de la administración de testosterona se corrigieron los valores séricos de testosterona, el paciente recuperó la libido y manifestó una mejoría parcial de la función eréctil. Se plantean otras posibles causas de la disfunción sexual.
Se advierte sobre las posibles contraindicaciones al tratamiento con testosterona así como la necesidad de controles posteriores a su administración.
Se concluye que el hipogonadismo es una complicación posible del tratamiento prolongado con morfina intratecal, que debe ser detectada por exámenes periódicos, tratada en caso de presentarse, y sobre la que los pacientes deben ser informados previamente.
Palabras clave: Opiode intratecal. Liberación de droga intratecal. Dolor crónico no oncológico.
SUMMARY
A case of hypogonadism in a patient with an implanted intrathecal morphine infusion pump is reported.
Sexual dysfunction lead to the diagnosis of hypogonadism wich was confirmed by low total serum testosterone and low free testosterone levels found.
Hypogonadism secondary to prolonged morphine treatment is considered and other hypogonadism causes are discussed.
The low testosterone effects and the testosterone replacement response are described.
After testosterone replacement, testosterone serum levels were restored to normal, the patient recovered the libido and manifested a partial improvement of the erectile function. Other dysfunction sexual causes are considered.
The possible complications of testosterone replacement and the need of controls after the administration are advised.
We conclude that hypogonadism is a possible complication in a prolonged morphine intrathecal treatment, must be searched by periodic controls, treated if it is found, and the patients must be informed about it before the treatment.
Key words: Intrathecal opiods. Intrathecal drug delivery. Chronic noncancer pain.
RESUMO
Comunica-se um caso de hipogonadismo em um paciente em tratamento crônico com morfina intratecal por bomba de infusão implantada. Os transtornos da função sexual orientaram ao diagnostico de hipogonadismo, que foi confirmado pelo o descenso dos valores sanguíneos de testosterona total e livre.
Considera-se que o hipogonadismo é conseqüência do tratamento prolongado com morfina é se discutem outras possíveis causas de hipogonadismo.
Descrevem-se os efeitos do déficit de testosterona e a resposta a sua reposição. Logo após a administração de testosterona se corrigiram seus valores séricos, o paciente recuperou sua libido e manifestou uma melhora parcial da função erétil.
Avaliam-se outras possíveis causas da disfunção sexual.
Adverte-se sob as possíveis contra-indicações ao tratamento com testosterona assim como a necessidade de controles posteriores a sua administração.
Concluiu-se que o hipogonadismo é uma complicação possível no tratamento prolongado com morfina intratecal, que deve ser detectada por análises periódicos, tratada no caso de apresentar-se, e que os pacientes devem ser informados previamente.
Palavras chave: Opioides intratecal. Liberação de droga intratecal. Dor crônica não oncológica.
INTRODUCCIÓN
El propósito de este trabajo es comunicar la instalación de un hipogonadismo en un paciente en tratamiento crónico con morfina intratecal (IT), discutir sus posibles causas, describir los efectos presentados, y mostrar la evolución luego del tratamiento con testosterona (T).
CASO CLÍNICO
Paciente de 54 años, sexo masculino, 92 kg de peso, ex-fumador, portador de cardiopatía dilatada, insulino-resistencia, depresión mayor, y síndrome post-laminectomía por el que se le implantó, hace 6 años y 6 meses, una bomba IsoMed (Medtronic) para administrar morfina IT.
La bomba implantada es de flujo constante, tiene 60 ml de capacidad y libera 1 ml. /día de la solución en el espacio subaracnoideo.
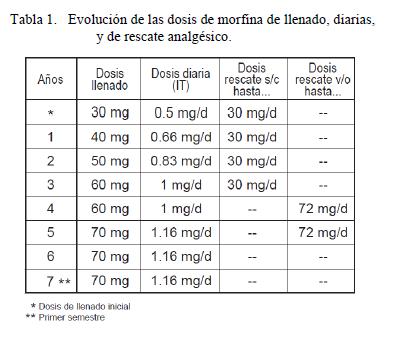
En la tabla 1, se detalla la evolución de las dosis de llenado, de las dosis diarias de morfina IT, y de las dosis diarias máximas de rescate por vía subcutánea (s/c) y por vía oral (v/o). Durante los primeros 3 años los rescates se efectuaron por vía s/c y en los siguientes por v/o, salvo en el último año y medio donde que no requirió rescates.
Hace 3 años y medio agravó su patología respiratoria por una fibrosis pulmonar requiriendo oxigenoterapia a permanencia y corticoterapia.
La oxigenoterapia logró mantener niveles adecuados de oxigenación arterial (saturación de oxígeno de 96-97 %). El tratamiento con prednisona (20 mg/día) por un período prolongado se acompañó de un síndrome de Cushing y un aumento de peso de 15 kg, que revirtieron hace más de un año al suspender el fármaco.
Coincidiendo con la administración de corticoides instaló una diabetes por la que recibió Insulina HPH y cristalina, medicación que actualmente no recibe.
Continúa en tratamiento con psicofármacos antipsicóticos, antidepresivos, ansiolíticos e hipnóticos, además de broncodilatadores y diuréticos.
Con la analgesia intratecal se logró una disminución significativa del dolor, una franca mejoría de la capacidad de caminar y de la calidad de vida, no obstante en los últimos 3 años ha notado disminución de la libido y posteriormente dificultad en la erección que no respondió al tratamiento con inhibidores de la fosfodiesterasa (sildenafil o tadalafil). También ha observado sudoración nocturna y disminución del bello esternal.
Se realizó dosificación hormonal de testosterona total (TT), hormona folículo- estimulante (FSH) y prolactina (PRL) por quimioluminiscencia, testosterona libre (TL) por radioinmunoanálisis, y hormona luteinizante (LH) por electroquimioluminiscencia.
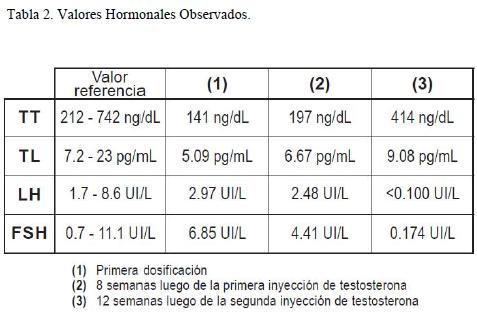
En la tabla 2 se detalla la a evolución de los valores hormonales encontrados y su relación con la administración de testosterona (T).
Los resultados de la primera dosificación hormonal mostraron un descenso de TT y TL con valores de LH y FSH dentro de los límites normales. Los valores de prolactina fueron normales.
Se realizó una resonancia magnética nuclear (RMN) de cráneo con enfoque de región hipotálamo-hipofisaria, que resultó normal.
Para la corrección del hipogonadismo se administró Undecanoato de Testosterona por vía intramuscular (i/m) a la dosis de 1000 mg.
La segunda dosificación hormonal realizada 8 semanas después de la inyección de T, mostró un leve aumento de los valores de TT y TL pero por debajo de lo normal, y un leve descenso de LH y FSH pero dentro del rango normal.
Luego de esta dosificación se aplicó una segunda dosis de 1000 mg i/m de T y se efectuó una tercera dosificación 12 semanas luego de la segunda inyección (20 semanas luego del inicio del tratamiento), que mostró normalización de los valores de TT y TL con valores muy descendidos de LH y FSH.
Previo a la inyección de T se descartaron posibles contraindicaciones para su administración, como un aumento del tamaño prostático o una elevación del antígeno prostático específico total (PSA).
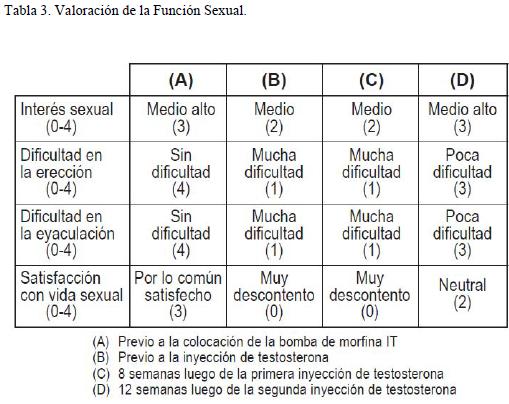
La función sexual se estudió mediante el Inventario Breve de la Función Sexual Masculina (1), valorando interés sexual, dificultad para tener una erección, dificultad para eyacular y satisfacción con la vida sexual en los últimos 30 días, en una escala de 0 a 4, donde el valor mayor es indicador de mejor función sexual.
El inventario se aplicó interrogando sobre los siguientes momentos:
A.- Previo a la colocación de la bomba de morfina IT.
B.- Con diagnóstico de hipogonadismo y previo a la inyección de T.
C.- 8 semanas después de la primera inyección de T.
D.- 12 semanas después de la segunda inyección de T.
En la tabla 3 se muestra la evolución de la función sexual en los distintos momentos analizados, donde se observa una severa disfunción sexual previa a la administración de T.
Esa alteración no mejoró luego de la primera inyección de testosterona, pero se logró una mejoría parcial luego de la segunda dosis de testosterona. Recuperó el interés sexual pero la mejoría en la erección y en la eyaculación no fue total, aún bajo tratamiento con Tadalafilo 5 mg /día.
Refiere haber notado una sensación de aumento de vitalidad, energía y motivación, y reaparición del bello precordial luego del tratamiento con T, aunque mantiene la sudoración nocturna.
Los valores de glóbulos rojos y el perfil lipídico incluida la relación HDL/colesterol, fueron normales antes y después del tratamiento con T.
El examen clínico y ecográfico de la próstata y los valores del PSA fueron normales y no mostraron modificaciones luego de la última administración de T.
El paciente expresó su consentimiento para la publicación de este caso.
DISCUSION
Un desorden en la función hipotálamo-hipófiso-testicular puede provocar un hipogonadismo (2).
La hormona liberadora de gonadotropinas (GnRH) es producida en el hipotálamo y estimula la secreción de las gonadotropinas LH y FSH por las células de la hipófisis anterior.
La LH actúa sobre las células de Leydig del testículo estimulando la producción de testosterona que en conjunto con la FSH, actúa sobre las células de Sertoli testiculares para iniciar y mantener la espermatogénesis.
La testosterona secretada en la circulación provoca una acción andrógena en casi todos los tejidos del cuerpo, incluyendo una inhibición (feedback negativo) de la producción de GnRH por el hipotálamo y de la secreción de LH y FSH por la hipófisis.
Por otra parte la FSH estimula la producción testicular de inhibina B que causa una inhibición (feedback negativo) de la secreción de FSH por la hipófisis.
Estos mecanismos permiten diferenciar el hipogonadismo primario de origen testicular, que cursa con niveles bajos de testosterona y altos de LH y FSH, del hipogonadismo secundario por alteración del hipotálamo o hipófisis, que cursa con valores bajos de testosterona con niveles bajos o inapropiadamente normales de LH y TSH.
En algunas situaciones el déficit se produce tanto a nivel hipotalámico como testicular, constituyendo un hipogonadismo combinado (2).
Niveles normales de testosterona permiten mantener la mayoría de los cambios inducidos durante la pubertad. La mayoría de sus acciones biológicas son mediadas por sus metabolitos activos, estradiol y dihidrotestosterona.
El hipogonadismo masculino es un síndrome que resulta de un fallo de los testículos para producir adecuadas cantidades de testosterona (deficiencia androgénica), que casi siempre se asocia a un empeoramiento de la producción de esperma.
Cuando el déficit de testosterona es severo y prolongado, puede tener manifestaciones clínicas como reducción de la libido, disfunción eréctil, disminución de la vitalidad, depresión del humor, aumento de la sudoración, ginecomastia, pérdida de masa muscular y osteoporosis, y de laboratorio con modificaciones del rango masculino del hematocrito y de la relación HDL/colesterol (2).
El hipogondismo puede también incrementar el consumo de alimentos, actuar sobre el sistema nervioso simpático causando hiperglicemia y empeoramiento de la secreción de insulina (2), disminuir el umbral del dolor (3, 4), disminuir el poder antinociceptivo de la morfina y otros opioides (5), o asociarse a un incremento de eventos cardiovasculares (6).
Los valores disminuidos de TT y TL sérica encontrados, confirmaron el diagnóstico de hipogonadismo, considerando que muchos de los síntomas orientadores de deficiencia androgénica podían en este caso corresponder a otros factores, como dolor crónico, efecto de psicofármacos o de la morfina, depresión, o enfermedad respiratoria.
El hipogonadismo puede ser provocado por afecciones de la hipófisis o el hipotálamo, que no se plantean en el presente caso por cursar con RMN de cráneo normal.
Los opioides pueden provocar una deficiencia androgénica y su mecanismo principal sería la supresión de la liberación pulsátil de gonadotrofinas por el hipotálamo, con reducción de la liberación de LH por la hipófisis y de T por el testículo.
Algunos estudios sugieren que la morfina también podría provocar una inhibición de la síntesis testicular de T (7, 8), o determinar bajos niveles de T plasmática por un aumento en su metabolismo (9).
Adams (7) en un estudio en ratas, encontró que los niveles de T sérica y del fluido intersticial disminuyen significativamente luego de la administración de morfina.
La morfina suprimiría la producción testicular de T y de fluido intersticial testicular, efecto que sería independiente de la acción de la morfina sobre la LH.
Chadnrashekar (8) encontró que las b-endorfinas inhiben la secreción de T testicular afectando probablemente la síntesis de precursores de la T.
Aloisi (9) plantea que la morfina provocaría un aumento de la actividad de la 5-alfa reductasa y de ese modo un aumento en el metabolismo de la testosterona.
El uso prolongado de opioides como heroína, metadona, fetanyl transdérmico u oxycodona, puede provocar una severa deficiencia androgénica (2).
Daniell (10) encontró hipogonadismo en el 89% de los pacientes que recibían opioides por vía oral. El 87% presentó severa disfunción eréctil y disminución de la libido.
Fraser (11) observó hipogonadismo en el 83% de los pacientes de sexo masculino en tratamiento con opioides por vía oral.
Paice (12) publicó la primera observación de disfunción sexual en 6 pacientes tratados con opioides intraespinales. En todos encontró disminución de la libido y en 4 de ellos dificultades en la erección, síntomas que se acompañaron de niveles de T descendidos salvo en 1 caso que fue normal. Las otras hormonas sexuales se mantuvieron dentro de lo normal, salvo en 2 pacientes en los que se encontró la FSH por encima de lo normal.
Plantea que los cambios hormonales pueden presentarse dentro del mes de inicio de la terapia intratecal y que los niveles de T se recobrarían luego de un mes de su interrupción.
Abs (13) en un estudio controlado que incluyó 29 hombres que recibieron morfina IT por un tiempo promedio de 26 meses, encontró disminución de la libido e impotencia en el 95.8%, disminución de la TT en el 86% y disminución de LH en el 68%, mientras que los valores de FSH solo descendieron en el 6.9% de los casos. Plantea que no se ha demostrado que la disfunción endócrina esté relacionada con la dosis del opioide o con la duración de su administración.
Finch (14) en un estudio controlado en pacientes de ambos sexos tratados con morfina IT, encontró evidencia de hipogonadismo con bajos niveles de testosterona o de estrógeno, acompañado de niveles descendidos de gonadotrofinas.
Un alto porcentaje de esos pacientes sufrían disfunción sexual con impotencia en el hombre, perdida de la libido en ambos sexos, así como amenorrea en la mujer.
Abs (13) plantea que el hipogonadismo parece ser más pronunciado cuando los opioides son administrados por vía intratecal que por vía oral, pero que no está claro si esos efectos son dosis dependientes o si hay una dosis umbral por debajo de la cual no se presentan.
La mayoría de los estudios sobre administración crónica de opioides, muestran valores de LH disminuidos con FSH normal o levemente afectada, que serían compatibles con una inhibición de la liberación de gonadotropinas por la hipófisis (15).
En el presente caso los valores de testosterona descendidos se acompañaron de un nivel de LH en el rango bajo de la normalidad y de FSH normal.
Similares resultados se encontraron en consumidores de heroína, en los que se observó valores bajos de T sérica, niveles bajos- normales de LH y disfunción sexual (16)..
Chapman (17) plantea que la respuesta neuroendócrina y los valores de LH y FSH encontrados en pacientes tratados con opioides intratecales, podrían estar influenciados por otros factores como el dolor crónico.
Los resultados obtenidos en el presente caso, nos hacen pensar que el hipogonadismo es secundario a la acción de la morfina sobre el hipotálamo, no pudiéndose descartar una acción directa sobre el testículo.
Si bien en la instalación del hipogonadismo podrían haber tenido alguna participación los rescates de morfina s/c y v/o, pensamos que su mantenimiento sería consecuencia de la morfina intratecal, considerando el momento en que fueron interrumpidos.
Las altas dosis de corticoides pueden acompañarse de un patrón hormonal de hipogonadismo secundario (2).
El hecho de que las manifestaciones de deficiencia androgénica hayan persistido luego de la suspensión de los corticoides, aleja esa causa como hipótesis del presente hipogonadismo.
Un fallo orgánico crónico como la enfermedad pulmonar, puede acompañarse de un hipogonadismo secundario (2). La causa en esos casos es multifactorial, donde el strees crónico vinculado a la desaturación de oxígeno es señalado como un factor primordial. No parece ser en este caso la causa del hipogonadismo, considerando los valores de oxígenación sanguínea registrados.
Otra causa de hipogonadismo secundario puede ser la hiperprolactinemia (2), que se descarta en este caso por los niveles normales de prolactina observados.
Katz (18) plantea que al decidir el reemplazo de T se deben considerar los riesgos del hipogonadismo, así como los riesgos y beneficios de su reposición.
Considerando los efectos del déficit androgénico, entre otros sobre la calidad de vida del paciente, se optó por la reposición exógena de T.
La meta del tratamiento es lograr niveles de T dentro de los límites normales, sabiendo que la mayoría de los pacientes se tarda entre 3 y 6 meses para experimentar mejoría en la libido, función sexual y vitalidad.
Daniell (16) utilizando parches transdérmicos de 5 mg de T, encontró que luego de 3 meses de tratamiento los valores de TT y TL aumentaron dentro del rango normal, y que la LH que se encontraba en el rango bajo o normal sufrió un marcado descenso, con mejoría de los síntomas de deficiencia androgénica.
Blick (19) utilizando T transdérmica en forma de gel, observó similar mejoría de TT, de TL, y de la función sexual y del humor, tanto en los pacientes que recibían morfina como en los que no la recibían.
Los resultados encontrados por Aloisi (20) sugieren que la terapia con T podría modular positivamente la dimensión del dolor en el paciente hipogonadal.
El tratamiento con T está contraindicado en el cáncer de próstata porque puede estimular el crecimiento de tumores andrógeno-dependientes (2).
Antes de iniciar el tratamiento con T, en los pacientes mayores de 40 años se debe tener un examen digital rectal normal y un valor normal PSA, y en aquellos casos con riesgo aumentado de cáncer de próstata una ecografía transrectal y una biopsia de próstata.
Otras contraindicaciones relativas para el tratamiento con testosterona son la apnea obstructiva del sueño por los trastornos en la respiración que puede provocar, un hematocrito elevado (> 50%) por la posible estimulación de la eritropoyesis, un severo estado edematoso por la retención de fluidos asociados a su uso, o severos síntomas del tracto urinario vinculados a una hipertrofia benigna de próstata.
En el caso del paciente analizado, no existían contraindicaciones para el reemplazo de T que se realizó en forma de Undecanoato, lográndose la normalización de los valores de TT y TL, documentada a las 12 semanas de la segunda inyección.
Se optó por la vía intramuscular por ser una vía que permite lograr niveles normales de T por un largo período, sin la necesidad de su aplicación diaria o la posibilidad de trasferir testosterona por contacto a otras personas, como ocurre con la vía transdérmica (2).
Se recomienda administrar 1000 mg de T i/m, repetir la misma dosis a las 6 semanas y luego cada 10-14 semanas, dependiendo del monitoreo de los valores de T (2).
Los valores bajos de LH y FSH observados luego de la administración de T, en particular luego de la segunda dosis, serían consecuencia del efecto feedback negativo provocado por la T exógena sobre el eje hipotálamo-hipofisario (16).
Daniell (10) plantea que la disminución de LH luego de la administración de T, sería mayor cuando la deficiencia androgénica es causada por opioides que por otras causas.
La administración crónica de morfina aumentaría la sensibilidad del hipotálamo al feedback negativo provocado por los esteroides gonadales (21).
Daniell (10) encontró al igual que en el presente caso, que la FSH disminuye en paralelo con los niveles de LH luego del tratamiento con T.
Es probable que otros factores como el dolor, la depresión, los antidepresivos y los otros psicofármacos que recibe el paciente, tengan incidencia en la disfunción sexual del paciente, y expliquen la mejoría parcial observada al corregir el hipogonadismo.
La persistencia de la sudoración puede explicarse como un efecto secundario de la morfina.
Durante el tratamiento con T puede presentarse un aumento de peso probablemente vinculado a su acción anabólica sobre la masa muscular y a una posible retención de fluidos. El presente caso se acompañó de un descenso del peso y no se observaron edemas.
La reposición con T exógena se deberá continuar de acuerdo a la evolución del paciente, sus síntomas clínicos, sus valores séricos y los eventuales efectos secundarios a su administración.
La terapia crónica con opioides intratecales puede afectar también a otras hormonas hipofisarias tales como la hormona tirotrópica (TSH), la hormona adrenocorticotrópica (ACTH) o la hormona del crecimiento (GH).
Xenedis (22) encontró supresión simultánea de estas hormonas durante el tratamiento con morfina IT, alteración que persistió con la administración crónica de morfina y/o luego de la supresión de la vía IT, por lo que los pacientes deben ser clínicamente controlados para detectar otras posibles alteraciones hormonales.
CONCLUSIONES
Durante la terapia con morfina intratecal pueden presentarse alteraciones hormonales.
Los pacientes deben ser advertidos sobre la posible instalación de un hipogonadismo y se deben realizar exámenes para su detección. En caso de presentarse un hipogonadismo debe ser corregido mediante la administración de testosterona una vez descartadas las contraindicaciones para su aplicación.
BIBLIOGRAFÍA
1. O´Leary MP, Fowler FJ, Lenderking WR, Barber B, Sagnier PR, Guess HA, et al. A brief male sexual function inventory for urology. Urology 1995; 46 (5): 697-706.
2. Matsumoto AL, Bremner WJ. Testicular Disorders. In: Melmed S. Williams Texbook of endocrinology, 12 th ed. Philadelphia: Elsevier-Saunders; 2011. p. 688-777.
3. Forman LJ, Tingle V, Estilow S, Carter J. The response to analgesia testing is affected by gonadal steroids in the rat. Life Sci 1989; 45(5):447-54.
4. Pednekar J, Mulgaonker V. Role of testosterone on pain threshold in rats. Indian J Physiol Pharmacol 1995; 39(4): 423-4.
5. Stoffel EC, Ulibarri CM, Craft RM. Gonadal steroid hormone modulation of nociception, morphine antinociception and reproductive indices in male and female rats. Pain 2003; 103(3): 285-302.
6. Shahani S, Braga-Basaria M, Basaria S. Androgen deprivation therapy in prostate cáncer and metabolic risk for atherosclerosis. J Clin Endocrinol Metab 2008; 93(6): 2042-9.
7. Adams ML, Sewing B, Forman JB, Meyer ER, Cicero TJ. Opioid-induced suppression of rat testicular function. J Pharmacol Exp Ther 1993; 266(1): 323-8.
8. Chadnrashekar V, Bartke A. The influence of B-endorphin on testicular endocrine function in adults rats. Biol Reprod 1992; 47(1):1-5.
9. Aloisi AM, Ceccarelli I, Fiorenzani P, Maddalena M, Rossi A, Tomei V, et al. Aromatase and 5-alpha reductase gene expression: modulation by pain and morphine treatment in male rats. Mol Pain 2010; 6: 69-77.
10. Daniell HW. Hypogonadism in men consuming sustained-action oral opioids. J Pain 2002; 3(5): 377-84.
11. Fraser LA, Morrison D, Morley-Forster P, Paul TS, Tokmakejian S, Larry Nicholson R, et al. Oral opioids for chronic non-cancer pain: higher prevalence of hypogonadism in men than in women. Exp Clin Endocrinol Diabetes 2009; 117: 38-43.
12. Paice JA, Penn RD, Ryan WG. Altered sexual function and decreased testosterone in patients receiving intraspinal opioids. J Pain Symptom Manage 1994; 9(2): 126-31.
13. Abs R, Verhelst J, Maeyaert J, Van Buyten JP, Opsomer F, Adriaensen H, et al. Endocrine consequences of long-term intrathecal administration of opiods. J Clin Endocrinol Metab 2000; 85(6): 2215-22.
14. Finch PM, Roberts LJ, Price L, Hadlow NC, Pullan PT. Hypogonadism in patients treated with intrathecal morphine. Clin J Pain 2000; 16(3): 251-4.
15. Vuong C, Van Uum SH, O'Dell LE, Lutfy K, Friedman TC. The effects of opioids and opioid analogs on animal and human endocrine systems. Endocr Rev 2010; 31(1): 98-132.
16. Daniell HW, Lentz R, Mazer NA. Open-label pilot study of testosterone patch therapy in men with opioid-induced androgen deficiency. J Pain 2006;7(3):200-10.
17. Chapman CR, Tuckett RP, Song CW. Pain and stress in a systems perspective: reiprocal neural, endocrine, and immune interactions. J Pain 2008, 9(2): 122- 45.
18. Katz N, Mazer NA. The impact of opioids on the endocrine System. Clin J Pain 2009; 25(2): 170-5.
19. Blick G, Khera M, Bhattacharya RK, Nguyen D, Kushner H, Miner M. Testosterone replacement therapy outcome among opioid users: the testim registry in the United States (TRiUS). Pain Med 2012; 13(5): 688-98.
20. Aloisi AM, Ceccarelli I, Carlucci M, Suman A, Sindaco G, Mameli S, et al. Hormone replacement therapy in morphine-induced hypogonadic male chronic pain patients. Reprod Biol Endocrinol 2011; 9:26-36.
21. Gabriel SM, Berglund LA, Kaira SP, Kaira PS, Simpkins JW. The influence of chronic morphine treatment on the negative feedback regulation of gonadotropin secretion by gonadal steroids. Endocrinology 1986; 119(2): 2762-7.
22. Xenedis M, Pandya N, Heames E. Effects on intrathecal opiod administration on pituitary function [online].2013, 19 jul [Consulta: 20.07.2013]. Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/pme.12205/full