Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Anestesia Analgesia Reanimación
versión On-line ISSN 1688-1273
Anest Analg Reanim vol.25 no.1 Montevideo 2012
ARTíCULO DE REVISIóN
Manejo anestésico en cirugía hepática, vía biliar y de páncreas
Dres. Juan Lagarda Cuevas*, María Elena Rendón Arroyo †,
Lenin Yerves González †, Juan Manuel Rodríguez Zepeda ‡
* Centro Médico Nacional Siglo XXI. UMAE Hospital de Oncología, Servicio de Anestesiología. Centro Médico ABC The American British Cowdray Medical Center. Servicio de Anestesiología.
† Centro Médico Nacional Siglo XXI. UMAE Hospital de Oncología. Servicio de Anestesiología.
‡ Centro Médico ABC The American British Cowdray Medical Center. Instituto Nacional de Pediatría.
Correspondencia: Barranca del Muerto 335 interior 204 Colonia San José Insurgentes Delegación Benito Juárez CP 03900 Tel 56608828
RESUMEN
El paciente oncológico representa un reto intelectual y físico para el médico anestesiólogo. Dentro de la complejidad del tratamiento de cáncer, la cirugía hepática, de vía biliar y páncreas requieren consideraciones especiales. La epidemiología y el tipo de neoplasias específicas de esta zona del cuerpo hacen que los tratamientos quirúrgicos sean extensos y radicales para lograr ampliar la sobrevida de los pacientes. El manejo anestésico va encaminado a corregir y optimizar las comorbilidades del paciente previo a la cirugía. El transanestésico involucra un monitoreo invasivo para estabilizar hemodinámicamente al paciente y lograr mantener en adecuado plano anestésico a lo largo del procedimiento. La revisión que a continuación se expone es una actualización sobre la epidemiología y tipo de neoplasias que se involucran en esta zona. Se recuerdan los puntos importantes del manejo anestésico desde la valoración preoperatoria hasta el postoperatorio inmediato. Por último se sugiere un manejo anestésico óptimo basado en la literatura y en consensos de expertos en pacientes con estas condiciones.
Palabras clave:
HEPATECTOMíA PARCIAL
PROCEDIMIENTO DE WHIPPLE
MELD SCORE
CLASIFICACIóN DE CHILD Y PUGH
SUMMARY
Cancer patients are an intellectual and physical challenge for the anesthesiologist. Within the complexity of cancer treatment, surgery of liver, bile duct and pancreas requiere special attention. The specific types of neoplasmas in this area of the body along with their unique epidemiology, make surgical treatments to be radical with the objective of achieving a longer expectation of life. The anesthetic management is aimed to correct and optimize the patient´s comorbidities prior and during surgery. This involves invasive hemodynamic monitoring to keep the patient in an adequate level of anesthesia and stable in their neurologic, renal and cardiovascular variables. The review that is set out below is an update of the types of tumoral diseases that involve this area. Key points are being highlighted regarding the anesthetic management from the preoperative assessment until the inmmediate postoperative period.Finally we suggest an optimal anesthetic procedure based on literature and expert consensus in patients with these conditions.http://jaf.com.uy/2012/07/16/parador-al-aire-libre-en-pueblo-centenario/
Key words:
PARTIAL HEPATECTOMY
WHIPPLE PROCEDURE
MELD SCORE
CHILD AND PUGH CLASSIFICATION
RESUMO
O paciente oncológico apresenta um desafio intelectual e físico para o médico anestesiologista. Dentro da complexidade do tratamento, a cirurgia hepática, de via biliar, e pâncreas, requer considerações especiais. A epidemiologia, e o tipo de neoplasia especifica desta região do corpo, fazem com que os tratamentos cirúrgicos sejam extensos e radicais para conseguir uma maior sobrevida. O manejo anestésico visa a corrigir e diminuir as co-morbilidades do paciente previamente à cirurgia. O trans-anestésico obriga a um monitoramento invasivo para estabilizar hemodinamicamente o paciente e conseguir manter um adequado plano anestésico durante o procedimento. Nesta revisão continuada se expõe, uma atualizaçao da epidemiologia e o tipo de neoplasias que se envolvem nesta região. Recordam-se os pontos importantes do manejo anestésico desde a avaliação pré-operatório até o pós-operatório imediato. Por último se sugere um manejo anestésico ótimo fundamentado na literatura e no consenso de expertos em pacientes com estas condições.
Palavras chave:
HEPATECTOMIA PARCIAL
PROCEDIMENTO DE WHIPPLE
MELD SCORE
CLASIFICAçAO DE CHILD E PUGH
INTRODUCCIóN
La cirugía de la vía biliar es de las más realizadas en el mundo. Si bien en el contexto de la oncología los tumores de esta zona pueden ser resecables, en muchos de ellos, por su forma de presentación y diagnóstico tardío, la cirugía pasa a segundo término como tratamiento de primera línea. En ese caso el paciente es sometido a estudios endoscópicos terapéuticos para disminuir los síntomas y alargar en lo posible la sobrevida. Por otra parte, los tumores de hígado están relacionados con patologías de larga evolución, como cirrosis y coinfección con virus de la hepatitis B y C, agentes etiológicos predisponentes para tumores primarios, aunque la mayoría de los tumores son metastásicos. Los tumores de páncreas también son de diagnóstico tardío y muchas veces fuera de tratamiento quirúrgico. Sin embargo, en nuestro país y en la medicina institucional muchos de estos criterios son ampliados y se someten a cirugía como tratamiento definitivo. A continuación haremos un recordatorio de las consideraciones generales que se deben de tener para los pacientes con tumores de la vía biliar, hígado y páncreas. Se mostrarán manejos anestésicos sugeridos para optimizar al paciente antes, durante y después de la cirugía. Por último haremos hincapié en los puntos claves a considerar.
MANEJO PERIOPERATORIO DEL PACIENTE CON DISFUNCIóN HEPáTICA ASINTOMáTICA O ENFERMEDAD CRóNICA AVANZADA
Comenzaremos este capítulo revisando el manejo perioperatorio de los pacientes con algún tipo de disfunción hepática crónica, sintomática o no. La mayor parte de los pacientes que llegan a oncología por tumores primarios de hígado tienen una enfermedad crónica por coinfección por VHB o VHC. También por cirrosis de larga evolución de diferentes etiologías (alcohólica, etcétera) aunque suelen ser menos frecuentes. Mientras que en una vasta mayoría los pacientes llegan con diagnóstico de cáncer primario desconocido o en estudio, o tumor metastásico.
A fin de cuentas, el paciente ya no tiene una función hepática normal y además se le ha sumado la aparición de un tumor primario. Por lo tanto es importante considerar para el manejo anestésico que nuestro paciente no está funcionando adecuadamente.
La anestesia entonces se encaminará a optimizar al paciente previo a la cirugía por medio de la valoración preanestésica y se realizará un plan de medicamentos para el tipo de anestesia seleccionada. Edad del paciente, comorbilidades, medicación actual, duración de la cirugía a la cual será sometido, son probablemente, a juicio del autor, los factores de riesgo más importantes previos a la administración de la anestesia.
El objetivo primario es, por lo tanto, evitar que se produzca más disfunción de la ya existente, que resista el procedimiento quirúrgico y que su sobrevida se alargue dependiendo de la estirpe histológica del tumor y la reserva funcional del paciente (1).
A estas alturas, el paciente necesita de un manejo anestésico que disminuya los insultos potencialmente hepatotóxicos de medicamentos propios de comorbilidades preexistentes o que fueron administrados de manera previa para manejo del tumor. Asimismo el manejo asegurará la suficiencia de aporte de oxígeno durante la cirugía para evitar el deterioro intraoperatorio.
De tal manera que hay que saber qué medicamentos pueden exacerbar la lesión hepática, para tenerlos en cuenta antes de la cirugía. Se muestran a continuación:
FáRMACOS QUE INDUCEN HEPATOTOXICIDAD (1)
- Acetaminofén
- Alcohol
- Alopurinol
- Amiodarona
- Amoxicilina
- Aspirina
- Azatioprine
- Bleomicina
- Bosentán
- Bloqueadores de los canales de calcio
- Captopril
- Carbamazepina
- Chlorpromazina
- Cisplatino
- Cyclosporina
- Danazol
- Dantrolene
- Dapsona
- Disulfiram
- Enalapril
- Erythromicina
- FeSO4
- Floxuridina
- Oro
- Isoniacida
- Ketoconazol
- Metimazole
- Metotrexate
- Metildopa
- Nafcillina
- Nevirapine
- Niacina
- Nitrofurantoina
- Antiinflamatorio no esteroideo
- Pemolina
- Penicilina
- Phenitoína
- Propafenona
- Propiltiouracil
- Quinidina
- Rifampina
- Riluzole
- Esteroides, anabólicos
- Anticonceptivos orales
- Sulfonamidas
- Tacrina
- Tamoxifeno
- Tetraciclina IV
- Ticlopidina
- Tolcapona
- Nutrición parenteral total
- Trazodona
- Valproato
- Vitamina A
- Zafirlukast
- Pruebas de función hepáticas completas (TGO, TGP, LDH, FA, BI, BD, BT)
- INR
- TTP
- TP
- Tiempo de sangrado
- Cruzar sangre y tener listo para el día de la cirugía:
- Cinco PG
- Siete PFC
- Una aféresis plaquetaria
- Pruebas de función renal
- Química sanguínea
- Biometría hepática completa
- Gasometría arterial
- Telerradiografía de tórax
- Electrocardiograma
- Escirroso (60%).
- Papilar (25%).
- Mucoide (15%).
(Lista tomada de Miller’s Anesthesia, 6th ed.,Copyright © 2005 Elsevier).
Esta lista servirá para saber qué medicamentos podemos prescindir de su dosis nocturna o matutina. Tomando en cuenta medicamentos que son altamente necesarios para el paciente con comorbilidades (por ejemplo: no suspender anticonvulsivantes, antiarrítmicos, etcétera.)
En cuanto al uso de opioides para manejo del dolor previo, se sabe que a nivel biliar pueden provocar espasmo del esfínter de Oddi. Si bien clínicamente un paciente sometido a cirugía de esta zona hepatobiliar no representa en el escenario oncoquirúrgico ningún problema, cabe señalar que con el uso de fentanilo, morfina y meperidina el espasmo es mayor. En mucho menor medida con agonistas-antagonistas, por lo cual sería conveniente evitar los primeros y manejar el dolor con nalbufina o buprenorfina (2,3).
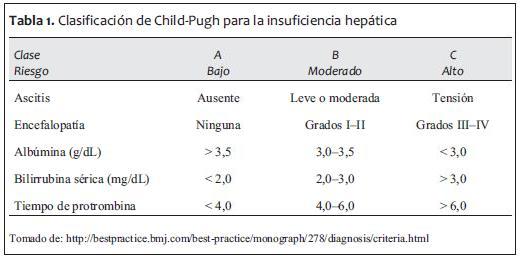
Posteriormente se correlacionan estos medicamentos con sus comorbilidades para empezar a planear el monitoreo intraoperatorio. Es, por lo tanto, imprescindible tomar en cuenta dos escalas perioperatorias que han servido en la estratificación de mortalidad de pacientes con enfermedad hepática (2-4):
1. Clasificación de Child-Pugh.
2. MELD Score.

Una de las complicaciones importantes de la falla hepática es la encefalopatía. Esta ocurre cuando el hígado acumula amonio no metabolizado, la aparición de falsos neurotransmisores inhibidores (seudo GABA) receptores endógenos GABA alterados por el glutamato y por ende alterando el estado mental del paciente (5,6).
Los factores que pueden acelerar la aparición de un deterioro mental en el perioperatorio son:
1. Hipokalemia y su efecto en la producción renal de amonio.
2. Alkalemia, difunde el amonio más rápido a través de la barrera hematoencefálica(5,6).
Por lo tanto se debe mantener una buena perfusión preoperatoria con líquidos adecuados (de preferencia coloides, especialmente si se realizó una paracentesis para vaciar la ascitis), con el fin de mantener el volumen sin provocar fallo por sobrecarga de líquidos. Restablecer los electrolitos, como el potasio, entre 24 a 48 horas antes del procedimiento. Mantener el pH arterial y dar oxígeno suplementario vía nasal o con mascarilla Venturi desde el ingreso. Esto mejora la oxigenación del hígado y promueve el metabolismo de las toxinas.
Evitar el uso de benzodiacepinas como premedicación pues exacerban el delírium y empeoran el cuadro de encefalopatía hepática.
El uso de lactulosa, ya sea por sonda nasogástrica o por enema, metronidazol 500 mg IV cada 8 horas y en ciertos casos flumazenil (dosis respuesta 1 mg por kg de peso) puede servir para revertir los efectos del amonio previo a la cirugía (7,8).
El siguiente punto importante previo a la cirugía es conocer por medio de la clínica y el laboratorio cómo se encuentra la función hepática general y la coagulación del paciente. Clínicamente hay que ser minuciosos en la exploración física buscando diátesis hemorrágicas y sangrado de encías, así como los estigmas de la insuficiencia hepática. En cuanto a laboratorios, se debe solicitar de rigor:
Si bien en el contexto de la oncología las recidivas por transfusión por el incompetente sistema inmune del paciente son altas, hay que tomar previsiones en el caso de sangrados masivos o necesidad de ayudar en la coagulación.
Para esto es conveniente iniciar con vitamina K al ingreso 20 UI cada 8 horas, 24 horas previas a la cirugía (9,10).
También gastroprotección con inhibidores de bomba (omeprazol de 40 a 60 mg IV cada 24 horas) desde el ingreso, pues el ayuno preoperatorio en pacientes sin buena coagulación puede precipitar sangrados del tubo digestivo, además a todo paciente con comorbilidad similar se le debe considerar con estómago lleno (11,12).
Si el paciente se presenta con ascitis por la hipertensión portal es necesario evaluar el grado de esta y si no está repercutiendo en la ventilación. Si es así, es necesario indicar la paracentesis previa a la cirugía y corroborar que la reposición de líquidos sea la adecuada (13,14). Una vez estratificado nuestro paciente, haber buscado y optimizado posibles signos y síntomas agudos o agudizados, es necesario saber el tipo de procedimiento a realizar y el diagnóstico tumoral de ingreso.
TUMORES MáS FRECUENTES
Y TIPOS DE CIRUGíA
CáNCER PRIMARIO DE HíGADO
Los tumores de hígado primarios pueden ser de los hepatocitos o de las células epiteliales. También pueden ser de células blásticas o precursoras de hepatocitos. Su incidencia es relativamente poco común, aunque está en aumento (15). En Asia, por ejemplo, hay zonas donde se le considera el tumor abdominal más frecuente, con una tasa importante de mortalidad. Por lo general, el cáncer primario de hígado se ve en la quinta década de la vida y los hepatoblastomas durante los dos primeros años de vida (15).
La infección crónica por virus de la hepatitis C y B es el principal factor de riesgo para el desarrollo de carcinoma hepatocelular. Se ha descrito la integración del ADN del VHB en los hepatocitos provocando un efecto oncogénico (16,17). Lo curioso es que se puede desarrollar cáncer en ausencia de cirrosis, mientras que la infección por VHC lleva casi de manera absoluta al desarrollo de cáncer en presencia de cirrosis. Como habíamos comentado anteriormente, la cirrosis hepática de cualquier etiología es un fuerte factor predisponente para el desarrollo de cáncer y no necesariamente de etiología infecciosa (18,19). Es importante señalar que a diferencia del carcinoma hepatocelular, el colangiocarcinoma intrahepático no se asocia frecuentemente a cirrosis pero sí a condicionantes específicos, como la colangitis esclerosante primaria.
TRATAMIENTO
La resección parcial o hepatectomía parcial es el tratamiento de elección. Sin embargo, es necesario cumplir con ciertos criterios (20-22):
1. Enfermedad confinada al hígado.
2. Enfermedad sujeta a resección completa técnicamente hablando.
3. No tener invasión de vasos sanguíneos portales o venas hepáticas.
4. No tener múltiples lesiones en el hígado.
A pesar de estos criterios de resecabilidad, la recurrencia es alta (hasta 70% a cinco años) y si el paciente tiene cirrosis la recurrencia es mayor. Algunos candidatos pueden ser sometidos a una cirugía de nuevo. La sobrevida a cinco años es de 40% sin cirrosis preexistente (23-25).
CáNCER SECUNDARIO (METASTáSICO) DE HíGADO
Los tumores secundarios de hígado son hasta 20 veces más frecuentes que los tumores primarios (26,27). Cánceres primarios de tubo digestivo como colon, páncreas, esófago, estómago, así como de mama, pulmón, sistema genitourinario, ovario, útero, melanoma y sarcomas dan metástasis al hígado con una alta frecuencia (28,29). Se producen por diseminación vía circulación portal de células malignas del tumor primario. Si bien cada tumor primario tiene su patrón característico de diseminación, lo más común es que sea de colon y pulmón (30). Por lo general, se debe considerar que la enfermedad ya no se encuentra confinada al lugar donde está el tumor primario si hay presencia de metástasis en el parénquima hepático. Aunque en lo que respecta al cáncer de colon, la metástasis hepática suele permanecer durante largos períodos sin migrar o producir enfermedad en otros sitios (31,32).
TRATAMIENTO
El tratamiento en este caso va enfocado al tumor primario. Por lo regular se usa la quimioterapia como tratamiento paliativo. En el caso del cáncer de colon, la resección de las lesiones hepáticas es potencialmente curativa y muy efectiva. Por lo tanto, la quimioterapia es adyuvante en este sentido (33,34).
De los aproximadamente 130.000 pacientes diagnosticados con cáncer colorrectal en Estados Unidos, 50% de ellos tienen lesiones hepáticas al diagnóstico. Por otro lado, en 40% de ellos se encuentran los hallazgos hepáticos como único lugar de enfermedad demostrable del tumor primario (35). Con resección completa de las lesiones, la tasa de sobrevida a los cinco años va desde 25% a 40%, más el tratamiento adyuvante posterior. Sin embargo, los factores de peor pronóstico tras la resección son los siguientes (34-36):
1. Enfermedad en cadena ganglionar estadio III o Dukes C.
2. Lesiones múltiples.
3. Menos de un año tras la resección del tumor primario.
4. Niveles en ascenso del antígeno carcinoembrionario.
La tasa de mortalidad por el procedimiento en tumores secundarios de hígado es de 1%-2% en hospitales de concentración y de subespecialización (37,38). Al igual que en los tumores primarios, los pacientes pueden ser sometidos a una segunda resección si sus condiciones lo permiten. La resección hepática en tumores secundarios que no sean de colon, no es apropiada en casi ninguno de los casos (37,38).
CáNCER DE LA VESíCULA BILIAR
Los tumores de la vesícula biliar son raros y ocurren por lo general en pacientes adultos mayores, presentándose generalmente después de la sexta década de la vida. Se relaciona con la presencia de cálculos biliares (70%) y su degeneración maligna tiene que ver con el tiempo de exposición de estos en la vesícula. Es más frecuente en mujeres que en hombres. El tipo de tumor más frecuente es adenocarcinoma y se diferencia histológicamente en:
La forma de diseminación es por invasión directa al hígado, ganglios linfáticos y estructuras del hilio, principalmente. Si de manera incidental tras la resección de la vesícula el tumor se encuentra confinado a la glándula se le considera in situ o lesión temprana. Usualmente la tríada de dolor en cuadrante superior derecho, masa palpable e ictericia da el diagnóstico de cáncer en esta zona.
TRATAMIENTO
Si está aparentemente confinado a la vesícula, según la imagenología, se debe hacer una laparotomía exploradora y subsecuentemente una colecistectomía (39). Al mismo tiempo una resección en cuña de tejido adyacente hepático (3 a 5 cm) más disección de ganglios linfáticos de manera regional, preferentemente (40,41). Algunos cirujanos sugieren resecar el ducto biliar común de rutina. Si no se puede resecar, hay que colocar stents de manera endoscópica para abrir el ducto y quitar la ictericia obstructiva. En caso de enfermedad diseminada, la cirugía no ofrece mayor beneficio (42). El pronóstico es malo: 85% de mortalidad durante el primer año después del diagnóstico. Aquellos pacientes que sobreviven más tiempo son los que tuvieron cáncer confinado a la vesícula (43,44).
CáNCER DE LA VíA BILIAR
Tienen una misma frecuencia de aparición entre hombres y mujeres y no se relacionan con litiasis (45). Su incidencia es por lo general después de los 60 años. Se relaciona con colitis ulcerativa, colangitis esclerosante y algunas parasitosis (46). Usualmente son adenocarcinomas, aunque las metástasis son poco frecuentes, el tumor por lo regular ha crecido para el diagnóstico hacia el hilio hepático (47).
TRATAMIENTO
Si el paciente en el momento del diagnóstico se encuentra libre de metástasis u otros signos de enfermedad avanzada, debe someterse a una laparotomía exploradora. En aquellos que no son candidatos a tratamiento quirúrgico (30%), se coloca un stent en el conducto biliar para restablecer el flujo de bilis hacia el duodeno y disminuir la ictericia obstructiva (48).
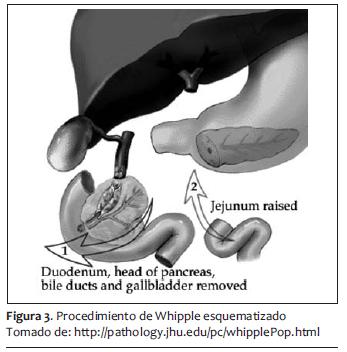
El procedimiento quirúrgico de elección para aquellos que son candidatos a tratamiento mediante cirugía es la pancreatoduodenectomía o procedimiento de Whipple (49).
Si el tumor no puede ser resecado hay que restablecer el flujo biliar mediante una colecistoyeyunoanastomosis o una coledocoyeyunoanastomosis en Y de Roux (50,51).
La sobrevida es menor al año tras el diagnóstico. La tasa de sobrevida total es de 15% a los cinco años. La cirugía paliativa y la colocación de stents mejoran la calidad de vida sin cambiar el pronóstico (50,51).
CáNCER DE PáNCREAS
Se ha estimado que a partir de 2001 más de 30.000 pacientes desarrollarán cáncer de páncreas, de los cuales más del 90% morirá de la enfermedad (52,53). La tasa de mortalidad por la enfermedad prácticamente sigue siendo la misma desde los años 70. Es la tercera causa de muerte por cáncer en hombres entre la tercera y sexta década de la vida. Se asocia a factores como fumar, dieta con alto contenido en grasas y carnes, gastrectomía 20 años antes, y más en afroamericanos que en otras razas (54,55). En dos tercios de los casos, el tumor se localiza en la cabeza del páncreas. La estirpe histológica más frecuente es adenocarcinoma poco diferenciado (80%). De manera temprana su diseminación es a estructuras adyacentes con metástasis a hígado y ganglios (56). Posteriormente se extiende a pulmón y peritoneo. La presentación más frecuente es pérdida de peso, ictericia y dolor exquisito abdominal, y en la espalda este último es un signo de mal pronóstico. Si es palpable es prácticamente irresecable (signo de Courvoisier). En los carcinomas del cuerpo y cola, por lo general, no hay ictericia, y en 10% de los casos hay tromboflebitis migratoria, la cual se creía que era única para cáncer de páncreas (57).
TRATAMIENTO
El procedimiento de Whipple es la técnica de elección si el tumor se presenta con las siguientes características (57,58):
1. Arteria hepática libre de tumor cerca del origen de la arteria gastroduodenal.
2. Arteria mesentérica superior libre de tumor en su paso por el cuerpo del páncreas.
3. Hígado y ganglios linfáticos libres de tumor.
Por lo general hay extensión del tumor a la vena porta y los vasos mesentéricos. Solo 20% de los cánceres de la cabeza pueden ser resecados y prácticamente nunca para los tumores del cuerpo y cola (59,60).
Cuando se realiza por manos experimentadas, la tasa de mortalidad es menos de 5%. En centros menos especializados y con cirujanos poco entrenados la tasa de mortalidad asciende de 20% a 30%. Las complicaciones más frecuentes son las fístulas biliares, hemorragia e infección. Las lesiones irresecables se someten a colecistoyeyunoanastomosis y coledocoyeyunoanastomosis para disminuir la ictericia. También se pueden colocar stents de manera endoscópica para el mismo propósito. A pesar del tratamiento completo con cirugía, el promedio de sobrevida es de 18 meses. La tasa de sobrevida a cinco años es de 10% (61,62).
CáNCER DE LA AMPOLLA DE VATER
Corresponde 10% de los tumores de la vía biliar, de los cuales dos tercios son adenocarcinomas y el resto adenomas. Parece que hay una malignización de adenomas a adenocarcinomas (63,64). Se presentan con ictericia, pérdida de peso y dolor abdominal, siendo los síntomas, por lo tanto, muy inespecíficos. El método diagnóstico más importante es mediante CEPR, por el cual se puede visualizar el tumor en 75% de los casos. El procedimiento de Whipple sigue siendo el método terapéutico más adecuado, y dejar métodos no invasivos en pacientes que no son candidatos a cirugía (65,66).
TRATAMIENTO
Con el abordaje de Whipple la mortalidad es menor a 5% tras la cirugía, y la sobrevida a cinco años es de 50%. Con métodos no invasivos por extensión tumoral la sobrevida tras esfínterotomía y colocación de stents es de menos de un año (67).
EXTENSIóN DE LA CIRUGíA HEPáTICA Y PROCEDIMIENTO DE WHIPPLE
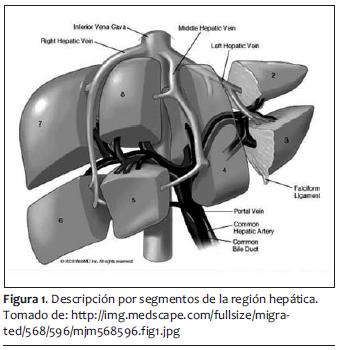
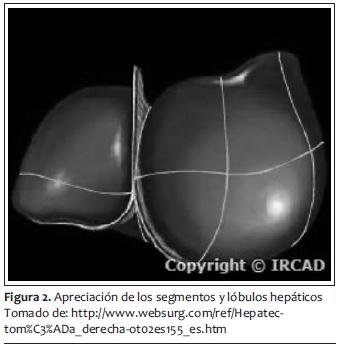
Como hemos comentado, la resección hepática está indicada en tumores primarios y secundarios del hígado. Una resección de hasta 85% es factible si no hay compromiso en la función hepática previa (68). Por lo tanto, cirugías tan extensas solo están indicadas cuando es comprobable una función normal hepática en el paciente, pues en otros escenarios clínicos, como esteatosis o cirrosis, el procedimiento es poco tolerado por el paciente. El efecto regenerador del hígado tras una resección es inmediato, comenzando con replicación celular a las 24 horas postquirúrgicas y hasta volver a tener su volumen previo (69,70). Su pico máximo se presenta en los primeros diez días y se termina de regenerar entre la cuarta y quinta semana después del evento quirúrgico. Se ha clasificado la resección hepática en anatómica (por segmentos) y no anatómica (resecciones en cuña, enucleaciones, debridamiento de tejido desvitalizado). Las resecciones segmentarias son las que se asocian con menos sangrado transoperatorio y se puede ser más exacto en dejar los márgenes libres. La mayoría se realiza por abordaje abdominal y en ciertas ocasiones toracoabdominales. La forma técnica de tener menor sangrado durante la cirugía va encaminada a seguir (71,72):
1. Control vascular antes de entrar al parénquima.
2. División anatómica cuidadosa previa a la resección.
3. PVC bajas (5 a 8 mmHg) durante la anestesia.
Esto es cierto también para el procedimiento de Whipple, en especial para evitar las complicaciones postoperatorias, que en el caso de este último el exceso de líquido transoperatorio puede provocar dehiscencias de las anastomosis y posterior infección (73). Otras complicaciones comunes que hay que tener en cuenta, y que pueden ser afectadas no solo por el tipo de abordaje sino por el manejo anestésico son derrames pleurales, atelectasias y hasta neumonías (74,75). También falla renal aguda posoperatoria, por no manejar bien los tiempos de cirugía en cuanto al manejo de líquidos y no lograr mantener al mínimo indispensable la perfusión renal y el gasto urinario. A pesar de los riesgos que implican las resecciones hepáticas y el procedimiento de Whipple, la tasa de mortalidad en centros hospitalarios subespecializados y de alto volumen es de 3% a 5% (figuras 1 y 2) (76,77).
MANEJO ANESTéSICO PARA RESECCIóN HEPáTICA Y PROCEDIMIENTO DE WHIPPLE
Ahora sí entramos en materia objetiva acerca de cómo debemos manejar a un paciente comórbido que llega a cirugía para una resección hepática o procedimiento de Whipple (78-80). Consideramos conveniente comentar antes que el manejo es muy parecido pues es una zona contigua anatómicamente hablando y las consideraciones generales y específicas van encaminadas a preservar la función residual de los órganos, mantener el flujo sanguíneo y presiones de perfusión de la zona, estabilizar hemodinámica y metabólicamente hablando al paciente, y por último brindar un adecuado control del dolor, relajación e hipnosis durante la anestesia (81-84).
CONSIDERACIONES GENERALES PARA TODA CIRUGíA MAYOR HEPáTICA O PROCEDIMIENTO DE WHIPPLE (85-90)
- Anemia y trastornos de la coagulación, tratar de corregirlos de manera preoperatoria y tener los suficientes hemoderivados disponibles durante el procedimiento.
- Iniciar en recuperación con antibióticos de amplio espectro, o continuar con el esquema ya indicado desde piso.
- Tener en mente la medicación actual del paciente por sus efectos potenciales en cuanto al metabolismo del hígado.
- Suspender medicamentos que puedan alterar la farmacocinética o farmacodinamia de otros o sinergizar efectos no deseados.
- Corroborar si hay o no alergias a medicamentos o sustancias de cualquier índole, incluyendo alimentos.
- No suspender medicamentos vitales para el paciente (por ejemplo, anticonvulsivantes, antiarrítmicos).
- Evaluar el estado cognitivo del paciente previo a la cirugía (Glasgow, Nursing Delirium Scale).
- Corroborar consentimiento informado y autorización para transfusiones.
- Evaluar clínicamente datos de coagulopatía clínica (diátesis hemorrágicas, sangrado de encías, hematomas).
- Evaluar las extremidades, región yugular y subclavia para planear el abordaje de líquidos y de monitoreo invasivo (catéter central para PVC, punzocaths 14 o 16, etcétera).
- Corroborar diagnóstico y procedimiento a realizar con equipo de enfermería y cirugía.
MONITOREO TRANSANESTéSICO
A continuación se enumeran los puntos claves del abordaje anestésico (91-96):
1. Posición del paciente: semifowler para intubar, considerándose a estos pacientes como con estómago lleno y Trendelemburg ligero durante resección para mejorar perfusión y visibilidad del equipo quirúrgico.
2. Inducción sugerida:
- Fentanilo 5 a 10 µg/kg.
- Inductor: propofol 1 mg/kg.
- Relajante neuromuscular: cisatracurio 1 mg/kg.
3. Técnica preferente: anestesia general balanceada.
4. Halogenado preferente: sevorane (no tiene efecto sobre el flujo portal hepático y no sufre metabolismo extenso o parcial en el hígado).
5. Colocación de sonda nasogástrica.
6. Índice biespectral o entropía (rango a mantener de 40 a 60).
7. Dos vías grandes de altos flujo punzocaths número 14 o 16.
8. Colocación de catéter venoso central para medición de PVC (rango a mantener durante resección o realización del procedimiento de Whipple de 5 a 8 mmHg, posteriormente mantener una PVC entre 10 a 15 mmHg y hasta terminar cirugía).
9. Colocación de línea arterial para toma de muestra continua de gases arteriales así como presión arterial media (PAM) (la meta será mantener una PAM de 50 a 60 mmHg durante la resección y de 60 a 70 mmHg posterior a ésta y hasta terminar la cirugía).
10. Sonda Foley para cuantificar orina y gasto urinario (la meta será mantener el gasto urinario 1 ml/kg/h durante la resección y hasta 1,5 a 2 ml/kg/h posterior a esta y para finalizar cirugía).
11. Se debe mantener un estricto monitoreo de gases arteriales y de sangre venosa central por lo menos cada 30 minutos durante la resección y posteriormente cada 60 minutos, tomando en cuenta que esto es a demanda del paciente y sus necesidades durante el evento.
Recordar que la cirrosis hepática cambia el flujo hepático, lo cual varía la biotransformación de los medicamentos que se metabolizan en el hígado. Asimismo la hipoalbuminemia y la desnutrición del paciente alteran el volumen de distribución (97-101).
Hay que tomar en cuenta que los medicamentos anestésicos como las benzodiacepinas y los relajantes neuromusculares sufren cambios en su farmacocinética y farmacodinamia. Es por eso que no se recomienda el uso de las primeras y se prefiere al cisatracurio y atracurio sobre los demás relajantes. En cuanto al manejo de líquidos es recomendable, si el paciente viene muy deshidratado, iniciar con cristaloides, y reponer de manera adecuada si se sacaron más de 3 litros de ascitis durante el abordaje. Está descrito que el uso de coloides (albúmina al 5% o al 25%, voluven, etcétera) repone de manera adecuada y no sobrecarga de líquidos al paciente previo a la resección (102,103).
La temperatura también se debe mantener normal lo más que se pueda durante el procedimiento. La hipotermia empeora coagulopatías, enlentece el metabolismo de los medicamentos y hace el despertar del paciente más prolongado.
El desequilibrio de electrolitos y de la glucosa debe ser monitorizado y corregido a conveniencia durante todo el procedimiento quirúrgico. A su vez es importante recordar que la transfusión juega un papel fundamental en la recidiva de los tumores y altera de por sí deteriorado sistema inmune del paciente y hay que recurrir a ella cuando el transporte de oxígeno sea insuficiente (calculando, por ejemplo, la extracción de oxígeno y el contenido arterial del mismo por medio del taller de gases).
En un escenario ideal sería conveniente tener un tromboelastógrafo disponible para medir qué factor de la coagulación necesitamos dar al paciente. El cuadro de síndrome de reperfusión, aunque ha sido descrito con maniobras de Pringle y en trasplante hepático, hace suponer que es importante aumentar el aporte de líquidos posterior a la resección y con el uso de esta maniobra, y estar pendiente de los cambios por la liberación de potasio (100,102,103).
El gasto urinario también es una preocupación transoperatoria. El uso de medicamentos para promoverlo o aumentarlo, como es la utilización de diuréticos de asa, dopamina, manitol y fenoldopam, entre otros, ha sido descrito.
El exceso de líquidos provoca que las asas intestinales y el hígado se vean inflamados e ingurgitados, lo cual hace más difícil su manejo por parte de los cirujanos y provocan dehiscencia de las anastomosis en caso de necesitar realizar una colecistoyeyunoanastomosis o una coledocoyeyunoanastomosis (101-103).
El sangrado promedio de segmentectomías y Whipple para cáncer de páncreas en manos expertas es de 500 a 1.000 ml, que siempre es un sangrado considerable y que puede ser más y masivo. Posteriormente a la hemostasia y al cierre de pared abdominal se puede proseguir a la extubación y su manejo postoperatorio hacia terapia intensiva o recuperación (figuras 3, 4 y 5).
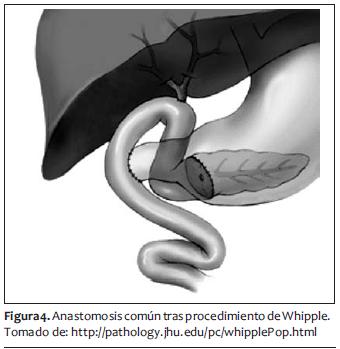
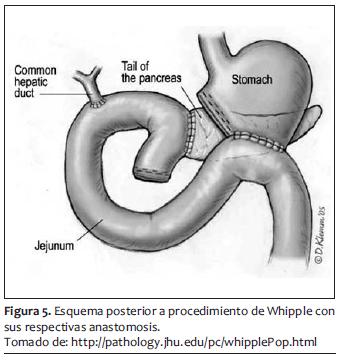
MANEJO POSTOPERATORIO INMEDIATO
Siempre que sea posible es importante extubar al paciente. Los criterios estándares para extubar se deben de seguir al pie de la letra o preparar al paciente con relajación y una adecuada sedación para su pase a terapia intensiva si esta fuera necesaria (100-106).
El control postoperatorio del dolor, por lo general, no es difícil de manejar de manera convencional con opiodes como la buprenorfina (104-106).
En un estudio se describió que la mentencefalina, un neuropéptido que modula el dolor, se eleva de manera significativa durante cirugías hepáticas, por lo cual el manejo del dolor responde a terapias y dosis convencionales. Si bien no se sabe cuál es el mecanismo de acción exacto para producir más cantidades de este neuropéptido, se cree que el administrar dosis preoperatorias de esteroide promueven su liberación (107-110).
CONCLUSIONES
La cirugía hepática y el procedimiento de Whipple son métodos realizados en pacientes con cáncer. Las comorbilidades de los pacientes deben ser estabilizadas previas al evento. El tener disponible hemoderivados y un monitoreo invasivo completo hace que el manejo anestésico sea más completo y seguro para el paciente. Si bien la sobrevida de los pacientes es corta en general para todos los tumores de la vía biliar, páncreas e hígado, las indicaciones precisas para la cirugía mejoran considerablemente la calidad de vida y la prolonga para bienestar a corto plazo del paciente. Con el advenimiento de nuevas quimioterapias, entornos quirúrgicos más seguros y un manejo anestésico consciente y profesional, se podrá brindar en un futuro no muy lejano mejores expectativas de vida y una mejor calidad de atención y tratamiento al paciente oncológico.
AGRADECIMIENTOS
Es un honor haber realizado este trabajo, que gracias a la iniciativa de la Dra. Rendón y a su constante motivación para realizar trabajos académicos, hemos logrado terminar. También a mis compañeros de batalla, el Dr. Yerves y otros, que se ven reflejados en el manejo cotidiano de sus pacientes que con experiencia y conocimiento tratan de manera formidable el estado crítico de los casos a los que se enfrentan.
BIBLIOGRAFíA
1. Wahbah AM, el-Hefny MO, Wafa EM, et al. Perioperative renal protection in patients with obstructive jaundice using drug combinations. Hepatogastroenterology 2000; 47: 1691–8.
2. Sanyal AJ, Stravitz RT. Acute liver failure. In Zakim D, Boyer D (eds): Hepatology: A Textbook of Liver Disease. Philadelphia: WB Saunders, 2003: 445–96.
3. McCammon RL, Stoelting RK, Madura JA. Effects of butorphanol, nalbuphine, and fentanyl on intrabiliary tract dynamics. Anesth Analg 1984; 63: 139–42.
4. Radnay PA, Duncalf D, Novakovic M, Lesser ML. Common bile duct pressure changes after fentanyl, morphine,meperidine, butorphanol, and naloxone. Anesth Analg 1984; 63: 441–4.
5. Riordan SM, Williams R. Treatment of hepatic encephalopathy. N Engl J Med 1997; 337: 473–9.
6. Blei A, Larsen FS. Pathophysiology of cerebral edema in fulminant hepatic failure. J Hepatol 1999; 31: 771–6.
7. Ochs A, Rossle M, Haag K, et al. The transjugular intrahepatic portosystemic stent-shunt procedure for refractory ascites. N Engl J Med 1995; 332: 1192–7.
8. Pomier-Layrargues G, Giguere JF, Lavoie J, et al. Flumazenil in cirrhotic patients in hepatic coma: A randomized double-blind placebo-controlled crossover trial. Hepatology 1994; 19: 32–7.
9. Clemmesen JO, Gerbes AL, Gulberg V, et al. Hepatic blood flow and splanchnic oxygen consumption in patients with liver failure. Effect of high-volume plasmapheresis. Hepatology 1999; 29: 347–55.
10. Menon KVN, Kamath PS. Managing the complications of cirrhosis. Mayo Clin Proc 2000; 75: 501–9.
11. Lamberts SWJ, van der Lely AJ, de Herder WW, Hofland LJ. Octreotide. N Engl J Med 1996; 334: 246–54.
12. Roberts LR, Kamath PS. Ascites and hepatorenal syndrome: Pathophysiology and management. Mayo Clin Proc 1996; 71: 874–81.
13. Epstein M. Hepatorenal syndrome: Emerging perspectives of pathophysiology and therapy. J Am Soc Nephrol 1994; 4: 1735–53.
14. Lange PA, Stoller JK. The hepatopulmonary syndrome. Ann Intern Med 1995; 122: 521–9.
15. Akriviadis EA, et al. Hepatocellular carcinoma. Br J Surg 1998; 85: 1319.
16. Baffis V, et al. Use of interferon for prevention of hepatocellular carcinoma in cirrhotic patients with hepatitis B or hepatitis C virus infection. Ann Intern Med 1999; 131: 696.
17. Bergsland EK, Venook AP. Hepatocellular carcinoma. Curr Opin Oncol 2000; 12: 357.
18. Fong Y et al. Hepatocellular Carcinoma: An analysis of 412 HCC at a Western center. Ann Surg 1999; 229: 790-800.
19. Grasso A, et al. Radiofrequency ablation in the treatment of hepatocellular carcinoma—a clinical viewpoint. J Hepatol 2000; 33: 667.
20. Krinsky GA, Lee VS, Theise ND. Focal lesions in the cirrhotic liver: high resolution ex vivo MRI with pathologic correlation. J Comput Assist Tomogr 2000; 24: 189.
21. Llovet JM, etal. Hepatocellular carcinoma. Lancet 2003; 362: 1907.
22. Mor E et al. Treatment of hepatocellular carcinoma associated with cirrhosis in the era of liver transplantation. Ann Intern Med 1998; 129: 643.
23. Trevisani F et al. Randomized control trials on chemoembolization for hepatocellular carcinoma: is there room for new studies? J Clin Gastroenterol 2001; 32: 383.
24. Tung-Ping Poon R, Fan ST, Wong J. Risk factors, prevention, and management of postoperative recurrence after resection of hepatocellular carcinoma. Ann Surg 2000; 232: 10.
25. Cady B et al. Surgical margin in hepatic resection for colorectal metastasis: a critical and improvable determinant of outcome. Ann Surg 1998; 227: 566.
26. DeMatteo RP et al. Results of hepatic resection for sarcoma metastatic to liver. Ann Surg 2001;234:540.
27. Fong et al. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg 1999; 230: 309.
28. Gruenberger T et al. Reduction in recurrence risk for involved or inadequate margins with edge cryotherapy after liver resection for colorectal metastases. Arch Surg 2001; 136: 1154.
29. Harmon KE et al. Benefits and safety of hepatic resection for colorectal metastases. Am J Surg 1999; 177: 402.
30. Heslin MJ et al. Colorectal hepatic metastases: resection, local ablation, and hepatic artery infusion pump are associated with prolonged survival. Arch Surg 2001; 136: 318.
31. Kokudo N, et al. Anatomical major resection versus nonanatomical limited resection for liver metastases from colorectal carcinoma. Am J Surg 2001; 181: 153.
32. Lambert LA, Colacchio TA, Barth RJ Jr. Interval hepatic resection of colorectal metastases improves patient selection. Arch Surg 2000; 135: 473.
33. Nagakura S, Shirai Y, Hatakeyama K. Computed tomographic features of colorectal carcinoma liver metastases predict posthepatectomy patient survival. Dis Colon Rectum 2001; 44: 1148.
34. Primrose JN. Treatment of colorectal metastases: surgery, cryotherapy, or radiofrequency ablation. Gut 2002; 50: 1.
35. Scudamore CH et al. Radiofrequency ablation followed by resection of malignant liver tumors. Am J Surg 1999; 177: 411.
36. Strasberg SM et al. Survival of patients evaluated by FDG-PET before hepatic resection for metastatic colorectal carcinoma: a prospective database study. Ann Surg 2001; 233: 293.
37. Taylor I, Gillams AR. Colorectal liver metastases: alternatives to resection. J R Soc Med 2000; 93: 576.
38. Baillie J. Tumors of the gallbladder and bile ducts. J Clin Gastroenterol 1999; 29: 14.
39. Bismuth H, Majno PE. Hepatobiliary surgery. J Hepatol 2000; 32(1 Suppl): 208.
40. Kondo S et al. Regional and para-aortic lymphadenectomy in radical surgery for advanced gallbladder carcinoma. Br J Surg 2000; 87: 418.
41. Mainprize KS, Gould SW, Gilbert JM. Surgical management of polypoid lesions of the gallbladder. Br J Surg 2000; 87: 414.
42. Scott TE et al. A case-control assessment of risk factors for gallbladder carcinoma. Dig Dis Sci 1999; 44: 1619.
43. Ahrendt SA, Nakeeb A, Pitt HA. Cholangiocarcinoma. Clin Liver Dis 2001; 5: 191.
44. Burke EC et al. Hilar cholangiocarcinoma: patterns of spread, the importance of hepatic resection for curative operation, and a presurgical clinical staging system. Ann Surg 1998; 228: 385.
45. Chamberlain RS, Blumgart LH. Hilar cholangiocarcinoma: a review and commentary. Ann Surg Oncol 2000; 7: 55.
46. Jarnagin WR. Cholangiocarcinoma of the extrahepatic bile ducts. Semin Surg Oncol 2000; 19: 156.
47. Kosuge T et al. Improved surgical results for hilar cholangiocarcinoma with procedures including major hepatic resection. Ann Surg 1999; 230: 663.
48. Lillemoe KD, Cameron JL. Surgery for hilar cholangiocarcinoma: the Johns Hopkins approach. J Hepatobiliary Pancreat Surg 2000; 7: 115.
49. Balci NC, Semelka RC. Radiologic diagnosis and staging of pancreatic ductal adenocarcinoma. Eur J Radiol 2001; 38: 105.
50. Bodner WR, Hilaris BS, Mastoras DA. Radiation therapy in pancreatic cancer: current practice and future trends. J Clin Gastroenterol 2000; 30: 230.
51. Bornman PC, Beckingham IJ. ABC of diseases of liver, pancreas, and biliary system. Pancreatic tumours. BMJ 2001; 322: 721.
52. Crane CH et al. Combining gemcitabine with radiation in pancreatic cancer: understanding important variables influencing the therapeutic index. Semin Oncol 2001; 28(3 Suppl 10): 25.
53. Farnell MB, Nagorney DM, Sarr MG. The Mayo clinic approach to the surgical treatment of adenocarcinoma of the pancreas. Surg Clin North Am 2001; 81: 611.
54. Kozuch P et al. Treatment of metastatic pancreatic adenocarcinoma: a comprehensive review. Surg Clin North Am 2001; 81: 683.
55. Madura JA et al. Adenosquamous carcinoma of the pancreas. Arch Surg 1999; 134: 599.
56. Mangray S, King TC. Molecular pathobiology of pancreatic adenocarcinoma. Front Biosci 1998; 3: D1148.
57. Molinari M, Helton WS, Espat NJ. Palliative strategies for locally advanced unresectable and metastatic pancreatic cancer. Surg Clin North Am 2001; 81: 651.
58. Rose DM et al. 18Fluorodeoxyglucose-positron emission tomography in the management of patients with suspected pancreatic cancer. Ann Surg 1999; 229: 729.
59. Bakaeen FG et al. What prognostic factors are important in duodenal adenocarcinoma? Arch Surg 2000; 135: 635.
60. Crucitti A et al. Ampullary carcinoma: prognostic significance of ploidy, cell-cycle analysis and proliferating cell nuclear antigen (PCNA). Hepatogastroenterology 1999; 46: 1187.
61. Howe JR et al. Factors predictive of survival in ampullary carcinoma. Ann Surg 1998; 228: 87.
62. Lee JH et al. Outcome of pancreaticoduodenectomy and impact of adjuvant therapy for ampullary carcinomas. Int J Radiat Oncol Biol Phys 2000; 47: 945.
63. Belghiti et al. Seven hundred forty-seven hepatectomies in the 1990’s: an update to evaluate the actual risk of liver resection. J Am Coll Surg 2000; 191: 38.
64. Ettorre GM et al. Postoperative liver function after elective right hepatectomy in elderly patients. Br J Surg 2001; 88: 73.
65. Jackson PG et al. Predictors of outcome in 100 consecutive laparoscopic antireflux procedures. Am J Surg 2001; 181: 231.
66. Jarnagin et al. Improvement in perioperative outcome after hepatic resection: analysis of 1803 cases over the past decade. Ann Surg 2002; 236: 397.
67. Nagino M et al. Liver regeneration after major hepatectomy for biliary cancer. Br J Surg 2001; 88: 1084.
68. Nuzzo G et al. Liver resections with or without pedicle clamping. Am J Surg 2001; 181: 238.
69. Papadimitriou JD et al. The impact of new technology on hepatic resection for malignancy. Arch Surg 2001; 136: 1307.
70. Strasberg SM. Terminology of liver anatomy and liver resections: coming to grips with hepatic Babel. J Am Coll Surg 1997; 184: 413.
71. Takayama T et al. Randomized comparison of ultrasonic vs clamp transection of the liver. Arch Surg 2001; 136: 922.
72. Yamashita Y et al. Bile leakage after hepatic resection. Ann Surg 2001; 233: 45.
73. Prah GN, Lisman SR, Maslow AD, et al. Transesophageal echocardiography reveals an unusual cause of hemodynamic collapse during orthotopic liver transplantation—two case reports. Transplantation 59: 921–5, 1995.
74. O’Connor CJ, Roozeboom D, Brown R, et al. Pulmonary thromboembolism during liver transplantation: Possible association with antifibrinolytic drugs and novel treatment options. Anesth Analg 91: 296–9, 2000.
75. Fitzsimons MG, Peterfreund RA, Raines DE. Aprotinin administration and pulmonary thromboembolism during orthotopic liver transplantation: Report of two cases. Anesth Analg 92: 1418–21, 2001.
76. Colle IO, Moreau R, Godinho E, et al. Diagnosis of portopulmonary hypertension in candidates for liver transplantation: A prospective study. Hepatology 37: 401–9, 2003.
77. Blackwell MM, Chavin KD, Sistino JJ. Perioperative perfusion strategies for optimal fluid management in liver transplant recipients with renal insufficiency. Perfusion 2003; 18: 55–60.
78. Avery RK. Recipient screening prior to solid-organ transplantation. Clin Infect Dis 2002; 35: 1513–9.
79. Schumann R. Intraoperative resource utilization in anesthesia for liver transplantation in the United States: A survey. Anesth Analg 2003; 97: 21–8.
80. Veroli P, O’Kelly B, Bertrand F, et al. Extrahepatic metabolism of propofol in man during the anhepatic phase of orthotopic liver transplantation. Br J Anaesth 1992; 68: 183–6.
81. Raucoules-Aime M, Kaidomar M, Levron JC, et al. Hepatic disposition of alfentanil and sufentanil in patients undergoing orthotopic liver transplantation. Anesth Analg 1997; 84: 1019–24.
82. De Wolf AM, Freeman JA, Scott VL, et al. Pharmacokinetics and pharmacodynamics of cisatracurium in patients with end-stage liver disease undergoing liver transplantation. Br J Anaesth 1996; 76: 624–8.
83. O’Kelly B, Jayais P, Veroli P, et al. Dose requirements of vecuronium, pancuronium, and atracurium during orthotopic liver transplantation. Anesth Analg 1991; 73: 794–8.
84. Lukin CL, Hein HA, Swygert TH, et al. Duration of vecuronium-induced neuromuscular block as a predictor of liver allograft dysfunction. Anesth Analg 1995; 80: 526–33.
85. Gao L, Ramzan I, Baker B. Neuromuscular paralysis as a pharmacodynamic probe to assess organ function during liver transplantation. J Clin Anesth 2000; 12: 615–20.
86. Gao L, Ramzan I, Baker B. Rocuronium plasma concentrations during three phases of liver transplantation: Relationship with early postoperative graft liver function. Br J Anaesth 2002; 88: 764–70.
87. Gao L, Ramzan I, Baker B. Rocuronium infusion requirements and plasma concentrations at constant levels of neuromuscular paralysis during three phases of liver transplantation. J Clin Anesth 2003; 15: 257–66.
88. Shangraw RE, Hexem JG. Glucose and potassium metabolic responses to insulin during liver transplantation. Liver Transpl Surg 1996; 2: 443–54.
89. Martin TJ, Kang Y, Robertson KM, et al. Ionization and hemodynamic effects of calcium chloride and calcium gluconate in the absence of hepatic function. Anesthesiology 1990; 73: 62–5.
90. Ozier Y, Steib A, Ickx B, et al. Haemostatic disorders during liver transplantation. Eur J Anaesthesiol 2001; 18: 208–18.
91. Laine E, Steadman R, Calhoun L, et al. Comparison of RBCs and FFP with whole blood during liver transplant surgery. Transfusion 43: 322–7, 2003.
92. Parrilla P, Sanchez-Bueno F, Figueras J, et al. Analysis of the complications of the piggy-back technique in 1,112 liver transplants. Transplantation 1999; 67: 1214–7.
93. Aggarwal S, Kang Y, Freeman JA, et al. Postreperfusion syndrome: Cardiovascular collapse following hepatic reperfusion during liver transplantation. Transplant Proc 19(4 Suppl 3): 54–5, 1987.
94. Webster NR, Bellamy MC, Lodge JP, et al. Haemodynamics of liver reperfusion: Comparison of two anaesthetic techniques. Br J Anaesth 72: 418–21, 1994.
95. Koelzow H, Gedney JA, Baumann J, et al. The effect of methylene blue on the hemodynamic changes during ischemia reperfusion injury in orthotopic liver transplantation. Anesth Analg 2002; 94: 824–9.
96. Ayanoglu HO, Ulukaya S, Tokat Y. Causes of postreperfusion syndrome in living or cadaveric donor liver transplantations. Transplant Proc 2003; 35: 1442–4.
97. Acosta F, Sansano T, Contreras RF, et al. Changes in serum potassium during reperfusion in liver transplantation. Transplant Proc 1999; 31: 2382–3.
98. Parrilla P, Sanchez-Bueno F, Figueras J, et al. Analysis of the complications of the piggy-back technique in 1,112 liver transplants. Transplantation 1999; 67: 1214–7.
99. Aggarwal S, Kang Y, Freeman JA, et al. Postreperfusion syndrome: Cardiovascular collapse following hepatic reperfusion during liver transplantation. Transplant Proc 1987; 19(4 Suppl 3): 54–5.
100. Webster NR, Bellamy MC, Lodge JP, et al. Haemodynamics of liver reperfusion: Comparison of two anaesthetic techniques. Br J Anaesth 1994; 72: 418–21.
101. Koelzow H, Gedney JA, Baumann J, et al. The effect of methylene blue on the hemodynamic changes during ischemia reperfusion injury in orthotopic liver transplantation. Anesth Analg 2002; 94: 824–9.
102. Ayanoglu HO, Ulukaya S, Tokat Y. Causes of postreperfusion syndrome in living or cadaveric donor liver transplantations. Transplant Proc 2003; 35: 1442–4.
103. Acosta F, Sansano T, Contreras RF, et al. Changes in serum potassium during reperfusion in liver transplantation. Transplant Proc 31: 2382–2383, 1999.
104. http://pathology.jhu.edu/pc/whipplePop.html
105. http://pathology2.jhu.edu/gbbd/treatmnt.cfm
106. http://www8.georgetown.edu/dml/facs/graphics/POP-UPS/pop-up-gastrowhipple.html
107. http://www.websurg.com/ref/Hepatectom%C3%ADa_derechaot02es155_es.htm
108. http://img.medscape.com/fullsize/migrated/568/596/mjm568596.fig1.jpg
109. http://bestpractice.bmj.com/bestpractice/monograph/278/diagnosis/criteria.html
110. http:// img.medscape.com/fullsize/migrated/572/659/sld572659.tab3.gif