Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Anestesia Analgesia Reanimación
versión On-line ISSN 1688-1273
Anest Analg Reanim vol.17 no.1 Montevideo ago. 2001
Anticoagulantes y anestesia regional
Dr. Victor Bouchacourt
Palabras clave: anestesia regional anticoagulantes
Key words: regional anesthesia anticoagulants
AINE
Heparinas
Uroquinasa |
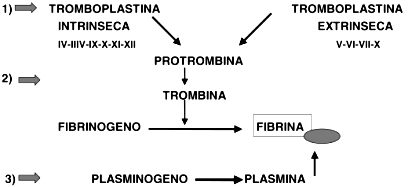
Figura 1. Esquema simplificado del mecanismo hemostático
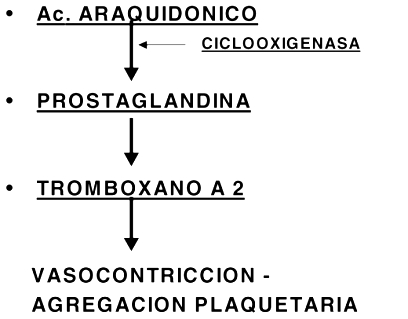
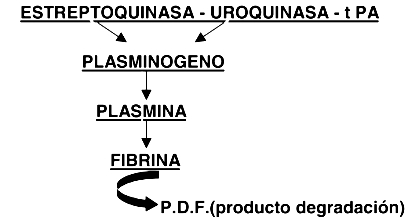
Conductas de seguridad: anticoagulantes orales y bloqueo neuroaxialCuando la terapia anticoagulante oral y el bloqueo neuroaxial son usados juntos, se pueden presentar cuatro situaciones bien definidas. Para minimizar el riesgo de complicaciones debemos tomar algunas precauciones (3): 1) Si el paciente recibe la medicación en forma crónica, la terapia anticoagulante debe ser detenida hasta normalizar los valores de tiempo de protrombina e INR antes de ser sometidos al bloqueo. Es necesario recordar que al inicio de la discontinuidad de la terapéutica los valores reflejan predominantemente los niveles de factor VII y que a pesar de valores aceptables de factor VII, los factores II y X pueden no ser adecuados para una hemostasis normal. 2) Para pacientes que recibieron una dosis inicial antes de la cirugía, determinar los tiempos de protrombina (TP) e INR si la primera dosis fue dada más de 24 horas antes o si ya se administró la segunda dosis. 3) Evitar el uso de medicación que afectan la coagulación por otros mecanismos y que pueden aumentar el riesgo de sangrado sin afectar el tiempo de protrombina o el INR. Esta medicación incluye aspirina, AINE y heparina. 4) Para remover el catéter peridural, monitorizar la coagulación si la dosis inicial de warfarina fue dada 36 horas antes. Fármacos antiplaquetarios y bloqueo regional La aspirina y los fármacos antiinflamatorios no esteroideos (4,5), son fármacos de uso frecuente en pacientes con dolor musculoesqueletico o con enfermedades inflamatorias que serán sometidos a cirugía ortopédica. Son inhibidores de la función plaquetaria , como se muestra en la figura 2. La aspirina inhibe la ciclooxigenasa plaquetaria e impide la producción de tromboxano A, potente vasoconstrictor y agregador plaquetario. La presencia de aspirina en el organismo puede influir en la hemostasis a través de la inhibición de la vasocontricción y de la formación del plug plaquetario, lo que resulta en moderado aumento de la tendencia al sangrado durante los procedimientos quirúrgicos que puede ser evidenciado en la paraclínica por un tiempo de sangría prolongado (normal: 1 a 4 minutos). Dado que las plaquetas no sintetizan proteínas nuevas , el efecto de la aspirina en la ciclooxigenasa plaquetaria es permanente, dura toda la vida de la plaqueta: siete a diez días (12). Los AINES también alteran la función plaquetaria, pero sus efectos son limitados ya que desaparecen tres a cuatro días luego de interrumpir el tratamiento (4). El ticlopidine es un compuesto que causa inhibición selectiva del ADP, mediador de la activacion plaquetaria. Se une irreversiblemente a las plaquetas resultando una acción aspirinosímil, persistiendo su efecto 10 a 15 días después de retirada la medicación (5). La realización de bloqueos en pacientes utilizando aspirina o AINE ha sido analizado en numerosos estudios. En la amplia revisión realizada por Vandermeulen (12) ya referida, donde encontraron 61 hematomas espinales, solamente en cuatro oportunidades comprobaron el concomitante uso de medicación antiplaquetaria, y todos resultaron estar asociado con factores de riesgo, como punción traumática o interacción medicamentosa con otros anticoagulantes. Hacemos referencia al trabajo publicado por Horlocker (4) estudiando los efectos de la asociación de fármacos antiplaquetarios y anestesia regional. El estudio, con características prospectivas, evaluó 1.000 bloqueos peridurales y subaracnoideos, realizados en pacientes sometidos a cirugía ortopédica, de los cuales 39% fueron tratados en el período preoperatorio con fármacos antiinflamatorios no esteroideos o aspirina. No evidenciaron ningún caso de complicaciones hemorrágicas mayores a nivel medular y emplean el término de "complicaciones hemorrágicas menores" para definir la presencia de sangre en la aguja o el catéter durante el bloqueo. La incidencia de complicaciones hemorrágicas menores encontrada fue de 22% y no hubo diferencia significativa a pesar de considerar si la terapia antiplaquetaria estaba en uso o no. El estudio apoya los resultados de la experiencia clínica, donde existe fuerte evidencia que la terapia antiplaquetaria preoperatoria no es un factor de riesgo significativo para desarrollar un hematoma en pacientes que se realizará un bloqueo. Pero debemos realizar algunas puntualizaciones con respecto a la conducta adoptar en estos pacientes (5): 1) El uso de fármacos antiplaquetarios solos no crea niveles de riesgo que interfieran con la performance de los bloqueos neuroaxiales. 2) El uso concomitante de otra medicación que afecte los mecanismos de coagulación tales como dicumarínicos, HS o HBPM puede aumentar el riesgo de sangrado. 3) No hay un test totalmente aceptado, incluyendo el tiempo de sangría, que nos guíe en la terapia antiplaquetaria. Una cuidadosa evaluación preoperatoria sobre antecedentes de sangrados es crucial para evitar complicaciones. Fármacos trombolíticos y bloqueo regional Los agentes trombolíticos/fibrinolíticos (22) como la uroquinasa, la estreptoquinasa y el activador del plaminógeno, lisan el coágulo de fibrina, tienden a disolver tanto el trombo patológico como el coágulo hemostático en el sitio de la injuria vascular. Como resultado, la hemorragia es el principal efecto secundario. Este mecanismo de acción se detalla en la figura 3. Actualmente existen nuevas técnicas en el manejo de la enfermedad vascular periférica, que incluyen la infusión de uroquinasa combinada con la infusión continua de heparina. Estos agentes tienen diferentes efectos sobre el mecanismo hemostático. La heparina suprime la formación de fibrina, mientras la uroquinasa induce lisis del coágulo formado. En estas circunstancias, existe un potencial riesgo de formación de un hematoma espinal con maniobras invasivas, por lo cual se contraindican los bloqueos raquimedulares en los últimos 10 días de tratamiento (22). Si por alguna circunstancias se administran fármacos fibrinolíticos o terapia trombolítica en horas cercanas a la realización de un bloqueo, se debe monitorizar la función neurológica a intervalos cortos, menores de dos horas. Diagnóstico y tratamiento del hematoma espinal
|
| HS | HBPM |
| Peso molecular | 15.000 | 5.000 |
| Unión a proteínas | Alta | Baja |
| Anti-Xa: Anti IIa | 1:1 | 4:1 |
| Biodisponibilidad | Baja | Alta |
| Inhibición plaquetaria | Fuerte | Moderada |
| Monitorización | TTPa | Anti-Xa |
Tabla 3. Actividad farmacológica de HS y HBPM
| Pico plasmático | Hemostasis normal | |
| Heparina intravenosa | Minutos | 2-4 horas |
| Heparina subcutánea | 60 minutos | 4-6 horas |
| Heparina de bajo peso molecular | 2-4 horas | 12 horas |
Todo paciente al que se le realiza una anestesia regional con algún grado de anticoagulación, requiere monitorización neurológica cuidadosa y continua. El reconocimiento temprano de los signos y síntomas del desarrollo de un hematoma espinal puede permitir una intervención quirúrgica temprana, fundamental para la resolución del déficit neurológico (12). El equipo de enfermería, especialmente las nurses, deben ser instruidas en la sospecha diagnóstica, monitorizando la función neurológica, especialmente durante la analgesia peridural posoperatoria que debe ser conducida con mínimo bloqueo motor (8,11). El primer síntoma es un déficit motor y sensorial, frecuentemente con disfunción vesical e intestinal. Esto suele estar acompañado de un dolor súbito y severo de espalda con componente radicular. La debilidad motora progresa hacia la paraplejia y puede ser al inicio desapercibida si el paciente permanece en reposo por el dolor que soporta o confundida con una neuropatía diabética (10,12). La recuperación depende de la extensión y duración de la compresión de la médula. La sospecha clínica debe ser confirmada por la tomografía axial computarizada (TAC) con contraste o la resonancia magnética. El tratamiento consiste en laminectomía descompresiva tan pronto como sea posible para evitar el daño permanente. El resultado neurológico final depende sobre todo de la velocidad con que se desarrolló el hematoma, el tamaño del mismo, la severidad del déficit neurológico y, lo más importante, del tiempo entre la formación del hematoma y la descompresión quirúrgica (12). La recuperación completa es posible si la cirugía se realiza dentro de las primeras ocho horas de iniciada la paraplejia. También los resultados han sido influenciados negativamente por la localización del hematoma. La incidencia de recuperación es más alta en pacientes con hematoma lumbosacro y más baja con sangrado dorsal, esto probablemente se debe a la pobre suplencia vascular de la médula dorsal (12).
Tabla 4.
| Factores vit. K dependientes | Vida media (horas) |
| II | 48 |
| VII | 6 |
| IX | 24 |
| X | 96 |
Figura 2. Mecanismo de acción de los fármacos antiplaquetarios (aspirina, aines, etc)
Consideraciones finalesLa decisión de realizar un bloqueo regional en pacientes que están recibiendo trombolíticos, anticoagulantes o fármacos antiplaquetarios será analizada en forma individual, tomando algunas precauciones generales: 1) Cuidados al seleccionar el paciente. Un aspecto importante es la historia de sangrados, evaluando la respuesta del paciente a cambios hemostáticos previos (8). 2) Técnica atraumática. Uso de material adecuado para el bloqueo específico. El uso de catéteres peridurales sin conductor disminuye el trauma de los vasos. El abordaje debe ser por vía medial e introducir el mismo menos de 5 cm en el espacio (8). Indicar, si es posible, la raquianestesia con aguja fina, una técnica menos traumática que la peridural. 3) La realización del bloqueo se adaptará a la farmacocinética de las sustancias administradas concomitantemente, respetando los tiempos de máxima anticoagulación (23). 4) Evaluar la función neurológica durante el posoperatorio en forma regular para establecer un diagnóstico oportuno y aplicar las medidas terapéuticas. La recuperación neurológica dependerá del intervalo de tiempo entre la ocurrencia de la lesión y su tratamiento (12,23).
Figura 3. Mecanismo de acción de los fármacos fibrinolíticos
Conclusión El pequeño riesgo de sangrado no debe ser decisivo al compararlo con las múltiples ventajas que tiene la indicación de una técnica de anestesia regional. Incluso debemos pensar que un fenómeno tromboembólico pulmonar fatal causado por la ausencia de un tratamiento profiláctico excede el riesgo de producción de un hematoma espinal generado por el bloqueo. Consideramos que si nos ajustamos a las precauciones antedichas, existe un margen de seguridad adecuado que nos permite asociar la anestesia regional y la anticoagulación.
Bibliografía1) Tuman KJ, McCarthy RJ, March RJ, Pharma D, March RJ, DeLaria GA et al. Effects of epidural anesthesia and analgesia on coagulation and outcome after major vascular surgery. Anesth Analg 1991; 73: 696-704. 2) Clagett PG. Prevention of venous thromboembolism. Chest 1995; 108: 312-34.
3) Enneking FK, Benzon H. Oral anticoagulants and regional anesthesia: a perspective. Reg Anesth Pain Med 1998; 23: 140-5.
4) Horlocker TT, Wedel DJ, Schroeder DR, Rose SH, Elliot BA, McGregor DG et al. Preoperative antiplatelet therapy does not increase the risk of spinal hematoma associated with regional anesthesia. Anesth Analg 1995; 80: 303-9.
5) Urmey WF, Rowlingson J. Do antiplatelet agents contribute to the development of perioperative spinal hematoma? Reg Anesth Pain Med 1998; 23: 146-51.
6) Shimosato S, Etston BE. The role of the venous system in cardiocirculatory dynamics during spinal and epidural anaesthesia in man. Anesthesiology 1969; 30: 619-28.
7) Modig J, Malmberg P, Saldeen T. Comparative effects of epidural and general anesthesia on fibrinolysis function, lower limb rheology and thromboembolism after total hip replacement. Anesthesiology 1980; 53 (suppl): S-34.
8) Horlocker TT, Wedel DJ. Anticoagulation and neuraxial block: historical perspective, anesthetic implications and risk management. Reg Anesth Pain Med 1998; 23:129-34.
9) Checketts MR, Wildsmith JAW. Central nerve block and thromboprophylaxis- is there a problem? Br J Anaesth 1999; 164-7.
10) Horlocker TT, Wedel DJ. Neurologic complications of spinal and epidural anesthesia. Reg Anesth Pain Med 2000; 25: 83-98.
11) Cheney FW, Domino KB, Caplan RA, Posner KL. Nerve injury associated with anesthesia. A closed claims analysis. Anesthesiology 1999; 90: 1062-9.
12) Vandermeulen EP, Van Aken H, Vermylen J. Anticoagulants and spinal-epidural anesthesia. Anesth Analg 1994 ; 79: 1165-77.
13) Schroeder DR. Statistics: Detecting a rare adverse drug reaction using spontaneous reports. Reg Anesth Pain Med 1998; 23: 183-9.
14) Wulf H. Epidural anaesthesia and spinal haematoma. Can J Anaesth 1996; 43: 1260-71.
15) Tryba M. European practice guidelines: Thromboembolism prophylaxis and regional anesthesia. Reg Anesth Pain Med 1998; 23: 178-82.
16) Liu SS, Mulroy MF. Neuroaxial anesthesia and analgesia in the presence of standard heparin. Reg Anesth Pain Med 1998; 23: 157-63.
17) Chaney MA. Intrathecal and epidural anesthesia and analgesia for cardiac surgery. Anesth Analg 1997; 84: 1211-21.
18) Heit JA. Low-molecular weight heparin: biochemistry, pharmacology, and concurrent drug precautions. Reg Anesth Pain Med 1998; 23: 135-9.
19) Horlocker TT, Heit JA. Low molecular weight heparin: biochemistry, pharmacology, perioperative prophylaxis regimens and guidelines for regional anesthetic management. Anesth Analg 1997; 85: 874-85.
20) Horlocker TT, Wedel DJ. Neuroaxial block and low-molecular weight heparin: balancing perioperative analgesia and thromboprophylaxis. Reg Anesth Pain Med 1998; 23: 164-77.
21) Landow L, Bedford RA. Editorial. Low-molecular weight heparin, spinal hematomas, and the FDA: What´s wrong with this picture? Reg Anesth Pain Med 1999; 24: 8-11.
22) Rosenquist RW, Brown DL. Neuroaxial bleeding: fibrinolytic/thrombolytics. Reg Anesth Pain Med 1998; 23: 152-6.
23) Sandhu H, Morley-Foster P, Spadafora S. Epidural hematoma following epidural analgesia in a patient receiving unfractionated heparin for thromboprophylaxis. Reg Anesth Pain Med 2000; 25: 72-5.
Correspondencia: Faustino Carámbula 1554. Rivera 40000. Uruguay. E-mail: boucha@adinet.com.uy














