Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Anestesia Analgesia Reanimación
versión impresa ISSN 0255-8122versión On-line ISSN 1688-1273
Anest Analg Reanim vol.16 no.2 Montevideo dic. 2000
Inicio en sala de operaciones del tratamiento de la hipertensión pulmonar con óxido nítrico (NO) en tres pacientes con cardiopatías congénitas
Dr. Domingo A. Bianchi 1
1. Médico Anestesiólogo.
Instituto de Cardiología Infantil (ICI) Hospital Italiano, Montevideo Uruguay.
Correspondencia: E-mail dbianchi@chasque.apc.org
Resumen
Presentamos el caso de tres pacientes de 5, 7 y 8 meses de edad, portadores de retorno venosos anómalo pulmonar total supradiafragmático en los casos 1 y 2, y de canal aurículo ventricular completo (canal A-V) en el caso número 3, sometidos a cirugía correctiva bajo circulación extracorpórea (CEC), hipotermia profunda y bajo flujo.
Al momento de finalizar la CEC, al tener todos ellos hipertensión pulmonar, presión media de la arteria pulmonar (PMAP) de 28 ± 9,8 mmHg y una relación de PMAP/presión arterial media (PAM) del orden del 80,6 ± 43% (48 a 130%); pese a hiperventilación, alcalosis y uso de inodilatadores, descartando la presencia de defectos residuales por ecocardiograma intraesofágico, se inicia la inhalación de NO a 20 ppm (partes por millón).
Luego de estabilizada esta terapéutica y al momento del traslado, aproximadamente 90 minutos después, la respuesta se consideró aceptable en los pacientes 1 y 2, con una mejoría clínica notoria, SpO2 de 99%, PMAP normales de 18,5 ± 2,1 mmHg, aumento de la PAM de 56%, y relación PMAP/PAM del orden de 36%.
Para no precipitar un efecto rebote al suspender bruscamente la inhalación de NO, se monta para el traslado un sistema portátil de balones de NO y O2 al 100%, se precalibra un sistema de ventilación manual tipo Ambú, para administrar hasta el arribo de los pacientes al centro de tratamiento intensivo (CTI) la misma concentración efectiva usada en sala de operaciones.
Queremos destacar entonces, que cuando esté indicado el uso de NO, el mismo puede empezarse en sala de operaciones usando un método simple de administración, y que adecuando los recursos comunes de ventilación manual para el traslado de los pacientes a la unidad de cuidados intensivos es posible administrar la misma dosis de NO que con los métodos de ventilación mecánica.
Palabras clave: Óxido nítrico
Hipertensión pulmonar
Sala de operaciones
Introducción
La hipertensión pulmonar complica la evaluación, el tratamiento y el curso clínico de niños con cardiopatías congénitas. La presión pulmonar también es determinante en el tipo de corrección y en la oportunidad de la misma.
En pacientes con enfermedades como tronco arterioso, anomalía total del retorno venoso, canal aurículo ventricular completo (canal A-V), comunicación interventricular (CIV) grande, trasposición de grandes arterias (TGA) con CIV, etcétera, las crisis de hipertensión pulmonar luego de la corrección quirúrgica de las mismas son frecuentes y determinantes en la mortalidad de los mismos (1-3).
Los recién nacidos y los niños pequeños presentan una reactividad arterial pulmonar mayor que los adultos, también debido a que el miocardio es todavía inmaduro, y existe una mala tolerancia a la sobrecarga ventricular.
Junto a estos factores, la coexistencia de clampeos aórticos prolongados, hipotermia profunda, circulación extracorpórea (CEC) y ventriculotomías en el tratamiento de estas enfermedades complejas, hace que el uso de medidas terapéuticas agresivas ya desde la salida de la asistencia circulatoria sean mandatorias para una evolución final satisfactoria de estos delicados pacientes (4-6).
En aquellos casos en los que el manejo ventilatorio para disminuir las resistencias pulmonares (hiperventilación, alcalosis, FiO2 100%, etcétera) no es suficiente; el uso de vasodilatadores sistémicos como las prostaglandinas, el nitroprusiato de sodio o la nitroglicerina es muy riesgoso pues al no ser selectivos disminuyen la perfusión sistémica.
El óxido nítrico (NO) inhalado es un vasodilatador pulmonar selectivo, actúa exclusivamente en los vasos pulmonares próximos a los alvéolos ventilados, al pasar a la sangre se inactiva en aproximadamente 30 segundos al unirse a la hemoglobina formando metahemoglobina, no llegando entonces a alcanzar las arteriolas sistémicas periféricas (7-9).
Desde inicios de la actual década el uso de este recurso terapéutico ha aumentado, al contar con él desde el año 1997 en nuestro Servicio, hemos comenzado a utilizarlo en forma lo más rápida posible, luego de ensayar primero el tratamiento clásico de la hipertensión pulmonar en aquellos pacientes en los cuales se ha demostrado que su uso es diríamos imprescindible; por ello describimos a continuación nuestra experiencia inicial en estos tres primeros casos en los cuales el comienzo de la terapéutica se hizo en sala de operaciones luego de la salida de CEC.
Casos y método de trabajo
Se estudia el curso intraoperatorio de tres pacientes con edades de 5, 7 y 8 meses, portadores de cardiopatías congénitas tipo retorno venosos anómalo pulmonar supradiafragmático en los casos 1 y 2, y canal A-V completo en un paciente con síndrome de Down en el caso 3; que fueron sometidos a cirugía correctiva, en CEC, hipotermia profunda y bajo flujo. En la tabla 1 se muestran los datos de los pacientes.
Tabla 1. Datos patronímicos
| Paciente | Edad (meses) | Enfermedad | Peso (kg) |
| 1 | 5 | RVAPTsc | 5,355 |
| 2 | 7 | RVAPTvcs | 7,200 |
| 3 | 8 | Canal A-V | 6,150 |
RVAPTsc: retorno venoso anómalo pulmonar a seno coronario; RVAPTvcs: retorno venoso anómalo pulmonar a vena cava superior; Canal A-V: canal aurículo ventricular.
Se realiza anestesia intravenosa con inducción y mantenimiento con fentanyl, midazolam, y relajación muscular con pancuronium en todos los casos. Se usa y monitoriza un patrón ventilatorio de acuerdo a la edad y características de los pacientes en un ventilador Siemens 900 D sin humidificador incorporado.
La CEC se cumple en una máquina Stocker SIII, con oxigenadores de membrana pediátrico Polystan.
A parte de la monitorización invasiva y no invasiva habitual en las cirugías cardíacas, a todos estos pacientes se les coloca un catéter de arteria pulmonar transventricular derecho.
Para administrar NO se utiliza un equipo compuesto por balones de NO en nitrógeno a 1.000 ppm (partes por millón), manómetro reductor, y microflujímetro AGA. El mismo posee una escala aleatoria.
A los efectos de lograr la concentración deseada de NO, que en nuestros casos es al inicio de 20 ppm., debe calcularse el flujo de este gas en ml/min de acuerdo a la siguiente fórmula:
NO en ml/min = FGN* en l/min x
concentración deseada de NO en ppm
* FGN: flujo de gas nuevo
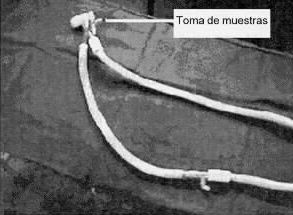
Este flujo de NO se introduce en la rama inspiratoria del sistema de ventilación a una distancia entre 35 a 60 cm del extremo del paciente, como lo muestra la figura 1.
Se monitoriza constantemente la concentración alcanzada de NO y la generación de NO2 en el sistema en un monitor electromecánico tipo NoxBox (Bedfont, England), tomando las muestras del extremo del sistema ventilatorio próximo al paciente. Mediante una llave de tres vías en ese lugar, se conecta el medidor a la atmósfera circundante al paciente para analizar también allí la concentración de NO y NO2; como está ilustrado en la figura 2.
Se registran los parámetros hemodinámicos y ventilatorios desde un monitor Spacelabe modelo 903585, antes de la administración de NO, aproximándonos a 60 minutos de iniciada la misma, y al traslado de los pacientes a CTI.
En todos los casos antes de introducir el NO se realizó hiperventilación, alcalosis, y apoyo inotrópico con dopamina y amrinona.
Al salir de CEC, al comprobarse los parámetros que se expresan en la tabla 2, se coloca a los pacientes en circulación asistida, se comienza la inhalación de NO a 20 ppm y cuando se logra la estabilización de los mismos se abandona la asistencia.
Tabla 2. Parámetros al inicio del óxido nítrico
| Paciente | PAS | PAD | PAM | PSAP | PDAP | PMAP | %MAP/ | PAI | pH | PaCO2 | EB |
| 1 | 70 | 35 | 52 | 35 | 17 | 25 | 48 | 10 |
|
|
|
| 2 | 40 | 20 | 31 | 26 | 15 | 20 | 64 | 15 | 7,46 | 33 | 0,1 |
| 3 | 58 | 29 | 29 | 56 | 29 | 39 | 130 | 19 | 7,45 | 32 | 0 |
PAS: presión arterial sistólica; PAD: presión arterial diastólica; PAM: presión arterial media; PSAP: presión sistólica de la arteria pulmonar; PDAP: presión diastólica de la arteria pulmonar; PMAP: presión media de la arteria pulmonar; PAI: presión en la aurícula izquierda; EB: exceso de bases
El exceso de gases del ventilador se extrae de la sala a través de un tubo corrugado a una área ventilada fuera de la misma. La sala se encuentra ventilada a 18 Cº durante la cirugía y a 23 Cº luego de la salida de CEC.
Al finalizar con la cirugía, manteniendo el soporte inotrópico citado se traslada a los pacientes al CTI, manteniendo la administración de NO, con un equipo portátil, y un sistema de ventilación manual tipo Ambú precalibrado, como se especifica en la tabla 3.
Tabla 3. Ambú de traslado
| FGN | NO ml/min | NO ppm |
| 5 | 10 | 3 |
| 5 | 30 | 8 |
| 5 | 60 | 25 |
ppm: partes por millón
En los pacientes 2 y 3, para descartar defectos residuales en la reparación quirúrgica, se realiza ecocardiograma intraesofágico intraoperatorio, en el caso 2 no muestra alteraciones funcionales ni residuales, mientras que en el caso 3 se evidencia fundamentalmente una mala función ventricular (fracción de acortamiento de 31%), que se acompaña de valores de presión de aurícula izquierda de 18 mmHg.
Los datos estadísticos se procesaron en una planilla electrónica tipo Excel Microsoft Office 1997, realizándose estadística inferencial con la prueba Chi cuadrado para las variaciones de la presión media de la arteria pulmonar (PMAP) y de la presión arterial media (PAM).
Resultados
Los valores registrados antes y después de instaurada la terapéutica con NO, y la valoración de la respuesta a la misma se representan en las tablas 2,4,y 5 y la figura 3.
Tabla 4. Parámetros luego de estabilizada la dosis de óxido nítrico
| Paciente | NO ppm | Minutos | PAS | PAD | PAM | PSAP | PDAP | PMAP | SpO2 | EtCO2 | %AP/ |
| 1 | 30 | 60 | 76 | 45 | 61 | 34 | 20 | 26 | 91 | 24 a 28 | 42 |
| 2 | 20 | 70 | 78 | 43 | 58 | 29 | 16 | 19 | 100 | * | 32 |
| 3 | 20 | 45 | 48 | 26 | 32 | 44 | 25 | 32 | 98 | * | 100 |
* no se pudo contar con equipo por reparación
PAS: presión arterial sistólica; PAD: presión arterial diastólica; PAM: presión arterial media; PSAP: presión sistólica de la arteria pulmonar; PDAP: presión diastólica de la arteria pulmonar; PMAP: presión media de la arteria pulmonar; PAI: presión en la aurícula izquierda; EB: exceso de bases; ppm: partes por millón.
Tabla 5. Parámetros al traslado a CTI
| Paciente | NO ppm | PAS | PAD | PAM | PSAP | PDAP | PMAP |
| 1 | 20 | 80 | 43 | 58 | 29 | 15 | 20 |
| 2 | 20 | 60 | 32 | 44 | 26 | 11 | 17 |
PAS: presión arterial sistólica; PAD: presión arterial diastólica; PAM: presión arterial media; PSAP: presión sistólica de la arterria pulmonar; PDAP: presión diastólica de la arteria pulmonar; PMAP: presión media de la arteria pulmonar; ppm: partes por millón.
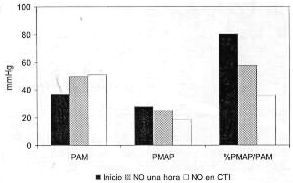
Figura 3. Óxido nítrico en sala de operaciones
La evolución de los pacientes se registra en las tablas 6,7 y 8.
Tabla 6. Evaluación de la respuesta inicial
| Paciente | PMAP | PAM | EtCO2 | %AP/PA | Respuesta |
| 1 | 1% | 17,5% | 14% | 48 a 32 | Buena |
| 2 | -38% | 87% | * | 64 a 32 | Buena |
| 3 | -17% | 10% | * | 130 a 100 | Ausente |
* no se pudo contar con equipo por reparación
Tabla 7. Evaluación de la respuesta al traslado
| Paciente | PMAP | PAM | %AP/PA | Respuesta |
| 1 | -20% | 12% | 48 a 34 | Buena |
| 2 | -15% | 42% | 64 a 38 | Buena |
| 3 |
|
|
|
|
Tabla 8. Evolución de los pacientes
| Paciente | NO ppm | NO horas | %AP/PA | Alta (días) |
| 1 | 20 | 48 | 30 | 15 |
| 2 | 20 | 36 | 25 | 14 |
| 3 | 40 | 17 | 50* | - |
* fallece por fibrilación ventricular; ppm: partes por millón.
De estos resultados se destaca:
1. Desde el punto de vista de la indicación del tratamiento con NO en base a la medición de la presión de la arteria pulmonar, la PMAP era al inicio en promedio 80,6% (48 a 130%) de la PAM (se acepta como valor superior de lo normal hasta 50%). A su vez la PMAP en todos los casos era mayor de 20 mmHg (28 mmHg promedio).
2. Las presiones de llenado izquierdas y la evaluación visual de la contractilidad del ventrículo izquierdo eran buenas en los casos 1 y 2, no así en el caso 3.
3. De la valoración de la respuesta se destaca que en los casos 1 y 2 la misma debe ser catalogada de aceptable pues la PMAP desciende en promedio 24%, aumentando la PAM en 40%, y disminuyendo la relación entre ambas a 36%.
4. En esos dos casos la dosis de mantenimiento fue de 20 ppm durante 6 horas y se fue descendiendo paulatinamente hasta que en un período de 36 a 48 horas se retiró la misma, produciéndose un destete de la ventilación mecánica favorable y un alta definitiva en 15 y 14 días respectivamente.
5. En el caso número 3, la respuesta debe calificarse como no aceptable, pues la PMAP disminuyó sólo 17%, aumentando la PAM en 10%, descendiendo la relación entre ambas sólo a 100%. En la unidad de cuidados postoperatorios se aumentó la dosis de NO a 40 ppm, lográndose una mejoría parcial de la PMAP que pasó a ser 50% de la PAM, pero pese a una estabilización parcial del cuadro clínico, se mantuvo la mala función ventricular, produciéndose a las 17 horas de postoperatorio una arritmia ventricular que causó la muerte del paciente.
6. La medición de la concentración del NO y del NO2 en el ambiente próximo al paciente fue de 5,3 y 1,2 ppm respectivamente. La medición del NO2 en los pacientes estuvo por debajo de 2 ppm (promedio 1,1)
7. La correlación estadística por el test usado para la variación de la PMAP y la PAM fue de 0,81 y 0,89 respectivamente.
Discusión
El NO inhalado se distribuye a las áreas bien ventiladas de los pulmones, allí difunde al espacio vascular donde actúa sobre los vasos pulmonares, a nivel del músculo liso vascular donde activa a la guanilato ciclasa produciendo GMPc, el que a su vez causa relajación muscular por medio de la disminución intracelular de calcio y por defosforilización de las cadenas livianas de la miosina (1).
De esta forma mejora la oxigenación, al favorecer la irrigación de zonas bien ventiladas, además de disminuir la presión arterial pulmonar (2,9).
Es una terapia con muy poco tiempo de aplicación, no estando aún establecidos los efectos deletéreos que pudiera acarrear su uso; por ello debe recurrirse a ella luego de usar primero otros tratamientos de la hipertensión pulmonar, incorporando además a los pacientes que reciban NO a alguno de los protocolos compasivos que a través del mundo se están realizando (1,2,3,9).
Desde el punto de vista de la indicación del NO en pacientes portadores de cardiopatías congénitas se acepta que puede hacerse de acuerdo a:
- Si se mide la presión de la arteria pulmonar; cuando la PMAP es mayor de 50% de la PAM, o su valor absoluto es mayor de 20 a 25 mmHg (2,7).
- Si no contamos con medición de la misma, cuando el gradiente entre aurícula izquierda y derecha sea mayor de 15 mmHg. O de otra forma, si se nos informa de la existencia de elementos indirectos en el ecocardiograma que sugieran hipertensión pulmonar severa (1).
- En forma preventiva para evitar las crisis de hipertensión pulmonar. Se debe recordar que en enfermedades como tronco arterioso, anomalía total del retorno venoso, TGA con CIV, canal A-V generalmente en pacientes Down mayores de 3 meses de vida sin tratamiento previo, etcétera, el desarrollo de hipertensión pulmonar en el postoperatorio es un hecho reiterado y grave, por lo que la indicación preventiva del uso de NO en esos casos está más que justificada (1,2).
Como se ve en el análisis de nuestros casos, los criterios de inclusión en el tratamiento con NO se justifican tanto por las enfermedades de los pacientes como por las medidas de presión encontradas.
La administración de NO debe ser muy cuidadosa, al contar con un ventilador de flujo variable, optamos por un sistema de administración como el descripto, en el cual el NO se introduce a la distancia mencionada de la rama inspiratoria del paciente, a efectos de lograr una mezcla lo más ajustada posible para ofrecer una concentración constante durante la fase inspiratoria de la ventilación, con la generación menor de NO2 posible (1,9).
Generalmente la administración de NO a menos de 40 ppm no se acompaña de una excesiva producción de NO2, es por ello que en sala de operaciones, optamos por no colocar un canister de cal sodada en el sistema, para simplificar el mismo al máximo. Deberíamos recurrir a su colocación si necesitáramos colocar dosis de NO mayores de 80 ppm, o si la concentración medida de NO2 en el extremo del paciente pasara de las 3 ppm (1,2).
Las medidas ambientales tanto de NO como de NO2 encontradas, pese a usar sondas sin manguito, están por debajo de los máximos reseñados como aceptables en la literatura de 25 y 3 ppm respectivamente. Anecdóticamente, debe recordarse que el NO está presente en la atmósfera en una concentración de 20 a 40 ppb (partes por billón), y que un cigarrillo contiene cerca de 400 a 1000 ppm.
En pacientes con cardiopatías congénitas el uso de NO respeta según los centros una dosis de inicio de entre 10 a 20 ppm (1,2,10).
La evaluación de la respuesta debe hacerse en períodos mayores de 15 minutos de colocada la dosis inicial o de los sucesivos cambios de la misma y se juzga de acuerdo a estos criterios:
1. En general se acepta como buena si la oxigenación y los parámetros hemodinámicos mejoran en un entorno del 20 al 25% (2-8).
2. Si contamos con medida de la presión pulmonar, si la PMAP desciende por debajo de 50% de la PAM.
Entonces de acuerdo a los resultados que se reseñaron y a estos criterios, es válido catalogar la respuesta al tratamiento de los pacientes 1 y 2 como de buena, llegando incluso al momento del traslado a obtener valores de PMAP normales de 18,5 ± 2,12 mmHg.
La respuesta parcial del caso número 3, puede explicarse en parte a que este paciente es portador de una cardiopatía evolucionada, que por motivos de tardanza en la referencia al servicio, no fue posible realizarle antes de la cirugía correctiva un banding de la arteria pulmonar, y ello generará una alteración irreversible de las resistencias pulmonares. En él además debe tenerse en cuenta que al salir de CEC tenía una mala función ventricular, que llevó a que fuéramos muy cautelosos al introducir el NO, o al aumentar su dosis, para no aumentar bruscamente el retorno venoso a las cavidades izquierdas con un daño contráctil severo. Debe destacarse que con los cuidados señalados el uso de NO en este paciente nos permitió sacarlo de asistencia circulatoria y de sala de operaciones, hecho que en otras circunstancias no hubiera sido posible (1,2).
Los efectos contraproducentes del uso el NO, se enmarcan frecuentemente en la posibilidad de un efecto rebote si se suspende su administración en forma brusca, a la producción excesiva de NO2 y de ácidos al reaccionar este con el agua, y a la producción de metahemoglobinemia al inactivarse el NO en sangre con la hemoglobina (1-7).
Se admiten como máximo un tenor de NO2 en los sistemas de administración del orden de las 3 ppm, y un valor de metahemoglobina hasta de 5%.
Como la cirugía y especialmente la CEC pueden aumentar las cifras de metahemoglobina por sí mismas, debería solicitarse una dosificación control antes de comenzar el uso del NO, lo cual por razones de coordinación en esta serie no fue posible.
A los efectos de no propiciar un fenómeno rebote, se mostró eficaz el sistema que se montó para trasladar a los pacientes, así como el hecho de contar con otro equipo para administrar NO que estaba conectado al ventilador que esperaba a los pacientes en el CTI, recalcándose que el mismo sistema manual de ventilación precalibrado que se usa para el traslado es el que queda para hiperventilar con NO a los pacientes antes de someterlos a aspiraciones de la vía aérea.
Como conclusión entonces debemos decir que con todas las precauciones diagnósticas, de control, y de aseguramiento de continuidad del uso del NO que hemos reseñado, su uso en los pacientes en que esté indicado es posible comenzarlo en sala de operaciones, con una modificación simple de los circuitos usados comúnmente en nuestro sistema de ventilación; y que el montaje de un sistema de traslado con ventilación manual también con los recursos con los que nos manejamos rutinariamente es efectivo y de fácil aplicación para mantener la concentración necesaria de NO hasta arribar a la unidad de cuidados postoperatorios.
Bibliografía
1. Área de Terapia Intensiva Neonatal. Publicación del 2º Simposio Internacional de Terapia Intensiva Cardiovascular Pediátrica: Taller de óxido nítrico. Unidad de Cuidados Intensivos Cardiovascular. Área de Terapia Intensiva Neonatal. Hospital de Pediatría "Prof. Dr. JP Garrahan". Buenos Aires: Hospital Garrahan, 1997: 1-20.
2. Wessel D, Adatia I, Thompson J. Inhaled nitric oxide (NO) for the treatment of pulmonary hypertension before and after bypass (CPB). Circulation 1992; 86 (S): 3088.
3. Wessel D, Adatia I, Thompson J, Hickey P. Delivery and monitoring of inhaled nitric oxide in patient with pulmonary hypertension. Crit Care Med 1994; 22: 930-8.
4. Luciani G, Chang A, Starnes V. Surgical repair of transposition of great arteries in neonates with persistent pulmonary hypertension. Ann Thorac Surg 1995; 60: 1791-3.
5. Shah A, Smerling A, Quagebeur J, Michler E. Nitric oxide tratment for pulmonary hypertension after neonatal cardiac operation. Ann Thorac Surg 1995; 60: 1791-3.
6. Hoffman G. Pulmonary vascular hyper-reactivity during prolonged treatment with inhaled nitric oxide in infant and children. Abstrac detail A254 Poster discusión. Philadelphia: Lippincott-Raven, Annual Meeting ASA, 1997: A254.
7. Rich GF, Murphy GD, Roos CM, Johns RA. Inhaled nitric oxide selective pulmonary vasodilatation in cardiac surgical patient. Anesthesiology 1993; 78: 1028-35.
8. Janzen PR, Darowski M. Nitric oxide in a premature infant in the operating room. Anesthesiology 1995; 83 ( 6): 1388.
9. Intersurgical complete respiratory systems training manual " nitric oxide therapy", Nº 1 LN Abril 1997. Directors: Williams SK, Belim H, Williams D England: reg nº 1488409.
10. Hoffman G. Effective doses of unhaled nitric oxide during prolonged administration in children. Abstract detail poster presentation A234. Philadelphia: Lippincott-Raven, Annual Meeting ASA, 1997: A234.