Introducción
La gastrosquisis (GQ) es una malformación congénita caracterizada por una herniación visceral a través de un defecto al lado derecho de la pared abdominal, con un cordón umbilical intacto y no cubierto por membranas1. Es uno de los defectos de la pared abdominal más frecuente, con una prevalencia global de 3-4/10.000 embarazos2,3. La incidencia varía en diferentes regiones del mundo, pero con valores crecientes en los últimos años4,5. En el CHPR, centro de referencia quirúrgico neonatal del subsector público del sistema de salud, también se observó un aumento de la incidencia de 8/10.000 nacidos vivos en 2009 a 20/10.000 nacidos vivos en 2016, con una incidencia acumulada entre 2009 y 2016 de 10,7/10.000 nacidos vivos6.
De etiología y patogenia no bien aclarada, la GQ es una patología compleja que requiere de tratamiento en centros de cuidado intensivo altamente especializados con participación de manera conjunta de varias especialidades (neonatología, cirugía pediátrica, anestesiología y cuidados de enfermería especializada).
Aunque la sobrevida alcanza al 90% de los pacientes portadores de GQ a nivel de países desarrollados, la morbilidad permanece siendo muy elevada, requiriendo internaciones prolongadas y alta demanda de recursos hospitalarios7. La falta de evidencia clara y de alta calidad de las mejores prácticas determinan muchos aspectos controversiales en la asistencia del feto y el recién nacido con GQ, vinculados al momento óptimo y vía del nacimiento, el manejo de las vísceras, el tiempo de vida al cierre quirúrgico del defecto abdominal, así como a los cuidados anestesiológicos a llevar a cabo. En el posoperatorio los desafíos están vinculados al adecuado sostén nutricional y a la prevención de infecciones intrahospitalarias8,9.
En este contexto, la realización de estrategias de mejoría de calidad asistencial que incluyen la estandarización de los procedimientos y conductas llevadas a cabo por equipos multidisciplinarios, han demostrado ser positivas desde el punto de vista de costo/efectividad7,10-13.
Objetivo
Evaluar el impacto de la protocolización del manejo de pacientes con GQ sobre la mortalidad y variables asistenciales asociadas a morbilidad.
Metodología
Criterios de inclusión
• Pacientes portadores de GQ, nacidos entre enero de 2016 y diciembre de 2021, asistidos en el Servicio de Recién Nacidos del CHPR (incluidos los pacientes trasladados desde otras instituciones en las primeras 12 horas de vida), con edad gestacional ≥ 36 semanas y score Z para peso al nacer mayor a -2 DS.
Criterios de exclusión
• Pacientes con mal adaptación a la vida extrauterina con score de Apgar al quinto día de vida < 5 y/o acidosis grave de cordón: pH < 7,10, BE < -10, factores que pueden incidir en la toma de decisiones inmediatamente al nacer.
• Signos de encefalopatía neonatal moderada a severa al nacer, diagnóstico prenatal o sospecha clínica de cardiopatía congénita, diagnóstico prenatal de malformaciones extradigestivas graves, cromosomopatías o alteraciones genéticas.
• No conformidad de los padres en participar de este estudio.
Protocolo
En junio de 2019 se concretó la realización de un protocolo asistencial para el feto y recién nacido portador de GQ, en cuya confección participaron los servicios de Neonatología, Obstetricia, Medicina Perinatal, Cirugía y Anestesiología Pediátrica, siendo recientemente publicado en Archivos de Ginecología y Obstetricia14.
En la (Figura 1) se representa el diagrama de Ishikawa en el que se visualizan los diferentes problemas vinculados al control, cuidados y tratamientos del feto y recién nacido portador de GQ del Servicio de Recién Nacidos del CHPR, identificados por el grupo de trabajo.

Figura 1 Diagrama de Ishikawa para la mejoría de la calidad de atención. Cada uno de los ítems implica un aspecto que puede mejorarse en búsqueda del resultado final.
El protocolo se basa en los siguientes principios14.
• Seguimiento prenatal por parte de la Unidad de Medicina Perinatal a partir del diagnóstico de prenatal a partir del diagnóstico de GQ.
• Coordinación entre las diferentes disciplinas que participan en el momento del nacimiento.
• Para la embarazada que no ha iniciado trabajo de parto, se propone la realización de operación cesárea programada (hora 8), cuando se alcance la edad gestacional entre 36 semanas (+ 0 días) a 36 semanas y 6 días, previa realización de esquema completo de inducción de la maduración pulmonar fetal.
• Para la embarazada que arriba al CHPR en trabajo de parto, se propone el desarrollo de éste y el nacimiento por vía vaginal. Siempre que las condiciones de salud materna y fetal lo permitan se realizará inducción de la maduración pulmonar fetal en los embarazos con edad gestacional < 37 semanas.
• Prevención de hipotermia y pérdida de líquidos por exposición de asas intestinales.
• Introducción precoz de vísceras y cierre quirúrgico de pared abdominal (utilizando flap de cordón umbilical en casos de necesidad) bajo anestesia general. En los casos en que la situación clínica no lo permita, realización de silo quirúrgico para reintroducción por etapas.
• Anestesia multimodal: basada en el uso inicial de anestésico inhalatorio para colocación de vía intravenosa, seguido de anestesia intravenosa total basada en tres fármacos aplicados con bomba de infusión (dexmedetomidina, propofol y remifentanil) y finalmente anestesia locorregional mediante bloqueo del músculo cuadrado lumbar (BCL) con bupivacaína bajo control ecográfico.
• Minimización de la utilización de opioides en la analgesia posquirúrgica.
• Extubación precoz en período posoperatorio inmediato.
• Inicio de APT en las primeras 24 horas de vida.
• Inicio de alimentación enteral precoz con leche de madre fresca (o de donación) en acuerdo con cirujano tratante.
Diseño
Estudio comparativo tipo antes/después. A partir de la implementación del protocolo asistencial mencionado, en junio de 2019, se incluyeron pacientes en el grupo intervención o posaplicación del protocolo referido (grupo GP), realizándose la extracción de datos de manera prospectiva. Se comparó con una cohorte histórica de pacientes que cumplieron con el criterio de inclusión, tratados previamente a la implementación del protocolo cuyos datos fueron extraídos retrospectivamente (grupo GH).
Se compararon variables de cuidados y conductas perinatales, así como evolución clínica, complicaciones, sobrevida y tiempo de estadía intrahospitalaria.
Se definió como GQ simple aquellas que no mostraron alteraciones malformativas, atresias o peel grueso identificados por el cirujano en el momento de la exploración. Se calculó de manera retrospectiva el score pronóstico de gastrosquisis (SPG) desarrollado por la Red de Cirugía Pediátrica de Canadá. Éste se basa en la presencia o ausencia de alteraciones a nivel intestinal (peel, atresia, perforación o necrosis) y ha sido validado como herramienta pronóstica de morbilidad15. De acuerdo al mismo se identificaron aquellos pacientes con un SPG ≥ 2 con un riesgo significativamente aumentado de morbilidad, tiempo de estadía, inicio de vía enteral y tiempo total de APT. Por otra parte, un SPG ≥ 4 se asoció a mayor riesgo de muerte15.
Se consideró reintervención cuando el paciente requirió una nueva intervención luego de la primera instancia en block quirúrgico. En todos los casos se realizó medición de la presión intraabdominal (PIA) luego del cierre de piel en el acto quirúrgico, que se realizó por técnica de medición de presión intravesical (de preferencia) o intragástrica.
Se definió el tiempo de inicio de la vía enteral como el primer día de alimentación enteral, habiéndose mantenido el aporte sin interrupción por 72 horas independientemente del volumen administrado (no se tomó en cuenta la impregnación de calostro en boca), y se consideró la primera deposición de meconio constatada (espontánea o por enema evacuador). El tiempo total de ventilación mecánica se definió desde la intubación orotraqueal hasta la retirada definitiva del soporte invasivo y tiempo de alimentación parenteral desde el inicio de ésta hasta el último día completo. Se definió como sepsis la presencia de uno o más hemocultivos positivos.
Desde el punto de vista estadístico la comparación entre grupos se realizó considerando datos demográficos perinatales, así como variables de tratamiento y evolución. Los datos se analizaron usando test de Fisher o chi cuadrado y test de Mann-Withney para las variables categóricas, respectivamente, considerando significativo un valor de p < 0,05. Las variables continuas se representaron como mediana y rango intercuartílico.
Los datos fueron almacenados en planilla Excel (R) confeccionada a tales efectos y procesados en Graph Pad Prisma (R) versión 6.0c.
Aspectos éticos
El estudio fue aprobado por el Comité de Ética de investigación del CHPR.
Se confeccionó un material escrito para brindar información a los padres acerca de la patología en curso y de las posibilidades terapéuticas. Integrantes del equipo de cuidados paliativos neonatales tomaron contacto con la familia en las primeras consultas de seguimiento a partir del diagnóstico prenatal, brindando información de manera presencial caso a caso. Dado el carácter coordinado de la intervención, fue posible un abordaje en tiempo y forma para una adecuada toma de decisiones. En todos los casos se solicitó consentimiento informado para la aplicación del protocolo y el manejo de los datos incluidos en la historia clínica con fines académicos o de divulgación.
En el caso del grupo histórico o control, dado el carácter retrospectivo del estudio, no se solicitó consentimiento. En todos los casos se preservó el principio de confidencialidad mediante la codificación de los pacientes incluidos.
Resultados
En el período estudiado, 64 pacientes portadores de GQ nacieron o fueron asistidos en el CHPR. Un total de 29/38 pacientes en el grupo GH y 18/26 pacientes en el grupo GP cumplieron con los criterios de inclusión. Fueron excluidos 17 pacientes, 9 en el grupo GH (8 pacientes con EG < 36 semanas y 1 paciente con score z para PN -3 DS) y 8 en el grupo GP (7 pacientes con EG < 36 semanas y 1 con score Z para PN -4 DS).
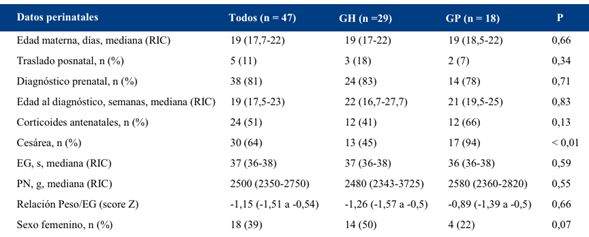
Los datos perinatales relevantes se muestran en la (Tabla 1). No se observaron diferencias significativas entre ambos grupos, con excepción del número de nacimientos por cesárea en el grupo GP, intervención programada para este grupo, al igual que la administración de corticoides que muestra un aumento no significativo de 25%. Todos los traslados fueron realizados por equipos de los centros que enviaron los pacientes, sin participación del centro receptor.
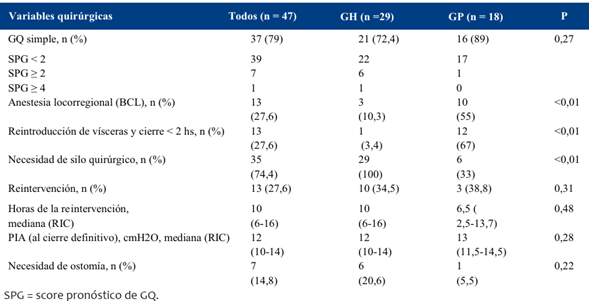
Las GQ complejas se observaron en el 21% de los pacientes incluidos en el estudio (Tabla 2). En el grupo GH se observaron como patologías asociadas estenosis y atresia duodenal, atresia yeyunal, microcolon asociado a las atresias y en ocho pacientes peel con diferentes grados (leve a severo), mientras que en el grupo GP se observó atresia ileal y de sigmoides, hipoplasia colónica, y dos pacientes con bridas, el peel no fue evidenciable en este último grupo de pacientes. Si bien la incidencia de GQ simples no mostró diferencias significativas entre ambos grupos de estudio, al evaluar el SPG puede observarse un mayor número de pacientes con SPG ≥ 2 e incluso un paciente con SPG ≥ 4 en el grupo GH (total n = 7), a diferencia del grupo GP en el cual solo uno de ellos presentó un score ≥ 2.
Los pacientes en el grupo GP recibieron BCL en una proporción significativamente mayor al grupo GH (55% vs 3,4%), lográndose la reintroducción de vísceras a la cavidad abdominal en las primeras dos horas de vida (ingreso precoz a sala de cirugía) en 67% vs 3,4% del grupo GP, con una necesidad de silo quirúrgico en 6/18 pacientes (33%). El 13% del total de pacientes requirieron una segunda intervención, siendo la tasa similar en ambos grupos de estudio. No se observaron diferencias en las demás variables evaluadas (Tabla 2).
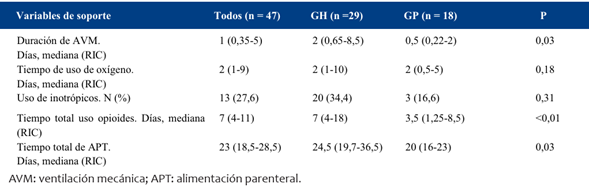
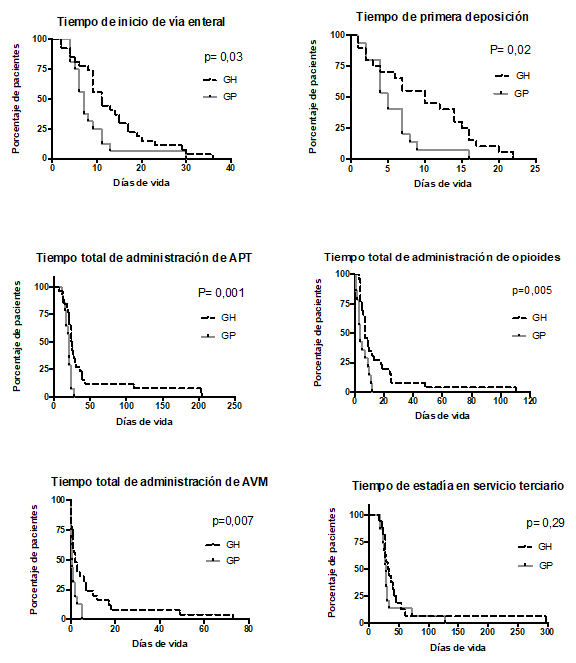
Para las variables de soporte consideradas, se observó un menor tiempo total de AVM, mediana de 0,5 días (RIC 0,22-2 días) vs 2 días (RIC 0,65-8,5 días, p = 0,03); menor tiempo de administración de opioides, mediana de 3,5 días (RIC 1,25-8,5 días) vs 7 días (RIC 4-18 días, p < 0,01) y menor tiempo de necesidad de APT, mediana 20 días (RIC 16-23 días) vs 24,5 días (RIC 19,7-36,5 días, p = 0,03) en el grupo GP al compararlo con el grupo GP respectivamente (Tabla 3).
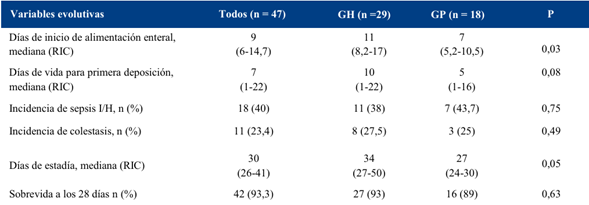
En tanto en las variables evolutivas se observó un menor tiempo para el inicio de la alimentación enteral, mediana 7 días (RIC 5,2-10,5 días) vs 11 días (RIC 8,2-17 días), p = 0,03 y una tendencia a la reducción del tiempo de internación en el centro de referencia, mediana de 28 días (18-128 días) vs 37 días (RIC 17-297 días), p = 0,05 para el grupo GP.
La incidencia de sepsis en los pacientes con GQ analizados en este estudio alcanzó el 40%, sin diferencias significativas entre ambos grupos evaluados. Al igual que la incidencia de hiperbilirrubinemia directa (23,4%), una de las complicaciones observadas a partir de la administración prolongada de APT (grupo GH 27,5% vs grupo GP 25%). Entre las complicaciones analizamos la presencia de hiponatremia (sodio < 135 mEq/L), la misma se constató en el 83% de los pacientes (grupo GH 83% vs grupo GP 77%). En esta variable el valor más bajo de sodio registrado en el posoperatorio inmediato fue 124,5 mEq/L (RIC 120 - 128 mEq/L) en el grupo GH vs 124 mEq/L (RIC 117,5 - 126,5 mEq/L) para el grupo GP.
La sobrevida previa al egreso hospitalario alcanzó al 93,3% de los pacientes analizados, sin diferencia entre ambos grupos (grupo GH 93% vs grupo GP 89%), (Tabla 4).
Se realizó además la comparación de las variables evolutivas ya mencionadas, exclusivamente los pacientes portadores de GQ simples, las diferencias entre ambos grupos solo se mantuvieron para el tiempo de inicio de la vía enteral grupo GH, mediana 11 días (RIC 7 - 15 días) vs GP, mediana 7 días (4,5 - 10 días) (p= 0,02), y tiempo total de administración de APT grupo GH, mediana 24 días (RIC 19,2 - 29,5 días) vs GP, mediana 20 días (RIC 15,5 - 22 días) (p = 0,03), (Figura 2).
Discusión
En este estudio hemos observado que la aplicación de un protocolo de manejo y tratamiento del paciente con GQ, centrado en el cierre precoz del defecto abdominal y la introducción de la anestesia locorregional en el acto quirúrgico, se asoció a una reducción del tiempo total de uso de opioides, de AVM y APT, así como menor demora en el inicio de la alimentación por vía enteral. Sin embargo, no se observaron diferencias en la incidencia de sepsis, hiperbilirrubinemia directa, tiempo de estadía y sobrevida al egreso hospitalario.
La aplicación de un protocolo asistencial ha demostrado ser efectiva para mejorar resultados de pacientes con GQ de acuerdo a varios reportes previos. Haddock C y colaboradores estandarizaron el uso de bolsa plástica para protección de las asas intestinales, aporte de fluidos intraoperatorios, antibioticoterapia preventiva, cierre de la pared abdominal diferido previa realización de silo quirúrgico en sala de nacimiento, sumado a sedación y analgesia (utilizando morfina y dexmedetomidina), observaron reducción en el tiempo de ventilación mecánica, así como reducción en la tasa de infección de herida operatoria16. De Ugarte DA y colaboradores establecieron una línea de tratamiento a seguir en GQ, que incluyó el manejo estandarizado del soporte respiratorio intraoperatorio, uso de antibióticos y discontinuación a las 48 horas con hemocultivo negativo, manejo del dolor con suspensión de opioides en las primeras 48 horas, manejo de las vías centrales y guía de alimentación basada en la introducción precoz de leche de madre con aumento progresivo de acuerdo a la tolerancia gástrica. Los resultados mostraron una reducción en el tiempo total de AVM, de ATB y en el inicio precoz de la alimentación enteral17. Zalles-Vidal C y colaboradores establecieron un protocolo asistencial para nacimientos extrahospitalarios en pacientes portadores de GQ, basados en el cierre precoz o reintroducción progresiva de vísceras sin utilización de anestesia general, manejo de vías centrales por punción periférica e inicio precoz y progresivo (20 ml/kg/día) de la alimentación enteral (a las 72 horas luego de cierre de sonda orogástrica cuando el residual gástrico fue < 30 ml/kg/día) con leche de madre. Observaron una reducción significativa de la mortalidad, el tiempo de AVM, APT e incidencia de sepsis18 .
Como puede apreciarse, los protocolos establecidos y evaluados no son comparables, ni pueden ser unificados, ya que cada uno de ellos atiende a las particularidades de cada centro. Por otro lado, queda claro también que una iniciativa de mejoría de la calidad asistencial en GQ implica indefectiblemente la participación de múltiples disciplinas que deben acordar y ajustar, para que los cambios propuestos efectivamente puedan llevarse a cabo.
Hasta el momento, a lo largo de múltiples revisiones realizadas, no se ha podido demostrar que la interrupción del embarazo mediante cesárea electiva antes del término de la gestación, sea una conducta beneficiosa para el paciente en todos los casos19. La evolución definitiva parece estar fundamentalmente asociada a la extensión de la lesión intestinal in utero (lo cual se ha vinculado a la exposición de las asas intestinales al líquido amniótico) y a la presencia de complicaciones secundarias a su pasaje por la brecha abdominal (constricción con estrangulación relativa de asas y/o alteraciones de la vascularización intestinal con atresia, estenosis, vólvulo, etc., como consecuencia)20. Sumado a que la prematurez y la ausencia de trabajo de parto son factores intercurrentes que pueden afectar la morbilidad en este grupo de pacientes21,22.
Aun así, Landisch RM y colaboradores encontraron que la cesárea electiva antes del término determinada por la presencia de GQ, se ha asociado a menor tiempo para alcanzar la vía enteral total y menor incidencia de sepsis, mientras que Goldstein MJ y colaboradores encontraron en un subanálisis una posible reducción de la incidencia de sepsis y tiempo total de ventilación mecánica sin aumentar el tiempo de internación o la mortalidad23,24.
La cesárea electiva tiene como ventajas algunos aspectos logísticos ineludibles, permitiendo una adecuada coordinación entre los equipos asistenciales, sin la cual es imposible alcanzar las metas propuestas en el CHPR. Este fue uno de los argumentos para considerar la indicación del nacimiento por cesárea coordinada a las 36 semanas (0-6 días) en los embarazos que alcanzada esta edad gestacional no iniciaron el trabajo de parto.
Los reportes históricos muestran que el embarazo cuyo feto es portador de GQ, con frecuencia finaliza de manera espontánea antes del término de la gestación (30%-40% de los casos), con una mediana de EG al nacimiento en el CHPR de 36 semanas25,26. Por otra parte, la incidencia de terminación del embarazo por operación cesárea en este mismo centro se ha reportado entre 45% y 62%26,27. En este estudio estos resultados se confirman, ya que en el grupo evaluado previo a la instauración del protocolo asistencial, se observó una mediana de 37 semanas de EG al nacer (RIC 36-38 semanas) con 45% de los nacimientos por operación cesárea.
Un elemento crucial para el pronóstico evolutivo de los pacientes portadores de GQ es la presencia de anomalías o malformaciones intestinales asociadas (GQ complejas), que para este estudio alcanzan a 21% de los pacientes incluidos, lo cual es similar a lo reportado por la literatura28.
Si bien la incidencia de GQ compleja no fue diferente entre ambos grupos, en este trabajo se aplicó el SPG, cuya relevancia radica en diferenciar la carga de morbilidad de acuerdo al grado de injuria intestinal, siendo más bajo en el grupo posprotocolo. Cabe la posibilidad de que el estado de las vísceras intestinales impacte en los resultados evolutivos.
Por otra parte, se analizó de manera comparativa los resultados entre las GQ simples exclusivamente, observándose diferencias significativas en la reducción de los tiempos de inicio de vía enteral y de tiempo total de administración de APT. El bajo número de la muestra no permitió comparar ambos grupos entre los pacientes portadores de GQ complejas.
Uno de los aspectos diferenciales del protocolo desarrollado incluye la sedación y analgesia abarcando los períodos preoperatorio, intraoperatorio y posoperatorio (mediato e inmediato). El equipo de anestesiología del CHPR realizó una estrategia basada en la anestesia intravenosa total (TIVA, por su sigla en inglés) utilizando dexmedetomidina, propofol y remifentanil, administrados con bomba de infusión y evitando la utilización de paralizantes musculares. Formando parte del concepto de anestesia multimodal, en el período de aplicación del protocolo asistencial referido se logró sistematizar la realización de anestesia locorregional (en 10/18 pacientes versus 3/29 pacientes en el período previo). El objetivo planteado fue reducir al mínimo el uso de agentes anestésicos intraoperatorios, que pueden prolongar el efecto anestésico en el posoperatorio. En este procedimiento el fármaco utilizado (bupivacaína 0,25%) se administró a nivel de las fascias del músculo cuadrado lumbar, difundiendo hasta el espacio paravertebral, determinando bloqueo analgésico de la pared y de la cavidad abdominal. La analgesia regional mediante BCL ha sido bien descripta en adultos, sin embargo, en pacientes pediátricos con cirugía abdominal, la evidencia disponible es aún escasa, aunque en los estudios realizados ha mostrado efectividad en lograr analgesia sostenida en el posoperatorio. La dosis utilizada (0,3-0,5 ml/kg de bupivacaína al 0,25%) surge de la adaptación de los estudios realizados en niños, considerando las características propias del período neonatal, sobre todo la menor proporción de proteínas plasmáticas a los que se une el fármaco, así como el menor metabolismo y clearence hepático. Si bien no se constataron eventos adversos vinculados a la estrategia analgésica empleada, claramente este reporte no está diseñado con ese objetivo y es motivo de un estudio particular cuyos resultados serán presentados aparte (Figura 3).
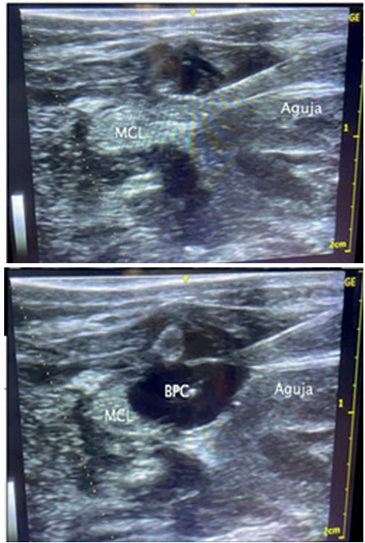
Figura 3 Analgesia locorregional. Administración de bupivacaína mediante inyección (aguja) en la fascia a nivel del músculo cuadrado lumbar. En la imagen A se observa la aguja penetrando en la fascia y en la imagen B el líquido desplazándolo (espacio negro).
Uno de los objetivos del protocolo asistencial fue la precoz reintroducción de las vísceras en la cavidad abdominal y el cierre quirúrgico de la pared en las primeras dos horas de vida, utilizando la estrategia anestésica ya descripta (GH 3,4% vs GP 67%, p<0,01). Como consecuencia, una reducción en el uso de silo quirúrgico (100% en período GH a 3% en GP), sin aumento significativo de la necesidad de reintervención. En este estudio la introducción precoz de las vísceras intestinales con cierre de la pared abdominal no se asoció con cambios en las variables evaluadas, con excepción de una significativa reducción en el tiempo de administración de opioides (p < 0,01).
Con respecto al método de cierre de la pared abdominal, no está claro cuál es el más apropiado. En la actualidad muchos centros optan por técnicas diferentes a las de este protocolo, como son el cierre de pared abdominal sin sutura o la introducción de las vísceras por etapas, mediante la realización de un silo quirúrgico. Se han realizado múltiples estudios comparando resultados al utilizar estas diferentes técnicas de cierre de la pared abdominal, sin encontrar claras ventajas de una sobre otras para todos los casos. Sin duda, la heterogeneidad de presentación de las lesiones vinculadas a GQ hacen que una técnica predomine sobre otra obteniendo mejores resultados en función de las formas de presentación y compromiso de las vísceras herniadas.
Las mayores dificultades en la implementación del protocolo radicaron en lograr la integración de todo el equipo asistencial y en establecer un grupo de trabajo que registre la evolución de los pacientes durante su internación para poder mejorar las intervenciones propuestas o modificarlas.
El protocolo continúa vigente, los resultados aquí expuestos son estimulantes para continuar evaluando medidas que mejoren la calidad asistencial de los pacientes con GQ, entre ellas se destaca la búsqueda en el período prenatal de marcadores ecográficos y clínicos que determinen con mayor precisión la presencia de malformaciones digestivas así como complicaciones de las vísceras comprometidas. La diferenciación del manejo quirúrgico atendiendo a los hallazgos in situ para definir la técnica de cierre de la pared abdominal, los cuidados del aporte de volumen y la termorregulación en el intraoperatorio, así como la necesidad de generar guías que tiendan al inicio más precoz de la alimentación enteral, estrategias para modular la microbiota intestinal al producirse el nacimiento por cesárea y paquetes de medidas que reduzcan la preocupante incidencia de sepsis (40% de toda la muestra, 43,7% en el período posprotocolo) o de hiperbilirrubinemia directa (23,4%), son algunos de los desafíos a considerar en el futuro próximo del trabajo del grupo interdisciplinario.
Conclusiones
La aplicación de un paquete de medidas generadas por un equipo interdisciplinario se asoció a una reducción en el tiempo para la reintroducción de vísceras y en el cierre de la pared abdominal, así como del tiempo de uso de ventilación mecánica invasiva, alimentación parenteral y de opioides, con un inicio más precoz de la nutrición enteral. Estos resultados estimulan la continuidad de una cultura organizacional dedicada a la mejora continua en el paciente portador de esta patología tan frecuente y compleja.