Introducción
La encefalopatía neonatal (EN) asociada a eventos perinatales es una patología prevalente a nivel mundial, se ha calculado una incidencia de 8,5 casos cada 1.000 nacidos vivos (1,15 millones de neonatos), 96% de éstos en países de medianos y bajos ingresos económicos1. La incidencia depende de los criterios utilizados para su cálculo, en los países desarrollados se estima en 1,6/1.000 nacidos vivos (0,5-2,5/1.000 nacidos vivos), para Latinoamérica la información es escasa al respecto. Un reporte de la Sociedad Iberoamericana de Neonatología (SIBEN) encontró una prevalencia de 5,1% y una mortalidad de 42% para cinco países (33 unidades analizadas)1,2.
En Uruguay, no hay datos recientes. Briozzo L y Sosa CG refirieron una prevalencia de 2,12% en el año 2003; por otro lado, desde hace más de diez años la asfixia perinatal es la tercera causa de muerte en el período neonatal, solo superada en frecuencia por la prematurez y las malformaciones congénitas3.
La morbilidad determinada por la encefalopatía hipóxico isquémica (EHI) varía con el grado de severidad y las medidas terapéuticas interpuestas, entre ellas, se cita retardo mental, epilepsia, alteraciones neurosensoriales y parálisis cerebral4. La hipotermia controlada (HTC) se ha convertido en el tratamiento de elección para recién nacidos con EHI moderada a severa, estudios randomizados controlados y metaanálisis han demostrado que esta terapia es eficaz en reducir alteraciones del neurodesarrollo a los 18-24 meses, así como la incidencia de muerte5. En pacientes tratados con HTC en países de altos ingresos la mortalidad alcanza el 26%, mientras que entre los sobrevivientes el 26% presenta alteraciones mayores del neurodesarrollo, 25% muestra reducción significativa del índice de desarrollo mental y 23% parálisis cerebral6.
Sin embargo, hay que ser cautelosos al extrapolar estos resultados. El estudio Helix, realizado en países del sudeste asiático categorizados como de medianos y bajos recursos económicos, incluyendo unidades con capacidad de cuidados terciarios y equipamiento con servocontrol de temperatura, ha lanzado una voz de alarma al no demostrar beneficios a los 18-24 meses cuando se compararon pacientes que recibieron HTC con grupo control, observando además un aumento de la mortalidad7. Estos resultados ameritan una revisión de la seguridad y efectividad de la HTC en países de medianos y bajos recursos económicos, básicamente por las dificultades en contar con personal entrenado y adecuado en número para los cuidados necesarios, por las características particulares de la población asistida, así como por las limitaciones en la disponibilidad de dispositivos adecuados de enfriamiento.
En Uruguay la aplicabilidad de HTC es muy variable, los centros con mayor número de casos se encuentran en Montevideo, pero desde hace algunos años la terapia también se lleva a cabo en centros del interior del país, destacándose un creciente interés en asegurar la calidad de los cuidados. Sin embargo, el manejo adecuado de estos pacientes es difícil de lograr si el número de casos es muy espaciado en el tiempo. A esto debe agregarse el desafío que puede significar para el clínico iniciar el enfriamiento cuando se evidencian aspectos controversiales vinculados a aquellos pacientes que no cumplen de manera estricta con los criterios de inclusión utilizados en los estudios fundacionales de HTC8.
Por otro lado, es muy importante considerar que la neuroprotección es un concepto mucho más amplio que administrar HTC. Tan o más importante es el manejo de las diferentes alteraciones que pueden aumentar el daño iniciado a partir de la injuria hipóxico isquémica (HI). Para esto es fundamental el entrenamiento para una resucitación adecuada y un correcto manejo posterior. Esto incluye una ventilación gentil (evitando lesión pulmonar, así como híper e hipocapnia), un adecuado uso del oxígeno (evitando hipo e hiperoxia), el soporte hemodinámico precoz (diagnosticando y tratando precozmente la disfunción cardíaca y la hipotensión), el control y aporte precoz de glucosa en caso de necesidad (evitando la hipoglicemia y controlando la hiperglucemia), el manejo de las alteraciones hidroelectrolíticas y del equilibrio ácido base, así como el diagnóstico y tratamiento oportuno de las convulsiones.
En esta revisión nos proponemos ofrecerle al equipo asistencial un análisis de las herramientas disponibles para el diagnóstico precoz de EHI pasible de HTC, así como una revisión de la evidencia en aquellos aspectos en discusión, sumándole la postura del grupo de trabajo al cual pertenecemos, que desarrolla su actividad en un centro asistencial terciario de referencia nacional para los pacientes del subsistema público, con diez años de experiencia en esta terapia9.
Encefalopatía neonatal, hipoxia isquemia perinatal y encefalopatía hipóxico isquémica
Un aspecto fundamental para la toma de decisiones es tener claras las definiciones de EN, de asfixia perinatal (AP) y de EHI, ya que de esto surgirán las conductas a seguir (Figura 1).
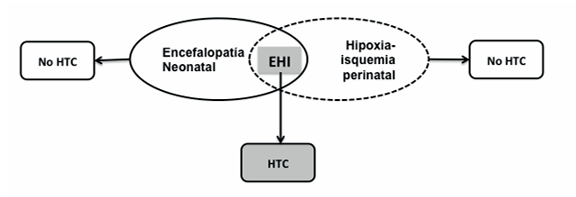
Figura 1 Inclusión de pacientes en HTC, reconociendo la conjunción de los signos de encefalopatía neonatal y de asfixia perinatal como requisitos ineludibles para la indicación de hipotermia controlada.
• En recién nacidos con edad gestacional mayor a 35 semanas, la EN ha sido definida como “un síndrome clínico caracterizado por algún grado de alteración de la conciencia, el tono y los reflejos que por lo general se acompaña de dificultades en el inicio o sostén del esfuerzo respiratorio”10. Las posibles causas de EN son múltiples, si bien hay autores que refieren a la HI perinatal en 50% a 80% de los casos, debe reconocerse que también alteraciones malformativas cerebrales, metabólicas, infecciones del período perinatal, anomalías placentarias y del cordón umbilical, sumados a coagulopatías y accidentes vasculares (stroke perinatal) puede estar en la base etiológica o sumar sus efectos a alteraciones HI. Por otro lado, en un importante número de casos no puede identificarse claramente la causa de EN11. Por tanto, queda claro que es un error relacionar la EN de manera exclusiva con la HI perinatal.
• La HI suficiente para determinar injuria cerebral ha sido bien definida por la Academia de Ginecología y Obstetricia de Estados Unidos de acuerdo a la presencia de los siguientes criterios10.
a) Criterio metabólico: pH ≤ 7,0 o déficit de base ≥ 12 mmol/L en sangre de cordón.
b) Criterio clínico: Apgar ≤ 5 al minuto 10 de vida o ventilación asistida al nacer o continuada al menos por 10 minutos.
c) En el entorno de un evento perinatal agudo o centinela:
• Prolapso de cordón o rotura de cordón.
• Rotura uterina.
• Trauma materno.
• Hemorragia materna.
• Paro cardiorrespiratorio materno.
• Anemia fetal por vasa previa o hemorragia materno fetal masiva.
• Alteraciones de la frecuencia cardíaca fetal: ausencia de variabilidad, desaceleraciones tardías reiteradas, bradicardia o patrón sinusoidal.
Por tanto, para definir la HI y vincularla al período perinatal es necesaria la sumatoria de las variables incluidas en los ítems a + b + c.
La EHI queda definida por el paciente que presenta signos clínicos de EN y cumple con los criterios de HI perinatal.
Identificación del paciente con EHI: el examen clínico
El diagnóstico precoz de la EHI es el paso fundamental para el inicio temprano de la terapia, reconociendo que la evidencia disponible muestra los mejores resultados cuando se inicia en las primeras seis horas de vida (más aun antes de las tres horas desde el nacimiento), además de tener valor pronóstico sobre las alteraciones de la función motora a los dos y cuatro años de vida sumado a una buena correlación con los hallazgos en resonancia nuclear magnética (RNM) en el período neonatal12.
El examen clínico inicial debe realizarse inmediatamente después de la estabilización cardiorrespiratoria, repitiéndose de manera seriada a partir de las primeras horas de vida para tener un criterio de evolutividad clínica, que es importante para el diagnóstico y pronóstico, de preferencia por el mismo operador, consignando los hallazgos. Una herramienta que ha demostrado ser útil para la identificación de la EHI y del nivel de gravedad es la utilización de registros de video (por ejemplo, con equipo celular), que pueden compartirse en tiempo real o a posteriori con otros técnicos de más experiencia o incluso con otros especialistas13, además de la importancia para establecer el criterio evolutivo de la patología en curso.
Considerando que la injuria cerebral es un proceso evolutivo, es habitual que los signos clínicos se modifiquen en las primeras horas de vida, en ocasiones haciéndose evidentes más allá del período ideal para iniciar terapias neuroprotectoras. Un ejemplo de ello es el momento de aparición de las crisis convulsivas cuyo tiempo promedio de presentación es entre las 12 y 24 horas de vida, coincidente con el período de falla energética secundaria (8 a 16 horas con un máximo de 24-48 horas)14.
Categorización de la EHI: escalas de valoración
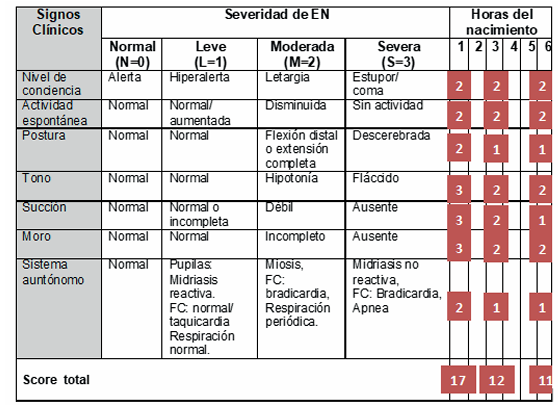
Se han validado varias escalas o scores (Sarnat y Sarnat, Thompson, Siben, NE-RS) como forma de sistematizar el examen clínico y evaluar el grado de compromiso neurológico. Entre ellas, el score de Sarnat y Sarnat con sus diferentes modificaciones ha sido el más utilizado en estudios clínicos15. Más recientemente, a partir de la implementación de la terapia con HTC, se ha valido el score de Sarnat total (agrega puntos a las categorías de severidad), que permite detectar recién nacidos en alto riesgo de lesión cerebral, aunque en la práctica clínica ofrece dificultades para separar los pacientes con EHI leve o moderada16. Evalúa siete categorías de signos clínicos, un puntaje ≥ 6 identifica afectación al menos moderada, mientras que el total de puntos ≥ 5 resultó predictivo para alteraciones del neurodesarrollo (área bajo la curva 0,83, IC95% 0,76-0,91). En la (Tabla 1) se muestra un ejemplo del cálculo realizado con el score de Sarnat y Sarnat total en las primeras seis horas de vida. Obsérvese que si bien hay cambios en el puntaje total, a las tres horas de vida es > 6 y esto se mantiene a las seis horas.
Tabla 1 Score de Sarnat y Sarnat total. Los valores corresponden a un ejemplo en las primeras seis horas de vida.
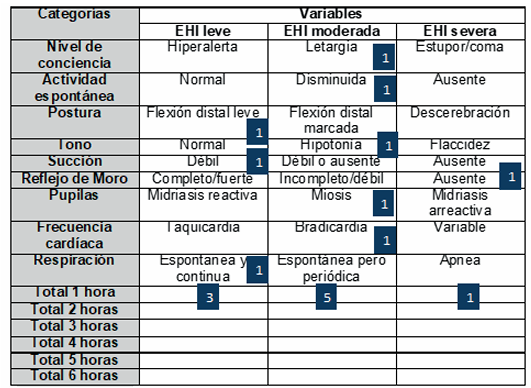
La escala SIBEN se desarrolló a partir del score de Sarnat y Sarnat, con el objetivo de simplificar el resultado del examen clínico de manera rápida, sin utilizar paraclínica ni considerar la presencia de convulsiones, atribuyendo un mismo valor a las nueve variables consideradas17. A cada variable se le atribuye un valor de 1 o 0, la categoría que sume más puntos a partir de ≥ 3 determina la severidad de la EHI. La escala SIBEN define de manera más precisa el umbral que diferencia los pacientes con EHI moderada de los pacientes con EHI leve, identificando los recién nacidos con riesgo aumentado de presentar convulsiones en la evolución, alteraciones en el electroencefalograma (EEG) o en los estudios de resonancia magnética, o ambos18. Esta escala además se correlaciona fuertemente con la de Sarnat y Sarnat (90% de acuerdo). En la (Tabla 2) se muestra un ejemplo del uso de esta escala calificando como EHI moderada a la hora de vida. Aún no hay estudios que analicen la relación de esta escala con la evolución neurológica a largo plazo.
Tabla 2 Escala SIBEN, ejemplo de su utilización en la categorización de la EHI en las primeras seis horas de vida.
Recientemente se ha publicado la escala NE-RS, que ha demostrado su aplicabilidad y validez en el diagnóstico de la EHI, así como su grado de severidad (https://www.neurologianeonatal.org/wp-content/uploads/2021/06/Figura_Escala.pdf)19. Esta escala tiene siete variables a evaluar, entre las que no se encuentran los reflejos primitivos y el examen pupilar, incluye la presencia de convulsiones y requiere de la realización de EEG de amplitud integrada (EEGa), esto limita su uso a aquellos centros que cuenten con este recurso tecnológico, pero no invalida su aplicación pudiendo prescindir de esta herramienta. Recientemente se ha demostrado que es capaz de discriminar entre EHI leve y moderada, un score ≥ 8 identifica los pacientes con EHI moderada separando de EHI con área bajo la curva 0,99 (IC95% 0,85-1,00). Mientras que un score ≥ 30 identifica pacientes con EHI severa (ABC 0,93; IC95% 0,81-0,99). Además, ha mostrado una fuerte asociación con la presencia de injuria cerebral en los estudios de imagen RNM, además de predecir la evolución neurológica a largo plazo (24 meses)19.
La recomendación de los autores es que el equipo asistencial adquiera experiencia con cualquiera de las escalas mencionadas.
La escala NE-RS es en la actualidad la de preferencia en nuestro servicio, requiere un proceso de capacitación del personal para evitar variabilidades interobservadores. La grabación del examen del paciente y la segunda opinión también es de utilidad en casos dudosos.
Aspectos relevantes del examen clínico en la categorización de la EHI
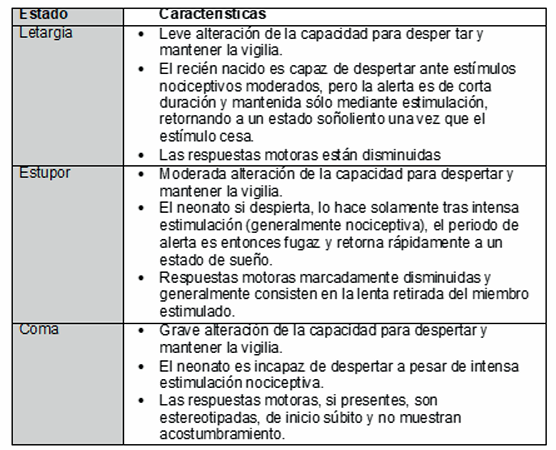
Cualquiera sea la escala o score utilizado es muy importante que el equipo asistencial esté familiarizado con las variables incluidas, de manera de aplicarlas de manera adecuada y alcanzar de esta forma diagnósticos correctos. En este sentido uno de los aspectos que ofrece dificultades en la valoración es el estado de conciencia. Por tal motivo, decidimos resumir para este trabajo las principales características que los definen (básicamente en la capacidad de despertar y mantenerse despierto) (Tabla 3).
Otro aspecto del examen clínico relevante es la categorización de la postura del paciente, sobre todo aquellas de mayor afectación del sistema nervioso central. La postura de descerebración refiere a un paciente con brazos y piernas extendidos, muñecas flexionadas y manos fijas. Indican compromiso de tronco encefálico por HI o hemorragia infratentorial, por ejemplo, invariablemente los pacientes están en coma. Mientras que la postura de decorticación está determinada por la flexión de los brazos y dedos de la mano (hipertonía flexora) con extensión de las piernas. Puede acompañarse de opistótonos. Indica alteración hemisférica con integridad del tronco encefálico, siendo la HI perinatal la causa más frecuente20.
Finalmente, tanto el score de Sarnat como la escala SIBEN incluyen en su evaluación el reflejo de Moro y el examen pupilar, los cuales pueden ofrecer dificultades en su realización y evaluación. El reflejo de Moro es dificultoso de obtener en pacientes que permanecen intubados en ventilación mecánica o con prótesis en los miembros. Mientras que el examen de las pupilas también ofrece problemas para determinar su condición. El iris es negro en este momento de la vida, los párpados por lo general están edematizados y la apertura ocular es dificultosa ante el estímulo de la luz, a esto debe sumarse el efecto de los opioides en aquellos pacientes que lo reciban previamente19. Por su parte, la escala NE-RS incluye la búsqueda y categorización de reflejos miotáticos (rotuliano, aductor o aquíleo) cuya valoración también requiere entrenamiento.
El rol del electroencefalograma de amplitud integrada
El EEGa ha demostrado ser una herramienta adecuada para el diagnóstico precoz de los pacientes con EHI y sus complicaciones, tomándose en cuenta entre los criterios de inclusión en HTC (afectación moderada o severa del voltaje, trazado de brote/supresión, o de actividad convulsiva)21 (Figura 2).
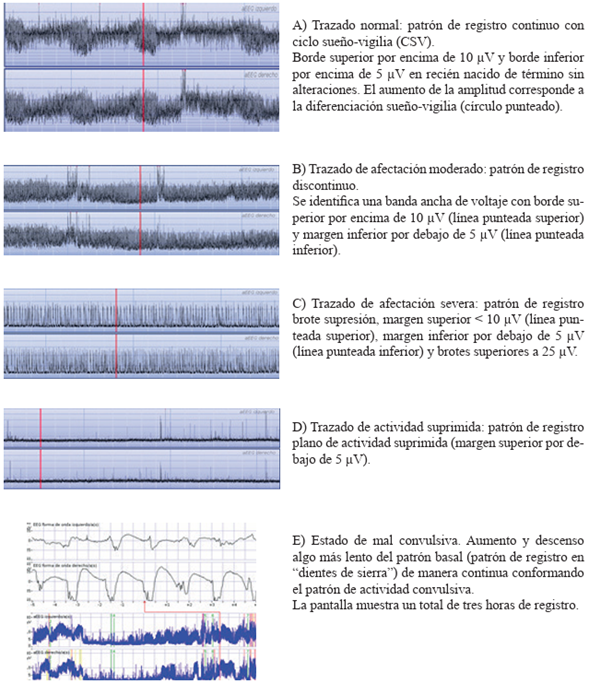
Figura 2 Patrones de trazado de EEG de amplitud integrada (EEGa) en recién nacidos. Los cuadros B al E entran en los criterios de inclusión de HTC en el contexto de EHI (registros realizados por los autores).
El trazado de EEGa, además, tiene valor para identificar muerte o alteración severa a largo plazo. En pacientes con EHI que no reciben HTC el valor predictivo es bueno ante la persistencia de un trazado alterado entre las 6-24 horas de vida, mientras que para pacientes enfriados el mayor valor predictivo se aprecia ante un trazado alterado hacia las 72 horas de vida22.
El registro debe iniciarse lo más precozmente posible y siempre antes de las tres horas de vida, su duración mínima debe ser de entre 20-90 minutos y la calidad del registro debe ser óptima para poder sacar conclusiones. La administración de fármacos anticomiciales, así como de opiáceos, puede determinar cambios transitorios en el trazado del EEGa, por lo general caracterizados por depresión del voltaje y alteración en el patrón de fondo (por ejemplo, aparición de trazado tipo brote/supresión). En el caso del fenobarbital el tiempo para la recuperación puede demorar hasta 2 - 2,5 horas. Estos efectos deben tomarse en cuenta para la toma de decisiones basadas en el EEGa23.
Criterios de inclusión en protocolo de hipotermia controlada
a) Criterio de edad gestacional y peso al nacer: recién nacidos con EG ≥ 36 semanas y PN ≥ 1.800 g24.
b) Criterios metabólicos y adaptación a la vida extrauterina (cualquiera de los siguientes):
• pH ≤ 7,0 o déficit de base ≥ -16 mmol/L, en sangre de cordón o de recién nacido (< 1 h de vida) o pH 7,01 a 7,15 o déficit de base -10 a -15,9 mmol/L, o no disponibilidad de gases sumado a evento perinatal agudo (desaceleraciones tardías o variables, prolapso de cordón o rotura de cordón, rotura uterina, trauma materno, hemorragia materna o paro cardiorrespiratorio materno, desprendimiento de placenta normoinserta, nudo real de cordón).
• Apgar ≤ 5 al minuto 10 de vida o necesidad de ventilación asistida al nacer o continuada al menos por 10 minutos.
c) Criterios neurológicos (cualquiera de los siguientes):
• Diagnóstico de EHI moderada o severa de acuerdo a los criterios de la escala o score utilizado y/o EEGa integrada (realizado al menos durante 30 minutos) que muestre afectación moderada a severa o actividad convulsiva eléctrica (clínicas o subclínicas).
• La presencia de convulsiones clínicas en contexto diagnóstico de EHI.
Criterios para el ingreso al protocolo de HTC
Si el paciente cumple con los criterios de edad gestacional y peso al nacer, presentando las alteraciones del metabolismo ácido base y de la adaptación inmediata a la vida extrauterina (definidas por el score de Apgar o la necesidad de ventilación asistida por 10 minutos) debe realizarse el examen neurológico una vez estabilizado el paciente y categorizarlo de acuerdo a una de las escalas disponibles en su unidad. De contar con EEGa, puede utilizarse para el diagnóstico. Si se diagnóstica EHI moderada a severa, o se objetivan convulsiones clínicas o subclínicas en el contexto de HI y el paciente tiene menos de seis horas de vida, entonces aplica para el inicio de HTC.
Contraindicaciones para realización de HTC
Las contraindicaciones surgen de los criterios utilizados en los protocolos de los estudios más importantes realizados, en este trabajo no se incluyeron y por tanto se desconoce el efecto de la HTC en pacientes que:
• Se encuentran en situación crítica por patología de base fuera de la HI perinatal (hernia diafragmática congénita, cardiopatía congénita compleja, etc.).
• Se plantea o tiene diagnosticadas cromosomopatías, como las trisomías 13 y 18 (no abarca el síndrome de Down).
• Se piensa que la muerte es inevitable (paciente en situación agónica).
• Presentan sangrado masivo que pone en riesgo la vida del paciente.
• Presentan trauma de cráneo con sangrado intracraneano severo, el hematoma subgaleal puede ser una contraindicación relativa de acuerdo a su evolución por la magnitud del sangrado y la posibilidad de coagulopatía de consumo.
• Los padres no consienten que el paciente reciba HTC.
Los pacientes en situación dudosa, ¿iniciar o no HTC?
La administración de HTC “fuera” de los criterios de inclusión reconocidos, por lo general atiende a tres aspectos: pacientes que no cumplen de manera completa con los criterios metabólicos o clínicos, pacientes que no cumplen con los criterios de edad gestacional o peso al nacer y pacientes que están fuera del tiempo recomendado para el inicio de la terapia.
La decisión de enfriamiento requiere de un análisis actualizado de la evidencia y consideraciones éticas, es imprescindible sopesar riesgos y beneficios para cada paciente en particular, aun cuando existan guías o recomendaciones generales al respecto8. No es infrecuente observar que se coloquen pacientes en enfriamiento basados en resultados de estudios retrospectivos o de baja calidad de evidencia, aquí el argumento que prima son los antecedentes de estudios que muestran resultados favorables al paciente que contrastan con las devastadoras consecuencias de la asfixia perinatal25. Para aplicar este razonamiento deben asegurarse los cuidados que se ofrecerán al recién nacido, además de contar y cumplir de manera estricta con un protocolo probado de intervención, atendiendo al principio de que el tratamiento no determine o aumente el daño ya instalado. En este sentido, el adecuado entrenamiento del personal en la terapia de enfriamiento (considerando la evaluación de los criterios de inclusión, pasando por el conocimiento de los métodos de enfriamiento y la detección precoz de complicaciones) es un requisito ineludible.
¿Hipotermia pasiva o activa?
La necesidad de iniciar el enfriamiento lo más rápido posible ha llevado a que los clínicos realicen precozmente medidas para evitar el sobrecalentamiento y mantener la temperatura en el rango de neuroprotección (33,5 °C - 34,5 °C). La hiportemia pasiva (ausencia de aporte de calor) definida por contraste con la hipotermia activa (en la que se coloca una fuente de frío) es una estrategia que se utiliza a partir de la sala de nacimientos y se mantiene en aquellos pacientes que requieren ser trasladados a centros donde se continuará con el enfriamiento.
Esta medida mostró resultados contradictorios en cuanto a su seguridad en estudios retrospectivos. Carreras N y colaboradores (n = 67) reportaron el riesgo aumentado de hipotermia profunda (≤ 32 °C) y sus complicaciones sobre todo en el contexto de EHI severa y acidosis metabólica severa en gases de cordón, mientras que Jayasinghe D y colaboradores (n = 26) no observaron efectos adversos26,27.
Entre los aspectos a considerar para la elección del método de enfriamiento está la estabilidad en el rango de temperatura deseado durante el período de enfriamiento, considerando que hay estudios que establecen peores resultados en la injuria cerebral ante el aumento de la variabilidad28.
Los principales estudios de HTC utilizaron el enfriamiento activo como método para alcanzar la temperatura objetivo, la cual parece ser más eficaz para mantener la estabilidad en el valor objetivo28. A su vez, el enfriamiento activo puede realizarse por métodos servocontrolados (dispositivos vinculados a la temperatura central del paciente) o no servocontrolados (planchas de hielo). Ambas estrategias han demostrado buenos resultados; sin embargo, cualquiera sea el método utilizado, el contar con un número adecuado de personal de enfermería (1 enfermero: 1 paciente en HTC), sumado a la experiencia del equipo asistencial, son los determinantes de la seguridad de la terapia y su eficacia.
Posibles escenarios para el inicio del tratamiento neuroprotector
La forma de presentación de la HI perinatal y de la EHI, así como los tiempos en los cuales se diagnostica, determinan variados escenarios en los que el clínico debe decidir cuál es la mejor opción para el paciente.
En la (Tabla 4) se resume una serie de escenarios y situaciones a los que el clínico puede enfrentarse, aclarándose cuáles son las recomendaciones actuales (tomando como base a la Academia Americana de Pediatría)29, la evidencia en la que se basan y la conducta que llevamos adelante en el Centro Hospitalario Pereira Rossell (lo cual no implica que se recomienden para otras instituciones).
Tabla 4 Posibles escenarios e indicación de HTC. En gris los aspectos controversiales. EC: eventos centinelas. Recomendación: Academia Americana de Pediatría (AAP). Conducta CHPR: se aplicó la jerarquía de nivel de evidencia del Centro de Medicina Basado en la Evidencia de Oxford (www.cebm.net/wp-content/uploads/2014/06/CEBM-Levels-of-Evidence-2.1.pdf).
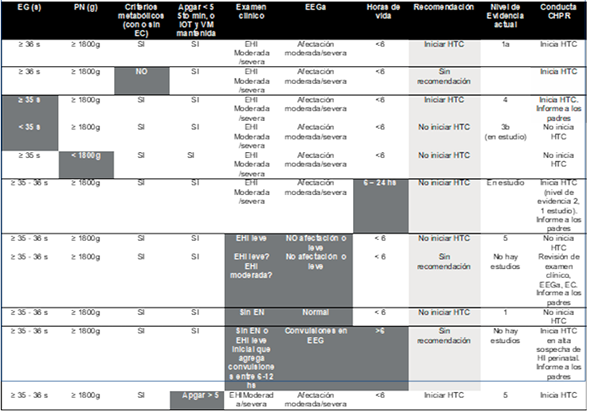
• La edad gestacional es uno de los puntos controversiales, si bien la mayoría de los estudios randomizados controlados consideran incluir pacientes a partir de las 36 semanas, hay estudios que muestran seguridad y resultados favorables en pacientes con edad gestacional de 35 semanas (0-6 días), por lo que en nuestro servicio consideramos su inclusión considerando la información a los padres30. Mientras que en pacientes con edad gestacional < 35 semanas sometidos a HTC se ha observado una elevada incidencia de efectos adversos (sobre todo alteraciones de la coagulación y hemorragia intracraneal), así como aumento de la incidencia del resultado combinado de muerte y discapacidad, por lo que en la actualidad no se recomienda la aplicación31,32. Se encuentra en progreso el estudio Preemie Hypothermia for Neonatal Encephalopathy (33-35 s y > 1500 g) (NCT01793129) que puede mostrar nuevos resultados al respecto.
• La presencia de EN desde la sala de partos con gases de cordón umbilical en rango de normalidad siempre debe hacer pensar en una causa diferente a la HI (alteraciones a nivel vascular cerebral, malformativas, neuromusculares, infecciosas o genéticas)33,34. Sin embargo, la ausencia de acidosis severa o moderada (pH > 7,10 y/o BE < -12) no es enteramente incompatible con hipoxia cerebral severa. Las causas no están del todo esclarecidas, habiéndose planteado posible recuperación de la hipoxia in utero, acidosis paradojal, o la presencia de eventos concomitantes (por ejemplo, corioamnionitis e infección fetal) que pueden determinar daño cerebral sin necesidad de hipoxia severa35. La recomendación es poner en consideración los demás elementos que orienten al evento hipóxico isquémico, sobre todo la presencia de eventos centinelas, en estos casos consideramos la administración de HTC.
• El tiempo de vida al momento del inicio de la HTC es un punto muy importante, el enfriamiento iniciado luego de las seis horas de vida aún no cuenta con resultados concluyentes. Laptook AR y colaboradores randomizaron 168 recién nacidos de término o casi término con EHI moderada a severa a recibir HTC o tratamiento de sostén entre las 6 - 24 horas de vida (media de 16 horas en el grupo HTC). Los resultados mostraron 76% de probabilidad de cualquier reducción de muerte o discapacidad y 64% de probabilidad de una reducción de al menos 2% de muerte o discapacidad a los 18-22 meses36. Mientras que el estudio de Jia W y colaboradores mostró buenos resultados solo en pacientes con EHI moderada, pero no en los que presentaron EHI severa37.
La recomendación sigue siendo acortar los plazos de diagnóstico e iniciar el enfriamiento en los plazos requeridos; sin embargo, aquellos pacientes que son trasladados hacia los centros de referencia no siempre pueden cumplir con esta premisa. En nuestros servicios, basados en el referido estudio de Laptook AR, optamos por iniciar HTC en pacientes con 6 a 24 horas de vida, mientras que definitivamente no se recomienda en pacientes mayores a 24 horas de vida.
• Si bien nos es frecuente, la posibilidad de HI y EHI en pacientes con anomalías congénitas o genéticas está vigente, y puede poner al clínico en una disyuntiva. La sola presencia de alteraciones, discapacidades físicas o intelectuales que acompañan a determinadas alteraciones genéticas, no son justificativo para la supresión de un tratamiento médico potencialmente beneficioso para el paciente8. En nuestro centro estamos a favor de iniciar HTC en pacientes portadores de anomalías congénitas o alteraciones genéticas cuyo pronóstico de vida es favorable (no consideradas incompatibles con la vida), entre las cuales puede citarse el síndrome de Down, por ejemplo. No hay datos que muestren resultados en este grupo de pacientes, ya que no fueron incluidos en los estudios. Esto determina que la decisión de entrar en HTC deba ser informada y discutida con los padres o responsables.
• El grado de afectación neurológica es determinante para la indicación de HTC. No quedan dudas de que los pacientes sin signos de EN no tienen indicación de HTC, mientras que los pacientes con EHI moderada/severa son los candidatos a recibirla. Diferente es lo que ocurre en aquellos pacientes que cumplen criterios metabólicos y de adaptación a la vida extrauterina pero presentan EHI leve. Hay evidencia creciente de la repercusión neurológica en esta categoría de EHI. Chalak LF y colaboradores encontraron 16% de discapacidad (7% discapacidad severa) a los 18-22 meses de vida con una afectación cognitiva, lenguaje y motor (score de Bayley < 85) en el 40% de los pacientes (n = 43) cuando se catalogaron a las seis horas de vida38. Por su parte, Finder M y colaboradores describen que pacientes con EHI leve presentaron a los 2 años peores resultados en test cognitivos que pacientes sin EHI. Por otro lado, estos resultados fueron comparables a los pacientes que habiendo tenido una EHI moderada recibieron HT38.
Aun con estas consideraciones, la evidencia disponible sobre la efectividad y los beneficios de HTC en EHI leve es prometedora, pero todavía insuficiente para recomendar HTC (considerando los riesgos y beneficios de la terapia tal cual está implementada en la actualidad)39,40. Hay estudios en curso que seguramente aportarán nuevos datos para acercarnos a la conducta más apropiada en estos pacientes: COOLPRIME: Comparative Effectiveness for Cooling Prospectively Infants With Mild Encephalopathy. NCT04621279; COMET: Optimising the Duration of Cooling in Mild Encephalopathy. NCT03409770; TIME: Therapeutic Hypothermia for Infants With Mild Encephalopathy. NCT04176471.
• Una situación frecuente es cuando el examen clínico no es suficientemente claro para diferenciar EHI leve de moderada en un paciente con criterios metabólicos y de adaptación a la vida extrauterina presentes. En estos casos puede ser de utilidad revisar todo el proceso diagnóstico desde la búsqueda de eventos centinelas de HI perinatal (se asocian a un 55% de lesiones a nivel cerebral y de los ganglios basales, por lo que es un elemento importante en la toma de decisiones)41, pasando por la evolución del examen clínico, la utilización de EEGa y de más de una escala de categorización disponibles, además de solicitar una segunda opinión y registrar en video la situación clínica del paciente. En la actualidad se han utilizado algoritmos de aprendizaje (machine learning) para identificar pacientes con EHI y predecir el grado de severidad de ésta basado fundamentalmente en datos clínicos, si bien su aplicación está en desarrollo, han demostrado ser una herramienta eficaz para determinar precozmente la necesidad de HTC42.
• Una situación que el clínico teme es el paciente que se presenta con criterios metabólicos y de adaptación a la vida extrauterina sin signos de EHI moderada a severa a las seis horas de vida, pero agrega convulsiones en la evolución (entre las 12-24 horas de vida). La EHI es la principal causa de convulsiones en la etapa neonatal, seguida del accidente vascular encefálico y la hemorragia intracraneana43. Sin embargo, la asociación entre EHI y convulsiones no siempre es fácil de objetivar. Dado que la HTC parece reducir la incidencia y la carga de convulsiones, lo cual es aditivo en su efecto neuroprotector, en nuestro servicio recomendamos iniciar HTC, aun cuando éstas se presenten entre las 6-24 horas de vida44.
• En los pacientes que son sometidos a HTC el período de recalentamiento e inmediatamente posterior es un tiempo de riesgo para la aparición de convulsiones (“recaída de convulsiones”), al cual hay que estar atentos. Es indispensable el diagnóstico certero de crisis convulsiva, para la cual el registro del EEGa es una herramienta muy útil. Está claro que no hay evidencia de resultados a largo plazo de esta conducta.
• Finalmente, ante la presencia de signos de EHI moderada a severa en un paciente con criterios metabólicos, aun cuando el puntaje de Apgar al quinto minuto sea mayor de 5, debe sospechar la presencia de asfixia perinatal y por tanto en el servicio recomendamos iniciar HTC en esta situación.
Conclusiones
La HTC es el tratamiento de elección para los pacientes con EHI moderada a severa. Sin embargo, el clínico se enfrenta a varios desafíos, el primero es el diagnóstico acertado y precoz de esta patología. El examen clínico es la mejor herramienta para el diagnóstico y su aplicación a diferentes escalas de severidad, es el método más apropiado para identificar aquellos pacientes que pueden beneficiarse de la HTC como neuroprotector. En este aspecto la correcta aplicación del EEGa es un complemento muy útil para la toma de decisiones e identificación de actividad convulsiva subclínica. Si bien la HTC ha demostrado ser eficaz con métodos de enfriamiento no servocontrolados y servocontrolados, es probable que estos últimos sean más seguros en lograr estabilidad en la temperatura objetivo, aunque es el control estricto de la terapia con personal de enfermería entrenado y en número adecuado el que puede brindar las mejores garantías.
Hay numerosos estudios que intentan dar respuesta a algunos aspectos controversiales fundamentalmente vinculados al impacto de la terapia en prematuros moderados o severos, en pacientes con afectación encefálica leve, o en aquellos casos en que el inicio se da más allá del tiempo estipulado. La evidencia disponible a la fecha es escasa y de baja calidad, por lo que iniciar HTC fuera de los criterios de inclusión ya probados, es una decisión que el clínico debe reflexionar antes de tomarla, incluyendo la opinión de los padres, considerando la experiencia del equipo asistencial y la seguridad de un adecuado control de los cuidados en el centro asistencial al que pertenece.