Introducción
La cetoacidosis diabética (CAD) es el trastorno metabólico de la infancia que más frecuentemente requiere el ingreso a la unidad de cuidados intensivos. En España, es la forma de presentación del 25-40% de los casos de diabetes mellitus tipo 1. La probabilidad de presentar una CAD en diabéticos conocidos oscila entre 1-10% por paciente y por año. Se considera la complicación más grave de la enfermedad en niños diabéticos siendo su principal causa de muerte.
Este protocolo fue realizado en el Hospital Británico como parte de un plan de mejora en la calidad asistencial y pretende ser una guía para el tratamiento inicial de los pacientes que presentan una CAD asistidos en la Unidad de Cuidados Intensivos (UCI).
Cuenta con el aval de la Cátedra de Cuidados Intensivos Pediátricos del CHPR.
Definición
La definición de CAD consiste en la comprobación por analítica de los siguientes parámetros (Tabla 1):
En cuando a la severidad, según la guía NICE (National Institute for Health and Care Excellance) se considera (Tabla 2):
Fisiopatología
La fisiopatología de la CAD involucra un déficit de insulina absoluto o relativo y el aumento de las hormonas contra reguladoras (glucagón, adrenalina, hormona de crecimiento y cortisol).
El déficit absoluto de insulina ocurre en las siguientes situaciones:
-Debut de la enfermedad.
-Omisión de la administración de insulina.
-Problemas técnicos en la infusión subcutánea continúa de insulina, en pacientes diabéticos conocidos que usen bomba de insulina.
-El déficit relativo, hace referencia al aumento de las necesidades de insulina que puede ser consecuencia de:
-Situaciones de estrés: infección intercurrente, traumatismo, etc.
-Uso de medicación que pueda aumentar la glicemia como algunos inmunosupresores: corticoides, ciclosporina, micofenolato, everolimus, tacrolimus)
-Transgresiones dietéticas (sobre una base de un mal control metabólico).
Las hormonas contra reguladoras aumentan en la situación de estrés metabólico agudo. La disminución del índice insulina/glucagón produce hiperglicemia por glucogenolisis, gluconeogenesis y menor captación de glucosa por el tejido muscular y graso con elevación de ácidos grasos libres y producción de cuerpos cetónicos.
Los cuerpos cetónicos son una forma de energía alternativa cuando no se puede usar la glucosa por falta de insulina y van a favorecer la presencia de acidosis metabólica.
En cuanto a la presencia de alteraciones del metabolismo del agua e iones vamos a encontrar:
-Alteraciones en el metabolismo del sodio (Na+): Existe déficit absoluto de sodio por pérdida del mismo por la orina, encontrándose frecuentemente hiponatremia. En algunas oportunidades puede existir hipernatremia, sobre todo en las primeras horas del ingreso, por mayor pérdida de agua libre respecto al sodio.
-Alteraciones en el metabolismo del potasio (K+) Existe perdida de potasio digestiva y urinaria con déficit global del mismo, debemos recordar esto para realizar una adecuada reposición ya que es frecuente encontrarlo normal o aumentado en el contexto de la acidosis, pero siempre existe un déficit global.
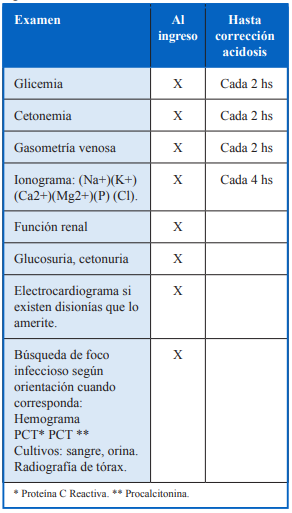
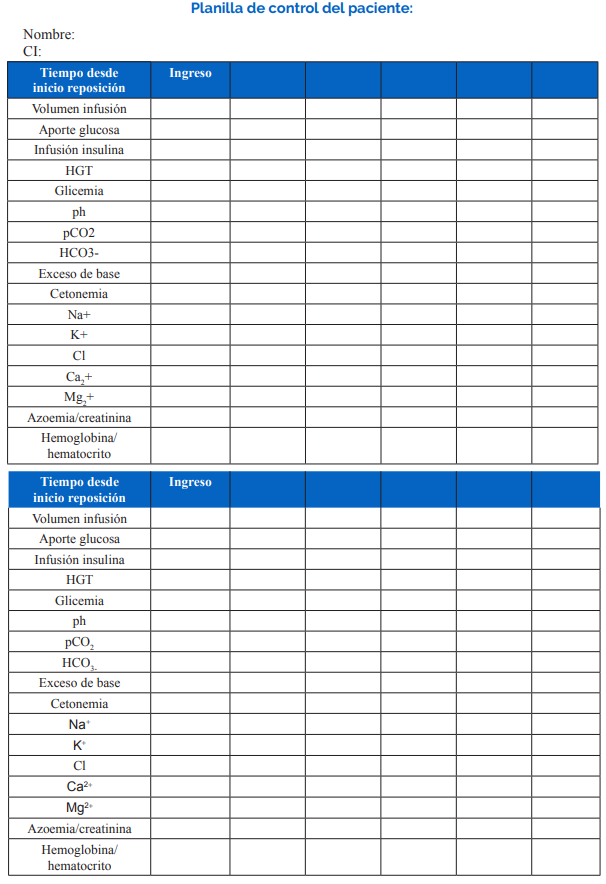
Paraclínica a solicitar el ingreso y en la evolución.
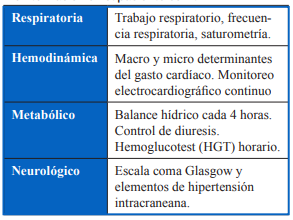
Monitorización sugerida en la UCI.
Tratamiento
El tratamiento de la CAD incluye medidas de reanimación iniciales, corrección de la deshidratación moderada o severa que presente el paciente, y la administración de insulinoterapia. Esta última es la base de la corrección de la acidosis por lo que debe mantenerse sin interrupciones con un aporte entre 0,05 y 0,1 U/kg/hora para asegurar dicha corrección. Es frecuente requerir con la rehidratación el aporte de glucosa suplementaria con el fin de mantener un aporte de insulina que permita corregir el déficit.
Reanimación inicial
-El tratamiento debe comenzar con “ABC” de la reanimación cuando corresponda, es importante considerar el manejo de la vía aérea, que la misma se encuentre permeable (A), el manejo de la respiración (B) y el manejo de la circulación (C), detectando precozmente alteraciones en la perfusión y elementos de shock.
-Respecto al manejo de la respiración (B), es frecuente que nos encontremos con un paciente con polipnea profunda de Kussmaul con intenso trabajo respiratorio, recordemos que esta polipnea forma parte de un mecanismo de compensación de la acidosis metabólica. Sugerimos la administración de oxígeno suplementario, la polipnea corregirá en la medida que corrija la acidosis metabólica. Debemos tener especial cuidado en la realización de intubación orotraqueal y asistencia ventilatoria mecánica en estos pacientes, porque al detener el mecanismo de compensación de la acidosis y determinar un aumento brusco de la pCO2 vamos a exacerbar el descenso del pH y además favorecer la vasodilatación cerebral, con el consiguiente empeoramiento del edema cerebral.
-Colocar al menos 2 accesos venosos periféricos, uno de preferencia que sea exclusivo para la administración de insulina y cuando sea posible 1 acceso venoso para extracciones.
-Se debe intentar evitar la colocación de una vía venosa central en el contexto de la deshidratación grave, ya que en estos casos existe un riesgo elevado de trombosis.
-En la primera hora se deben administrar fluidos 20 cc/kg de suero fisiológico, (representa el volumen de expansión). Si existen alteraciones en la perfusión (C) con elementos de shock podemos repetir una segunda carga de 20 cc/kg de suero fisiológico. Recordemos en este momento que en caso de shock, no restaremos el volumen de la fase de expansión del total a administrar en las primeras 24 hs de la reposición.
-Si se realizó una carga fuera del contexto del shock, se sugiere restarla a la sumatoria del basal en 48 hs más el porcentaje de deshidratación.
-La corrección con bicarbonato (HCO3-), no debe realizarse de forma rutinaria porque aumenta el riesgo de edema cerebral. Está indicado en pacientes con PH <6,9 con evidencia de compromiso de contractilidad cardíaca o como parte del tratamiento de una hiperpotasemia grave. De requerir una corrección, la misma se realiza con HCO3- 1/6 molar 1-2mEq/k en 1-2 hs.
Corrección de la deshidratación
-La deshidratación se corrige lenta en 48 hs, debe iniciarse previo a la insulinoterapia y estimar el déficit para 24-48hs.
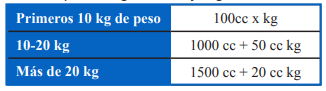
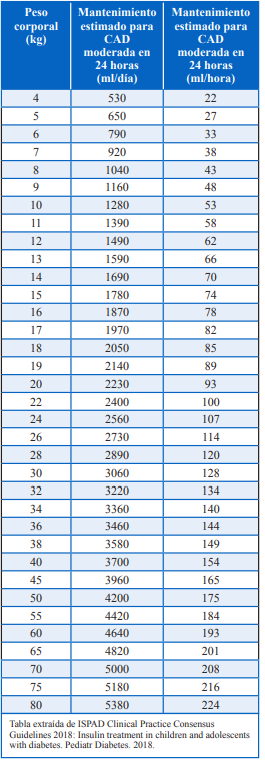
-Considerar en obesos realizarla acorde a peso ideal y no peso real para evitar la sobrecarga hídrica. Acercamos una tabla que se encuentra en las Guías ISPAD (International Society for Pediatric and Adolescent Diabetes) que es indicativa del volumen total de aporte requerido según el peso corporal y considerando un porcentaje de deshidratación de 5%. (Tabla 3)
-La siguiente fórmula es sugerida para el cálculo del aporte basal en las primeras 24 hs de ingreso a Unidad de Cuidados Intensivos.
(Aporte basal en 48 hs + déficit de deshidratación-volumen de expansión) / 48
-El aporte en 48 hs se considera de acuerdo con lo sugerido por Holliday Segar que es para 24 hs y se multiplica x 2 ya que el volumen se administrara en 2 días. (Tabla 4)
-Para el cálculo del déficit de deshidratación considerar 5% o 10% de
porcentaje de deshidratación que equivale a 50 cc/kg o 100 cc/kg respectivamente.
-Una vez que tengamos el cálculo del aporte total el mismo se divide en 48 hs para saber el goteo a administrar. (Tabla 5)
Ejemplo práctico
Si el paciente pesara 10 kg y presentara un porcentaje de deshidratación del 5% y recibió 200 cc en la primera hora de ingreso como expansión. Sin elementos de shock el cálculo sería:
Aporte basal 48hs: 100 x 10kg = 1000 ml x 2 = 2000 ml
Porcentaje de deshidratación: 50 cc x kilo = 500 ml
Volumen de expansión: 200 cc
2500ml - 200 ml = 2300 ml.
En 48 hs equivale a un goteo de 48 ml/hora.
Observemos que el valor que obtuvimos es similar al calculado por la tabla que adjuntamos de la guía, si no hubiéramos restado el volumen de expansión (Tabla 6).
Solución a emplear
-La misma debe tener un aporte de Na+ de 150 meq por litro como está presente en el suero fisiológico según la recomendación de todas las guías disponibles y un aporte de K+ de 40 meq/litro (recordemos que hay un déficit absoluto de potasio corporal total.)
-Cuando la glicemia es menor de 250 mg/dl debe realizarse un aporte de glucosa que permita mantener un aporte continuo de insulina mayor de 0,05 U/k/hora, de preferencia de 0,1 U/k/hora, necesario para corregir la acidosis.
-El aporte de glucosa entonces es muy dinámico y va a depender de la glicemia y también del pH, si se requiere por persistencia de la acidosis, aumentar el aporte de insulina.
-Si la glicemia desciende muy rápidamente (mayor de 100 mg/dl) el aporte de glucosa debe aumentarse, por lo que es habitual necesitar que el equipo de enfermería prepare los sueros a administrar en muchas oportunidades.
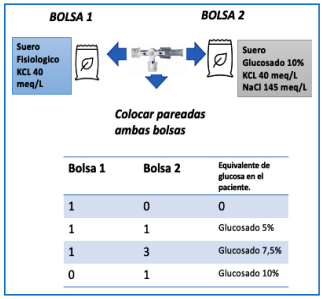
-Sistema de 2 bolsas: Para evitar demoras en el inicio de los aportes de glucosa, que son muy dependientes del descenso de la misma, se ha creado como sugerencia el sistema de 2 bolsas. El mismo es un sistema sencillo que permite preparando dos sueros, regular la concentración de glucosa administrada al paciente.
-Se prepararan dos sueros, ambos con un aporte de Na+ de 150 meq/litro y un aporte de K+de 40 meq/ litro con la diferencia de que uno tendrá un aporte de glucosa al 10% y el otro no tendrá aporte de la misma (suero fisiológico). Ambos sueros se conectarán pareados en una de las vías periféricas que presenta el paciente. Según la necesidad se administrara la infusión 1, la 2 o ambas.
-Si nuestro objetivo es realizar un aporte de glucosa al 10% administraremos el total del volumen calculado a través del suero con glucosa 10%. Si queremos bajar la concentración de glucosa a un aporte de 5% se infundirá la mitad del aporte calculado del suero fisiológico y la otra mitad de suero glucosado al 10%.
-En el ejemplo que referimos previamente sería del total del aporte de 48 ml/hora, se colocará en la bomba un aporte de suero glucosado 10% de 24 ml/hora y de suero fisiológico de 24 ml/hora de forma pareada.
-Si nuestro objetivo es administrar un aporte al 7.5%, en ese caso deberíamos infundir del volumen total 3/4 partes de suero glucosado al 10% y 1/4 de suero fisiológico, siguiendo el ejemplo 12 ml/hora de suero fisiológico y 36 ml/hora de suero glucosado al 10%.
Tabla 6: Mantenimiento de fluidos y volumen de reemplazo basado en peso corporal y asumiendo 5% de deshidratación
Ejemplifica lo referido la Figura 1.
Insulinoterapia
-La insulinoterapia debe empezar al menos 1 hora luego de iniciada la fluidoterapia.
-La dosis sugerida debe estar entre 0.05-0.1 UI/kg/h hasta corregir acidosis. En niños pequeños se sugiere iniciar con la dosis menor.
-La dilución sugerida mas sencilla es: 100 UI insulina en 100cc suero fisiológico para tener una relación 1:1.
-Se sugiere que el descenso horario de la glicemia no sea mayor del 10% o 100 mg/dl/h. Manteniendo una glicemia entre 150-250 mg/dl durante la infusión de insulina.
-Si el descenso es mayor a 10% se deberá disminuir la infusión o aumentar el aporte de glucosa. Intentar no suspender nunca el aporte de la misma porque esto retardará la corrección de la acidosis.
-En caso que la glicemia sea menor de 150 mg/dl suspender transitoria y brevemente y aumentar el aporte de glucosa hasta poder reiniciar la insulina.
-Si la acidosis es persistente aumentar el aporte de glucosa para una glicemia objetivo de entre 250-300 mg/dl y poder aumentar el goteo de insulina.
Importante - situaciones particulares
-En la actualidad estamos teniendo pacientes con diagnóstico previo de diabetes mellitus tipo 1 que cuentan con bomba de insulina. En los mismos es importante desconectar la “infusión subcutánea continua de insulina” al iniciar la terapia con insulina intravenosa. La disfunción de la bomba de insulina puede ser una causa de cetoacidosis diabética.
-Las Guías Ispad refieren que pacientes que ya reciben insulina de acción prolongada, puede continuarse la administración de esta 1 vez por día.
Reposición segundo día
-Una vez que el paciente mejore su hidratación puede iniciarse lentamente la vía oral aumentando progresivamente el aporte enteral y administrando
1/3 del aporte intravenoso y 2/3 enteral.
-Con tolerancia enteral asegurada, corregida la deshidratación y la acidosis, se interrumpe la insulina intravenosa 1 hora después de la primera corrección subcutánea.
-Se contactará a endocrinólogo o diabetólogo pediátrico en este momento que definirá la dosis de insulina subcutánea que se le indicará al paciente.
Complicaciones
Son complicaciones derivadas del tratamiento inadecuado la presencia de hipoglicemia, hipopotasemia, acidosis hipercloremica y la aparición de edema cerebral. Nos referiremos a este último especialmente por la gravedad de la instalación del mismo.
Edema cerebral
-Es la complicación más grave que puede ocurrir cuando la corrección de la CAD se realiza de forma brusca sin compensación de la osmolaridad plasmática.
-Es poco frecuente (0,5-0,9%) pero su mortalidad es elevada (21-24%) y la posibilidad de secuelas neurológicas asciende a 15-25%.
-Esta complicación está vinculada al tratamiento y por lo general ocurre en las primeras 24 horas después de la rehidratación.
-El aumento de la osmolaridad plasmática inicial estimula la producción osmoles neuronales para evitar deshidratación celular. Frente a una corrección rápida de la hiperglicemia, sin corrección de los niveles de Na+ plasmático se produce una disminución de la osmolaridad plasmática determinante de edema cerebral.
Son factores de riesgo para edema cerebral:
Para prevenir el desarrollo del edema cerebral, la corrección de la hidratación y la acidosis debe ser lenta. Frente a la aparición de elementos sugestivos, la corrección de la hidratación se realizará en 72 hs. El tratamiento es el ya conocido para corrección del edema cerebral, soporte respiratorio cuando corresponda, posición de cabeza a 30 grados, neutra y uso de terapia hiperosmolar con suero salino hipertónico al 3% o manitol. Considerar realizar una tomografía de cráneo cuando la estabilidad clínica lo permita (Anexos 1 y 2).