Introducción
Las infecciones fúngicas invasivas (IFI) en la infancia constituyen un problema de salud en creciente aumento1-4. Dado que sus manifestaciones clínicas son inespecíficas, en ocasiones el diagnóstico puede ser tardío, provocando una elevada morbimortalidad1-7.
La prevalencia de las IFI no es del todo conocida, las series pediátricas incluyen definiciones operativas diferentes1-10. En Uruguay el espectro de especies de hongos no es tan amplio como en otros países de Latinoamérica. La notificación de infecciones fúngicas no es obligatoria, por lo que no existen registros completos11.
Algunas de las IFI probablemente se encuentren en crecimiento, vinculadas al aumento de la población inmunodeprimida, secundarias a la infección del virus de la inmunodeficiencia humana (VIH), al trasplante de órganos sólidos, médula ósea y al uso prolongado de fármacos inmunodepresores1-10. En 2018 Macedo-Viñas y colaboradores estimaron que en Uruguay cerca de 127.968 adultos y niños (3.716/100.000) padecían infecciones fúngicas graves al año11.
La epidemiología y el agente fúngico involucrado varían según la comorbilidad subyacente, la presencia de factores de riesgos, existencia de profilaxis, sensibilidad de los estudios diagnósticos utilizados y la adherencia a los tratamientos específicos para cada situación clínica1-5.
Los principales agentes responsables de IFI en la infancia son Candida spp, Aspergillus spp, Cryptococcus spp, Histoplasma capsulatum, Coccidioides immitis, Paracoccidioides spp. y Fusarium spp1-10.
La literatura describe la existencia de diversos factores de riesgo para presentar IFI, algunos son compartidos por los diferentes agentes fúngicos, otros son característicos a una IFI en particular1-7. En las IFI por Candida spp se describen como factores de riesgo los recién nacidos prematuros con muy bajo o extremo bajo peso al nacer sometidos a procedimientos invasivos, niños con inmunodeficiencias primarias o adquiridas, enfermedades hematooncológicas con neutropenias severas persistentes, el paciente crítico con estadías prolongadas en cuidados intensivos, que requieren: procedimientos invasivos (catéteres venosos profundos, sonda endotraqueal, sonda vesical); cirugías abdominales, gastrointestinales o genitourinarias; alimentación parenteral; uso prolongado de antibioticoterapia de amplio espectro, glucocorticoides, inmunosupresores, inhibidores de la bomba de protones1-7.
Para la IFI por Aspergillus spp se reportan como factores de riesgo la presencia de alguna inmunodeficiencia primaria, sobre todo la enfermedad granulomatosa crónica, y las enfermedades hematooncológicas como leucemias y tumores sólido con neutropenias persistentes, necesidad de uso de catéteres venosos profundos, alimentación parenteral, y la presencia de complicaciones vinculadas a la inmunodepresión como el uso de corticoides, la enfermedad injerto contra huésped y la infección por citomegalovirus1-7. Se describen como factores de riesgo para IFI por Cryptococcus spp la presencia de una inmunodeficiencia primaria o secundaria moderada a severa, sobre todo secundaria a infección por VIH. La baja adherencia al tratamiento antirretroviral y a la profilaxis con fluconazol, así como la desnutrición proteico calórica y la exposición a excretas de palomas y otras aves de corral son otros factores de riesgo1-5,8,9.
La mayoría de los estudios de IFI en niños han analizado la incidencia y prevalencia de candidiasis invasivas (CI), otros únicamente las candidemias. La incidencia de CI en series internacionales es de 35-52 casos/100.000 niños hospitalizados12,13. En Uruguay Decia y colaboradores reportaron en la unidad de cuidados intensivos de niños del Centro Hospitalario Pereira Rossell (CHPR), una incidencia de CI de 0,23 casos cada 1.000 días/paciente, con una prevalencia de 0,18%6.
Algunas características epidemiológicas, clínicas y terapéuticas de las IFI son comparables con los pacientes adultos, pero existen particularidades que deben ser reconocidas por los pediatras, sobre todo sus manifestaciones clínicas. Otro punto desafiante constituye el abordaje terapéutico. La mayoría de los azoles requieren monitorización de sus niveles terapéuticos para optimizar la eficacia y seguridad. Las recomendaciones de profilaxis y tratamiento se encuentran en continua actualización5,6.
Son escasas las publicaciones sobre IFI en pediatría en nuestro medio, por lo que caracterizar este problema de salud podría contribuir a mejorar las prácticas asistenciales en una patología poco frecuente, pero de elevada morbimortalidad.
Objetivos
Describir las características epidemiológicas, microbiológicas y clínicas de los menores de 15 años con IFI hospitalizados en el Hospital Pediátrico-CHPR (HP-CHPR)entre 2010 y 2019.
Material y métodos
Se realizó un estudio observacional, descriptivo, retrospectivo en el que se incluyeron todos los menores de 15 años con diagnóstico de IFI confirmada por estudio micológico (examen directo en fresco, examen directo con tinta china, coloraciones y cultivos), ingresados en el HP-CHPR, entre 2010 y 2019.
Se excluyeron los recién nacidos hospitalizados en el Servicio de Neonatología del Hospital de la Mujer, CHPR.
Se consideraron como dispositivos invasivos que favorecen a la IFI: vías venosas profundas, sonda endotraqueal, sonda vesical, catéter de Tenckhoff, dispositivos de diálisis peritoneal, dispositivos de drenaje torácico, sistema de derivación ventricular externo, dispositivo de alimentación parenteral, y otros.
Los casos se enrolaron a través de la base de datos informatizada del laboratorio de Parasitología y Micología del CHPR. La fuente de datos fueron las historias clínicas y los registros de laboratorio.
Se registraron las siguientes variables: edad, sexo, comorbilidades (inmunodepresión congénita o adquirida, enfermedades crónicas), factores de riesgo de IFI según agente fúngico, manifestaciones clínicas al momento del diagnóstico (fiebre, síntomas respiratorios, digestivos, urinarios, neurológicos, sepsis, otros), estudios diagnósticos (estudio micológico, agente identificado), días de hospitalización, tratamientos (fármacos, efectos adversos), y evolución (complicaciones, fallecimientos).
En el laboratorio de Parasitología y Micología del CHPR se procesaron muestras biológicas para estudio micológico e identificación de hongos aislados en el laboratorio de microbiología a partir de hemocultivos y punta de catéter a los cuales se les había realizado estudios bacteriológicos.
A las muestras biológicas se les realizó examen directo en fresco con solución fisiológica, examen directo en fresco con tinta china, tinciones permanentes y cultivos en agar Sabouraud (AS), AS con cloranfenicol y medio selectivos con cicloheximida. La identificación de los mohos se realizó por los métodos fenotípicos clásicos (microscopía y macroscopía); la identificación de levaduras también se hizo por las características fenotípicas y fisiológicas (pruebas bioquímicas) disponibles en nuestro laboratorio al momento de aislar las cepas.
El mayor porcentaje de las especies de levaduras se identificó y se valoró la susceptibilidad a los antifúngicos (ATF) con el equipo VITEK 2 (bioMérieux, Marcy-L’Etoile, France, database v.3.01), los antifúngicos testeados fueron: anfotericina B, fluconazol, 5-flucitosina, voriconazol, caspofungina y micafungina. En nuestro país los métodos de microdilución en placa para ATF, se realizan en centros de referencia y control epidemiológico, otras técnicas como la espectrometría de masas (MALDI), no está disponible en este centro asistencial.
Las variables continuas se describieron mediante mediana y rangos, y las discretas con frecuencias absolutas y relativas. El análisis de datos se realizó con el programa Epi Info 7.
Los datos de los usuarios se manejaron con total anonimato, salvaguardando la confidencialidad y el secreto médico. Se contó con la aprobación del Comité de Ética de investigación de la institución.
Resultados
Durante el período de estudio se registraron 26 casos de IFI en 23 niños; tasa 2,21/10.000 egresos. La mediana de edad al ingreso fue 8 años (1 mes-15 años), 17 eran de sexo femenino. Presentaban comorbilidades previas 17 casos, las más frecuentes inmunodepresión secundaria a infección por VIH 5 y enfermedades hematooncológicas 4. Los 5 niños con VIH adquirieron la infección por transmisión vertical. Al ingreso hospitalario 3 presentaban inmunodepresión severa y 2 inmunodepresión moderada.
Presentaban factores de riesgo para desarrollar IFI los 23 niños incluidos. Al analizar la presencia de factor de riesgo según agente fúngico involucrado, se encontró que los niños con IFI por Candida spp habían presentado ingreso a cuidados intensivos (UCI) 14/14; utilizado dispositivos invasivos 14/14 (vías venosas profundas 14, sonda endotraqueal 10, sonda vesical 7, alimentación parenteral 6, catéter de Tenckhoff 3, tubo de tórax 3); utilizados antibióticos de amplio espectro 14/14; inhibidores de la bomba de protones 12/14; corticoides 6/14; inmunosupresores 3/14; y requirieron cirugías mayores abdomino- pélvicas 5/14.
En los niños con IFI secundarias a Aspergillus spp se encontró como factor de riesgo la presencia de una enfermedad hematooncológica en 4/4; neutropenia severa prolongada en 4/4, uso de catéter venoso profundo en 3/4, y uso de corticoides o inmunosupresores 2/4.
En los casos con IFI secundarias a Cryptococcus spp 4/5 presentaban inmunodeficiencias moderadas a severas secundarias a infección por VIH con baja adherencia a la terapia antirretroviral y a la profilaxis con fluconazol, un niño presentaba inmunodeficiencia primaria combinada severa. En la (Tabla 1) se expresan las características de la población de niños incluidos.
Tabla 1: Infecciones fúngicas invasivas en menores de 15 años hospitalizados en el CHPR, 2010-2019. Características epidemiológicas y clínicas (N=23).

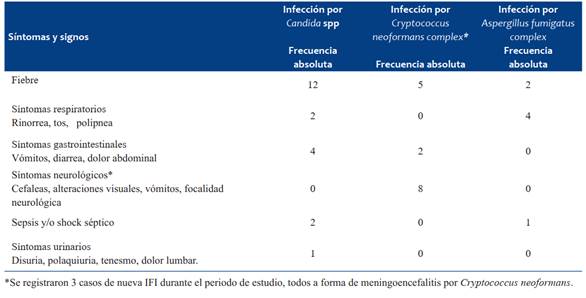
La fiebre fue la manifestación clínica que orientó la sospecha diagnóstica de IFI en 19/23 casos. En la (Tabla 2) se presentan las manifestaciones clínicas según agente fúngico identificado.
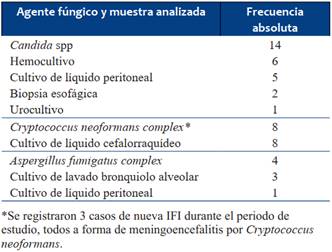
Las IFI se confirmaron mediante estudio de líquido cefalorraquídeo en 8, líquido peritoneal 6, hemocultivo 6, cultivo de lavado bronquioloalveolar (LBA) 3, biopsia esofágica 2, urocultivo uno. En los casos que se obtuvo cultivo de LBA, los tres presentaban muguet oral, imágenes compatibles con neumonitis fúngica, ventilación mecánica prolongada, un caso presentaba infección por VIH y en dos se sospechaba inmunodeficiencia primaria no confirmada. En el niño en que la IFI se confirmó por urocultivo, la muestra se tomó mientras presentaba cateterismo vesical a permanencia, pero junto a la candiduria se identificaron imágenes ecográficas intrarrenales ovales, móviles y ecogénicas interpretadas como nidos fúngicos o fungomas que no se puncionaron. El niño presentó múltiples urocultivos sin desarrollo de agentes bacterianos.
Los agentes de IFI identificados fueron Candida en 14 casos (Candida albicans 5, Candida parapsilosis 3, Candida sp 3, Candida lusitaniae 1, Candida tropicalis 1, Candida glabrata 1), Cryptococcus neoformans complex en 8 y Aspergillus fumigatus complex en 4. En la (Tabla 3) se muestran los agentes fúngicos identificados en función del tipo de muestra analizada.
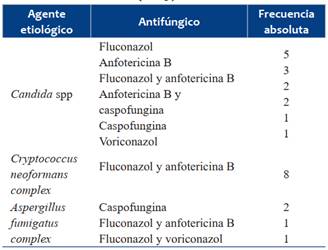
Se indicaron antifúngicos endovenosos en todos los casos, recibieron fluconazol 16, asociado a anfotericina B 11/16, caspofungina 5, anfotericina B sola 3 y voriconazol 2 niños. La mediana de duración de los tratamientos fue 20 días (1-90). Con el método de susceptibilidad a los ATF, utilizado, no se encontraron cepas resistentes a los azoles, anfotericina B ni a caspofungina.
Se encontró registro de dos casos de hipopotasemias leves, durante el uso combinado de fluconazol y anfotericina B. En la (Tabla 4) se muestran los tratamientos antifúngicos indicados según el agente.
La mediana de días de hospitalización fue 35 (rango 1-176 días), la mediana de días en UCI fue de 20 (rango 1-150 días). Durante el periodo de estudio tres niños presentaron una nueva IFI, todos a forma de meningoencefalitis criptococócica, dos de ellos eran portadores de VIH, y el tercero presentaba inmunodeficiencia combinada severa. En los dos casos portadores de VIH, la nueva infección se asoció a abandono de tratamiento de profilaxis secundaria con fluconazol y al tratamiento antirretroviral.
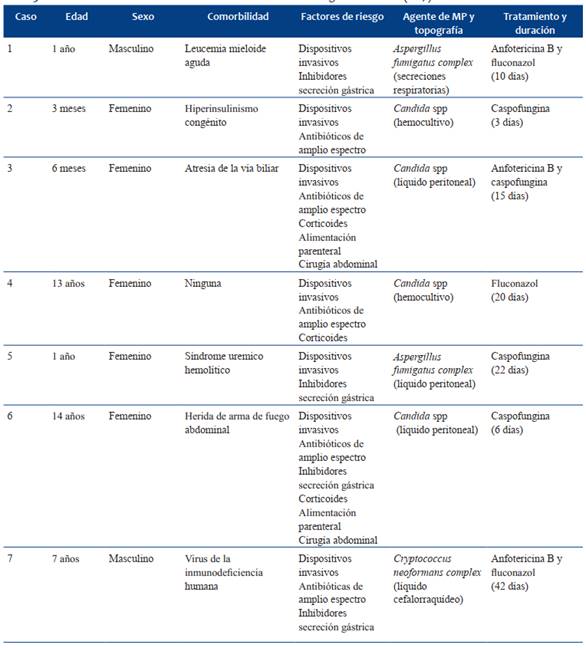
Fallecieron 7 niños (letalidad 30%), todos en UCI, mediana de edad 1 año (rango 3 meses- 14 años), de sexo femenino 5. En 4 casos se aisló Candida spp, en líquido peritoneal 2 (C albicans y C parapsilosis) y 2 en hemocultivo (C albicans y C tropicalis). En 2 niños se identificó Aspergillus fumigatus complex, en líquido peritoneal 1 y el otro en secreciones respiratorias. El séptimo niño presentó meningitis por Cryptococcus neoformans complex. En la (Tabla 5) se expresan las características de los niños fallecidos con IFI.
Discusión
La literatura describe como poblaciones más vulnerables a IFI en especial a la infección por Candida spp a los neonatos prematuros, especialmente menores de 1000 gramos y a niños portadores de inmunodeficiencias primarias o adquiridas. Otros grupos de riesgo son los desnutridos y los gravemente enfermos que requieren estadías prolongadas en UCI1-7. Esta serie no incluyó neonatos, por razones de organización estos se hospitalizan en el Servicio de Neonatología perteneciente al Hospital de la Mujer, que cuenta con salas de cuidados moderados y UCI neonatal.
La comorbilidad más frecuente identificada fue la inmunodepresión secundaria a infección por VIH, seguida por enfermedades hematooncológicas. En estos grupos particulares de niños pueden identificarse la existencia de factores favorecedores al desarrollo de IFI, estos factores varían según el agente fúngico involucrado, como se mencionó previamente1-10,12,14-20.
En niños con infección por VIH son factores de riesgo para desarrollar IFI y sobre todo para infección por Cryptococcus spp la presencia de: inmunosupresión moderada a severa y la mala adherencia a la terapia antirretroviral como ocurrió en esta serie8,9,18,19. Es rara la presentación de esta infección en niños previamente sanos8,9,18,19.
En niños con enfermedades hematooncológicas, segunda comorbilidad más frecuente en esta serie, las neoplasias que más se asocian a IFI sobre todo a infecciones secundarias a Aspergillus spp son las leucemias, seguidas por los tumores sólidos1-5,14-17,20. Se describen factores asociados vinculados al huésped como presencia de mucositis (mayoritariamente en relación a candidiasis) y colonización previa por agentes fúngicos; y factores relacionados a la enfermedad y sus tratamientos. Entre estos últimos la presencia de neutropenia prolongada, necesidad de procedimientos invasivos, cirugías, quimioterapia y las complicaciones vinculadas a la inmunosupresión, similar a los datos presentados en esta serie1-5,14-17,20.
La sintomatología de presentación de las diversas IFI son variadas e inespecíficas, lo que determina retraso diagnóstico. Los síntomas varían según el agente fúngico involucrado y la localización de la IFI. En este grupo particular de niños y adolescentes la fiebre fue el síntoma que más frecuentemente guió la sospecha diagnóstica, siendo acompañada en algunos casos por otros síntomas según la localización1-7,14-17.
La infección por Candida spp suele presentarse la mayoría de las veces con fiebre, sola o acompañada de vómitos, deposiciones líquidas y/o síntomas respiratorios como ocurrió en esta serie. En neonatos y lactantes pequeños la fiebre puede estar ausente. La candidiasis sistémica puede acompañarse de shock en 30%5,12-16.
En la infección por Cryptococcus spp, la manifestación clínica más frecuente fue la fiebre acompañada de cefalea y vómitos. Esta levadura capsulada tiene predilección por el sistema nervioso central (SNC), siendo la meningoencefalitis su principal forma de presentación9,14-19.
La infección por Aspergillus spp, sobre todo la aspergilosis invasiva suele cursar con fiebre persistente en el contexto de neutropenia prolongada. La afectación pulmonar (50%), se presenta con tos, disnea y dolor pleurítico, en oportunidades los síntomas son inespecíficos y la fiebre puede faltar, al igual que lo encontrado en este trabajo1-5,7,14-17,20,21. En niños suele ser menos frecuente la presentación cerebral, rinosinusal e intestinal5,7,20,21.
La confirmación diagnóstica representa un gran desafío. El cultivo, la microscopía y la histopatología continúan siendo el patrón de oro para el diagnóstico microbiológico pero con frecuencia no identifican ningún agente fúngico. Los hemocultivos presentan baja sensibilidad para identificar agentes fúngicos, reportándose sensibilidades menores a 50% para Candida spp y menor a 5% para Aspergillus spp5,14-17.
En los casos de sospecha de IFI con compromiso del SNC será necesario el estudio del líquido cefalorraquídeo en fresco con tinta china, siendo este método de baja sensibilidad pero específico para confirmar la meningitis criptococócica8,9,14-19.
Es posible que estas dificultades diagnósticas y el excluir a los neonatos pudieran contribuir en haber identificado únicamente 26 casos de IFI en los últimos 10 años en este centro de referencia de Uruguay.
Es importante en niños con factores de riesgo para desarrollar IFI mantener un alto índice de sospecha e interpretar adecuadamente alteraciones analíticas inespecíficas como hiperglucemia, trombocitopenia o acidosis metabólica, complementados con estudios imagenológicos según el agente fúngico y topografía de la afectación sospechada5,6,14-17,21.
En esta serie, al tratarse de un estudio retrospectivo, no se pudo relevar información sobre el uso de biomarcadores de infección micótica en este centro asistencial. Las pruebas no invasivas basadas en biomarcadores, como el beta-D-glucano (BDG), manano, antimanano y galactomanano, son los métodos sin cultivo más convenientes para el diagnóstico de IFI en pacientes sintomáticos, y en asintomáticos de alto riesgo así como también para monitorear la respuesta terapéutica1-4. En la aspergilosis pulmonar invasiva la sensibilidad del galactomanano en suero y LBA es similar al adulto para niños con enfermedad hemato-oncológica, pero varía en niños con inmunodeficiencias primarias y adquiridas. Ante la presencia de factores de riesgo y un cuadro clínico compatible para IFI estos biomarcadores podrían ser de utilidad para decidir el inicio de un antifúngico4,22,23.
La reacción en cadena de la polimerasa (PCR) multiplex obtenida de sangre, LBA o líquido cefalorraquídeo, podría ser útil para el diagnóstico de IFI grave, si bien la sensibilidad para Cryptococcus neoformans suele ser baja. Los resultados respecto a sensibilidad y especificidad para los diferentes agentes fúngicos necesitan ser validados en niños 14-17,24,25.
Si bien no todas las series pediátricas incluyen el análisis de IFI o profundas por mohos y levaduras de forma simultánea, la literatura refiere como los principales agentes patógenos a especies del género Candida seguida por Aspergillus1-5,7,8,14-17. En los casos de candidiasis invasora la especie aislada con más frecuencia al igual que en adultos es C. albicans, seguida por C. parapsilosis y C. tropicalis al igual que lo identificado en esta serie5,6,25,26,27.
Cryptococcus neoformans complex fue el segundo agente fúngico más identificado. En Uruguay se realiza en forma sistemática la identificación de la especie de Cryptococcus. Carbia y colaboradores analizaron 147 aislamientos de Cryptococcus entre los años 2006-2012, en distintos centros asistenciales de Uruguay aislados en muestras de pacientes con VIH en 91,8%. C. neoformans variante grubii fue la especie más identificada (74,1%), seguida de C. neoformans var. neoformans (23,1%). Este dato coincide con estudios internacionales previos. En esta serie los 5 casos en que se identificó Cryptococcus neoformans complex eran portadores de VIH20,28.
En relación a la elección del tratamiento antifúngico, fluconazol es el tratamiento de primera elección para la mayoría de las IFI por Candida spp, se trata de un fármaco con cinética conocida, buena penetrancia al SNC, adecuada tolerancia siendo el antifúngico más indicado en esta serie. Recientes revisiones sugieren en pacientes graves, con inestabilidad hemodinámica y sospecha de alta inoculación fúngica iniciar tratamiento con equinocandinas (caspofungina, micafungina). Después del curso inicial de la terapia con antifúngicos de amplio espectro, se puede recomendar una terapia de reducción con fluconazol, considerando la evolución clínica y la sensibilidad del agente fúngico. No se recomienda el tratamiento con fluconazol para infecciones por Candida krusei y Candida glabrata, ya que C. krusei es inherentemente resistente y C. glabrata tiene baja susceptibilidad a este fármaco2,3,13,16. Anfotericina B es el antifúngico de elección en las candidiasis urinarias y en la criptococosis. Se puede administrar como monoterapia o asociada a un azol en la criptococosis8,9,18,19. Como tratamiento empírico en la aspergilosis invasiva se encuentra indicado voriconazol. Anfotericina B liposomal es una alternativa aceptable para menores de dos años o que tienen contraindicado la utilización de voriconazol. No hay pruebas que apoyen el uso de la terapia antimicótica combinada para el tratamiento de niños con aspergilosis2.
En cuanto a la duración del tratamiento se encontró una gran disparidad en la mediana de días de tratamiento. La mayoría de ellos se trataron de pacientes críticos en los que se prolongó el uso de antifúngicos pudiendo esto sobrestimar la mediana de días de tratamiento2,3,13,16,18,19,29.
En serie la letalidad fue elevada y vinculada a algún tipo de inmunodeficiencia. Estos hallazgos son similares a lo comunicado en la literatura con tasas de letalidad en candidiasis invasivas de 35%-66%. En la aspergilosis invasiva se describe una mortalidad de 10-52% dependiendo del órgano afectado, la inmunidad del paciente y el tratamiento utilizado5,14-17.
Conclusiones
Las IFI en la infancia son una patología poco frecuente, que afecta en su mayoría en niños inmunocomprometidos o gravemente enfermos, asociadas a una elevada mortalidad.
Es necesario identificar los pacientes con factores de riesgo y tener un alto índice de sospecha dado que la presentación clínica es variada e inespecífica y se encuentra relacionada con el agente y la localización. La confirmación puede requerir el empleo simultáneo de varias técnicas diagnósticas. Candida spp y Cryptococcus spp son los agentes fúngicos más involucrados. El inicio precoz del tratamiento y acorde a los datos de susceptibilidad disponibles se asocia a menor mortalidad.