Caso clínico
Síndrome multisistémico post COVID-19 y dificultad en su diagnóstico etiológico. A propósito de un caso clínico
Multisystem post COVID-19 syndrome and its difficult etiological diagnosis. A clinical case
Síndrome multissistêmica pós COVID-19 e a dificuldade no seu diagnóstico etiologico. Relato de caso clínico
1Residente Pediatría. Clínica Pediátrica A. CHPR. Correo electrónico: natalia.com@gmail.com
2Jefa Servicio Pediatría. COMEPA.
3Coordinadora Servicio Pediatría. COMEPA.
4Pediatra Servicio Pediatría. COMEPA.
5Subdirectora Depto. Laboratorio Salud Pública. MSP.
6Médico Microbiólogo Jefe Unidad Virología. DLSP.
7Depto. Laboratorio Salud Pública. MSP.
8Prof. Agda. Clínica Pediátrica A. Facultad de Medicina. UDELAR.
9Prof. Adj. Clínica Pediátrica A. Facultad de Medicina. UDELAR.
10Prof. Directora. Clínica Pediátrica A. Facultad de Medicina. UDELAR.
Resumen:
El SARS-CoV-2 afecta a un reducido número de pacientes pediátricos, que en su mayoría son asintomáticos o presentan compromiso respiratorio leve y evolución favorable. Sin embargo, en niños previamente sanos puede aparecer el síndrome inflamatorio multisistémico (SIM-C) o similar a Kawasaki (Kawasaki-like) asociado a la enfermedad por COVID-19, que evolucionan al shock y requiere internación en la unidad de cuidados intensivo.
Presentamos el caso de un adolescente con antecedentes ambientales de SARS-CoV-2 37 días antes de su ingreso, que no se testeó en ese momento. Recibe la primera dosis de vacuna Pfizer 15 días antes de la presentación de un cuadro de sintomatología digestiva con dolor abdominal y fiebre, con test de antígenos COVID-19 y PCR viral negativos. Luego de una laparoscopia exploratoria, al sexto día de fiebre y dolor instaló conjuntivitis bilateral no supurada y exantema en tórax, odinofagia, astenia y lengua saburral con fenotipo Kawasaki. La serológica IgG anti spike fue positiva y la IgM negativa, con parámetros inflamatorios elevados, por lo que se planteó un síndrome multisistémico post COVID-19. Recibió tratamiento con inmunoglobulina intravenosa, ácido acetilsalicílico y metilprednisolona. Dada la necesidad de descartar la posibilidad de un evento atribuible a vacunación o inmunización (ESAVI), se realizó la búsqueda serológica para SARS-CoV-2, en un estudio cualitativo, buscando anticuerpos que no se generan con la vacuna Pfizer, que fueron positivos. De esta forma confirmamos la etiología post COVID-19 y descartamos la etiología por ESAVI, realizándose además el estudio cuantitativo de los anticuerpos anti spike con disminución de estos al mes del debut.
Palabras clave: Síndrome de respuesta inflamatoria sistémica; COVID- 19; Enfermedad de Kawasaki; Niño
Summary:
SARS-CoV-2 affects a low number of pediatric patients, most asymptomatic or with mild respiratory compromise and favorable evolution. However, in previously healthy children, Multisystem Inflammatory Syndrome (SIM-C) or Kawasaki-like Syndrome(Kawasaki-like) may appear linked to the COVID-19 disease, progressing to shock and requiring admission to the intensive care unit.
We present the case of an adolescent with an environmental history of SARS-CoV-2 37 days prior to her admission, who was not tested at that time. She had received the first dose of Pfizer vaccine 15 days before the presentation of digestive symptoms with abdominal pain and fever. She had a negative Covid-19 antigen test and viral PCR. After an exploratory laparoscopy, on the sixth day of fever and pain, she developed bilateral non-suppurative conjunctivitis and a rash on the chest, odynophagia, asthenia, and coated tongue with the Kawasaki phenotype. The anti-spike IgG serology was positive and the IgM negative, with elevated inflammatory parameters, so a post-COVID-19 multisystem syndrome was suggested. She received treatment with intravenous immunoglobulin, ASA and methylprednisolone. In order to rule out the possibility of an event allegedly caused by vaccination or immunization (ESAVI), the serological search for SARS-CoV-2 was carried out through a qualitative study, looking for antibodies that are not generated with the Pfizer vaccine. The result was positive. Therefore, we confirmed the post-Covid etiology and ruled out the ESAVI etiology, and also performed the quantitative study of the anti-spike antibodies, which showed a decrease one month after the debut.
Key words: System inflammatory response syndrome; COVID- 19; Kawasaki disease; Child
Resumo:
O SARS-CoV-2 afeta um número reduzido de pacientes pediátricos, em sua maioria, assintomáticos ou apresentando comprometimento do nível respiratório e evolução favorável. Porém, em crianças previamente sãs, pode aparecer a Síndrome Inflamatória Multissistêmica (SIM-C) ou similar a Kawasaki (Kawasaki-like) associada à doença por COVID-19, que pode evoluir a choque e requer a internação na UTI.
Apresentamos o caso de um adolescente com antecedentes ambientais de SARS-CoV-2 37 dias antes do seu ingresso, que não se testou nesse momento. Recebendo a dose da primeira vacina Pfizer 15 dias antes da apresentação de sintomatologia digestiva com dor abdominal e febre. Teve um teste de antígenos COVID-19 viral negativo. Depois de una laparoscopia exploratória, ao sexto dia de febre e dor, teve conjuntivite bilateral não supurada e exantema en tórax, odinofagia, astenia e língua saburral com fenótipo Kawasaki. A sorologia IgG anti-spike foi positiva e a gM negativa, com parâmetros inflamatórios superiores, indicando uma síndrome multissistêmica pós Covid 19. O tratamento recebido foi imunoglobulina intravenosa, AAS e Metilprednisolona. Com o fim de descartar a possibilidade de um evento supostamente atribuível à vacinação ou vacinação positiva (ESAVI), realizou-se uma busca sorológica para SARS COV2, através de um estúdio qualitativo, procurando anticorpos não gerados pela vacina Pfizer, os quais foram confirmados. Nesta forma, confirmamos a etiologia pós-Covid e descartamos a etiologia por ESAVI. Aliás, realizamos um estudo quantitativo dos anticorpos anti-spike e comprovamos a sua diminuição a um mês de ter acontecido o debut.
Palavras chave: Síndrome de resposta inflamatória sistémica; COVID-19; Doença de Kawasaki; Criança
Introducción
El SARS-CoV-2 afecta a un reducido número de pacientes pediátricos, la mayoría son asintomáticos o presentan compromiso respiratorio leve y evolución favorable. Sin embargo, en niños previamente sanos puede aparecer el síndrome inflamatorio multisistémico (SIM-C) o similar a Kawasaki asociado a la enfermedad por COVID-19, que evoluciona al shock y puede requerir internación en unidad de cuidados intensivos1-3. Se asocia a una infección activa o reciente por SARS-CoV-2 y se caracteriza por presentación clínica y laboratorio similares a los que se encuentran en la enfermedad de Kawasaki, el síndrome de shock tóxico o el síndrome de activación de macrófagos1.
Su evolución es potencialmente grave y puede resultar en falla cardiovascular; aunque la mortalidad es baja (2%)2.
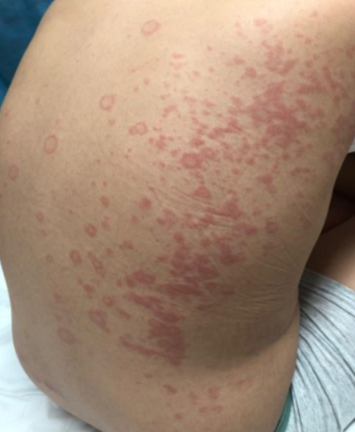
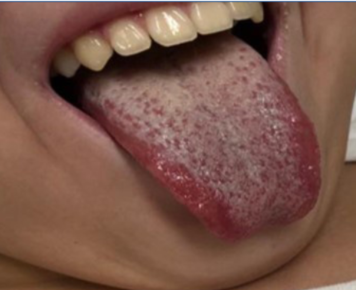
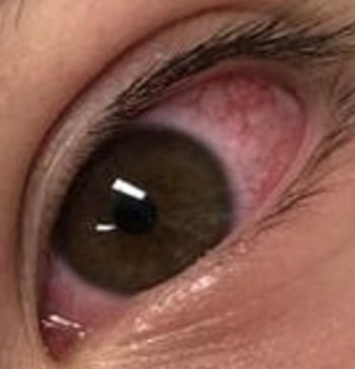
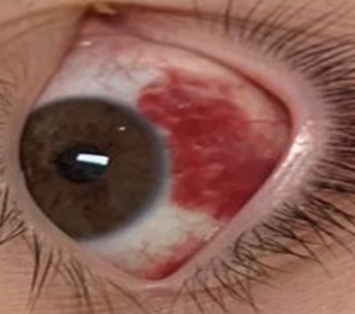
Presentamos el caso de un adolescente de 12 años con antecedentes ambientales de madre y hermana con SARS-CoV-2 hacía 37 días. Él y su padre permanecieron asintomáticos, sin testeo. 15 días antes de su ingreso al servicio de emergencia, recibió primera dosis de vacuna COVID-19 (Pfizer) y 13 días después comenzó con fiebre de hasta 39ºC, náuseas, vómitos, diarrea y dolor abdominal intenso. La paraclínica al ingreso presentaba 7.300 leucocitos/μl, 75% de neutrófilos, 15% linfocitos, 354.000 plaquetas/μl, PCR 130 mg/l. Aspirado nasofaríngeo para estudio de PCR múltiplex negativo, test de antígeno para estreptococo del grupo A negativo. Ionograma normal. Ecografía abdomen y radiografía de tórax normales. Se descartó cuadro agudo de abdomen por cirujano pediátrico. La búsqueda de rotavirus en materia fecal fue negativa. Se solicitó test antigénico y PCR para COVID-19 que fueron negativos. A las 24 h, por persistencia de dolor abdominal y fiebre, se realizó tomografía computada abdominal, que informó adenitis mesentérica con líquido libre en cavidad peritoneal. A las 48 h se realizó una fibrolaparoscopía exploratoria que confirmó la adenitis mesentérica con apéndice edematoso, que se extirpó. El cultivo de líquido peritoneal fue estéril. Pasó 24 h en apirexia y sin dolor y a los 6 días, instaló conjuntivitis bilateral no supurada y exantema en tórax morbiliforme, urticariforme, con algunas lesiones de centro pálido, odinofagia, astenia y lengua saburral (Figura 1), (Figura 2), (Figura 3) y (Figura 4). Reinicia la fiebre y reinstala el dolor abdominal. La función hepática y renal fueron normales. Para descartar otros agentes infecciosos se solicitó test de Paul Bunnel que fue negativo. La serología para CMV y toxoplasmosis resultaron negativas. El hemocultivo fue estéril. Se solicitó segunda PCR para COVID-19 que fue negativa. Clínicamente presentaba un fenotipo Kawasaki, por lo que se reiteró hemograma destacando 11.700 leucocitos/μl, 80% de neutrófilos y 8% de linfocitos con 383.000 plaquetas/μl, y se solicitó paraclínica inflamatoria: fibrinógeno 488 mg/dl (normal 180-350 mg/dl), dímeros D 1.960 ng/ml (normal 15 a 500 ng/ml) y ferritina 368 μl/l (normal 7-140 μl/l). LDH 583 μ/l (normal menos de 764 μ/l). Troponinas: menos de 14 ng/l (normal). Crasis sanguínea normal. Proteinograma electroforético normal. De acuerdo con las manifestaciones clínicas y de laboratorio comúnmente descritas y luego de descartar agentes infecciosos alternativos que pudieran estar causando la enfermedad, se planteó síndrome multisistémico post COVID-19 (MIS-C)1,3. Se solicitaron electrocardiograma y ecocardiograma, que fueron normales1,2.
El MIS-C generalmente se presenta con una mayor elevación de marcadores inflamatorios en comparación con la enfermedad de Kawasaki, mayores niveles de PCR, ferritina, citoquinas inflamatorias y péptido natriurético tipo pro BN-terminal (NT-proBNP), mayor frecuencia de linfopenia y trombocitopenia, sin diferencias en los niveles de dímeros D1.
Se estudió la serología anti spike con anticuerpos AcS: IgG positivo e IgM negativo, estudio cualitativo de anticuerpos específicos contra el subdominio RBD de la subunidad S1 de la proteína S (spike) del SARS-CoV-2.
El objetivo de nuestro trabajo es describir el caso clínico de un paciente que presentó un síndrome inflamatorio multisistémico con anticuerpos anti spike IgG positivos y definir si la clínica y la serológica del paciente se explicaban por haber cursado la enfermedad o por ESAVI.
Observación clínica
Se administró inmunoglobulina intravenosa a una dosis de 2 g/kg, ácido acetilsalicílico 5 mg/kg/día y metilprednisolona 1 mg/kg/día por 3 días, pantoprazol y medias de compresión neumática1-3. A las 24 h el paciente estaba en apirexia, sin dolor abdominal, con disminución de la conjuntivitis y de las lesiones de piel, reinstalando fiebre que en ese momento completaba 10 días, vómitos y decaimiento. Los parámetros inflamatorios persistían elevados. Por persistencia de la fiebre se administró una segunda dosis de inmunoglobulina3. El paciente se mantuvo asintomático con hemodinamia estable y completó 4 días en apirexia, agregando una descamación de piel leve en extremidades. Se otorgó alta, reingresando a las 24 h por fiebre y náuseas. Se constató en ese momento descenso de parámetros inflamatorios y una alteración leve de la función hepática. Se reinició prednisolona a mayor dosis por 3 días y ácido acetilsalicílico, completando 3 semanas con prednisona. A los 5 días de apirexia, se otorgó alta a domicilio.
Se solicitó anticuerpos IgM/IgG anti antígeno de proteína N del SARS-CoV-2 que fueron positivos por inmunocromatografía (Biohit®).
Se realizó el estudio cuantitativo de anticuerpos anti S en forma retrospectiva, con muestra de sangre en el momento del debut 3.800 BAU/ml y al mes 1.270 BAU/ml, en laboratorio de referencia del Ministerio de Salud Pública.
El paciente recibió la segunda dosis de vacuna a los 90 días, sin sintomatología.
Discusión
Se realizó diagnóstico de SARS-CoV-2 por nexo epidemiológico.
De acuerdo a los criterios definidos por la OMS para MIS-C, el paciente presentaba más de 3 días de fiebre, exantema, conjuntivitis bilateral no supurada, elevación de dímeros D mayor a 1.000 ng/ml en dos oportunidades, afectación gastrointestinal, aumento de PCR mayor a 50 mg/l y evidencia epidemiológica de infección por COVID-19, además de la exclusión de otras causas infecciosas1-4.
Nos encontrábamos ante la incógnita de la etiología del cuadro del paciente, con anticuerpos anti spike positivos en forma cualitativa al inicio que no permitían descartar ESAVI, dado que los mismos anticuerpos son generados por la vacuna Pfizer. Las vacunas actualmente autorizadas y casi todas las candidatas en estadio clínico tardío contienen la proteína spike del SARS-CoV-2 de longitud completa como antígeno, por lo que se dirigen a los epítopos fuera del RBD5, se realizó la búsqueda de otros anticuerpos no generados por la vacuna, como los anticuerpos anti antígeno de proteína N que fueron positivos, de esta forma pudimos confirmar la etiología post COVID-19, descartando ESAVI. Demostrando posteriormente con el estudio cuantitativo la disminución de los anticuerpos anti spike al mes del debut del síndrome inflamatorio multisistémico post COVID-19, en forma retrospectiva, con muestra de sangre del momento del debut y al mes.
El paciente recibió la segunda dosis de vacuna Pfizer a los 90 días de su enfermedad, permaneciendo sin sintomatología.
Bibliografía:
1. García A, Antón J, Martínez J, Giralt G, Gómez B, Tagarro A. Documento español de consenso sobre diagnóstico, estabilización y tratamiento del síndrome inflamatorio multisistémico pediátrico vinculado a SARS-CoV-2 (SIM-PedS). An Pediatr 2021; 94(2):116.e1-116.e11.
[ Links ]
2. Taffarel P, Jorro F, Rodríguez A, Widmer J, Meregalli C. Síndrome inflamatorio multisistémico en niños, relacionado con COVID-19: actualización a propósito de la presentación de 2 pacientes críticos. Arch Argent Pediatr 2021; 119(1):e26-e35.
[ Links ]
3. Ensinck G, Gregorio G, Flores R, Crowe C, Clerico P, Curi C, et al. Consenso sobre el tratamiento del síndrome inflamatorio multisistémico asociado a COVID-19. Arch Argent Pediatr 2021; 119(4):S198-S211.
[ Links ]
4. Whittaker E, Bamford A, Kenny J, Kaforou M, Jones C, Shah P, et al. Clinical characteristics of 58 children with a pediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2. JAMA 2020; 324(3):259-69.
[ Links ]
5. Fergie J, Srivastava A. Immunity to SARS-CoV-2: lessons learned. Front Immunol 2021; 12:654165. doi: 10.3389/fimmu.2021.654165.
[ Links ]