Introducción
Se presume que la viruela del mono está presente en el África subsahariana desde hace miles de años, los humanos adquirieron el virus a través del contacto directo con animales infectados. Fue descrita en el año 1958 en primates y los primeros casos en humanos fueron detectados en 19701,2. El reservorio primario son los roedores de África Central y Occidental3).
Es una zoonosis producida por el virus de la viruela del mono perteneciente a la familia Poxviridae, género Orthopoxvirus. Este virus se encuentra estrechamente relacionado con el virus de la viruela, dado que comparten la misma familia, subfamilia y género. Esta enfermedad tiene características similares pero es generalmente más leve4.
En 2003 se documentó un brote en EE.UU., el primero fuera de África. Afectó a 71 personas entre 1 y 51 años. La fuente de inoculación fueron mascotas infectadas (ratas gambianas) importadas desde África. De estos casos 18 fueron hospitalizados, algunos por precauciones de aislamiento. Dos niños tuvieron una enfermedad clínica grave. Uno desarrolló encefalitis y requirió internación en terapia intensiva durante 14 días. La encefalitis es una complicación muy rara de la viruela del mono y solo se había hecho una descripción previa. El segundo niño fue hospitalizado con linfadenopatía cervical y amigdalina dolorosa con lesiones de viruela difusa, incluidas lesiones en toda la orofaringe. No hubo muertes asociadas con el brote. Solo un paciente pediátrico tuvo una erupción generalizada similar a la observada en pacientes africanos, muchos pacientes desarrollaron lesiones localizadas en las manos y los dedos por el contacto directo con animales infectados5.
En el brote actual, el primer caso se reportó el 7 de mayo de 2022 en el Reino Unido, en un viajero proveniente de Nigeria6. El pasado 23 de julio, la Organización Mundial de la Salud declaró la viruela del mono como una emergencia global luego del aumento de casos en todo el mundo: 16.000 casos en 75 países.
Formas de transmisión
La transmisión de animales a humanos se produce por contacto directo con sangre, fluidos y lesiones cutaneomucosas de animales infectados. La transmisión entre personas es por contacto estrecho, principalmente a través de gotitas respiratorias, lesiones cutáneas de una persona infectada o fomites contaminados con fluidos corporales4,5.
Está documentada la transmisión transplacentaria (viruela símica congénita)6,7.
Síntomas o presentación clínica en la gestante
El cuadro clínico se asemeja al de la viruela (infección por Orthopoxvirus) aunque sería menos contagioso y causaría una enfermedad menos grave. La tasa de letalidad es de 3% a 6%.
La presentación clínica en las embarazadas no suele diferir a mujeres no gestantes, pero su control debe ser estricto por la posibilidad de una presentación más severa5.
Suele ser una enfermedad autolimitada8,9.
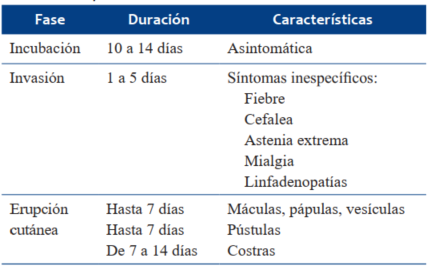
La enfermedad se puede dividir en diferentes etapas: transmisión, incubación, invasión y fase de erupción cutánea (Tabla 1). El período de incubación presenta una duración de unos 10 a 14 días2,5 con la replicación del virus en el sistema linfático. Luego ocurre la viremia con diseminación multiorgánica, lo que se denomina fase de invasión, con una duración de aproximadamente 1 a 5 días. Durante esta fase los síntomas son inespecíficos. Es la fase prodrómica, y se presenta con fiebre, astenia extrema, mialgias, cefalea y linfadenopatías.
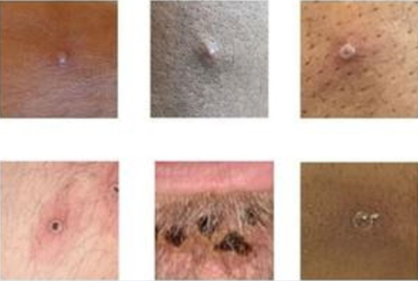
Durante la última fase, aparece el exantema maculopapular, en la mayoría de los casos en cara (95%), en palmas y plantas (75%) y el resto del cuerpo. Evoluciona a vesículas y pústulas dolorosas, que alrededor de 10 a 14 días quedan cubiertas por costras que duran de 1 a 2 semanas (Figura 1)10,11.
En personas inmunodeprimidas la enfermedad suele presentar mayor duración y gravedad, con exantema diseminado y riesgo de sepsis. Es importante destacar que hasta la resolución de las costras el paciente continúa contagiando la enfermedad.
Características de la infección durante la gestación
Existen datos limitados respecto a la evolución obstétrica y resultados feto/neonatales de la infección humana durante el embarazo principalmente debido a los escasos reportes de los países en los que es endémica. En ausencia de datos certeros, se presume que las embarazadas, al igual que pacientes inmunocomprometidos y niños menores de 8 años, constituyen una población de riesgo, en las que son más frecuentes complicaciones como neumonía, encefalitis e infecciones oculares
La Organización Mundial de la Salud (OMS) informa que la transmisión de la madre al feto puede ocurrir a través de la placenta (que puede conducir a la viruela símica congénita) o por contacto cercano durante y después del nacimiento2.
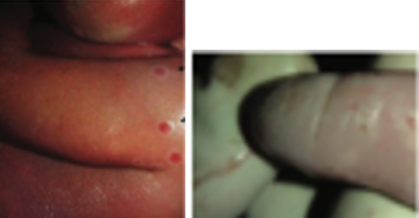
Un estudio observacional de una cohorte de 222 personas sintomáticas en la República Democrática del Congo entre 2007 y 2011, incluyó a cuatro mujeres embarazadas. Tres casos finalizaron con muerte fetal (dos abortos, un óbito) y un recién nacido de término infectado sintomático. Las dos gestantes con muerte fetal en el primer trimestre padecían enfermedad de moderada a grave. La tercera gestante tuvo enfermedad grave a las 18 semanas de gestación y sufrió una muerte fetal intrauterina. En el análisis el feto tenía características clínicas de infección por viruela del mono y había evidencia virológica, histológica y serológica que sugería que murió debido a la transmisión vertical de este virus. Presentaba lesiones maculopapulares cutáneas difusas en la piel de la cabeza, abdomen, tórax, espalda, en palmas y plantas. Se constató hidropesía fetal y hepatomegalia marcada con derrame peritoneal. No hubo malformaciones o deformidades congénitas (Figura 2). Se evidenciaron hemorragias placentarias en las superficies de los cotiledones maternos sin otras anomalías macroscópicas en la placenta, las membranas placentarias o el cordón umbilical. Se analizaron muestras fetales para confirmar la enfermedad. El tejido fetal contenía 1,7×107 copias del genoma/ml y los niveles placentarios eran 2,4×107 copias/ml; la sangre de la vena del cordón umbilical tenía niveles igualmente altos de virus (2,5×107 copias del genoma/ml). No se pudieron obtener muestras de sangre fetal, pero se obtuvo alrededor de 1 ml de líquido peritoneal estéril del feto, y arrojó un nivel de ADN MPXV de 1,6×103 copias del genoma/ml8.
Oportunidad y vía de nacimiento
Como la mayoría de los casos no son graves y son autolimitados, esta infección no suele ser indicación de finalizar la gestación. En caso de evidenciarse compromiso fetal o riesgo materno, teniendo en cuenta la edad gestacional, el peso fetal estimado y la condición del feto se evaluará la indicación de la interrupción del embarazo. De existir indicación de interrupción de la gestación, siempre que no sea de urgencia, se recomienda finalizar la misma luego de 7 días de la aparición de la erupción cutánea materna, con el fin de favorecer el pasaje de inmunidad transplacentaria7. Con respecto a la administración de corticoides, parecería poco probable que un ciclo único para la maduración fetal tenga un efecto adverso significativo en la condición materna.
No existe evidencia científica para decidir la mejor via para la finalización de la gestación pero algunos expertos recomiendan ofrecer una cesárea luego de discutir el riesgo (actualmente no cuantificable) de infección neonatal8-13.
Equipo de protección personal y aislamiento
El personal de salud debe usar el equipo de protección personal apropiado cada vez que esté cerca de casos sospechosos o confirmados de viruela del simio y seguir las prácticas utilizadas para la protección contra virus en el aire, por gotitas y por contacto. Esto debe incluir tapabocas, guantes, bata y protección para los ojos, como gafas o un protector facial, que estén bien ajustados9.
Manejo del recién nacido
No existe acteualmente evidencia para guiar la atención neonatal en caso de infección de la gestante por viruela del mono.
Se debe realizar un examen exhaustivo del neonato y realizar una prueba de reacción en cadena de polimerasa (PCR) viral de una muestra de hisopo de la orofaringe o cualquier lesión que esté presente. Se debe enviar muestras de placenta para anatomía patológica, cultivos y prueba de PCR.
Hasta descartar la infección en el recién nacido, debe permanecer aislado de su madre y de los demás, en una habitación individual, con los cuidadores usando el equipo de protección personal adecuado.
Si el recién nacido resulta positivo, pueden reunirse con su madre13,14.
Lactancia
El Centro para el Control y la Prevención de Enfermedades (CDC) recomienda no amamantar hasta que todas las lesiones hayan sanado, las costras se hayan caído y se haya formado una nueva capa de piel. Recomiendan descartar toda la leche materna que se extraiga durante ese tiempo15.
Diagnóstico
Es clínico y microbiológico. La PCR es la técnica de elección para la identificación viral dada su alta especificidad. La obtención de la muestra a partir de lesiones pustulosas debe realizarse por medio de hisopo de dacrón. No se recomiendan hasta el momento, la detección antigénica ni la búsqueda de anticuerpos.
Se considera caso sospechoso si presenta exantema agudo con uno o más de los siguientes síntomas (cefalea, fiebre > 38.5°C, mialgias, astenia y adenomegalias) y haber excluido causas de exantema agudo.
Se denomina caso probable si la persona que cumple con definición de caso sospechoso y uno o más de los siguientes criterios:
- Vínculo epidemiológico (exposición estrecha sin protección respiratoria; contacto físico directo, incluido el contacto sexual; o contacto con materiales contaminados, como ropa o ropa de cama) con un caso probable o confirmado en los 21 días anteriores al inicio de los síntomas.
- Antecedente de viaje a un país endémico de viruela símica en los 21 días previos al inicio de los síntomas.
Se denomina caso confirmado si la persona presenta una prueba de PCR positiva para el virus de la viruela símica.
Se deberá tener en cuenta que toda persona que haya estado expuesta a un caso probable o confirmado sin protección respiratoria o en contacto físico directo como el contacto sexual o indirecto con materiales contaminados deberá realizar aislamiento por 21 días desde el último contacto con el caso confirmado15.
Tratamiento
No existen tratamientos etiológicos probados para la viruela del mono.
La vacuna contra la viruela confiere protección cruzada, con una efectividad de un 85%, por lo cual se puede usar como profilaxis post exposición2.
Tecovirima es un antiviral con actividad contra poxvirus se desconoce su efecto durante el embarazo, pasaje a la leche materna o efecto en los lactantes16,17. Los antivirales cidofovir y brincidofovir, tienen efectos teratogénicos en animales y no se recomienda su uso en embarazadas cursando el primer trimestre, ni durante la lactancia porque tiene pasaje a la leche materna.
En cuanto al uso de inmunoglobulina vaccinia, no existen estudios que aporten información sobre su uso durante la gestación15,16.
Vacunas
Existen tres vacunas; JYNEOSTMes (o MVA-BN o IMVANEX®), ACAM2000®, y Aventis Pasteur (APSV), ninguna aprobada actualmente para embarazadas.
JYNEOSTMes es una vacuna a virus vivos atenuados con escaso poder replicativo y se encuentra indicada para la prevención de la viruela símica en mayores de 18 años con alto riesgo de infección.
ACAM2000® también es una vacuna a virus vivos, ésta tiene capacidad de replicación, y se encuentra indicada para personas con alto riesgo de contraer el virus, inmunocompetentes y no embarazadas dado que su poder replicativo puede producir afectación fetal.
En cuanto a APSV, es una vacuna a virus vivos con capacidad de replicación, pero se desconoce su efectividad contra la viruela símica.
Los efectos adversos graves como miopericarditis y encefalitis postvacunal se reportaron más frecuentemente con el uso de ACAM2000® (Tabla 2).
Tabla 2: Comparación de las características de las vacunas que tienen efectividad contra la viruela símica
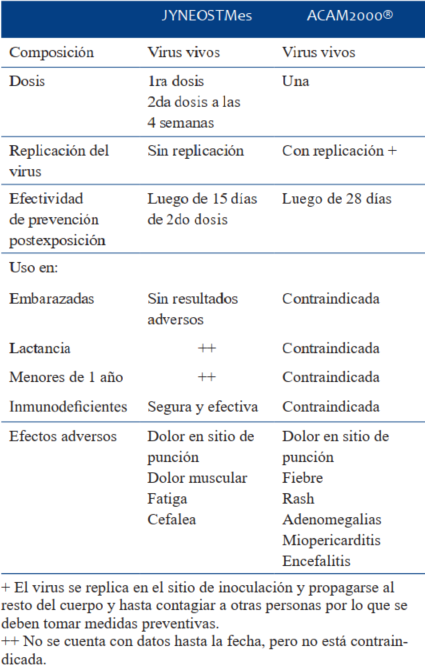
La vacuna JYNEOSTMes, fue administrada en 300 mujeres embarazadas y no se observó un aumento en los resultados adversos16.
El CDC recomienda que la primera dosis de la vacuna se administre dentro de los 4 días posteriores a la exposición para prevenir la enfermedad, si bien la prevención se asegura cuando el calendario vacunal está completo (a los 28 días para ACAM2000® y a los 15 días de la segunda dosis para JYNEOSTMes). Si se administra entre 4 y 14 días después de la fecha de exposición, la vacunación puede reducir los síntomas de la enfermedad, pero es posible que no prevenga la aparición de la enfermedad17.