Introducción
La enfermedad por coronavirus 2019 (COVID-19) causada por la infección por SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2) se ha extendido por todo el mundo desde diciembre de 20191; y es declarada pandemia en marzo de 2020 por la Organización Mundial de la Salud (OMS)2.
Luego de la primera ola de COVID-19, se reporta por primera vez en mayo del 2020 en el Reino Unido un estado hiperinflamatorio asociado a la infección por SARS-CoV-2 en un grupo de niños ingresados a unidades de cuidado intensivo pediátrico (UCIP). Este nuevo fenotipo con características similares a la enfermedad de Kawasaki y al síndrome del shock tóxico se ha denominado síndrome inflamatorio multisistémico en niños (SIM-PedS)3.
A pesar de la baja mortalidad3,4, es fundamental la sospecha y el reconocimiento temprano para ofrecer un tratamiento oportuno para prevenir la muerte y el desarrollo de secuelas5-7.
Presentamos el caso clínico de una preescolar, en la que se realizó diagnóstico de SIM-PedS con fenotipo shock e íleo paralítico. El objetivo es alertar mientras exista circulación comunitaria de SARS CoV-2. Se revisarán los criterios diagnósticos y las recomendaciones al momento actual.
Caso clínico
5 años, sexo femenino, apendicectomizada. Antecedentes ambientales: alta circulación de SARS-CoV 2 en el país. Niega contacto con COVID-19 y enfermedad respiratoria en convivientes en los dos meses previos. Padres no vacunados.
Consulta por dolor abdominal, vómitos y fiebre de hasta 39°C. Al examen se constata dolor a la palpación del hemiabdomen inferior, resto normal. Se realiza examen de orina en el que la orina tiene aspecto turbio con densidad 1032, leucocitos positivos (+) y nitritos negativos. Se toma muestra para urocultivo. Con diagnóstico de probable infección urinaria se otorga alta con tratamiento antibiótico (ATB). Vuelve a consultar a las 48 horas, con mal aspecto general, febril, taquicárdica, hipotensa. Abdomen distendido, doloroso a la palpación. Con planteo de shock séptico se realiza oxigenoterapia, carga de volumen y antibióticos.
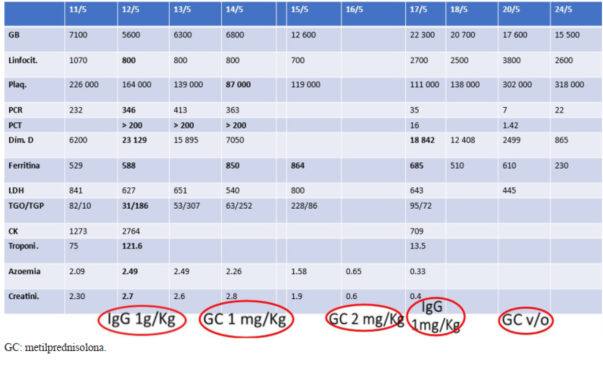
De los exámenes se destaca: acidosis metabólica, glóbulos blancos 7.100/mm3, polimorfonucleares 5.230/mm3, linfocitos 1.070/mm3. Plaquetas 226.000/mm3. PCR: 232 mg/l. Azoemia 2,09 g/l, Creatininemia 2,3 mg/dl. Dímeros D 6.200 mg/dl. Ferritina 529 ng/ml. LDH: 841 U/L. CPK total 1.273 U/L, CPK MB: 24 ng/ml. Troponinas 75 pg/ml. Amilasemia 50 U/L. Ecocardiograma: taquicardia sinusal de 180 cpm durante todo el estudio. FEVI 55%. Se descarta hipertensión pulmonar. Tomografía de abdomen: distención marcada de intestino delgado con niveles en la luz. Antígeno para SARS-CoV-2: no reactivo.
Teniendo en cuenta la alta circulación viral de SARS-CoV-2, la clínica y los elementos de hiperinflamación sistémica, se plantea probable SIM-PedS. Se realiza inmunoglobulina intravenosa (IGIV) a 1 g/kg, previa extracción de serología para SARS-CoV-2, enoxaparina 1 mg/kg cada 12 horas y se traslada a UCIP.
Al ingreso a UCIP se destaca paciente con mal estado general, febril, FC 185 cpm, hipotensa, polipneica, SaO2 85% con catéter nasal a 2 l/m, abdomen distendido, doloroso, ruidos hidroaéreos (RHA) ausentes, con residual porráceo por sonda nasogástrica (SNG). Se plantea fallo orgánico múltiple secundario a shock séptico a punto de partida enteral o SIM-PedS. Se realiza sostén de las funciones vitales, triple plan antibiótico (ampicilina + gentamicina + metronidazol) y se mantiene la enoxaparina. Se confirma infección previa por SARS-CoV-2 (IgG reactivo e IgM negativo). En la (Tabla 1) se muestran los exámenes y el tratamiento instituido. Estabilización hemodinámica y respiratoria en las primeras 24 horas. Agrega deposiciones líquidas a las 48 horas, con mejoría de la distensión abdominal. Cultivos (hemocultivo, urocultivo, cultivo de secreciones y de líquido cefaloraquídeo) negativos, por lo que se suspenden ATB.
Discusión
Este caso clínico se presentó como en otros países, luego de un ascenso exponencial de casos de COVID-19 en Uruguay, lo que respalda una asociación temporal entre la infección por SARS-CoV-2 y el SIM-PedS1-8.
La enfermedad se presenta 2-6 semanas después de la infección por SARS-CoV-25. Como ocurrió en la paciente, puede estar ausente el antecedente de infección9.
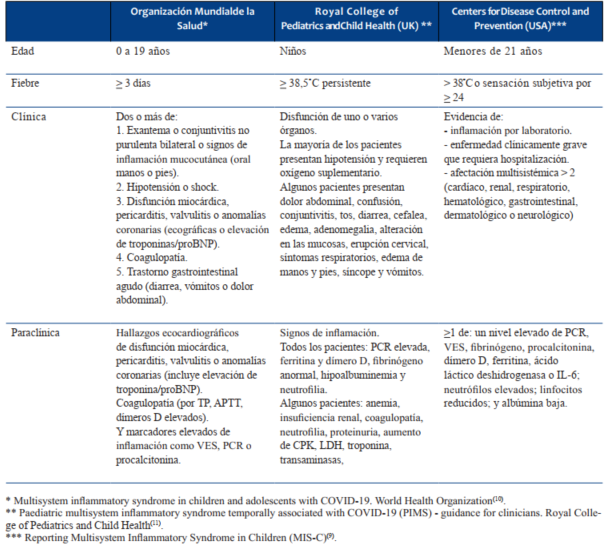
Los pacientes con SIM-PedS se presentan con fiebre persistente y una variedad de síntomas y signos que traducen afección multiorgánica, con marcadores de inflamación elevados9. Los criterios diagnósticos se muestran en la (Tabla 2).
La fiebre y la taquicardia son signos cardinales, estando presentes en más del 90%8. Los síntomas gastrointestinales son frecuentes1,8-12. Dentro de los mecanismos implicados se postula la isquemia intestinal secundaria a vasculitis de vasos intestinales. La rápida resolución de los síntomas luego del tratamiento con inmunoglobulina intravenosa apoya esta hipótesis12. En esta paciente, se destaca dentro de los síntomas gastrointestinales un importante íleo paralítico dado por la distensión abdominal, los RHA ausentes, el residual porráceo por la SNG, con una imagen tomográfica compatible con dicho planteo.
Se clasificó el SIM-PedS en tres fenotipos: shock, Kawasaki like y no Kawasaki/ no shock/ no síndrome de activación macrofágica5. Nuestra paciente se presentó con fenotipo shock.
Ante la ausencia de antecedente de infección, es fundamental extraer sangre para la realización de serología para SARS CoV-2 previo a la administración de inmunoglobulina. La mayoría de los pacientes (87%) con SIM-PedS, se presenta con serología positiva y un 32% tienen una prueba para RT-PCR positiva, lo que sugiere que este síndrome puede ser posinfeccioso y no relacionado con una infección aguda temprana7,8.
Las características del laboratorio son: linfopenia con neutrofilia, trombocitopenia, anemia leve y marcadores de infamación elevados (VES, PCR, procalcitonina, dímeros D, fibrinógeno, ferritina e IL-6). Los marcadores cardíacos como troponina y péptido natriurético pueden estar elevados aún sin compromiso cardíaco importante, como ocurrió en la paciente. Los marcadores de inflamación usualmente se correlacionan con la severidad de la enfermedad3-6,7-13. Los hallazgos ecocardiográficos característicos, cuando están presentes, son: disfunción del ventrículo izquierdo, anormalidades de las arterias coronarias (dilatación y/o aneurismas) y derrame pericárdico3-13.
Es importante la diferenciación entre infección aguda por COVID-19 con hiperinflamación y SIM-PedS. Si bien el “estado de hiperinflamación” es característico de la COVID-1913 tanto en infección aguda como en postinfecciosa (SIM-PedS), en este último está recomendado el tratamiento con inmunoglobulina5.
Los objetivos del tratamiento son disminuir la inflamación sistémica y restaurar la función de los órganos, con el fin de disminuir la morbimortalidad y reducir el riesgo de secuelas. El tratamiento deberá guiarse por el fenotipo del paciente, hasta contar con mayor evidencia en las recomendaciones terapéuticas. Las recomendaciones actuales se basan en la extrapolación de otros síndromes similares y constituyen en la mayor parte opiniones de expertos4,7,14.
El tratamiento inmunomodulador con IGIV y/o glucocorticoides son considerados agentes de primer nivel con la evidencia disponible a la fecha14.
Cuando no existe riesgo de vida, se recomienda confirmar el diagnóstico de SIM-PedS previo al inicio del tratamiento inmunomodulador14. Ante la existencia de riesgo vital, como el caso clínico reportado, se puede iniciar un tratamiento inmunomodulador antes de completar la evaluación diagnóstica, ya que podrían beneficiarse14.
En pacientes con fenotipo Kawasaki like se recomienda el tratamiento con altas dosis de inmunoglobulina intravenosa (2 g/kg)5-7. Dado los resultados favorables en niños con SIM-PedS con otros fenotipos, también se sugiere dicho tratamiento (1-2 g/kg) por sus posibles efectos inmunomoduladores, como también se ve en el síndrome de shock tóxico7. En esta paciente con fenotipo shock se realizó IGIV a 1 g/kg en forma precoz. En aquellos niños que no respondan a la primera dosis de IGIV, puede administrarse una segunda dosis5. La paciente reportada recibió una segunda dosis de IGIV a 1 g/kg por aumento de dímeros D y persistencia de ferritina elevada.
El tratamiento con corticoides debe considerarse en forma precoz ante descompensación hemodinámica, fenotipo Kawasaki like de alto riesgo (menores de 1 año o con anomalías en las arterias coronarias) o pacientes con fenotipo de síndrome de activación macrofágica. En estos casos se recomienda el tratamiento con metilprednisolona i/v en forma concomitante con la gammaglobulina, a dosis de 10-30 mg/kg/día x 3 - 5 días. Se ha sugerido también, dosis menores: 1-2 mg/kg/día5,13-15.
En aquellos pacientes con SIM-PedS hemodinamicamente compensados, se debe considerar el uso de esteroides cuando no respondan a la IGIV y se encuentren aún activos (persistencia o reaparición de fiebre, signos mucocutáneos, abdominales o persistencia de reactantes de fase aguda elevados)5-13. En estos pacientes se recomienda el uso de dosis bajas a moderadas (1-2 mg/kg/día)14. En el caso clínico reportado, cuando se confirmó la infección previa por SARS-CoV-2 y por lo tanto se planteó el diagnóstico de SIM-PedS, la paciente se encontraba hemodinámicamente compensada. Se decide realizar metilprednisolona debido a que los reactantes de fase aguda se mantenían elevados y se optó por la conducta sugerida para pacientes estables en lo hemodinámico, realizándose a 1 mg/kg, que a las 48 horas se aumenta a 2 mg/kg por reaparición de la fiebre.
Se sugiere realizar el descenso gradual de corticoides para evitar la reactivación de la inflamación5-14.
En pacientes que se presenten con fenotipo Kawasaki like, trombocitosis (> 450.000/mm3) o que desarrollan aneurismas, se recomienda el uso de ácido acetilsalicílico13.
En el SIM-PedS, existe un estado procoagulante6 por lo que se recomienda el uso de heparina de bajo peso molecular (HBPM) a una dosis que se ajustará al riesgo de trombosis de cada caso. La paciente presentó alto riesgo de trombosis (estado crítico, hiperinflamación: PCR > 150 mg/l, dímero D > 1.500 ng/ml, ferritina > 500 ng/ml) por lo que se administró a dosis anticoagulante16.
El shock generalmente es de causa multifactorial (hipovolemia, vasoplejia y disfunción cardíaca)6. La hipotensión en niños con SIM-PedS a menudo es resistente a fluidoterapia, por lo que generalmente se requieren inotrópicos y/o vasopresores. Se recomienda iniciar la fluidoterapia con soluciones cristaloides balanceadas: bolos de 10-20 ml/Kg hasta 40-60 ml/kg. El uso de adrenalina o noradrenalina está supeditado al perfil hemodinámico del paciente, con mayor extensión en el uso de adrenalina en los casos de shock frío y de noradrenalina en los de shock caliente. De existir disfunción miocárdica se recomienda un inotrópico1,6,16-18.
Debido a que la infección bacteriana grave es uno de los diagnósticos diferenciales más frecuentes, se recomienda el tratamiento empírico con antibióticos hasta disponer de los cultivos5.
Conclusiones
Debemos mantener alta sospecha diagnóstica mientras exista circulación viral, sabiendo que su incidencia es baja y existe gran variabilidad en su forma de presentación.
Es importante considerar diagnósticos diferenciales con enfermedades con presentación clínica similar.
Aunque existe una superposición clínica con otras afecciones de la infancia, como la enfermedad de Kawasaki y el síndrome de shock tóxico, se desconoce la efectividad de utilizar una estrategia de manejo similar para esta novel afección inflamatoria emergente. Urge la necesidad de estudios controlados doble ciego para valorar la eficacia real del tratamiento.