Introducción
La sepsis neonatal precoz se define como la que se manifiesta en las primeras 72 horas de vida. Es una importante causa de morbilidad y mortalidad neonatal.
Su diagnóstico se basa principalmente en la presencia de factores de riesgo como la corioamnionitis y la edad gestacional (EG). Los signos clínicos son inespecíficos y los exámenes paraclínicos disponibles actualmente, como los reactantes de fase aguda (proteína C reactiva y procalcitonia) tienen escaso valor predictivo positivo.
Es de las principales causas por las que se indican antibióticos. Se cuenta actualmente con información científica de elevada calidad que propone la asociación entre el uso de antibióticos en el período neonatal con la alteración en la adquisición de microbiota intestinal con efectos a corto plazo (enterocolitis necrotizante, broncodisplasia pulmonar y muerte), y a largo plazo (obesidad, enfermedades autoinmunes, diabetes tipo 2).
Existe además el concepto de que el hemocultivo tiene baja sensibilidad, por lo que frecuentemente y aún con un resultado negativo, se mantiene el tratamiento antibiótico.
En un estudio retrospectivo de un período de 25 años, la sepsis se confirmó en 109 de 5.313 recién nacidos (RN), 97% de los cuales tenían 3 factores de riesgo: prematurez, rotura prematura y prolongada de membranas y corioamnionitis1. Los hemocultivos fueron positivos entre las 36-48 horas. Los autores concluyen que la decisión de iniciar o finalizar el tratamiento con antibióticos se puede basar en la presencia de los factores de riesgo y en el resultado del hemocultivo2-4.
Incidencia
La incidencia de sepsis neonatal es inversamente proporcional a la EG.
La incidencia reportada a nivel internacional según la EG es de 0,5 cada 1.000 nacidos vivos con EG mayor o igual a 37 semanas, 6 cada 1.000 en menores de 34 semanas y 2 cada 100 en menores de 29 semanas3,4.
En Uruguay, en un estudio descriptivo, retrospectivo, sobre la incidencia y características clínicas de sepsis neonatal precoz por Streptococcus β hemolítico del grupo B (SGB) en RN del Centro Hospitalario Pereira Rossell de Uruguay, durante los años 2007 y 2015, a partir de una cohorte de 66.075 nacidos vivos, la incidencia reportada fue de 0,23 por 1.000 recién nacidos vivos (RNV), similar a la incidencia en centros donde se realiza quimioprofilaxis5.
Etiología
Los microorganismos considerados como frecuentes son Streptococcus del grupo B (SGB), Escherichia coli (E. coli) y Listeria monocytogenes.
Si analizamos la etiología según la EG en los RN pretérmino menores de 34 semanas, E. coli representa el 50%, seguido de SGB con el 20%, especies de Candida menos del 1%. En los RN de término o pretérminos tardíos, el SGB es el agente más frecuentemente encontrado (40%-45%), seguido de E. coli en un 10%-15%3,4.
Factores de riesgo
Corioamnionitis
Uno de los grandes cambios en los últimos años es la redefinición del concepto de corioamnionitis, considerada como el principal factor de riesgo para la sepsis precoz. Ésta puede ser histológica o clínica. La corioamnionitis histológica es una inflamación limitada a las capas de corion y amnios de las membranas fetales. Sin embargo, esta descripción histológica ha evolucionado hasta convertirse en un término genérico comúnmente utilizado para describir un grupo heterogéneo de afecciones que incluyen inflamación estéril (es decir, no infecciosa) de membranas materno-fetales, invasión microbiana del espacio intrauterino de diversos grados de gravedad, afectación fetal y en algunos casos, simplemente la presencia de fiebre materna durante el parto.
Clásicamente se definió corioamnionitis clínica la presencia de fiebre materna mayor a 38 grados acompañada de otros dos elementos clínicos o paraclínicos: irritabilidad uterina, taquicardia materna, taquicardia fetal, fetidez del líquido amniótico y leucocitosis materna mayor 15.000/mm3. Desde 2015 surge un nuevo concepto de corioamnionitis: “Inflamación intrauterina, infección o ambas (triple I)” destacándose que la inflamación no siempre es igual a la infección.
La fiebre materna documentada de forma adecuada es aquella medida a nivel bucal mayor o igual a 39°C (en una lectura) o temperatura bucal mayor o igual a 38°C y menor de 39°C (en dos lecturas con 30 minutos de diferencia)6,7.
El término “fiebre materna aislada” también se presenta actualmente como una entidad distinta del triple I y puede ser secundaria no sólo a infección sino a anestesia epidural, deshidratación, exceso de calor ambiental u otras causas no infecciosas.
Se considera “Inflamación intrauterina, infección o ambas (triple I)” la presencia de fiebre materna sin una fuente clara y cualquiera de los siguientes: taquicardia fetal mayor a 160 cpm por 10 minutos o más, recuento de glóbulos blancos maternos mayor de 15.000/mm3 en ausencia de tratamiento con corticoesteroides la última semana, o secreción de fluido purulento por el orificio cervical. No deben considerarse para el diagnóstico clínico ni la taquicardia materna ni la irritabilidad uterina.
El concepto de triple I confirmado se cumple cuando están presentes los criterios de sospecha triple I y hallazgos de laboratorio sugestivos de infección en líquido amniótico (tinción de Gram positiva para bacterias, glucosa en líquido amniótico baja, recuento alto de glóbulos blancos en ausencia de sangre en el líquido amniótico, o resultados positivos del cultivo de líquido amniótico). La triple I confirmada es cuando hay evidencia histopatológica de infección o inflamación, o ambos, en la placenta, las membranas fetales o los vasos del cordón umbilical. En la (Tabla 1) se resumen las características estas entidades. Dado que estas pruebas a menudo no se realizan o sus resultados no están disponibles hasta después del parto, se espera que en la gran mayoría de los casos, la triple I se encuentre en la categoría de sospecha.
Edad gestacional
La EG es uno de los predictores más importantes de sepsis precoz. Las estrategias de estratificación de riesgo no se pueden aplicar a los RN prematuros de la misma manera que los RN de término.
Rotura de membranas ovulares
La relación entre la rotura prematura de membranas y el riesgo de sepsis precoz no se describe simplemente por su aparición o duración, sino por la asociación con otros factores de riesgo como la EG, presencia adicional de corioamnionitis clínica, y la administración de antibióticos3,4.
Colonización materna por Streptoccocus grupo B
El SGB emergió como la principal bacteria causante de sepsis precoz en 1970, y subsecuentes estudios identificaron la colonización materna por SGB como el principal factor de riesgo para sepsis precoz por SGB. La etiopatogenia más aceptada para la sepsis precoz por SGB es la colonización ascendente de la cavidad uterina por SGB que se encuentra presente en la flora gastrointestinal y genitourinaria materna. La infección se da en el feto por colonización del mismo e infección invasiva y/o aspiración fetal del líquido amniótico infectado.
La colonización materna es un requisito necesario para el desarrollo posterior de sepsis precoz por SGB. Los autores de un reciente metaanálisis estiman que globalmente, la colonización materna por SGB fue detectada a nivel vaginal o rectal en 18% de las mujeres embarazadas8.
En un estudio realizado por Laufer tomando una muestra de 300 gestantes de la maternidad del CHPR en un período de 2008, se calculó una prevalencia similar de colonización, siendo su valor 17,3%9.
En ausencia de inflamación intraamniótica y sin profilaxis antibiótica aproximadamente 50% de los RN hijos de madres portadoras de SGB son colonizados, pero solamente 1%-2% de esos van a desarrollar sepsis precoz por este patógeno8,10.
Evaluación paraclínica
Como ya fue mencionado anteriormente, el diagnóstico de sepsis neonatal precoz se basa principalmente en factores de riesgo. Los signos clínicos son inespecíficos y los exámenes paraclínicos disponibles como los reactantes de fase aguda (proteína C reactiva y procalcitonia) tienen escaso valor predictivo positivo.
Hemocultivo
Schelonka y colaboradores demostraron que la sensibilidad de los HC se aproxima al 100% cuando se inocula 1 ml y el neonato tiene una bacteriemia de al menos 4 UFC por ml. Un HC correctamente realizado (aquel que toma 1 ml de sangre en un tubo con medio enriquecido pediátrico), con las técnicas actuales para el análisis de HC, tiene una excelente sensibilidad aún con bajos conteos de bacterias (1-4 UFC/ml), muy inferior a la concentración media de una sepsis neonatal (>100 UFC/ml)11,12.
En la guía IDSA de 2018 sobre la utilización de las técnicas microbiológicas para el diagnóstico de enfermedades infecciosas se sugiere la realización de HC con un volumen de al menos 2 ml para detectar bacteriemias de muy bajo grado (definidas como 1,1 a 10 UFC/ml); e idealmente la realización de dos HC, uno para microorganismos anaerobios y otro para aerobios (de al menos 1 ml de volumen de sangre). En estos casos, 1 ml puede detectar 5 UFC hasta en 99% de los casos. Sin embargo, un volumen inadecuado puede dar hasta 50% de falsos negativos, por lo que la recomendación en la recolección de al menos 1 ml de sangre, idealmente 2 ml13.
Reactantes de fase aguda
Como reactantes de fase aguda a solicitar, la NICE en su revisión en 2016 sugiere proteína C reactiva (PCR), basado en un estudio prospectivo en el cual con una única medición de PCR a las 18 horas de vida se identificaron aquellos RN que por riesgo de sepsis habían iniciado antibióticos, para una posterior y segura suspensión de estos dado su alto valor predictivo negativo.
La sensibilidad y especificidad de la determinación de PCR a las 18 horas para sepsis precoz seria de 64% (IC95% 56%-73%) y de 56% (IC95% 53%-59%) respectivamente. El valor predictivo negativo (VPN) fue de 93% (IC95% 91%-95%) y el valor predictivo positivo (VPP) fue de 14% (IC95% 11%-17%).
Dada el bajo valor predictivo positivo no es un parámetro que deba ser tomado de forma aislada para el diagnóstico de sepsis neonatal precoz, aunque un resultado con valores normales a las 18 horas permite descartar la presencia de infección14.
No se recomienda actualmente la realización de procalcitonina (PCT), dado que su elevación fisiológica en los primeros días de vida parece relacionarse sobre todo con la situación de estrés desencadenada por el parto y la adaptación al ambiente extrauterino.
Hemograma
Sigue siendo el análisis de laboratorio más solicitado frente a la sospecha de sepsis neonatal.
El recuento de glóbulos blancos buscando la presencia de leucocitosis o leucopenia es de poca utilidad clínica, pero con la combinación de análisis del número total de neutrófilos, número de neutrófilos inmaduros y el cociente entre el número de inmaduros sobre el número total de neutrófilos (relación I/T) constituye un parámetro de laboratorio muy útil.
Una sola determinación de la relación I/T tiene un valor predictivo positivo pobre (aproximadamente 25%) pero una muy alto valor predictivo negativo, que llega a 99%.
Debemos recordar que la leucopenia puede estar presente por complicaciones frecuentes, como estados hipertensivos del embarazo y asfixia. A su vez, la definición de leucopenia o neutropenia depende de la edad gestacional y la vía de nacimiento, entre otros factores. La definición más aceptada es la de Manroe y colaboradores3,4.
Hornik y colaboradores, basados en un estudio que incluyó 166.902 neonatos, concluyeron que el recuento bajo de glóbulos blancos, el recuento absoluto de neutrófilos y la alta relación de neutrófilos inmaduros a totales se asociaron con mayores probabilidades de infección, pero ningún índice derivado del recuento sanguíneo completo posee la sensibilidad para descartar sepsis precoz confiable en RN. La presencia de leucopenia en presencia de sepsis neonatal precoz se asocia a mayor riesgo de mortalidad.
También está descrita la disminución del número de plaquetas, trombocitopenia menor de 150.000/mm3 en neonatos con sepsis precoz, pero no tiene la sensibilidad del número de glóbulos blancos.
Los resultados del hemograma permiten identificar alteraciones frecuentes en el RN como anemia, poliglobulia, plaquetopenia no infecciosa por lo cual el hemograma es una herramienta importante y de bajo costo para la adecuada atención del RN independientemente de su utilidad para el diagnóstico de infección.
Los valores de sensibilidad, especificidad, con su respectivo valor predictivo positivo y negativo se resumen en la (Tabla 2).
Punción lumbar
La incidencia de meningitis es mayor en los RN pretérminos (aproximadamente 0,7 casos por cada 1.000 RNV de 22-28 semanas de EG) comparado con la incidencia de meningitis en todos los nacimientos (aproximadamente 0,02-0,04 casos por cada 1.000 RNV).
Para todos los casos de sepsis confirmada con hemocultivo positivo se recomienda la realización de la punción lumbar. También puede justificarse en un RN que aún sin resultado positivo del hemocultivo, se encuentra críticamente enfermo o con síntomas compatibles de meningitis3,4,15.
Signos clínicos
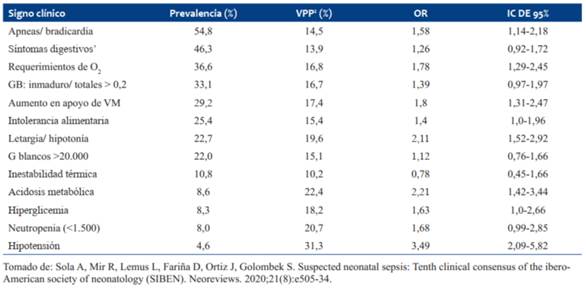
Los signos clínicos de sepsis son un indicador mucho más sensible de sepsis neonatal de inicio precoz que los parámetros de laboratorio. Se ha demostrado que la sepsis neonatal precoz es de 0,21:1.000 en RN asintomáticos con antecedentes de riesgo, de 2,6:1.000 en aquellos en que el examen físico es dudoso, y esta cifra asciende a 11:1.000 cuando hay enfermedad clínica en el examen15) Los signos clínicos y su valor predictivo positivo se muestran en la (Tabla 3).
Guías clínicos para la atención de recién nacidos con riesgo de sepsis neonatal
Ninguna estrategia identifica inmediatamente todos los RN que desarrollan sepsis precoz o evita el tratamiento de un gran número de RN en los cuales posteriormente no se confirma infección. Es de gran importancia desarrollar estrategias institucionales.
En base a la última evidencia y recomendaciones de expertos surgen las siguientes recomendaciones para el manejo actual.
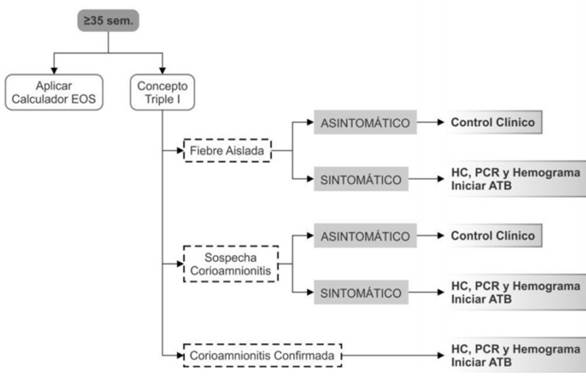
1. Edad gestacional mayor o igual a 35 semanas
Existen tres diferentes aproximaciones posibles, aunque todas se basan en la presencia de clínica compatible y/o factores de riesgo, entre ellas la evaluación de riesgos multivariada: calculador de sepsis precoz (Early Onset Calculator).
Este calculador incluye una síntesis individualizada de factores de riesgo en el RN evaluando conjuntamente su estado clínico para estimar el riesgo de sepsis precoz, se recolectan datos del nacimiento y de la evolución clínica del RN a las 6-12 horas del nacimiento.
Los datos incluidos son: horas de vida, la incidencia de sepsis precoz del centro (0,3:1.000 RN vivos en el CHPR), EG, la mayor temperatura intraparto materna, el estado de colonización para SGB materno, la duración de las membranas rotas, y el tipo y duración de antibióticos utilizados intraparto.
Surgiendo como resultado las posibles recomendaciones según el riesgo de sepsis para ese RN: si el RN tiene un riesgo estimado de sepsis mayor igual a 1 por cada 1.000 nacidos vivos se recomienda la extracción de hemocultivo y observación clínica por 48 horas. Ante riesgos menores se recomienda la observación clínica. Los RN con un riesgo estimado mayor o igual a 3 por cada 1.000 nacidos vivos se recomienda la toma de hemocultivo e iniciar el tratamiento antibiótico empírico3.
También consideramos adecuado en base a la evidencia actual, además de la realización del hemocultivo previo al inicio de tratamiento, realizar a las 18 horas de vida el hemograma y la PCR por su valor predictivo negativo, siendo de ayuda para la posterior suspensión de los antibióticos. El volumen del hemocultivo se adecuará al peso del RN.
En la (Figura 1) se presenta una propuesta de aproximación en RN de 35 semanas o mayor EG incorporando el concepto de la triple I o través del calculador de sepsis siempre y cuando el control clínico del RN pueda ser garantizado.
2. Edad gestacional menor a 35 semanas
El abordaje en este grupo se realiza en base a la estratificación por riesgo, como se muestra en la (Figura 2).
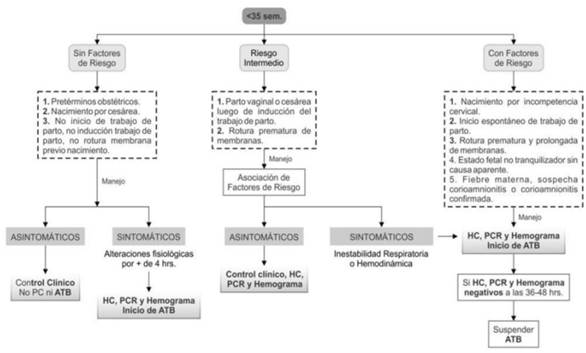
Figura 2: Manejo del recién nacidos menores de 35 semanas de edad estacional. HC: hemocultivo; PCR: proteína C reactiva; ATB: antibióticos.
Se consideran RN de bajo riesgo aquellos prematuros cuyo nacimiento se debe a una causa obstétrica (estados hipertensivos del embarazo, restricción del crecimiento, etc.) sin elementos clínicos atribuibles a infección connatal.
Pero ante la persistencia de signos clínicos que persisten más de cuatro horas o no responden a las medidas terapéuticas instauradas según lo esperado deben ser considerados como elementos de sospecha de sepsis connatal, y estos RN pasarían a tener un riesgo aumentado de sepsis precoz.
En el caso de los RN menores de 35 semanas considerados con factores de riesgo o que se presenta con clínica compatible de sepsis, se aconseja la realización de HC previo al inicio de antibióticos y a las 18 horas de vida realizar hemograma y PCR4,16,17.
Tratamiento
El tratamiento empírico se basa en la combinación de gentamicina con ampicilina. Esta combinación es efectiva contra SGB, la mayoría de los estreptococos, enterococos y L. monocytogenes. Aunque dos tercios de las especies de E. coli aisladas en la sepsis precoz son resistentes a la ampicilina, la mayoría continúan siendo sensibles a la gentamicina.
La duración del tratamiento antibiótico dependerá de la evolución clínica, así como del resultado del hemocultivo
En RN inicialmente asintomáticos, quienes por la presencia de factores de riesgo tenían indicación de inicio de antibióticos, luego de obtener HC negativo se suspenderá el tratamiento.
En el caso de RN sintomáticos, sin mejoría clínica, pero con HC negativo, evaluar la posibilidad de diagnósticos diferenciales cómo la sepsis viral u otras patologías
En caso de HC positivo, la duración del tratamiento dependerá de si asocia meningitis y del germen
¿Cuál es nuestro desafío?
- Identificar rápidamente los RN con alta probabilidad de sepsis e iniciar inmediatamente la terapia antimicrobiana.
- Distinguir los RN de alto riesgo asintomático y aquellos con signos clínicos que no requieren que se haga ningún estudio de laboratorio ni que se inicie tratamiento antibiótico.
- Distinguir los RN de alto riesgo con signos clínicos que requiere evaluación clínica detallada y hemocultivo, pero que no requieren que se inicie tratamiento empírico antibiótico.
- Suspender los antibióticos una vez que se considera descartada la sepsis.