Objetivo
Describir un caso clínico de sepsis neonatal precoz y sus complicaciones, ocurrido en la maternidad del Hospital Las Piedras.
Los autores cuentan con la autorización de la familia para la publicación del caso clínico así como para mostrar la fotografía que está en la publicación.
Introducción
La sepsis neonatal es una causa importante de morbimortalidad en los recién nacidos. Con la introducción de la profilaxis antibiótica durante el trabajo de parto, la incidencia y epidemiología de la sepsis neonatal ha ido cambiando. A nivel mundial se estima que 20%-30% de las embarazadas son portadoras de estreptococo grupo B (EGB) o Streptococcus agalactiae, en nuestro país la tasa de colonización vaginal en embarazadas a término era de 3,9% en un estudio realizado en 1978, sin encontrar datos nacionales más recientes1-3.
La incidencia de sepsis neonatal, según un trabajo realizado en Chile, es de aproximadamente 23/1.000 nacidos vivos, la de meningitis 3/1.000. La sepsis precoz por EGB, aquella que se produce en las primeras 72 h de vida, alcanza 31,5%, en la sepsis tardía representa 6,6%; este germen es responsable de 5%-20% de las muertes en países desarrollados y de un alto porcentaje de secuelas entre los sobrevivientes4. En Estados Unidos la incidencia de enfermedad invasiva por EGB de 0,5 a 1 por 1.000 nacidos vivos1. Según un estudio realizado en el Centro Hospitalario Pereira Rossell en el período 2007-2015 la incidencia de sepsis precoz por EGB fue de 0,23 por 1.000 recién nacidos vivos5.
El Streptococcus agalactiae es un coco Gram positivo, del cual se han identificado 9 serotipos distintos. A pesar de que la incidencia de infección por este germen ha disminuido con el correr de los años, continúa siendo la principal causa de sepsis neonatal; seguido por bacilos Gram negativos como Escherichia coli6,7.
De acuerdo al momento de inicio de la sintomatología, se clasifica como sepsis precoz aquella que se presenta durante los primeros 7 días de vida y sepsis tardía aquella que ocurre luego de la primera semana de vida hasta los tres meses; algunos autores toman como punto de corte las 72 h1,6,8. Se ha visto que la profilaxis antibiótica intraparto es eficaz para la prevención de sepsis precoz por EGB. No se ha demostrado que las estrategias de prevención disminuyan la incidencia de sepsis tardía por EGB2,6.
Este microorganismo coloniza de forma habitual el tracto gastrointestinal inferior y vagina, pudiendo existir portación transitoria, intermitente o crónica; la adquisición o recolonización es frecuente en mujeres sexualmente activas. La transmisión de gérmenes se produce por vía trasplacentaria, durante el trabajo de parto y parto, 1% a 2% de los recién nacidos de madres colonizadas desarrollarán sepsis. La sensibilidad del cultivo rectovaginal a las 36 semanas de gestación para predecir la colonización al momento del parto es de 91% y la especificidad de un 89%1.
El recién nacido es susceptible a este tipo de infecciones debido a la inmadurez que presenta su sistema inmune, esto hace que la infección se disemine con facilidad, generando cuadros clínicos graves, siendo más frecuente aún en prematuros y recién nacidos con bajo peso6.
Caso clínico
Recién nacido, sexo femenino, producto de primera gestación. Madre 20 años, sana, padre 28 años, sano. Embarazo no planificado, captación tardía, bien controlado, mal tolerado por diabetes gestacional, recibió tratamiento con insulina, buen control metabólico, serología para HIV, hepatitis B, Chagas y VDRL en tercer trimestre negativas, no se realizó exudado rectovaginalpara búsqueda de colonización de EGB. Ecografías fetales normales. Madre ingresa a la maternidad en trabajo de parto 6 h previas al nacimiento. Parto vaginal a las 38 semanas de edad gestacional, rotura artificial de membranas 3 h previas al parto, líquido amniótico claro, se recibe recién nacida de sexo femenino, peso al nacer 2.940 g, talla 48 cm, perímetro cefálico 35 cm, adecuada para la edad gestacional, Apgar 9/10. Examen clínico: bolsa serohemática parietooccipital derecha, resto normal. Gasometría de cordón presentó leve acidosis metabólica con pH 7,29, PO2 37 mmHg, PCO2: 43,2 mmHg, HCO3 19, BE: -5, lactato 3.
A las 5 h de vida se constata dificultad en la succión por lo que ingresa a unidad neonatal para alimentación y controles metabólicos, presenta temperatura axilar 37,2°C que disminuye con medidas físicas, sin otras alteraciones clínicas. Se alimenta por succión, clínicamente sin alteraciones metabólicas, con hemoglucotest normales; a las 12 h pasa a alojamiento conjunto.
A las 56 h de vida se constata zona indurada con eritema y rubor en región de muslo izquierdo de 12 por 8 cm aproximadamente (Figura 1), con dolor a la palpación y extensión del miembro, en apirexia. No se evidencia puerta de entrada ni zona de punción. Se destaca tinte ictérico hasta abdomen, resto sin particularidades. Con planteo de celulitis de muslo izquierdo reingresa a unidad neonatal. Se realiza paraclínica infecciosa (Tabla 1), radiografía de cadera y miembro inferior izquierdo (Figura 2). Se inicia vancomicina i/v y analgesia. En la evolución agrega llanto, irritabilidad inconsolable y vómitos, deposiciones normales, en apirexia. Del examen físico se destaca fontanela anterior normotensa, abdomen blando, depresible, sin defensa, moviliza los cuatro miembros. Se traslada a centro de tratamiento intensivo (CTI) para continuar valoración. Permanece en CTI 26 días. Se realizó punción lumbar aproximadamente 12 h después de haber comenzado antibióticos, sin aislarse germen (Tabla 2). Hemocultivo a las 56 h de vida en la maternidad del Hospital Las Piedras y hemocultivo al ingreso a CTI, ambos desarrollaron Streptococcus agalactiae sensible a penicilina. A las 12 h de ingresada en CTI se realizó drenaje quirúrgico de articulación de rodilla izquierda que confirma osteoartritis supurada, buena evolución, se aisló Streptococcus agalactiae (Tabla 3). Con planteo de sepsis connatal precoz a Streptococcus agalactiae, con meningitis aguda supurada y osteoartritis de rodilla izquierda, recibe tratamiento de primera línea con ampicilina y gentamicina por 21 días. Requirió intubación orotraqueal (IOT) por 24 h, cargas de volumen e inotrópicos por 48 h. Presentó alteración inicial de la crasis y anemia normocítica normocrómica, por lo que se realizó reposición con plasma y glóbulos rojos. Hidratación parenteral por 72 h, luego aporte vía oral, dada la intolerancia digestiva alta recibió tratamiento con omeprazol y ondansetrón. Examen neurológico normal.
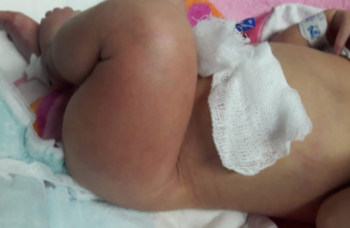
Figura 1: Recién nacido. Sepsis precoz a S. agalactiae. Zona indurada con eritema y rubor en región de muslo izquierdo, a las 56 h de vida.
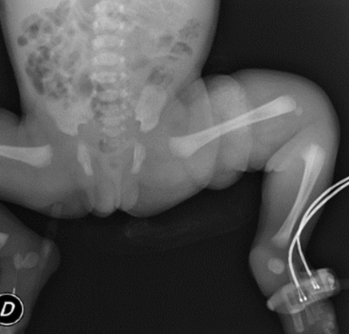
Figura 2: Recién nacido. Sepsis precoz a S. agalactiae. Radiografía de cadera y miembros inferiores, a las 56 h de vida
Tabla 2: Recién nacido. Sepsis precoz a S. agalactiae. Estudio del líquido cefalorraquídeo a las 72 h de vida.
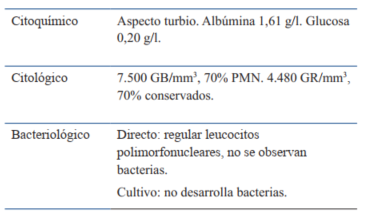
Tabla 3: Recién nacido. Sepsis precoz a S. agalactiae. Estudio de líquido de punción de articulación de rodilla izquierda a las 72 h de vida.

Estudios imagenológicos: ecografía transfontanelar, torácica y abdominal a los 3 días de vida normales, se destaca derrame pleural simple bilateral a predominio izquierdo, resto normal. Se reitera ecografía transfontanelar a los 10 días de vida sin alteraciones. Ecocardiograma Doppler a los 10 días de vida normal. Tomografía de cráneo a los 15 días de vida normal. Radiografía de rodilla a los 20 días de vida: a nivel de fémur distal calcificación de partes blandas de mayor entidad en cara posterior, sin clara evidencia de deformación del periostio, núcleo de osificación femoral desplazado hacia atrás, aumento de la densidad del sector proximal de tibia como se observa en el edema de procesos infecciosos. Resonancia nuclear magnética de cráneo a los 22 días de vida sin alteraciones.
Discusión
La mayoría de las infecciones connatales bacterianas suceden dentro de la primera semana de vida, siendo el mayor porcentaje de diagnósticos en las primeras 48 h 1.
La inmunidad celular y humoral de los recién nacidos no está completamente desarrollada (actividad fagocítica, síntesis de inmunoglobulinas, actividad del complemento, función de los linfocitos), por tal motivo son más propensos a desarrollar infecciones, además de que durante el período intrauterino no existe un estímulo inmunológico significativo que active las reacciones inmunitarias preventivas8.
La importante mortalidad por la sepsis en el neonato está relacionada con la “inmunodeficiencia transitoria” que existe en este periodo de la vida, ya que prácticamente todas las líneas del sistema inmune se encuentran reducidas, tanto en cantidad como en calidad, así como también en forma secundaria, las barreras naturales se encuentran alteradas por la monitorización invasiva y las técnicas terapéuticas que se utilizan en las unidades de cuidados intensivos neonatales8.
Además existen otros factores de riesgo como la prematuridad, y factores de riesgo relacionados con la madre como fiebre materna por corioamnionitis, rotura prolongada de membranas (riesgo aumentado si es mayor a 18 h), exudado vaginorrectal o urocultivo positivo para Streptococcus agalactiae en el embarazo actual2,6,9,10. En el caso que se presenta, como factor de riesgo la paciente no tenía realizado el exudado vaginorrectal.
Con la profilaxis antibiótica durante el trabajo de parto se ha logrado disminuir la transmisión de EGB en aquellas mujeres portadoras, así como en aquellas en las cuales se desconoce la existencia de este microorganismo por no haberse realizado la pesquisa; a pesar de esto continúa presentando una incidencia significativa. Actualmente la profilaxis antibiótica en embarazadas en las cuales se desconoce la situación de colonización bacteriana por no haberse realizado el exudado recto vaginal, está basada en los factores de riesgo previamente mencionados en el texto.
Dentro de las manifestaciones clínicas que presentan los neonatos infectados, las más frecuentes son las respiratorias, seguidas por letargia, ictericia, fiebre, dificultades en la alimentación, distensión abdominal, infecciones osteoarticulares; podemos ver que algunas están presentes en el caso clínico expuesto. Si bien la clínica es inespecífica, se debe tener alto índice de sospecha ante cualquier factor de riesgo y clínica infecciosa en un recién nacido, dada la alta morbimortalidad1,6.
La bacteriemia es un factor de riesgo conocido para meningitis neonatal, se describe en la bibliografía una incidencia de meningitis de 23%. A pesar de esto, un tercio de los casos de meningitis puede ocurrir en ausencia de sepsis. La punción lumbar debe ser realizada en recién nacidos con hemocultivo positivo, en aquellos que presentan clínica o paraclínica sugestiva de sepsis bacteriana y en aquellos que vayan a recibir tratamiento antibiótico, pudiendo diferirse en aquellos que presentan descompensación cardio-respiratoria. El diagnóstico definitivo de sepsis y meningitis requiere el aislamiento del microorganismo en sangre y líquido cefalorraquídeo. En este caso el paciente desarrolló Streptococcus agalactiae en el hemocultivo, presentando clínicamente una meningitis, apoyado este diagnóstico por las características citoquímicas del líquido cefalorraquídeo, sin lograr aislar el germen en el cultivo del mismo, probablemente por el inicio precoz de antibióticos. En estos casos es posible apoyarse también en el laboratorio; una leucopenia y una proteína C reactiva (PCR) elevada son una herramienta importante, sumado a las manifestaciones clínicas, para realizar diagnóstico de probable sepsis4,11.
La osteoartritis séptica es un cuadro grave, relativamente frecuente en pediatría. La rodilla y la cadera son las articulaciones más afectadas, siendo elevado el riesgo de complicaciones. La detección de la infección puede ser difícil, sobre todo en neonatos. En este paciente se planteó inicialmente una celulitis de miembro inferior, realizándose posteriormente diagnóstico de osteoartritis de rodilla izquierda, realizando punción articular y logrando identificar el germen. Según diversos estudios, la osteoartritis séptica es mayormente monoarticular, como ocurrió en este caso. Como factores de riesgo para desarrollar osteoartritis se han identificado la colocación de vías venosas centrales y periféricas, cateterizaciones umbilicales y venopunciones múltiples; no existiendo dichos desencadenantes en este paciente. La evolución sin secuelas depende del diagnóstico y tratamiento precoz, es de gran importancia el alto índice de sospecha clínica y el abordaje quirúrgico temprano, como también el tratamiento ortopédico adecuado12-14.
La asociación de sepsis y meningitis aumenta la mortalidad en un 50% durante la primera semana de vida. En aquellos que presentan meningitis por EGB, se describe persistencia de secuelas neurológicas en un 50%, como hidrocefalia, ceguera, sordera y alteraciones en el neurodesarrollo5,6.
Una vez que se sospecha le existencia de sepsis en un recién nacido es de gran importancia comenzar tratamiento antibiótico empírico, adecuándolo posteriormente de acuerdo al germen y al antibiograma1,5-7,9. En este paciente se inició precozmente tratamiento con vancomicina, rotando posteriormente a ampicilina y gentamicina. La Asociación Americana de Pediatría recomienda para el tratamiento de un recién nacido con infección de inicio temprano por EGB el uso de penicilina G o ampicilina15,16; para las bacterias entéricas Gram negativas, la combinación de ampicilina y aminoglucósidos ha sido utilizada por mucho tiempo, sin embargo se ha detectado resistencia de dichos microorganismos a los aminoglucósidos. El aminoglucósido intraventricular no se usa de rutina, puede ser considerado en caso de ventriculitis obstructiva complicada, aunque su aprobación está en discusión16. Se desconoce la causa por la cual se continuó con ambos antibióticos luego de tener el resultado del antibiograma, ya que la bibliografía recomienda en todos los casos adecuar el tratamiento según germen y resistencia antibiótica. En cuanto a la duración del tratamiento, en este caso fue de 21 días, se recomienda en quienes presenten artritis séptica prolongarlo 3 a 4 semanas15,17.
Este paciente evolucionó favorablemente con el tratamiento realizado, sin presentar secuelas a nivel encefálico según los estudios imagenológicos realizados, recordando que se debe continuar con el seguimiento para detectar posibles alteraciones del neurodesarrollo. A nivel osteoarticular presentaba elementos inflamatorios aún, debiendo permanecer en seguimiento por traumatología y ortopedia.
Conclusión
Si bien luego de la introducción de la profilaxis antibiótica en el preparto la incidencia de infecciones en recién nacidos por Streptococcus agalactiae ha disminuido, aún continúa siendo el mayor responsable de la sepsis connatal precoz, causante de mortalidad neonatal o responsable de secuelas.
















