Introducción
La mejora de las condiciones socioeconómicas en el Uruguay y el desarrollo de políticas inclusivas1 se reflejan en mejores indicadores de salud maternoinfantil, con drástica reducción de la mortalidad infantil (MI) y perinatal. Sin embargo, las malformaciones congénitas, deformaciones y anomalías cromosómicas (MDAC) representan cerca del 3% de la mortalidad infantil, valores que se han mantenido prácticamente constantes en las últimas tres décadas (Figura 1).
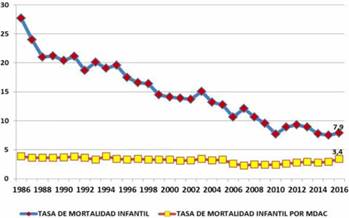
Figura 1: Mortalidad infantil y anomalías congénitas en Uruguay 1986-2016. MDAC: malformaciones, deformaciones y anomalías cromosómicas. Fuente: Elaboración propia. Adaptada del Plan Integral de Defectos Congénitos y Enfermedades Raras del Ministerio de Salud Publica2.
En mayo de 2010 la Organización Mundial de la Salud (OMS), en su 63ª Asamblea Mundial (AMS), aprobó una resolución que exhorta a los Estados miembros a “prevenir defectos congénitos, implementar programas de screening neonatal y de vigilancia de anomalías congénitas, proporcionar apoyo continuo y cuidado a niños con defectos congénitos, así como a sus familias”2,3. La Public Heatlh Genetics Foundation (PHG)en Cambridge, Reino Unido, respondió a dicha resolución creando el Programa Born Healthy (http://www.bornhealthy.org/br.toolkit.bornhealthy/br-pt.htm) y desarrollando el “Toolkit para Anomalías Congénitas”4. Se trata de un conjunto de herramientas versátiles, diseñadas para ayudar a la toma de decisiones basadas en evidencias, relativas a las anomalías congénitas, con el objetivo de desarrollar servicios eficaces para el cuidado y la prevención de estas condiciones. Existe amplia evidencia de la aplicación de esta herramienta en el abordaje de estos problemas5-7. Es importante resaltar que no todas las anomalías congénitas tienen la misma frecuencia e importancia epidemiológica, médica y social. Consideradas globalmente las cardiopatías congénitas (CC), los defectos de tubo neural (DTN), el síndrome de Down (SD), las hemoglobinopatías (HBP) y la deficiencia de 6 fosfato deshidrogenasa (6PDH) son las cinco más frecuentes y representan aproximadamente el 25% de todas ellas8. A propósito de este trabajo consideraremos las tres primeras, ya que en Uruguay no existen antecedentes de screening neonatal para la detección de la 6PDH y los trastornos de hemoglobina aún no se realizan en forma mandatoria y forman parte del plan piloto del Programa Nacional de Pesquisa Neonatal y del Lactante9.
Medidas de prevención primaria de las anomalías congénitas
Existen medidas de prevención primaria bien establecidas para anomalías congénitas, como la vacunación contra la rubéola, el control de la diabetes materna, evitar la exposición durante la gestación a teratógenos conocidos como drogas antiepilépticas, isotretinoína, litio, enfermedades infecciosas, toxoplasmosis, sífilis, citomegalovirus10. Si bien está aun en debate, la obesidad y la ganancia de peso podrían también aumentar el riesgo11. En la literatura existe amplia y contundente evidencia que confirma que el uso preconcepcional del acido fólico (sea por suplementación o por fortificación) reduce significativamente los casos de DTN alrededor del mundo12,13. Sin embargo, aún es controvertido el efecto protector de esta vitamina para las cardiopatías congénitas13-15.
Cardiopatías congénitas
Representan las anomalías congénitas más comunes presentes en el nacimiento. Su prevalencia varía de 5 a 10 por 1.000 nacidos vivos15. Algunos factores pueden influir en su ocurrencia, como la edad materna (asociada a anomalías cromosómicas) y la nutrición materna (por deficiencia de folatos). El fenotipo de las CC es muy variable: desde pequeñas lesiones sin significado clínico hasta condiciones graves y que necesitan intervenciones precoces. Estas últimas requieren una atención de salud específica y pueden comprometer la capacidad física y la expectativa de vida de los recién nacidos afectados porque estarán presentes a lo largo de su vida15. Aproximadamente el 50% de los recién nacidos con CC necesitan cirugía inmediatamente después del nacimiento. Otros pueden necesitarla en algún momento durante la infancia o más tardíamente además de la medicación cardiológica16.
Síndrome de Down
El SD o trisomía 21 ocurre cuando el feto hereda una copia extra del cromosoma 21 que produce mayor morbimortalidad a corto y largo plazo. Los niños con SD tienen deficiencia cognitiva y física, que puede variar en gravedad dependiendo del cuidado posnatal. La mayoría de los casos son por trisomía 21 libre (95%) y la edad materna avanzada (>35 años) es su mayor factor de riesgo. La prevalencia del nacimiento varía globalmente entre 1-5/10.000 nacidos vivos17, o más frecuentes 1,2-2,3/100016.
Defectos del tubo neural
Son malformaciones congénitas del sistema nervioso central (SNC), producidas por el cierre incompleto del tubo neural durante el período embrionario. Se clasifican en espina bífida, encefalocele y anencefalia. Esta última es incompatible con la vida posnatal. La mayoría de los DTN son aislados, pero también pueden estar presentes frecuentemente en algunos síndromes. La revisión sistemática realizada por Zaganjor y colaboradores18 demuestra gran variabilidad alrededor del mundo en las estimaciones de prevalencia de 0,3-199,4 por 10.000 nacimientos. La etiología de los DTN aislados es multifactorial, y la deficiencia de folato materno se considera el factor de riesgo más importante. El riesgo de recurrencia es aproximadamente 4%-5%19. El uso durante la gestación de ácido valproico y carbamazepina, así como la diabetes materna, pueden aumentar el riesgo. El tratamiento precoz durante el período perinatal y neonatal disminuye la mortalidad precoz asociada a esta anomalía congénita. Los niños que sobreviven pueden no presentar ninguna secuela o presentar deficiencias motoras y cognitivas graves16.
Las estrategias más adecuadas para la evaluación de las necesidades de salud de la población relacionadas con las CC, SD y DTN, apuntan a la reducción de la prevalencia, la morbilidad y la mortalidad, teniendo en cuenta el curso de vida, focalizado a la prevención. Su empleo permite visualizar el impacto de las intervenciones.
Objetivos
El objetivo de este trabajo fue analizar las anomalías congénitas más frecuentes en Uruguay entre 2011 y 2014 y evaluar posibles factores de riesgo al compararlos con el total de los nacimientos en ese período.
Material y método
El presente trabajo utilizó el kit de herramientas para evaluar las necesidades en salud para las anomalías congénitas de la Fundación PHG16. Se seleccionaron las tres anomalías congénitas consideradas más frecuentes en Uruguay.
Se trató de un estudio transversal descriptivo de los nacimientos ocurridos en el país entre el 1 de enero de 2011 hasta el 31 de diciembre de 2014, con datos disponibles en dos fuentes principales:
- Estadísticas Vitales del Ministerio de Salud de Uruguay20) (disponible en: http://colo1.msp.gub.uy/redbin/RpWebEngine.exe/Portal?lang=esp); las tasas de natalidad por institución y departamento fueron obtenidas a través de ese sistema de información, que opera a través del Certificado de Nacido Vivo y el Certificado de Defunción de Uruguay, tanto en su formato electrónico (la gran mayoría) como en papel.
- Registro Nacional de Anomalías Congénitas y Enfermedades Raras (RNDCER)21. Se seleccionaron las notificaciones al RNDCER, codificadas de acuerdo con la Clasificación Internacional de Enfermedades y Problemas relacionados Salud (CID-10), capítulo 17: malformaciones congénitas deformidades y anormalidades cromosómicas (Q00-Q99). De estos analizamos: a) malformaciones congénitas del sistema circulatorio: Q20-Q28; b) síndrome de Down: Q90; c) defectos del tubo neural: Q00: anencefalia y malformaciones congénitas similares; Q01: encefalocele; Q05: espina bífida.
Las variables estudiadas fueron: a) edad gestacional; b) control prenatal; c) duración de la gestación en semanas; d) edad materna; e) peso al nacer; f) sexo; g) la puntuación de Apgar; h) lugar del parto.
Los criterios de inclusión para el mal resultado perinatal fueron: peso al nacimiento <2.500 g; depresión neonatal Apgar <7 en el primero y/o quinto minuto; edad gestacional <37 semanas.
Plan de análisis estadístico: empleamos epidemiología descriptiva para el análisis de los datos, se incluyeron medias, desviación estándar, tasas de nacidos vivos y muertes fetales, a partir de las fuentes de datos ya mencionadas.
Resultados
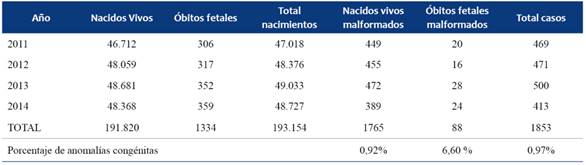
El número total de nacidos en Uruguay en el período de 2011 a 2014 fue de 193.154, siendo 191.820 vivos y 1.334 muertes fetales. Se notificaron al RNDCER en ese período 1.853 (0,97%) anomalías congénitas, de las cuales 1.765 (0,92%) correspondieron a nacidos vivos y 88 (6,6%) a óbitos fetales (Tabla 1).
Tabla 1: Condición de nacimiento de los casos notificados al Registro Nacional de Defectos Congénitos y Enfermedades Raras-RNDCER entre 2011 y 2014.
La (Figura 2) ilustra claramente cómo prácticamente la mitad, el 46% (812/1765) de las notificaciones recibidas de nacidos vivos en el período analizado, corresponden con el grupo seleccionado. Para los óbitos con malformaciones, este porcentaje fue ligeramente inferior al 43,18% (38/88).
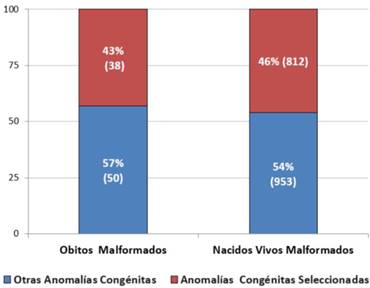
Figura 2: Frecuencia de las anomalías congénitas seleccionadas notificadas al RNDCER, de acuerdo con su condición de nacimiento entre 2011-2014.
Las anomalías seleccionadas reportadas al RNDCER (CC, DTN, SD) representaron el 0,42% (812/191.820) del total de los nacidos vivos y el 2,85% (38/1334) de las muertes fetales. En relación a la contribución en la mortalidad infantil de las patologías seleccionadas, se observó que las CC tuvieron una mortalidad del 17% (120/702), el SD de 29% (20/70) y los DTN 30% (12/40). Sólo el 14% (10/70) de los casos reportados de SD notificaron el resultado del estudio cito genético.
En la (Tabla 2) se puede observar que del total de CC analizadas, el 97% correspondió a nacidos vivos y el 3% a óbitos fetales. Para los DTN, en cambio, prácticamente un tercio (29,8%) correspondió a óbitos fetales, a expensas fundamentalmente de casos de anencefalia. En los dos tercios restantes (72,7%) el defecto más frecuentemente observado fue la espina bífida. Solamente un caso de SD fue notificado como óbito fetal (1,5%). La tabla ilustra también la prevalencia de estas entidades por 10.000 nacimientos. A efectos del cálculo de las CC separamos las notificaciones de acuerdo a la presencia o ausencia de SD. De esta forma obtuvimos un valor de 39,09/10.000 casos cuando incluimos el SD y de 36,29/10.000 cuando excluimos el síndrome. Cuando consideramos solamente los recién nacidos vivos esta cifra fue de 38,52. Para los nacidos muertos con CC la frecuencia fue mucho más elevada en ambos casos 149,93 y 119.
Tabla 2: Resultado perinatal de las de las patologías más frecuentes notificadas al RNDCER 2011-2014 y sus prevalencias por 10.000 nacimientos.
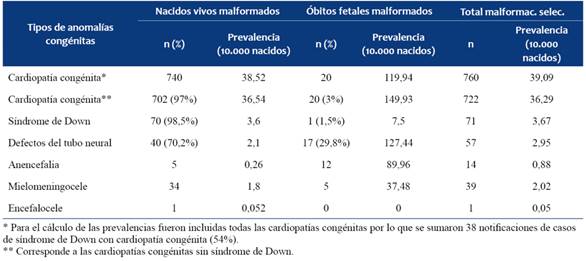
- Para el SD la prevalencia fue de 3,6 y 7,5 casos por 10.000 para nacidos vivos y óbitos fetales respectivamente.
- Considerados en su conjunto los DTN (anencefalia, mielomeningocele y encefalocele) tuvieron una prevalencia de 2,1 y 127,4 en nacidos vivos y muertes fetales. Siendo el mielo meningocele más frecuente en nacidos vivos 1,8 y la anencefalia en óbitos fetales 89,96, como mencionado anteriormente.
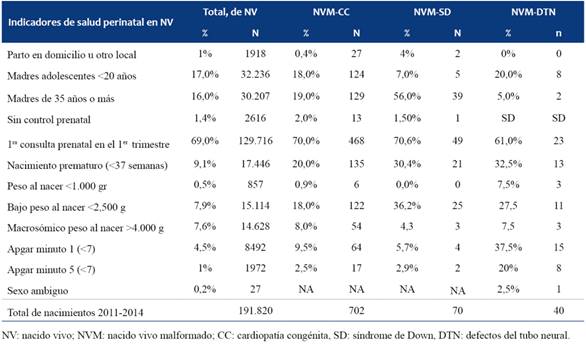
En la (Tabla 3) se especifican algunos factores de riesgo que pueden estar asociados a las anomalías congénitas. La tasa de madres adolescentes fue mucho menor en los casos con SD (7%) en comparación con la población general (17%). Para las otras patologías analizadas ésta fue similar para CC (18%) y levemente aumentada para DTN (20%). La edad materna avanzada (35 o más años) fue del 56% de los casos con SD vs. 16% en la población general. El parto prematuro fue común en las anomalías seleccionadas oscilando entre 20%-33%, duplicando la frecuencia de la población general (9,1%) en el caso de las CC o triplicándola en el caso de SD y NTD. La frecuencia del bajo peso al nacer (<2.500 g) fue el doble en el grupo con CC, el triple en el grupo con DTN y cuatro veces más en los recién nacidos con SD en comparación con la población general (7,9%). La depresión neonatal con el valor de Apgar (<7) en el primer minuto fue del 4,5% para la población general, comparado con 9,5%, 5,7% y 37,5% para CC, SD y DTN respectivamente. El Apgar <7 a los 5 minutos fue de sólo el 1% en la población general, 2,5%, 2,9% y 20% para CC, SD y DTN respectivamente. Prácticamente dos tercios de las madres de los recién nacidos estudiados tuvieron su primer control prenatal en el primer trimestre, con excepción del grupo con DTN donde esta cifra fue un poco inferior (en torno al 60%). En cuanto al lugar del parto, el 100% de los casos con DTN y el 99,6% de los casos con CC nacieron en una institución de salud, cifra ligeramente inferior para los casos con SD (96%). La afectación del sexo masculino fue del 53% (369) y del 57% (40), para los casos con CC y SD respectivamente, superior a lo observado en la población general (51%, 98.191). Sin embargo, la preponderancia para la afectación del sexo femenino para DTN fue muy marcada (60% de los casos) y 48,8% (93.558) en el total de la población.
Discusión
Como señalaban Darmstadt y colaboradores22, la VII Conferencia Internacional sobre Defectos Congénitos y Deficiencias en los países en desarrollo (ICBD) en Tanzania en 2015, fue una oportunidad crucial para dar seguimiento a las resoluciones de la 63ª AMS en conjunto con los recién lanzados Objetivos de Desarrollo Sostenible (ODS) por la Organización de las Naciones Unidas23. Construir consenso y compromiso para la prevención urgente de las anomalías congénitas y mejorar el cuidado de los niños afectados en países de baja y media renta es la clave para poder avanzar. En este contexto la epidemia de microcefalia por virus Zika en Brasil posicionó nuevamente en la agenda internacional la relevancia de las anomalías congénitas en general, y la necesidad de generar capacidades para dar respuestas epidemiológicas y sanitarias adecuadas24.
La mencionada agenda 2030 de los ODS23 propone reducir las tasas de incapacidad, mejorar la calidad de vida y la supervivencia de los recién nacidos y los niños, disminuir el actual impacto emocional y económico en los individuos afectados, en sus familias y comunidades en las que viven. Por lo tanto, el objetivo global es “garantizar vidas saludables y promover el bienestar para todos, en todas las edades, sin dejar a nadie atrás”23. Sin duda, el bienestar de todos incluye a las personas y familias con anomalías congénitas, enfermedades raras y discapacidad. Por lo tanto, el monitoreo de la prevalencia de éstas es fundamental para determinar el impacto de las acciones ya establecidas o de nuevas estrategias basadas en evidencias o de cambios en los factores de riesgo. De acuerdo con los datos del Estudio Colaborativo Latinoamericano de Malformaciones Congénitas (ECLAMC)25, la frecuencia de malformaciones congénitas identificadas en el nacimiento varía entre 2% y 4%, en las diferentes maternidades de América Latina que participaron del estudio entre 1968 y 200026, por lo que se podría inferir una probable subnotificación al RNDCER en el período 2011-2014 (0,92%). En cuanto a las prevalencias estimadas para las patologías estudiadas, se observó que son similares a los datos de la literatura para otros países16-19. Pero estas cifras son muy amplias, por lo tanto es relevante para este grupo de patologías determinar el comportamiento epidemiológico a lo largo del tiempo y generar la propia línea de base, lo que permitirá su monitoreo. Si comparamos con datos de Uruguay previamente establecidos por el ECLAMC, publicados o no, las prevalencias generales estimadas en este trabajo son más bajas para DTN y SD y más altas para CC. Castilla y colaboradores27) establecieron la línea de base para DTN y SD en Uruguay a partir de datos de tres hospitales participantes del ECLAMC durante el año 1999, cuya prevalencia en el nacimiento fue de 16,15/10.000 y 8,08/10.000 respectivamente. Sin embargo, datos no publicados de López-Camelo y Larrandaburu (comunicación personal Jorge López-Camelo) de ocho maternidades de Uruguay participantes del ECLAMC durante 1982-2000 mostraron una prevalencia al nacimiento de 13,9 (IC95% 11,7-16,1) para DTN (298 casos/204.669 nacimientos). También fue analizada la prevalencia para CC en esas mismas maternidades (1982-1998), que fue de 21,29 (IC95% 18,4-24,1), 376 casos/177.051 nacimientos). Las diferencias de prevalencia podrían ser explicadas en forma diferente de acuerdo al tipo de patología. El incremento del diagnóstico del 45% para CC podría ser explicado por la definición de caso cada uno de los de los Sistemas de Vigilancia. De esta forma el RNDCER, a diferencia del ECLAMC, no se limita al alta hospitalaria, realizándose una búsqueda activa de los casos a través de la notificación desde el Fondo Nacional de Recursos. Por lo que se contempla toda la información de los procedimientos médicos o quirúrgicos de las cardiopatías congénitas, independientemente de la edad del egreso hospitalario. En relación al SD y DTN, la subnotificación podría explicar parcialmente esas diferencias. Sin embargo, la importante disminución del 83%, con una prevalencia cuatro veces inferior para los DTN, podría ser explicada fundamentalmente por el efecto de la folación de las harinas en Uruguay26,28 a partir de 2008, ya que los datos de ECLAMC son previos a la implementación de la legislación nacional al respecto. Otro estudio realizado con egresos hospitalarios habría mostrado datos similares29. No existen datos publicados respecto al diagnóstico prenatal de SD e interrupción de la gestación en Uruguay. En cuanto a los factores de riesgo asociados como edad materna avanzada para esta entidad30, los resultados demostraron que el 16% de la población de madres de 35 o más años en Uruguay contribuyeron con el 56% de los recién nacidos con SD en el período analizado. En Uruguay, como en otras regiones del mundo, ha sido demostrada una tendencia de las mujeres de posponer las gestaciones31.
La alta mortalidad para DTN de los casos notificados, el 30% (12/40) fue similar al hallazgo descrito por Blencowe y colaboradores19 en países de bajos ingresos (29%). Prácticamente la mitad de los casos (5/12) fueron anencefalias. De estas, sólo dos solicitaron interrupción voluntaria de la gestación de acuerdo a la legislación uruguaya28. La predilección por el sexo femenino en los casos de DTN también fue consignada como lo descrito en la literatura32. Como un porcentaje importante de las gestaciones no son planificadas, estrategias preventivas a nivel poblacional como la fortificación de las harinas con folato y la vacunación parecen ser más efectivas. Como fue mencionado por Mc Keating y colaboradores33, las mujeres cuyo primer embarazo no fue planificado tienen mayor riesgo de repetir la misma conducta en los embarazos subsiguientes.
Existen diferentes acciones de prevención de anomalías congénitas de acuerdo momento del ciclo de vida34-36. El Toolkit de la PHG propone acciones de salud específicas de acuerdo al curso de vida y proporciona un enfoque epidemiológicamente racional para la planificación de las mismas. Tiene como objetivo identificar programas, servicios, intervenciones, oportunidades y recursos para mejorar la atención de salud y establecer prioridades. Con estos criterios consideramos que en Uruguay es necesario apostar en la educación para la salud generando programas que difundan las estrategias de prevención basadas en las evidencias y que permitan monitorear el impacto a largo plazo, el uso de dicha herramienta puede ser una opción para alcanzar ese objetivo. Nuestro país recientemente incorporó la oximetría de pulso obligatoria a todos los RN del país28 dentro de la Pesquisa Neonatal y del Lactante (PNPNL). Creemos que la línea de base generada por el presente trabajo puede ser un insumo valioso para medir el impacto de esta nueva estrategia aplicada.
Conclusión
Esta investigación determinó la prevalencia en Uruguay de un grupo de patologías congénitas para las que no se disponía de información nacional publicada. También definió factores de riesgos específicos encontrados en esa población. Se observó por primera vez, a partir de datos de vigilancia específicos de anomalías congénitas (ECLAMC/RNDCER), una disminución del número de casos de DTN en el periodo postfolación de las harinas. Los resultados aquí presentados, a través de una sistemática de trabajo con foco epidemiológico, pueden ser un insumo para la planificación de los servicios de salud en Uruguay, podrían ayudar a mejorar la atención, concentrándose en algunas anomalías congénitas para las cuales están disponibles medidas de prevención. Existe suficiente evidencia en relación a normativas nacionales e internacionales que pueden ser usadas como apoyo para el desarrollo de políticas públicas relacionadas a la discapacidad y las anomalías congénitas. Finalmente creemos que involucrar a la ciudadanía en estas acciones es indispensable para alcanzar los objetivos deseados.