Introducción
Los Staphylococcus coagulasa negativos (SCN) son de los microorganismos más frecuentemente aislados en el laboratorio de microbiología1-10. Dentro de ellos, la especie más frecuentemente aislada es Staphylococcus epidermidis1,3,10.
El significado clínico puede ser difícil de establecer dado que son microorganismos comensales habituales de la piel y mucosa, y muchas veces contaminan las muestras al momento de la toma. Bajo condiciones especiales pueden causar patologías con diversos grados de complejidad1,3,7,10,11.
En la población neonatal, particularmente en pretérminos, los SCN pueden causar infecciones graves y su protagonismo como patógenos ha ido en aumento en los últimos tiempos5-7.
Se ha evidenciado que el riesgo de desarrollar bacteriemia en los recién nacidos se asocia a ciertos factores de riesgo, como la prematuridad, el menor peso al nacimiento, la inmadurez inmunitaria, la utilización de catéteres vasculares, la alimentación parenteral, la asistencia ventilatoria mecánica, y otras enfermedades asociadas, como las quirúrgicas, además de una estadía hospitalaria prolongada5-7.
La resistencia antimicrobiana es un problema a nivel mundial y es más prevalente en patógenos nosocomiales y en unidades con uso indiscriminado o poco regulado de antibióticos7. Es por esto que en muchos centros se han puesto en marcha protocolos de vigilancia antibiótica (Antimicrobial Stewardship). Un ejemplo de esto es el estudio Scout, realizado en el hospital Parkland de Dallas, EEUU (2011-2012). Dicho estudio constó de un período de referencia (fase observacional) y un período de intervención. Luego del primer período, la continuación de la terapia antibiótica empírica para sepsis descartada más allá de las 48 horas, la neumonía y la sepsis con cultivo negativo fueron seleccionados como objetivos para las intervenciones de administración de antibióticos. Durante el período de intervención, la terapia antibiótica empírica se interrumpió después de 48 horas en la historia clínica electrónica y la duración de la terapia para la neumonía y la sepsis con cultivo negativo se limitó a 5 días. El uso de antibióticos, definido como días de terapia por 1.000 días de paciente, se comparó entre ambos períodos. El resultado primario fue el cambio en el total de días de tratamiento con antibióticos por 1.000 días de paciente entre el período inicial y los períodos de intervención. Dicho estudio demostró que la vigilancia de uso antibiótico en unidades de cuidados intensivos neonatales puede lograrse de forma segura12).
La vancomicina es uno de los antibióticos de uso empírico más frecuente y entre los problemas de su excesivo uso se destaca la resistencia bacteriana de gérmenes Gram positivos, particularmente comensales con escaso efecto patológico en otras etapas de la vida, pero potencialmente mortales para los neonatos más gravemente enfermos2,9,10.
Caso clínico
Recién nacido de sexo femenino, pretérmino extremo13, 25 semanas de edad gestacional, bajo peso extremo13, peso al nacer 680 gramos. Apgar 3/6/8, ingreso a CTI. Corticoterapia antenatal incompleta. Por riesgo de infección connatal recibe antibióticos al ingreso, ampicilina y gentamicina, que se suspenden a las 48 horas con hemocultivo sin desarrollo.
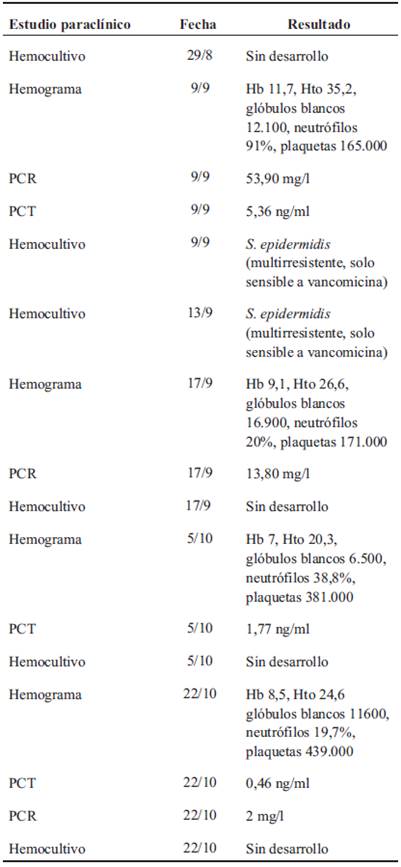
Buena evolución inicial, a los 11 días de vida presenta deterioro clínico dado por apneas reiteradas, hemocultivo positivo a S. epidermidis, no se inicia tratamiento antibiótico.
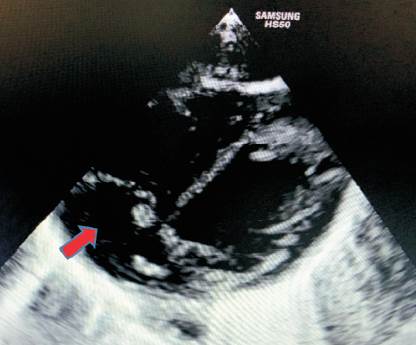
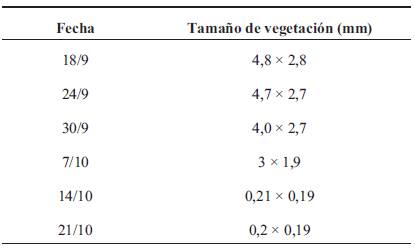
A los 14 días de vida se observa lesión en topografía de inserción de catéter percutáneo, solicitándose hemocultivo, nuevamente positivo a S. epidermidis, por lo que se decide inicio de vancomicina. En este contexto se realiza diagnóstico de endocarditis sobre válvula nativa, en válvula tricúspide en corazón sin patología estructural, de acuerdo a lo criterios de Duke modificados (Figura 1). Se realiza tratamiento con vancomicina durante 6 semanas y control con ecocardiografía (Figura 2) (Tabla 1). Desaparición macroscópica de la vegetación a los 54 días de vida (Tabla 2).
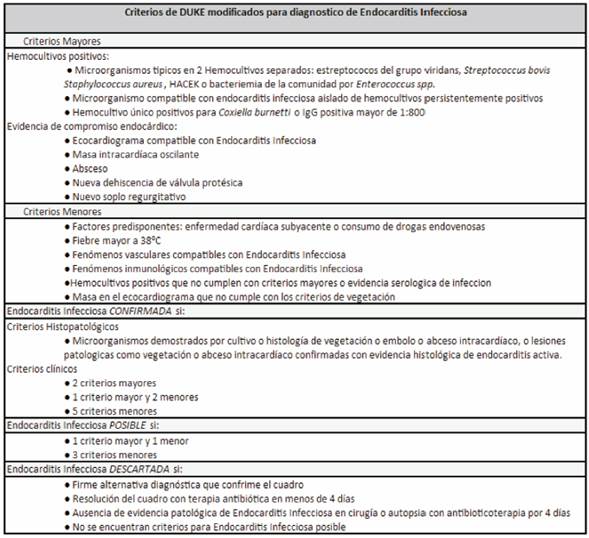
Figura 1: Criterios de Duke para el diagnóstico de endocarditis infecciosa. Tomado y modificado de Capelli H, 2019.
En este punto cabe destacar que dentro de los factores de riesgo para la endocarditis, además de tratarse de un paciente prematuro extremo con una internación prolongada, presentó múltiples vías centrales, que se sabe son uno de los factores de riesgo más importantes para el desarrollo de endocarditis. En resumen, mantuvo 4 días el catéter venoso umbilical, 5 días el arterial, 8 días una vía venosa percutánea en MSD (sitio en el que se constató el trayecto de linfangitis), tres vías periféricas para transfusiones de concentrados de glóbulos rojos.
Discusión
Los estafilococos son bacterias gram-positivas que se pueden dividir en dos grandes grupos: coagulasa positivos (estos producen una enzima que coagula el plasma oxalatado o citratado) y coagulasa negativos (no productores de la enzima antes mencionada)3.
Los Staphylococcus coagulasa negativos (SCN) son de los microorganismos más frecuentemente aislados en el laboratorio de microbiología1,2,4,9,10,14. Dentro de ellos, la especie más frecuentemente aislada es S. epidermidis, seguido de S. haemolyticus y S. saprophyticus1,3,10).
Cabe destacar que el S. epidermidis es el contaminante más importante en las muestras de hemocultivos, líquidos biológicos y exudados de heridas, por lo que su aislamiento debe ser interpretado con precaución, teniendo en cuenta las condiciones de extracción la muestra, la condición clínica del paciente y la presencia de factores de riesgo11. En concordancia con lo antes mencionado, el primer hemocultivo de nuestro paciente fue positivo para S. epidermidis, que en un inicio fue interpretado como contaminante, luego, dada la clínica del paciente, se realiza un nuevo hemocultivo que desarrolla el mismo microorganismo, y es entonces que se inicia el tratamiento.
La virulencia de SCN está dada fundamentalmente por la capacidad de algunas cepas de expresar adhesinas y formar una biopelícula en los dispositivos protésicos y catéteres, donde se forman microcolonias que crecen protegidas de la acción de los antimicrobianos, anticuerpos y otros mecanismos de defensa del huésped. Además, pueden producir enzimas que degradan los tejidos y ayudan a la persistencia de la infección1.
Los SCN causan infecciones graves en neonatos y su protagonismo como patógenos ha ido en aumento en los últimos tiempos. Esto se ha asociado en parte al avance de la tecnología médica, que, por un lado, ha permitido una mayor supervivencia de neonatos cada vez más inmaduros -lo que lleva a internaciones más prolongadas- y, por otro, permite la utilización de procedimientos avanzados que son nuevas fuentes de entrada para las infecciones5,6,7,14
Como agentes causantes de bacteriemias asociadas al uso de catéteres se han reportado infecciones de válvulas derivativas ventrículo-peritoneales y ventrículo-atriales, endocarditis en válvulas tanto nativas como protésicas, infecciones asociadas al empleo de otros dispositivos proteicos, infecciones de piel y parte blandas, etc1,3,4,6,7,14.
Existen muchos factores que favorecen el desarrollo de las infecciones en los neonatos, pero en cada centro es posible encontrar que el peso relativo de cada uno de estos factores es diferente5-7.
Volviendo a nuestro caso clínico, el paciente presentaba muchos de estos factores de riesgo, entre ellos se trata de un recién nacido preterido extremo, que requirió de una internación prolongada, del uso de APT y de múltiples accesos venosos.
En relación con la susceptibilidad antibiótica de estas bacterias, es variable en los diferentes hospitales y comunidades3.
La aparición de resistencias a los antibióticos entre los patógenos que infectan a los recién nacidos constituye un gran problema a nivel mundial y es más prevalente en patógenos nosocomiales y unidades con uso indiscriminado de antibióticos7,14. Muchos SCN aislados en infecciones nosocomiales (especialmente S. epidermidis y S. haemolyticus) son resistentes a múltiples antimicrobianos, con más del 80 % de resistencia a la meticilina. Se ha observado, además, una resistencia acompañante especialmente a la ciprofloxacina en ambas especies y a la eritromicina en S. haemolyticus. En concordancia con lo antes expuesto, el SCN cultivado en los hemocultivos de nuestro paciente poseía resistencia a múltiples antibióticos comúnmente utilizados en el medio, y únicamente era sensible a vancomicina. Este es otro punto en común con nuestro paciente, cuyos antibiogramas mostraron resistencia a múltiples antibióticos, y era sensible únicamente a vancomicina.
La vancomicina es uno de los antibióticos de uso empírico más frecuente, y entre los problemas de su excesivo uso se destaca la resistencia bacteriana de gérmenes Gram positivos2,9,10. Los enterococos resistentes a vancomicina y el S. aureus insensible a este fármaco son patógenos emergentes derivados del empleo generalizado de vancomicina. Aunque la administración de este fármaco no puede evitarse en las unidades neonatales donde el S. aureus resistente a meticilina es endémico, su empleo puede reducirse restringiendo el tratamiento empírico a los pacientes con una posibilidad elevada de infección grave por estafilococos coagulasa negativos (un recién nacido muy enfermo con un catéter intravascular permanente) y suspender su uso tras 2-3 días cuando los hemocultivos sean negativos. Cuando estén disponibles los resultados del antibiograma y no haya signos de afectación endovascular o del SNC, la clindamicina podría ser una alternativa idónea para el tratamiento de la bacteriemia no complicada y de las infecciones cutáneas y de partes blandas en el recién nacido14,15.
Existen ya algunos reportes aislados de S. epidermidis y S. haemolyticus resistentes a vancomicina y otros glucopéptidos1,2.
Se ha demostrado que el uso empírico de vancomicina no mejora la mortalidad a corto plazo ni reduce el tiempo de internación luego de un episodio de bacteriemia por SCN, por lo que su uso debería ser limitado, como ya hemos mencionado, a cuando se sospecha un germen meticilino resistente y guiado por los cultivos y la información de sensibilidad9. En nuestra unidad la vancomicina es un antibiótico de uso frecuente, en este caso el microorganismo era sensible únicamente a dicho antibiótico, pero en este punto y siguiendo los lineamientos mundiales quizá sea tiempo de plantear el uso de nuevos planes antibióticos.
Algunos trabajos plantean el inicio de antibioticoterapia empírica con combinaciones de antibióticos como oxacilina (betalactámico, de espectro reducido del grupo de las penicilinas, por lo que se indica en el tratamiento de infecciones causadas por bacterias Gram positivas, en particular las especies de estafilococos que suelen ser resistentes a otras penicilina) y gentamicina12, con los cuales han obtenido buenos resultados, pero hacen falta más estudios que avalen dicha práctica.
Conclusiones
Luego de lo expuesto anteriormente surge la interrogante: ¿cómo interpretar un hemocultivo positivo a un SCN?, ¿contaminante o patógeno?, ¿cuál es el rol del médico en disminuir la resistencia ATB y cómo hacerlo?
El significado clínico del hemocultivo depende de múltiples factores, por lo que deben tenerse en cuenta las condiciones de toma de la muestra, la condición clínica del paciente, su edad, peso y presencia de factores de riesgo para una infección por SCN (ejemplo catéteres venosos, alimentación parenteral, etc.), además de la prevalencia de dichos gérmenes en esa unidad en particular.
Otra variable a considerar es la aparición del mismo microorganismo en más de una muestra de hemocultivo. Se ha reportado además que los casos de contaminantes suelen desarrollarse más tardíamente en los caldos de hemocultivos. Es claro para nosotros que todos aquellos pacientes que presenten sintomatología en el contexto de un hemocultivo negativo deberán ser tratados, ya que, como en el caso de nuestro paciente, puede tratarse de una infección con potenciales complicaciones graves.
Las prácticas de administración de antimicrobianos, influyen en los tipos de microorganismos responsables de la sepsis neonatal y en sus patrones de resistencia, lo cual resulta evidente en este caso por el perfil de resistencia del microorganismo aislado. Numerosos estudios han mostrado un impacto positivo al realizar una estricta vigilancia del uso de antibióticos en las unidades de cuidados intensivos neonatales.