Introducción
La atrofia muscular espinal (AME) es una enfermedad del asta anterior de la médula espinal causada por la síntesis insuficiente de la proteína de supervivencia de la motoneurona (SMN), debido a una deleción específica de los exones 5, 6 o 7 en el gen SMN1 en el cromosoma 5q13, con el consecuente defecto en la transcripción del gen SMN1. Si bien los genes SMN1 y SMN2 codifican la misma proteína, la mayoría del segmento mensajero del exón 7 del ARN mensajero del producto del gen SMN2 no es funcional. Cuando no hay un gen SMN1 presente, cuantas más copias del gen SMN2, más proteína SMN funcionales produce y más leve es la condición. De hecho, las personas con cinco o seis copias de SMN2 pueden no verse afectadas fenotípicamente. Alrededor del 58% de todos los AME son tipo 1; 29% AME 2; 13% AME 3, y menos del 1% AME 41-3.
La AME es la enfermedad neuromuscular más común de los recién nacidos hipotónicos y afecta a 1 por 6.000 a 10.000 nacimientos1. La gravedad de la AME varía de la apnea perinatal y dependencia definitiva de ventilación mecánica continua hasta la aparición de debilidad muscular en edad adulta4,5.
El propósito de estas recomendaciones es describir las evaluaciones funcionales y subsecuentes intervenciones en cuidados respiratorios no invasivos en los tipos de AME de mayor prevalencia y severidad.
Fisiopatología de las afecciones respiratorias por debilidad muscular
La debilidad muscular puede comprometer a tres grupos fundamentales de músculos respiratorios: los inspiratorios (diafragma, paraesternales, escalenos y accesorios de la inspiración); los espiratorios (intercostales externos y abdominales), y los que inervan las vías aéreas superiores (palatinos, faríngeos, geniogloso).
La función muscular espiratoria adecuada es esencial para el aclaramiento de las vías aéreas y la eliminación de los tapones mucosos bronquiales. Una parte importante de la defensa de la vía aéreas es la tos, cuyo fin es remover las secreciones. La tos consta de tres fases: una fase inspiratoria que consiste en una inhalación forzada; una fase compresiva donde el cierre de la glotis está acompañado por un aumento de la presión intratorácica (como resultado de la contracción de los músculos espiratorios) y una fase expulsiva resultante de la apertura drástica de la glotis. La alta velocidad del flujo aéreo en la fase expulsiva transfiere energía cinética a través del aire a las secreciones o cuerpos extraños, sacándolos de la pared bronquial y transportándolos a la faringe o boca6,7.
En la mayoría de los casos la comorbimortalidad de las enfermedades neuromusculares, incluyendo las AME, es causada por debilidad muscular. Aproximadamente el 90% de los episodios de los fallos respiratorios ocurren a partir de infecciones benignas del tracto respiratorio superior, más que por narcosis progresiva de dióxido de carbono (CO2) u otras anormalidades respiratorias. Las formas progresivas de alteraciones musculares respiratorias producen alteraciones de los gases sanguíneos, hipoxemia e hipercapnia, ambas resultantes de la hipoventilación. De este modo, la consecuencia final del compromiso de los músculos inspiratorios es la hipoventilación alveolar con la correspondiente hipercapnia e hipoxemia. El compromiso de los músculos espiratorios determina la ineficacia de la tos y retención de secreciones y el compromiso de los músculos de la vía aérea superior afecta la deglución, lo que conduce a la aspiración de saliva y alimentos, que, junto a la tos ineficien te, produce infecciones respiratorias repeti das2,4,8-11.
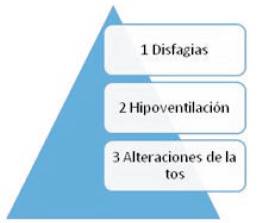
Las tres principales causas de la debilidad muscular que producen alteraciones respiratorias (Figura 1)
En la AME el compromiso respiratorio es más intenso en los músculos espiratorios, como también en músculos inspiratorios de la pared torácica, manteniendo capacidad de trabajo diafragmático. Esto lleva a que los pacientes con AME tengan mejor capacidad vital (CV) en posición supina, para permitir el movimiento de caja torácica inferior. Sin embargo, en formas más graves, independientemente del inicio de la enfermedad, esta debilidad exagerada de músculos de la caja torácica, con mejor funcionalidad diafragmática genera, en un tórax complaciente, como sucede en niños pequeños, respiración paradójica o paradojal. Esto es por defecto de la bomba respiratoria y no por obstrucción de vía aérea superior. En esta condición, pese a intentar mantener presiones transpulmonares mayores, existe una notable disminución de capacidad residual funcional, como de capacidad inspiratoria. Cuando la CV es menor de 30%, se relaciona con la aparición de microatelectasias, que sumadas, restan aún más CV a la inducida por la insuficiencia muscular inspiratoria2,5,11.
La AME tipo 1 se define por incapacidad para sentarse independientemente; tipo 2, por capacidad de sentarse, pero no caminar; tipo 3, por la capacidad de caminar por algún tiempo, y tipo 4, por inicio en adultos. El inicio de presentación clínica es más precoz según la severidad, debutando antes de los 6 meses en los pacientes con AME tipo 1 y antes de los 18 meses en los pacientes con AME tipo 2. Los pacientes con AME tipo 1, consecuentemente, tienen compromiso de músculos inervados bulbares generalmente antes del año, tienen su primer evento de insuficiencia respiratoria, habitualmente secundaria a infección respiratoria aguda alta (ITRA), antes del año de vida y mueren sin soporte ventilatorio antes de los 18 meses de vida1-3,5,6,8,11.
La debilidad muscular lleva a la disminución progresiva de la CV, la intensidad y precocidad se vinculan con grados de afectación de grupos musculares inspiratorios, espiratorios y deglutorios2,4,12.
La CV de llanto normal desde el nacimiento hasta los 10 días de edad es 85 a 105 ml y llega a más de 200 ml al año de edad. La CV supera 1.000 ml a los 5 años y 2.000 ml a la edad de 8 años. En sujetos normales, se alcanza el pico máximo de CV entre los 19 y 20 años de edad y luego empieza a disminuir 1% a 1,2 % por año. Los pacientes con AME tipo 1 alcanzan una meseta de CV < de 200 ml, y aquellos con CV > 200 ml (AME 1c) persisten con cierto grado de autonomía ventilatoria más allá de los 10 años. Los valores de CV logrados en pacientes con AME tipo 2 dependen de la existencia de respiración paradojal2,13-16).
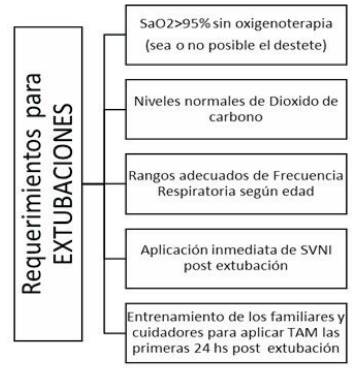
Después de los 6 meses de edad los niños con AME 1 (tipos B, C) tienden a desarrollar insuficiencia respiratoria aguda (IRA) como resultado de intercurrencia de ITRA o broncoaspiración, son intubados y solo 6% de las extubaciones convencionales son exitosas. Siguiendo el protocolo del Dr. John Bach y su equipo, este tipo de pacientes pueden ser extubados exitosamente a soporte ventilatorio no invasivo (SVN)2,11,17-20.
Una CV de 250 ml se asocia con destete del ventilador diurno, mientras que pacientes con CV más baja tienden a permanecer en ventilación mecánica. Se correlaciona CV con gravedad del deterioro muscular y con pronóstico para respiración autónoma. En pacientes con AME, esto ha sido descrito y estudiado claramente por Bach y colaboradores, y éstos relacionan la CV con los cuatro fenotipos clínicos de la AME5.
La AME tipo I fue diferenciada en tres subtipos según gravedad de las alteraciones respiratorias y mediciones de la CV2,5,13.
- AME tipo I A: con inicio antes de los 4 meses de edad, dependencia continua a ventilación mecánica y pérdida de ingesta oral antes de los 6 meses. Su CV máxima o plateau es < 100 ml.
- AME tipo I B: con inicio antes de los 4 meses de edad, CV máxima observada < 200 ml, fallo respiratorio agudo antes de los 12 meses, pérdida de ingesta oral antes de los 12 meses, y la dependencia continua a la ventilación mecánica se presenta antes de los 10 años.
- AME tipo I C: con inicio antes de los 6 meses de edad, CV > 200 ml, sin fallo respiratorio agudo antes de los 12 meses, sin pérdida de ingesta oral antes de los 12 meses y alcanza los 10 años de edad sin dependencia continua de ventilación mecánica.
Siguiendo la misma línea de investigaciones la AME tipo 2 se subdivide en:
Enfoque terapéutico de las alteraciones respiratorias en las atrofias musculares espinales
Dentro del enfoque del tratamiento de las afecciones respiratorias en los pacientes con AME se incluye el soporte ventilatorio no invasivo (SVNI) en combinación con técnicas de higiene bronquial, incluyendo la tos asistida mecánicamente (TAM)17-21.
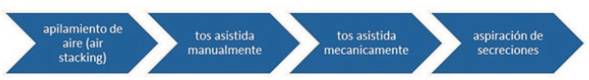
Técnicas de higiene bronquial en AME (Figura 2)
El manejo respiratorio es el aspecto más crítico para prolongar la supervivencia y la calidad de vida en estos pacientes sin recurrir a la traqueotomía, para esto es necesario el soporte de los músculos respiratorios2,6,7,9-11,17,22.
Las medidas de soporte respiratorio muscular son el conjunto de técnicas y dispositivos que asisten la inspiración y espiración, ya sea mediante la aplicación de manera mecánica o manual de fuerzas sobre la superficie externa del cuerpo o mediante cambios intermitentes en la vía aérea.
Las técnicas de SVNI tienen el fin de prevenir la insuficiencia respiratoria y el fallo ventilatorio permitiendo la extubación y decanulación de pacientes considerados “imposibles de destetar”. La aplicación de presión en la vía aérea en forma no invasiva durante la inspiración puede proporcionar un soporte ventilatorio continuo en pacientes con poca o inexistente CV. Así mismo podrá alcanzarse un pico flujo espiratorio efectivo en pacientes con disfunción severa de los músculos espiratorios17-20,23,24.
El soporte ventilatorio es aplicado siguiendo metas relacionadas con el mejoramiento en la funcionalidad del aparato respiratorio: todas estas metas pueden ser alcanzadas a través de la evaluación, el entrenamiento y el equipamiento de los pacientes en consultorio externo y en sus hogares9,10 (Tabla 1).
Para la aplicación de SVNI se recomienda la ventilación a volumen controlado (VCV) modalidad A/C de 800 a 1.500 ml, TV 13-15 ml por kilo, con PEEP/EPAP de 0 cm de H2O para adolescentes y adultos. Esto, según un seguimiento de casos por más de 40 años de Bach y colaboradores. A los usuarios se les deja elegir el volumen corriente y frecuencia respiratoria deseada según variaciones fisiológicas. Pudiendo realizar con el mismo equipo air stacking o apilamiento de aire, que es una técnica de hiperinsuflación activa para retener el máximo volumen posible de aire que es aportado a través del bolseo manual o a través de un ventilador volumétrico mediante un cierre efectivo de la glotis2,7,9,10,17-19.
Para los niños pequeños y otros pacientes que no puedan retener el aire y realizar el reclutamiento activo del volumen pulmonar, se prefiere la ventilación controlada por presión (VCP), también modalidad A/C, una presión preseteada de 18 cm H2O. Muchas veces la limitante es tener una apropiada interfase, con mascarillas nasales especialmente para aquellos pacientes con peso inferior a 5 kilos. En el caso de usar equipos generadores de flujo con entrega de presión en dos niveles (binivel) es importante, dado que estos equipos para impedir la recirculación de CO2 necesitan un EPAP mínimo, generalmente de 4 cm de H2O, usar presiones diferenciales altas no menores de 15 a 18 cm, high span para lograr una ventilación apropiada y un buen desarrollo del tórax2,7,9-11,17-19 (Tabla 1).
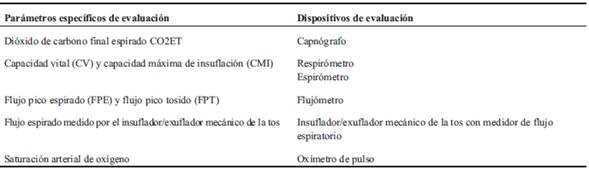
Antes de la prescripción del SVNI es necesaria una evaluación específica de estos pacientes para determinar el grado de insuficiencia respiratoria que presentan y darles el tratamiento más adecuado posible. Su evaluación específica requiere de cuatro dispositivos especiales17-19.
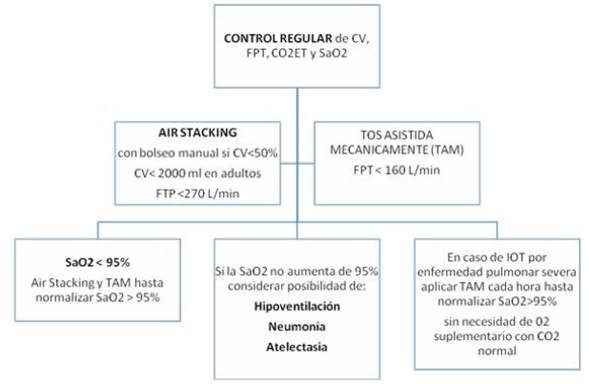
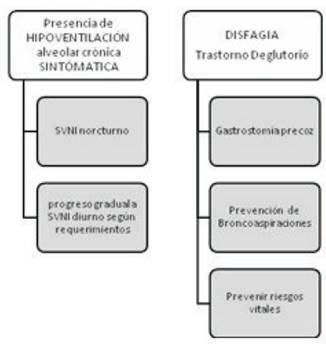
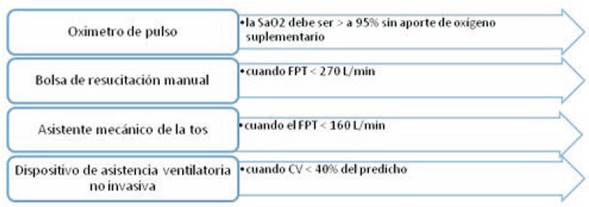
Tanto el espirómetro como el respirómetro son utilizados para valorar la CV y la capacidad máxima de insuflación (CMI). La CV es medida en sedestación y con el paciente acostado en decúbito supino. La diferencia entre ambas mediciones debe ser menor a 7%. En los pacientes neuromusculares la hipercapnia generalmente se desarrolla cuando la CV disminuye 40% a 55% de lo normal predicho, especialmente en la posición de decúbito supino (que es la posición más importante). La hipoventilación alveolar se presenta inicialmente durante el sueño. Según estudios realizados, los pacientes neuromusculares requieren asistencia ventilatoria nocturna cuando la CV en decúbito supino disminuye cerca del 30% de lo normal predicho. Mientras que la CMI se mide luego del apilamiento de aire de manera espontánea (air stacking) con bolsa de resucitación manual, con ventilación por pieza bucal o con respiración glosofaríngea7,9,10,17-19.
El flujo pico tosido determina el flujo máximo alcanzado con la tos. La falta de fuerza para la tos es una de las dificultades encontradas en las enfermedades neuromusculares. Un flujo pico de 160 L/m se considera muy mínimo; para conseguir una tos efectiva son requeridos flujos entre 270 a 300 L/m, pudiendo ser la misma espontánea o asistida manualmente (air stacking) aceleración del flujo espiratorio con presiones manuales6,17-19.
El flujo espiratorio medido por el insuflador/exsuflador mecánico de la tos, cuando su medida es sobre 150 L/m, se puede realizar la decanulación sea o no el paciente dependiente de ventilación mecánica. Cuando el mismo mide por debajo de 110 L/m no se pueden realizar las decanulaciones25. En bebés y niños pequeños que dependen del ventilador y están traqueostomizados no se realiza la decanulación.
La utilización del oxímetro de pulso facilita la introducción del SVNI en pacientes hipercápnicos con desaturaciones debidas a la hipoventilación alveolar crónica. Cualquier desaturación en aire ambiente indica alguna combinación de hipoventilación, acumulación de secreciones y enfermedad pulmonar residual, el mantenimiento de la SaO2 > 95% es un criterio altamente primordial para la decanulación o extubación de estos pacientes19,20,22. Establecer una alarma a un nivel de 94% de saturación ayuda a mantener la saturación de oxígeno normal durante todo el día, al caer por debajo del 95% se deben realizar respiraciones profundas. Si el paciente no puede realizar estas respiraciones profundas, el SVNI es introducido a través de una pieza bucal o a través de una interfase nasal. La monitorización continua de oxígeno es especialmente importante en el caso de las infecciones del tracto respiratorio7,9,17-19(Tabla 2).
En los pacientes con AME tipo 1 y 2 la respiración paradojal es una indicación para iniciar el SVNI, la medición de la CV, según el debut clínico y la presentación fenotípica de la severidad del compromiso motor es un indicador para la introducción del SVNI, que debe ser siempre complementario a maniobras de reclutamiento y protocolos de tos asistida2,5,17-19.
Asistencia de la tos
Es necesario tener en cuenta que la tos de los lactantes y niños que no tienen sedestación es inefectiva para prevenir las neumonías y puede llevar al fracaso respiratorio agudo. En el caso de las AME, donde la debilidad muscular es marcada incluyendo a los músculos respiratorios, además de la asistencia manual se recomienda combinar la misma con la TAM, que entrega insuflaciones profundas seguidas inmediatamente de exuflaciones profundas y cuya magnitud de las presiones y el tiempo de entrega son independientemente ajustables. Las presiones de insuflación y de exsuflación pueden ser entregadas por una interfase oronasal, una simple pieza bucal, un tubo endotraqueal o por una cánula de traqueostomía. El cambio brusco de presión en un espacio corto de tiempo genera un flujo de aire capaz de expulsar las secreciones6,11,24.
Un tratamiento de TAM consiste en realizar cerca de cinco ciclos seguidos por un corto período de respiración normal o uso del ventilador para evitar hiperventilación. Las presiones de insuflación y exuflación van de ± 50 a 60 cm de H2O por la boca o por boca y nariz (interface oronasal) o a ± 60 a 70 cm de H2O por cualquier tubo invasivo de las vías aéreas. Para los lactantes son usadas las mismas presiones, pero ellos respiran tan rápido que la insuflación y exsuflación deben ir coordinadas con el ritmo respiratorio o utilizar el Cough Track™ o el E70 CoughAssist™ usado para que el lactante dispare a la máquina. Es necesario tener en cuenta que la meta es alcanzar una rápida expansión torácica máxima seguida de un vaciamiento pulmonar inmediato, ambos en un tiempo que debe ser seteado con el tiempo de máxima insuflación y exhalación que alcanza cada paciente en particular6,11,24.
Aspectos relevantes en el tratamiento respiratorio en las atrofias musculares espinales (Figura 3)
La utilización de oxígeno exacerba el fallo ventilatorio al aumentar la SaO2 en forma artificial y alterar el control respiratorio a nivel del sistema nervioso central (SNC), dando como resultado el empeoramiento de la hipercapnia, debido a que la dificultad primaria de dichos pacientes es por la debilidad muscular y el fallo es ventilatorio; no obstante, la aplicación de la oxigenoterapia es útil en los casos de fallos respiratorios agudos hasta revertir la hipoxia pulmonar tisular.
Esto generalmente sucede durante las infecciones respiratorias tales como las neumonías, donde el fallo es respiratorio por alteraciones pulmonares intrínsecas o de las vías aéreas y la descompensación es aguda, con deterioro de los gases sanguíneos arteriales y consecuente disminución del pH sanguíneo a niveles inferiores a 7.25, produciéndose un aumento de la resistencia vascular pulmonar con alteraciones de la ventilación-perfusión o una hipoxia pulmonar tisular. Además, en estos casos los músculos respiratorios pueden fatigarse más y la acumulación de secreciones puede ser mayor, siendo insuficientes los medios no invasivos de tratamiento hasta que se resuelva la patología pulmonar7,17-19.
Complicaciones de la traqueostomía: las complicaciones incluyen del 8% al 65% de incidencia de estenosis traqueal, fístula traqueoesofágica y aumento de aspiración de la comida, hemorragia, bronquitis crónica purulenta, formación de granuloma en la vía aérea subglótica, colonización e infecciones traqueobronquiales, sinusitis, parálisis de la cuerda vocal, estenosis laríngea, disfunción de los músculos hipofaríngeos y colapso de las vías aéreas (traqueobroncomalacia). La no utilización de traqueostomía facilita el destete del ventilador y mejora la calidad de vida. Además, las funciones de la musculatura inspiratoria y espiratoria pueden suplirse incluso en pacientes con 0 ml de CV con el SVNI. Para evitar la traqueostomía lo más importante es el SVNI en forma continua y el uso de la TAM6,7,11(Figura 4) y (Figura 5).
El SVNI: debe asistir directamente al músculo, por lo tanto la entrega de presión positiva continua en las vías aéreas (CPAP) y las modalidades de binivel de presión (BiPAP) a bajos niveles de intensidad o low span pressure (< a 18 cmH20), no son considerados como soportes ventilatorios y no son útiles para pacientes con insuficiencia ventilatoria por fallo de los músculos de la bomba respiratoria que necesitan de un soporte ventilatorio completo, como es la condición de los pacientes con AME con pobre o sin intervalo libre de ventilación (del inglés ventilatory free breathing ability). Por otra parte, la ventilación controlada por presión (VCP) tiene la ventaja de facilitar la iniciación del SVNI en infantes, niños o en pacientes que sólo tienen hipoventilación nocturna (Figura 6). Sin embargo, muchos de los pacientes con un nivel de comprensión de 5 o más años de edad prefieren la ventilación ciclada por volumen (VCV), en especial durante el día, ya que les permite el acúmulo de aire a través del air stacking o apilamiento de aire6,7,11,17-19).
Cifoescoliosis (Figura 7)
El ángulo de Cobb mide el grado de angulación de la columna vertebral. Este se calcula midiendo el ángulo que produce la intersección de líneas perpendiculares al plano de la primera y última vértebra que encierran la curvatura anormal de la columna, determinando de esta forma la severidad de la escoliosis. Esta puede ser categorizada en leve: curva < 20o, moderada: 20o-40o y severa > 40o(26,27.
Los niños con AME tipo 1 y 2 presentan escoliosis en 78% a 100% de los casos, y esta requiere fijar criterios precisos para su manejo y el momento de la corrección quirúrgica con atrodesis, independientemente a qué técnica e instrumentos sean los que se utilicen26-28.
En ENM de debut temprano, como AE tipo 2, en que se observan angulaciones antes de los 4 años de edad, son un desafío adicional. Todos los pacientes con AME tipo 2 requerirán artrodesis en algún momento de su evolución. Aquellos pacientes que presentan escoliosis significativa entre los 4 y 7 años suelen mantener la flexibi lidad suficiente para retardar la artrodesis posterior hasta los 7 y 9 años27.
Hay predominancia de curvas torácicas y dorso-lumbares derechas y lumbares izquierdas. Suelen ser curvas flexibles que pueden acompañarse en menor frecuencia de cifosis. Iniciada la escoliosis, evoluciona de forma rápida, dado que el paciente no tiene la capacidad de la marcha. En el tipo II su inicio es precoz, con una edad media de cuatro años; se suele indicar corsé o asientos moldeados con el objetivo de proporcionar una mayor estabilidad del tronco en el sedente, permitir un uso funcional de sus manos y espera de la cirugía. En el tipo III, la aparición es más tardía y menos constante, y suele coincidir con la etapa de pérdida de marcha. El uso del corsé es controversial; puede ser utilizado para soporte postural, pero no hay evidencia científica suficiente que demuestre el retraso en la progresión de la curva. Si se utilizan, deben ser fabricados con un recorte abdominal, permitiendo la adecuada excursión diafragmática y el acceso a la gastrostomía, si la tiene26,27.
El tratamiento quirúrgico es el manejo de elección, no hay consenso en relación con la edad óptima para su realización, como tampoco del rol de las órtesis espinales en su manejo. La corrección quirúrgica de la escoliosis debe ser considerada sobre la base de progresión de la curva, la función pulmonar y madurez ósea. La cirugía de escoliosis en niños con prolongada supervivencia proporciona beneficios en el equilibrio sentado, resistencia y cosmesis26,27(Figura 8).
Discusión
La AME es una enfermedad progresiva. En la actualidad existen bases para la intervención con medicación de precisión destinada a potenciar la síntesis de proteína de supervivencia de la motoneurona en pacientes con dos o más copias de SMN2 con el uso rutinario de oligonucleótidos antisentidos intratecales y más recientemente con la incorporación de exoma del SMN1 a través de un vector viral adeno-asociado endovenoso en una sola dosis. Incluso, existen especulaciones respecto al beneficio de tratamientos combinados, en etapa presintomática, en aquellas formas en que el bajo número de copias del SMN2 se relacione a expre siones fenotípicas con debut temprano.
Pese a esto, y al éxito que estas medicaciones de muy alto costo puedan tener en cambiar la expresión clínica de la enfermedad a formas menos severas, los cuidados respiratorios y específicamente los no invasivos son gravitantes en mejorar la sobrevida y la calidad de vida de estos pacientes, con resultados efectivos y eficientes. Aplicables a la totalidad de los pacientes con la colabo ración de sus cuidadores.
Por lo que consideramos importante, como equipo multidisciplinario, generar estrategias de intervención para lograr dar una atención oportuna y adecuada según la etapa que se está cursando1,3,5,8,26,27,29.
Los pacientes con AME de debut temprano mantienen la indemnidad diafragmática, propia de esta enfermedad, sin presentar insuficiencia respiratoria aguda sobre insuficiencia ventilatoria hasta hacer una infección respiratoria aguda alta. Los altos niveles de dependencia, más aún en quienes tienen ausencia de autonomía ventilatoria, con intervenciones respiratorias insuficientes, sin utilizar regularmente los cuidados respiratorios no invasivos que han sido presentados, se relaciona con resultados en que los pacientes son frecuentemente traqueostomizados en el medio latinoamericano1,21.
Los problemas respiratorios son la primera causa de muerte en ENM, la incapacidad para expulsar de forma efectiva las secreciones lleva a alteraciones de la ventilación alveolar y en la protección de la vía aérea, que constituye la principal causa de morbimortalidad11,12,17-19.
Las mediciones funcionales de la CV y PFT, como su relación con la severidad de la expresión fenotípica, que hemos verificado en uno de nuestros centros, son similares con los reportados casi diez años atrás por Bach y colaboradores5,13. No hay otros registros reportados en Latinoamérica de estas sencillas evaluaciones, realizables en forma ambulatoria, para pacientes con AME de presentaciones más tempranas y agresivas. De hecho, revisiones recientes referidas a las características clínicas y de los cuidados de estos pacientes, como recomendaciones respiratorias específicas, las obvian completamente1,8.
Por lo tanto, las recomendaciones que entregamos en este documento de la evaluación funcional respiratoria y las consecuentes intervenciones en los cuidados respiratorios, no se asocian con lo novedoso de la propuesta, sino con alertar a los profesionales de la salud, vinculados a los cuidados de estos pacientes, como a sus familias, de la importancia de estas mediciones rutinarias, más aún cuando existen recomendaciones de estudios de alto costo, como las polisomnografías, que no aportan en la toma de decisión. A diferencia de la verificación de respiración paradojal y parámetros funcionales que ya hemos descrito, que sí permiten tomar decisiones terapéuticas, como el soporte respiratorio no invasivo y protocolos de tos asistida. Esto resulta muy importante cuando más de la mitad de los pacientes con AME tipo 2 y la totalidad de los pacientes con AME tipo 1 tienen respiración paradojal, presentando internaciones en unidades de cuidados críticos, donde la mayoría tendrán riesgo de ser traqueostomizados2,4,5,11,13,17-20.
Las limitaciones de no hacer registros en el seguimiento de los pacientes desde el momento del diagnóstico y contar ocasionalmente sólo con datos de registros transversales impide determinar el momento de la meseta de la CV, que contribuya a aproximarse de mejor manera al deterioro funcional, especialmente el momento de pérdida de la autonomía respiratoria y en consecuencia la dependencia del SVNI2,5,17-19.
Otra importante limitación en el seguimiento de los pacientes es no tener estudios de oxicapnografiìa o CO2 transcutáneo de tendencia para la valoración no invasiva de la hipoventilación asociada a insuficiencia ventilatoria por falla de bomba, inicialmente presentada durante el sueño17-19.
Debe considerarse que en los pacientes con AME tipo 1 con pobre esfuerzo tusígeno los registros obtenidos en los flujos exsuflados o pico flujo exsuflado (PFE) con tos asistida mecánica (Cough assist MIE) son similares a aquellos obtenidos en modelos simulados de insuficiencia respiratoria probando con diferentes programaciones de presiones y tiempos inspiratorios/espiratorios. Es así como es posible concluir que cuando el PFE en los pacientes con AME tipo 2 es < 150 LPM y en los pacientes con AME tipo 1 < 100 LPM, éstos tienen una baja capacidad tusígena autónoma. Sin embargo, es notable que en estos infantes dichos flujos resultan funcionales y que pese a que la CV disminuye hasta llegar a 0 ml, los flujos exuflados aumentan, al no existir compromiso de los músculos bulbares por enfermedad de la motoneurona superior. Esto junto a bajos registros de CV, especialmente en aquellos con respiración paradojal, justifica la recomendación de uso de tos asistida mecánica y SVNI a lo menos nocturno en todos ellos, independiente de registros diurnos de SpO2 y CO2 espirado30-45.
Conclusión
Mucho se ha avanzado en el conocimiento molecular del defecto genético de la AME y en potenciales tratamientos que subsanen dicha alteración, particularmente en la última década. No obstante, los cuidados respiratorios no invasivos, descritos hace más de 20 años, siguen siendo sólo parcialmente difundidos entre los pacientes y los proveedores de salud. Estas recomendaciones sintetizan estándares de manejo sobre consideraciones particulares del escenario latinoamericano para el beneficio de la totalidad de los pacientes y sus familias, siendo, a nuestro entender, un aporte para que los profesionales de la salud puedan enfrentar paradigmas tradicionales.