Introducción
Los tumores pancreáticos malignos ocurren de forma poco frecuente en la población pediátrica. El tumor sólido pseudopapilar de páncreas (TSP) es un tumor de origen epitelial que presenta un bajo potencial de malignidad y excepcionalmente produce metástasis1,2.
Afecta principalmente a mujeres jóvenes con una incidencia aproximada de 0,191 casos por millón en el grupo etario comprendido entre 0 y 19 años y corresponde solo a 0,13% al 2,7% de los tumores primarios de páncreas1,3,4.
Fue descrito por primera vez por Frantz en 1959 y ha sido denominado de diferentes formas: neoplasia papilar epitelial, tumor acinar sólido y quístico, neoplasia papilar quística, carcinoma papilar quístico, tumor sólido y quístico, tumor papilar de bajo grado y tumor de Frantz. Finalmente, en 1996, la Organización Mundial de la Salud (OMS) le dio el nombre de tumor sólido pseudopapilar del páncreas, y lo clasificó dentro del grupo de tumores del páncreas exocrino tipo “borderline”, es decir, con incierto potencial maligno5-7.
Se observa principalmente en mujeres no caucásicas en 90%-95% de los casos (especialmente asiáticas y afroamericanas) que se encuentran en la 2ª y 3ª décadas de vida, con un pico de incidencia en la 3ª (promedio a los 24 años) y un rango que va desde los 2 hasta los 72 años. Los casos que se presentan en la primera década de vida son excepcionales: menos del 10% se reportan en pacientes mayores de 40 años. El TSP rara vez se observa en hombres; se ha encontrado una relación 1:3 hombre-mujer8-13.
El objetivo de esta comunicación es comparar las características del caso clínico presentado con las típicas referidas en la bibliografía al igual que su abordaje terapéutico.
Se cuenta para su realización con el consentimiento de la madre, el asentimiento de la adolescente y el aval del Comité de Ética de la institución.
Caso clínico
Paciente de 12 años, sexo femenino. Sin antecedentes patológicos a destacar. Comenzó 6 días previos a la consulta con dolor a nivel de flanco e hipocondrio izquierdo, intenso, de aparición brusca, acompañado al inicio del cuadro clínico de vómitos biliosos. Al examen se destacaba paciente bien hidratada y perfundida, normocoloreada. Examen pleuropulmonar y cardiovascular normal. A nivel abdominal se evidenciaba ausencia de tumoraciones, visceromegalias, así como de elementos de irritación peritoneal. Fosas lumbares libres e indoloras.
De la analítica se destacaba: hemograma: hemoglobina 11,5 g/dl, glóbulos blancos 8.000 elementos/mm3, plaquetas 238.000 elementos/mm3. Función renal: azoemia 0,17 g/l, creatininemia: 0,54 mg/dl. Ionograma: Na 138 mEq/l, K 4,1 mEq/l, Cl 102 mEq/l. Hepatograma: proteínas totales 8,7 g/dl, albúmina 4,7 g/l, bilirrubina total 0,45 mg/dl, bilirrubina directa 0,13 mg/dl, bilirrubina indirecta 0,32 mg/dl, ASAT 20 U/l, ALAT 5 U/l, fosfatasa alcalina 119 U/L, GGT 11 U/l, LDH 577 U/l, colinesterasa sérica 7.560 U/l. Amilasemia 58 U/l (N menor de 140 UI/l).
Se realizó en primera instancia una ecografía de abdomen que evidenció una masa sólida en el páncreas, de bordes bien delimitados que impresionaba encapsulada con pequeñas áreas quísticas en su interior, de aproximadamente 83 mm de eje anteroposterior, y 86 mm trans versal.
La RNM identificó voluminosa tumoración en relación a la cola de páncreas, de la cual parecía originarse, bien delimitada, de características expansivas de 9,7cm en su eje mayor. Su señal y realce eran heterogéneos, con áreas quísticas y otras hipertensas interpuestas con sectores sólidos. En suma: tumoración mixta (sólido quística) del sector caudal del páncreas que por sus características se planteó que pudiera corresponder a un tumor sólido pseudopapilar (Figura 1).
En el procedimiento quirúrgico se logró la resección completa de la tumoración y del polo inferior de bazo por presentar adherencias a cápsula esplénica. Procedimiento sin complicaciones. En el estudio macroscópico la pieza de resección pesó 330 g; al corte era quística con contenido friable, pardo-rojizo oscuro (Figura 2). Las secciones histológicas mostraron amplias áreas de necrosis y hemorragia entre las que se reconocía una proliferación celular atípica que se disponía en patrón pseudopapilar con células poco cohesivas, poligonales, de mediana talla; sus citoplasmas eran claros con ocasionales glóbulos hialinos (Figura 3). Se evidenciaron núcleos con hendiduras y cromatina en grumos, se observaron escasas mitosis típicas. El estroma presentaba áreas hialinizadas, acúmulos de macrófagos espumosos y escasas espículas de colesterol (Figura 4). Las técnicas de inmunohistoquímica mostraron positividad para enolasa, CD56, Fli-1, betacatenina (Figura 5) y vimentina, siendo negativo para sinaptofisina y cromogranina. Basados en estos hallazgos se realizó diagnóstico anatomopatológico de tumor sólido pseudopapilar de páncreas. Los bordes de resección y el parénquima esplénico se encontraban libres de lesión.
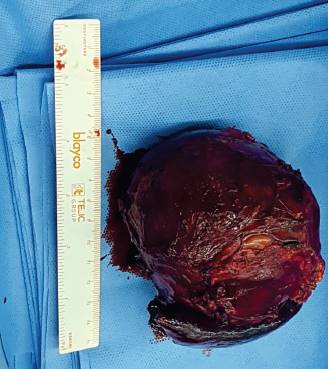
Figura 2: Pieza de resección de tumor pancreático compuesta por un sector ovoideo quístico de color pardo rojizo y un fragmento de parénquima esplénico adherido.
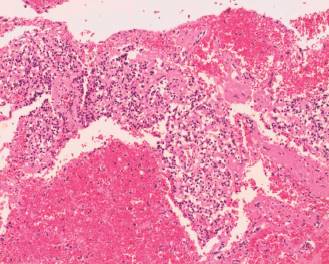
Figura 3: Proliferación con patrón seudopapilar, estroma focalmente hialinizado y amplias áreas de hemorragia (HE, 40 X).
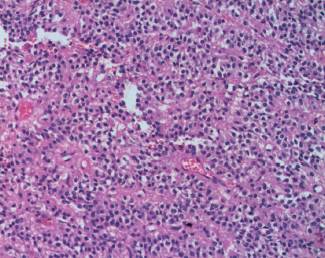
Figura 4: Vista a mayor aumento en la que se observa células con citoplasma claro, poco cohesivas en relación a vasos sanguíneos (HE, 400 X).
Se realizaron controles ecográficos posteriores a la cirugía que no mostraron alteraciones. Se plantea realizar seguimiento a largo plazo.
Discusión
La etiología del TSP aún es desconocida. Se han propuesto tres orígenes probables: las células del conducto pancreático, las acinares o en las células endocrinas. Otra hipótesis es que el TSP se origina de células pancreáticas pluripotenciales o derive de tejido extrapancreático, posiblemente gonadal (ovárico), que pudiera haberse adjuntado al parénquima pancreático durante la embriogénesis temprana. También se ha sospechado la presencia de factores genéticos aun no identificados10,14,15.
Clínicamente la paciente presentó dolor abdominal, siendo este el síntoma más frecuente en niños y adolescentes (87%). Otros signos y síntomas que se encuentran en la bibliografía son: dispepsia (26%), masa palpable (35%), sensación de plenitud o saciedad temprana, ictericia, náuseas y vómitos (32%), y pérdida de peso (18%). La palpación de una masa abdominal puede ser un signo tardío de la enfermedad4,15.
Los TSP son típicamente de gran tamaño, en este caso se trataba de una tumoración de 12 cm de eje mayor siendo el diámetro promedio según la literatura 8-10 cm, habitualmente no hay evidencia de disfunción pancreática o elevación de marcadores tumorales, como ocurrió en esta paciente16).
Ante el hallazgo de una masa pancreática con componente sólido y quístico se debe plantear el diagnóstico diferencial con pseudoquistes, otras neoplasias quísticas tales como las de tipo quístico mucinoso, el adenoma seroso microquístico, tumores de los islotes celulares quísticos entre otros16.
El estudio ecográfico puede evidenciar únicamente el carácter sólido quístico de la masa tumoral, pero no es eficaz para el diagnóstico etiológico17.
La tomografía computarizada abdominal o la RNM son útiles para identificar el TSP. En este caso el estudio de elección para el diagnóstico fue la RNM donde se visualizó señal y realce heterogéneo, con áreas quísticas y otras hipertensas interpuestas con sectores sólidos. Otros hallazgos frecuentes son la presencia de hemorragia dentro de la lesión que se observa en más de 70% de los casos. Las áreas de hiperintensidad en la serie T1 y de hipointensidad baja o no-homogénea en la serie T2 ayudan tanto a identificar las áreas de hemorragia como a diferenciar los TSP de otros tumores pancreáticos16,18.
La realización de la punción biópsica se reserva para los casos en que se presenten dudas diagnósticas19.
Teniendo en cuenta la edad de la paciente, las características imagenlógicas características, la ausencia de marcadores tumorales (alfa FP que orientaría al pancreatoblastoma), y su ubicación en cola pancreática (lo cual implica un procedimiento más simple respecto a la topografía cefálica, que requiere duodenopancreatectomía) se decidió realizar la exéresis quirúrgica.
En este caso, dado que se trataba de un tumor de gran tamaño, se optó por un abordaje convencional que permitió su manipulación evitando su rotura. Las firmes adherencias al polo inferior esplénico motivaron la exéresis del tumor en bloque; incluyendo cola del páncreas y el polo inferior esplénico.
Los TSP son tumores encapsulados y es muy infrecuente la infiltración de estructuras vecinas. La incidencia de metástasis reportada es de 12% a 15% de los casos, presentes en la mayoría al momento del diagnóstico. El sitio más frecuente de metástasis es el hígado. Otras topografías posibles son: bazo, vena porta, peritoneo, ganglios linfáticos. Con menor frecuencia se incluyen: duodeno, epiplón, colon, mesocolon y pulmón10,12,15,19.
En el estudio macroscópico se evidenció una lesión con amplias áreas friables y hemorrágicas. La presencia de una cápsula y de hemorragia intratumoral son características importantes en el diagnóstico, debido a que rara vez se encuentran en otras neoplasias pancreáticas. Histológicamente, para establecer el diagnóstico se requiere la presencia de estructuras seudopapilares con delicados ejes fibrovasculares y cambios pseudoquísticos, ocasionalmente áreas sólidas, combinadas con hemorragia. Otros hallazgos esperables son reacción granulomatosa con cristales de colesterol, células con citoplasma eosinófilo a claro y glóbulos hialinos PAS positivos diastasa resistente características que se observaron en el caso analizado7,20-24.
Esta neoplasia presenta un inmunofenotipo que no le es exclusivo. Es característico y necesario para el diagnóstico la marcación nuclear o nuclear y citoplasmática de la betacatenina. Es frecuente la pérdida de expresión de membrana de E-cadherina, la positividad para vimentina, enolasa neuronal especifíca, CD56 así como también a -1-antitripsina y CD10. En nuestro caso el perfil inmunohistoquímico concuerda con los descritos por la bibliografía7,9,14,23-27.
El tratamiento de elección es la resección quirúrgica completa del TSP que permite una tasa de supervivencia a los 5 años mayor del 95%. Se requiere de márgenes quirúrgicos negativos (resección R0) para lograr control local, prevenir el desarrollo de metástasis, aliviar los síntomas y garantizar resultados óptimos a largo plazo. El tipo de pancreatectomía depende de la localización de la neoplasia en el páncreas y no se requiere de disección linfática debido a lo poco frecuente de las metástasis ganglionares28,29.
Las complicaciones que se pueden presentar posteriores a la cirugía son: fístulas pancreáticas, biliares, infección de herida quirúrgica, absceso abdominal, vaciado gástrico prolongado, sangrado intraabdominal e íleo27,30.
Si bien la resección completa se asocia a un buen pronóstico, es necesario un seguimiento a largo plazo17,26,28.
Conclusiones
El TSP debe ser considerado en adolescentes de sexo femenino que presentan una tumoración pancreática e imagen compatible como en el caso clínico presentado. La resección quirúrgica es el gold standard de su manejo terapéutico.

















