Introducción
La infección del tracto urinario (ITU) es una de las infecciones bacterianas más frecuentes en niños, siendo la principal causa de hipertensión arterial y de cicatrices renales1,2. El riesgo de padecer una ITU depende de la edad y del sexo. En menores de 1 año con fiebre, el riesgo es 7%, siendo más frecuente en varones. En niños mayores la frecuencia de ITU febril y afebril es 7,8%, y predomina en mujeres, especialmente en adolescentes sexualmente activas3.
Escherichia coli (E. coli) es el agente más frecuente independientemente del sexo o edad, siendo el responsable del 86% de los casos de ITU adquirida en la comunidad. Otros microorganismos menos frecuentes son: Klebsiella pneumoniae (4,2%), Proteus mirabilis (3,8%)*.
* * Datos proporcionados por el Laboratorio Central del Centro Hospitalario Pereira Rossell. 2010-2015.
Los antibióticos recomendados para el tratamiento empírico de la ITU varían según la epidemiología local de los principales agentes etiológicos y sus patrones y mecanismos de resistencia. En Uruguay, las Normas nacionales de diagnóstico, tratamiento y prevención de la ITU en niños, recomiendan para el tratamiento de la ITU alta en niños mayores o iguales a 3 meses el uso empírico de cefuroxime si se requiere tratamiento intravenoso o cefuroxime axetil o amoxicilina-clavulánico en caso de tratamiento por vía oral. En caso de cistitis se recomienda amoxicilina-clavulánico o nitrofurantoína. Trimetoprim/sulfametoxazol se utiliza frecuentemente en la quimioprofilaxis en aquellos niños con reflujo vesicoureteral (RVU) grado III o superior, o que presentan cicatrices renales con grados menores de RVU4).
Las reacciones adversas, adherencia al tratamiento y el desarrollo de resistencia antibiótica interfieren con el éxito del tratamiento. En los últimos años ha surgido la utilización de “viejos antimicrobianos”, que habían quedado en desuso, como estrategia para mitigar estos problemas5,6. Un ejemplo es la fosfomicina trometamol (FT), que se ha reintroducido en el mercado como alternativa para el tratamiento de las ITU bajas. Fosfomicina es un agente bactericida derivado del ácido fosfónico que actúa sobre la pared celular bacteriana inhibiendo la síntesis del peptidoglicano. Su mecanismo de acción es la inactivación citosólica de la N-acetylglucosamina enolpyruvyl transferasa (MurA), previniendo la formación del ácido N-acetylmuramico a partir de N-acetyl glucosamina y fosfoenolpiruvato, que es el paso inicial de la síntesis del peptidoglicano7. La fosfomicina atraviesa la pared bacteriana utilizando el sistema de transporte del glycerol-3-phosphate (GlpT) y en segundo lugar el sistema de transporte de las hexosas fosfatos8,9. Existen diversas presentaciones, fosfomicina disódica (para uso parenteral) y FT con buena biodisponibilidad por vía oral10.
Es un antibiótico de amplio espectro con actividad sobre cocos grampositivos (Staphylococcus aureus, Enterococcus faecalis) y gramnegativos (Enterobacteriaceae, Pseudomonas aeruginosa), incluidas enterobacterias productoras de betalactamasas de espectro extendido (BLEE) y carbapenemasas10. También se ha reportado que podría tener actividad sobre biofilms11,12.
Los principales mecanismos de resistencia a fosfomicina son la pérdida o disminución de la producción de los transportadores, la disminución de la afinidad por MurA y la producción de enzimas modificadoras de fosfomicina. Los dos primeros mecanismos son codificados a nivel cromosómico, mientras que la producción de enzimas puede ser codificada tanto a nivel cromosómico como de plásmidos (FosA, FosB, y FosX)13,14. También se han descrito, menos frecuentemente, modificaciones en el sitio blanco de acción (MurA) o hiperproducción de MurA15,16. En algunos países donde se ha comenzado a utilizar frecuentemente fosfomicina se ha detectado resistencia en 1%-4% de los aislamientos de E. coli y 19% de los aislamientos de Klebsiella spp17,18).
Otras ventajas de la FT para el tratamiento de las ITU, además del perfil de actividad antimicrobiana, son rápida absorción vía oral, alta concentración a nivel urinario, buena tolerancia vía oral, efectos adversos poco frecuentes y administración en monodosis19-23).
Las guías del National Institute for Health and Care Excellence (NICE) recomiendan el uso de FT para el tratamiento de las ITU bajas causadas por enterobacterias productoras de BLEE en adultos24,25. Otras sociedades internacionales, como Infectious Diseases Society of America (IDSA) y la European Society for Clinical Microbiology and Infectious Diseases (ESCMID) también han actualizado sus guías y recomiendan su uso para el tratamiento de ITU no complicada en adultos26.
Sin embargo, se dispone de escasos estudios sobre el tratamiento de ITU con FT en niños. Uno de los más grandes, que incluyó 135 niños (entre 1 mes y 16 años), demostró curación bacteriológica (persistencia de cultivos de orina estériles hasta 30 días después del tratamiento) en el 80,2% de los niños tratados, con baja recurrencia27. La indicación de este fármaco se reserva para el tratamiento de la ITU baja en niños mayores de 6 años27. En el año 2019, la Asociación Española de Pediatría publica una guía para el diagnóstico y tratamiento de ITU, en la que recomienda FT para el tratamiento empírico de cistitis en niños mayores de 6 años28.
La inclusión de FT en los protocolos nacionales de tratamiento de la ITU baja requiere estudios de investigación clínico-microbiológicos que permitan conocer el perfil de susceptibilidad y la evolución clínica. Se trata de generar evidencia científica local que avale su inclusión en futuras recomendaciones.
Objetivos
Objetivo general
Describir la evolución clínica y microbiológica de una cohorte de niños mayores de 6 años con ITU baja tratados con FT en monodosis.
Objetivos específicos
1. Describir los microorganismos y el perfil de susceptibilidad antibiótica de los agentes causantes de ITU baja en niños mayores de 6 años.
2. Determinar la susceptibilidad a la fosfomicina en los microorganismos causantes de ITU baja.
3. En los niños con cistitis aguda tratados con FT monodosis describir la evolución clínica a través de las siguientes variables: curación clínica, esterilización de la orina, presencia de efectos adversos, recaídas y reinfecciones en los tres meses posteriores al tratamiento.
Material y método
Se incluyeron niños mayores de 6 años que consultaron en los servicios de emergencia del Hospital Pediátrico, Centro Hospitalario Pereira Rossell y Asociación Española, entre el 1/2/2018 y el 30/6/2019 con probable ITU baja.
Se consideró probable ITU baja la presencia de manifestaciones de síndrome urinario bajo (disuria, polaquiuria, pujos, tenesmo, urgencia miccional) de instalación aguda, sin elementos de síndrome urinario alto como dolor lumbar o fiebre.
Se excluyeron niños menores de 6 años, monorrenos, con insuficiencia renal, con sonda a permanencia o intermitente, vejiga neurógena, así como también aquellos niños cuyo familiar o cuidador no otorgó el consentimiento a participar.
A todos los niños con probable ITU baja se les tomó una muestra de urocultivo por chorro medio con estudio de la susceptibilidad antibiótica, y luego de obtenida la muestra, se prescribió FT 2 g vía oral monodosis.
Se realizó control evolutivo telefónico a las 72 horas y se solicitó urocultivo de control por chorro medio. Los urocultivos se procesaron en el laboratorio de la institución del prestador correspondiente. Se incluyó el seguimiento telefónico a los tres meses de finalizado el tratamiento para evaluar nuevos episodios de ITU.
La captación de los pacientes fue realizada por los profesionales que asisten habitualmente en los centros, previamente entrenados. El seguimiento fue realizado por el equipo investigador.
Se analizaron las siguientes variables:
1. Clínicas: edad, sexo, manifestaciones clínicas, antecedentes de ITU previas, tiempo de resolución clínica, presencia de efectos adversos a FT (control telefónico a las 72 horas); esterilización de urocultivo de control, presencia de recidivas o reinfecciones (con trol telefónico a los tres meses).
2. Paraclínicas: hallazgos en el examen - tira reactiva de orina.
3. Microbiológicas: microorganismos identificados y patrón de susceptibilidad antimicrobiana.
Se aplicaron las siguientes definiciones operativas:
- ITU baja: manifestaciones compatibles con ITU baja más bacteriuria significativa en el urocultivo4.
- Curación clínica: resolución de los síntomas y signos compatibles con ITU luego de 72 horas de haber terminado el tratamiento antibiótico.
- Curación microbiológica: urocultivo sin desarrollo bacteriano luego de 72 horas de haber iniciado el tratamiento con un antibiótico para el cual la bacteria fuera susceptible.
- Falla terapéutica: persistencia de síntomas o signos de ITU o persistencia de desarrollo bacteriano en el urocultivo luego de 72 horas de haber iniciado el tratamiento antibiótico4.
- Recidiva: presencia de síntomas compatibles con ITU que aparecen en los 15 días siguientes a finalizado el tratamiento con un antibiótico adecuado, por el mismo microorganismo4.
- Reinfección: síntomas compatibles con ITU que aparecen luego de los 15 días de terminado el tratamiento y hasta el año por una cepa distinta a la inicial4.
Análisis estadístico. Las variables cualitativas se expresaron en frecuencias absolutas y relativas (%), las variables cuantitativas continuas con mediana y rango. Para el estudio de asociación estadística se utilizó el test de chi cuadrado o exacto de Fisher, según correspondiera. En todos los casos se fijó como nivel de significación de 0,05. Para procesar los datos se utilizó el programa Epi InfoTM 3.5.4.
Consideraciones éticas. Se solicitó consentimiento informado a todos los padres o cuidadores, así como asentimiento a los niños participantes. Esta investigación contó con la aprobación de las direcciones de los centros participantes y de sus respectivos comités de ética en investigación.
Declaración de conflicto de interés. Este proyecto de investigación fue financiado por la Comisión Sectorial de Investigación Científica (CSIC) de la Universidad de la República. El laboratorio Roemmers® proporcionó la FT para el tratamiento de los pacientes incluidos.
Resultados
Durante el período de estudio se incluyeron 126 niños con sospecha de probable ITU baja que recibieron FT. El diagnóstico de ITU baja se confirmó en 37% (46).
La mediana de edad al momento de la consulta de los niños con ITU confirmada fue 9 años y 5 meses (rango 6-14 años), 98% de sexo femenino (45). Presentaban antecedentes de uno o más episodios de ITU previa, 28,3% (13).
La principal manifestación clínica fue disuria 96% (44), seguida de tenesmo 72% (33), poliaquiuria 67% (31), y dolor abdominal 26% (12).
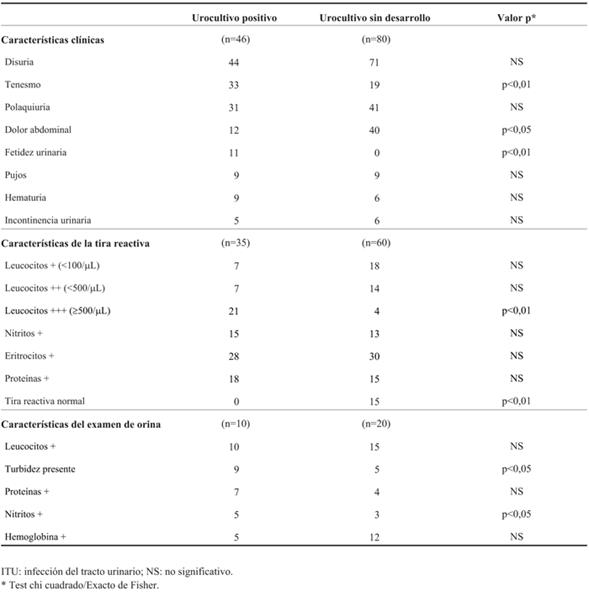
En la (Tabla 1) se comparan las características clínicas y los resultados de la tira reactiva de orina y examen de orina del grupo de niños con ITU baja confirmada versus el grupo de niños con urocultivo sin desarrollo bacteriano. El tenesmo, dolor abdominal y la fetidez en la orina se asociaron significativamente con ITU confirmada, mientras que la tira reactiva de orina normal con ausencia de desarrollo bacteriano en el urocultivo.
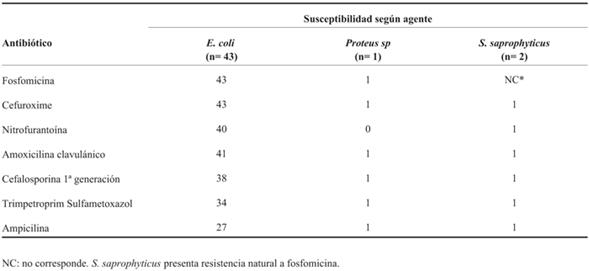
El microorganismo aislado con más frecuencia fue Escherichia coli 93% (43), seguido por Staphylococcus saprophyticus 4% (2) y Proteus sp 2% (1). El perfil de susceptibilidad antimicrobiana se expresa en la (Tabla 2). No se reportaron cepas resistentes a FT en la población incluida, a excepción de los aislamientos de S. saprophyticus que presentan resistencia natural, por lo que no está indicado el estudio de susceptibilidad a este antimicrobiano29).
En cuanto a la evolución clínica, se reportó resolución completa de los síntomas en 96% (44) pacientes. El tiempo de resolución de los síntomas fue 24 horas en 66% (29), 48 horas en 30% (13) y 72 horas en 5% (2). En los dos casos en que hubo persistencia de síntomas se rotó el antimicrobiano a amoxicilina-clavulánico.
Se obtuvo urocultivo de control en 31 de los 46 niños. Se documentó resolución microbiológica en 67,7% (21) y no resolución microbiológica 16,1% (5). En 12,9% (4), el urocultivo fue contaminado. De los cinco casos sin resolución microbiológica, en cuatro persistió E. coli y en uno desarrolló Klebsiella. Se observó resolución clínica en cuatro de estos pacientes, en el restante se rotó el tratamiento antibiótico a amoxicilina clavulánico. Ninguno de ellos reiteró ITU a los tres meses.
Se realizó el seguimiento telefónico a las 72 horas de recibir FT a 121 pacientes. Presentaron efectos adversos a FT 14,8% (18), siendo los más frecuentes: diarrea 13% (16/121), náuseas o vómitos 1,7% (2/121) y cefalea 0,86% (1/121).
En el grupo de los 46 niños en que se confirmó la ITU, solo 9 casos (19,6%) reportaron efectos adversos: diarrea (8/9), vómitos (1/9) y cefalea (1/9).
Se pudo realizar seguimiento telefónico a los tres meses del tratamiento a 44 de los 46 pacientes incluidos. Presentaron reinfecciones al mes de tratamiento seis de ellos, todas ITU bajas.
Discusión
El aumento de la resistencia antibiótica a nivel internacional es considerado por la Organización Mundial de la Salud como una de las grandes amenazas en salud pública (30. El escaso desarrollo de nuevos antimicrobianos obliga a considerar el uso de viejos antibióticos como alternativas terapéuticas. FT ha sido incluida en varias guías de práctica clínica para el tratamiento de la ITU baja en adultos y niños mayores de 6 años, pero las investigaciones que avalan su uso en población pediátrica son escasas24-28. En el presente estudio se propuso evaluar el uso de FT para el tratamiento de la ITU baja en mayores de 6 años, teniendo en consideración los siguientes criterios para la selección racional de los antimicrobianos: características del huésped, del antimicrobiano (respuesta clínica, microbiológica y seguridad) y del agente infeccioso (etiología y perfil de suscep tibilidad antimicrobiana).
En relación con el huésped, la población incluida con ITU confirmada fueron mayoritariamente niñas en edad escolar, previamente sanas. Entre las manifestaciones clínicas al momento de la consulta predominaron síntomas urinarios bajos como disuria, tenesmo, poliaquiuria y dolor abdominal. Si bien estos síntomas en niños continentes son poco específicos y pueden estar presentes en otras enfermedades urológicas y ginecológicas, su aparición debe alertar al pediatra a realizar una adecuada anamnesis y examen físico para luego definir la necesidad de solicitud del examen de orina y urocultivo28,31,32. En esta serie se encontró asociación estadísticamente significativa entre la presencia de tenesmo, dolor abdominal y fetidez urinaria e ITU baja. Se constató un importante número de niños que consultaron por síntomas urinarios bajos inespecíficos, con tira o examen de orina normal, a los que se indicó empíricamente FT monodosis con planteo de ITU que luego no se confirmó, encontrando asociación significativa entre la presencia de tira reactiva de orina normal con ausencia de desarrollo bacteriano en el urocultivo. Si bien son múltiples las causas que pueden explicar este hallazgo, la inadecuada técnica de recolección de la muestra de orina y la concomitancia con infecciones genitales bajas o gastroenteritis son descritas como las más frecuentes28. El diagnóstico inadecuado de ITU contribuye al uso irracional de los antimicrobianos.
En relación con el antimicrobiano y su eficacia, la resolución clínica de los síntomas que motivaron la consulta se observó en la mayoría de los casos en las primeras 48 horas luego de recibir la monodosis de FT. Con el uso de otros antimicrobianos la resolución clínica descrita ocurre generalmente entre el tercer y el quinto día de iniciado el tratamiento33. Los porcentajes de curación clínica y bacteriológica con el uso de FT son comparables con otros antibióticos, aunque la mayoría de los trabajos incluyen población adulta34,35.
El agregado de sal de trometamol favorece la absorción digestiva de la fosfomicina evitando que sea inactivada por la acidez gástrica, aumentando la biodisponibilidad por vía oral respecto a la fosfomicina con sal cálcica, por la misma vía de administración36,37).
La tolerancia y seguridad del uso de FT monodosis son buenas, reportándose efectos adversos leves, sin significación clínica, muchas veces inespecíficos, por lo que pueden atribuirse en oportunidades a otras causas como la propia enfermedad. En su inmensa mayoría son efectos adversos transitorios, principalmente digestivos, como náuseas, vómitos, diarrea y dolor abdominal, coincidiendo con lo reportado en esta serie. Son infrecuentes los reportes en la literatura de efectos adversos graves como angiedema, anemia aplásica, ictericia colestásica y neuritis óptica, que no se observaron en este estudio36-39).
No se registraron recidivas luego de culminado el tratamiento y las reinfecciones ocurrieron en baja proporción en los siguientes tres meses. La mitad de los pacientes que presentaron reinfecciones tenían antecedentes previos de ITU, teniendo en cuenta que cada infección urinaria aumenta el riesgo de recurrencias40).
Los agentes etiológicos encontrados y su perfil de susceptibilidad antimicrobiana son comparables con los descritos en la literatura nacional e internacional. E. coli fue el principal agente de ITU baja en niños mayores de 6 años, presentando elevada susceptibilidad a cefalosporinas de segunda generación (100%), amoxicilina clavulánico (95%) y nitrofurantoína (93%). En Uruguay los patrones de susceptibilidad antibiótica en niños se han mantenido relativamente estables en los últimos años: sensibilidad a ampicilina 35%, ampicilina sulbactam 75%, amoxicilina clavulánico 87%, cefuroxime 97,5%, cefalosporinas de tercera generación 99%, nitro furantoína 96,6%, trimetoprim sulfametoxazol 62%*.
En relación con FT no se registraron resistencias adquiridas en las cepas aisladas. Se destaca que los pacientes con ITU confirmada a S. saprophyticus presentaron buena evolución con resolución clínica y microbiológica a pesar de la resistencia natural in vitro documentada. No está clara la posibilidad de resolución in vivo al momento actual41.
FT comenzó a comercializarse en Uruguay en el año 2015, y su uso en pediatría aún es limitado. Conocer el porcentaje de susceptibilidad de los agentes de ITU en las primeras etapas de su uso resultará útil a la hora de evaluar la evolución del desarrollo de resistencia en el tiempo.
Teniendo en cuenta los resultados de susceptibilidad, respuesta clínica, microbiológica, seguridad y su posología (monodosis) parecería adecuado incluir a FT en las guías de práctica clínica para el tratamiento empírico de la ITU baja en niños mayores de 6 años. Sin embargo, algunas dudas surgen al respecto. Dado que FT es un antibiótico de amplio espectro, con actividad sobre enterobacterias productoras de BLEE y carbapenemasas, en regiones donde la susceptibilidad a otros antibióticos de menor espectro es elevada, ¿es adecuado utilizar FT como primera opción? ¿Cuál es el potencial de seleccionar cepas mutantes resistentes? El desarrollo de cepas mutantes resistentes a fosfomicina parecería ser un fenómeno frecuente en estudios in vitro, fundamentalmente en K. pneumoniae y P. aeruginosa, y más raro en E. coli42. A pesar del desarrollo de resistencia in vitro, la resistencia en patógenos urinarios gramnegativos se ha mantenido estable en aquellos países que han incorporado FT en sus guías terapéuticas43,44. Esta disociación entre la resistencia in vitro e in vivo puede estar dada por varios factores. Por un lado, el costo biológico para la bacteria (como menor capacidad de adherencia al urotelio) y, por otro, la localización de la infección, observándose menor desarrollo de resistencia cuando fosfomicina se utiliza para el tratamiento de ITU en relación con otros sitios de infección, fundamentalmente por la elevada concentración que alcanza en orina el pH ácido de la misma (selecciona menos mutantes resistentes), y los tratamientos cortos (habitualmente monodosis)42. Los factores de riesgo identificados para el desarrollo de resistencia son la presencia de patología nefrourológica anatómica o funcional, el uso de antimicrobianos en forma frecuente o en el último mes, y la utilización de FT como tratamiento de los últimos episodios de ITU baja14-16,45. Otro aspecto a con siderar es el bajo efecto de FT sobre la microbiota intes tinal.
Aunque aún son poco frecuentes en nuestro medio en pediatría, en los últi mos años en varios países han observado un aumento de infecciones por enterobacterias productoras de BLEE provenientes de la comunidad. Estos pacientes podrían beneficiarse del uso de fosfomicina.
Fortalezas y debilidades
Como debilidades se destaca que se trata de una serie pequeña de niños con ITU baja, precedentes únicamente de Montevideo y el área metropolitana. Otra dificultad encontrada fue la obtención de la muestra de urocultivo de control a las 72 horas. Por diversas razones ajenas al equipo investigador y probablemente tras la desaparición de los síntomas, algunas familias prefirieron no acercar a las instituciones participantes la muestra de orina de control.
Como fortalezas, esta constituye la primera experiencia nacional en pediatría de análisis clínico y microbiológico de la respuesta al uso de FT en la ITU baja no complicada en niños mayores de 6 años. Se registró un alto porcentaje del cumplimiento en el seguimiento telefónico tanto en el prestador público como en el privado, así como en la satisfacción reportada por las familias. Serán necesarias otras investigaciones para profundizar el estudio de efectividad clínica-microbiológica de este fármaco, mediante un ensayo clínico que incluya un grupo de control, de selección al azar y extendiendo el se guimiento telefónico para explorar la posibilidad de rein fecciones.
Conclusiones
No se registró resistencia adquirida en los microorganismos aislados. La administración de FT en monodosis para el tratamiento de la ITU baja se asoció con resolución clínica en las primeras 48 horas en la mayoría de los casos. Los efectos adversos comunicados fueron leves y autolimitados, siendo los más frecuentes los digestivos.
Ocurrieron reinfecciones al mes del tratamiento en una proporción pequeña de los pacientes seguidos.
Los resultados de esta primera experiencia en nuestro medio apoyan a considerar FT como alternativa terapéutica en el tratamiento de la ITU baja en niños mayores de 6 años, por su facilidad de administración, perfil de seguridad y elevada susceptibilidad de los agentes etiológicos más frecuentes.












 Curriculum ScienTI
Curriculum ScienTI