Introducción
A pesar de los avances en el conocimiento de las IRAB, la insuficiencia respiratoria sigue siendo la complicación más frecuente. Su tratamiento se basa en el uso de medidas de sostén y en las formas más graves, en soporte ventilatorio. La asistencia ventilatoria mecánica convencional (AVM) requiere hospitalización en centro de tratamiento intensivo (CTI) y no está exenta de riesgos y complicaciones que prolongan la estadía hospitalaria y elevan los costos asistenciales.
En el HP-CHPR funciona la Unidad de Cuidados Respiratorios Especiales Agudos (CREA) para pacientes menores de 24 meses con IRAB grave. Se aplican dos modalidades especiales de tratamiento: ventilación no invasiva (VNI) y cánula nasal de alto flujo (CNAF). La VNI se comenzó a aplicar en salas de cuidados moderados, fuera del área de CTI, desde 2009. La modalidad CNAF se inició en el año 2011.
Oxigenoterapia por cánula nasal de alto flujo1,2
Definición
La oxigenoterapia por CNAF consiste en la administración de oxígeno caliente y humidificado, solo o mezclado con aire, por encima del flujo inspiratorio del paciente, a través de una cánula nasal. La mezcla de gas se humidifica (95%-100%) y se calienta a una temperatura cercana a la corporal (34 °C-40 °C). Se considera alto a un flujo mayor a 2 L/min en recién nacidos y mayor a 4 L/min en niños.
A nivel internacional se ha comunicado su aplicación en niños de todas las edades. La mayor evidencia con respecto a su uso se ha demostrado en lactantes con IRAB. Esta técnica también se ha utilizado en niños mayores, adolescentes y adultos en diversas patologías.
La oxigenoterapia por CNAF disminuye la frecuencia respiratoria (FR) y la frecuencia cardíaca (FC), y mejora la oxigenación, pero tiene escaso efecto sobre el pH y la pCO2. Por tanto, no está indicada en la insuficiencia respiratoria que se acompaña de hipercapnia severa1,2.
Equipos
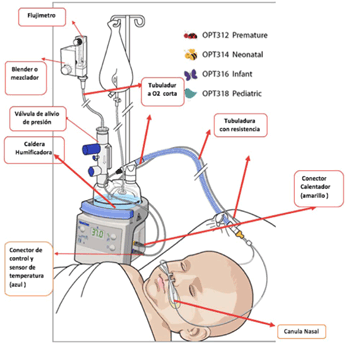
Existen diferentes equipos que pueden utilizarse tanto en niños como en adultos; ningún estudio demuestra que alguno sea superior a los otros. En el CHPR se utiliza el equipo Fisher Paykel®, aprobado por la Food and Drug Administration (FDA) para su uso (Figura 1). Requiere de fuente de aire y oxígeno, calentador-humidificador, circuito y cánulas nasales diseñadas para alto flujo, cortas, y que ocupen no más de la mitad del ancho de las narinas3.
Indicaciones3
En niños con IRAB e insuficiencia respiratoria:
- Score de Tal modificado >8 al momento de la consulta, o score de Tal modificado >6 mantenido sin respuesta al tratamiento.
- Apneas.
- Saturación de oxígeno menor de 90% con oxigenoterapia con máscara de flujo libre.
Se consideran criterios de exclusión: depresión de conciencia, inestabilidad hemodinámica y neumotórax. Criterios gasométricos como pH menor de 7,2 o pCO2 mayor de 55 mmHg se evalúan en conjunto con la clínica.
Otras indicaciones:
- Insuficiencia cardíaca.
- Síndrome de distrés respiratorio (SDR) del recién nacido (RN) pretérmino o término.
- Exacerbaciones agudas de enfermedades respiratorias crónicas (fibrosis quística, broncodisplasia pulmonar, enfermedades neuromusculares).
- Retirada de ventilación invasiva o no invasiva.
- Exacerbación aguda de asma moderada y severa.
- Apneas obstructivas del sueño.
- Obstrucción de la vía aérea superior. Laringitis posextubación.
- Situaciones con necesidad de aporte elevado de oxígeno (por ejemplo, sepsis, shock, anafilaxia).
Ventajas y efectos adversos1-3
Ventajas. Método no invasivo. Bien tolerado por el paciente. Permite comer, recibir medicamentos por vía oral y hablar. Aporta altas concentraciones de oxígeno de ser necesario. Sencillo y fácil de aplicar.
Efectos adversos. Se han reportado como efectos adversos: distensión abdominal por deglución de aire, rinorrea, sialorrea y lesiones de la mucosa nasal en casos de uso prolongado. Existe un potencial riesgo de infección por contaminación. El neumotórax es la complicación más grave, reportada en pocos casos.
Parámetros de inicio3
Los parámetros utilizados al inicio son: flujo de 2 L/kg/min y fracción inspirada de oxígeno (FiO2) de 60%, que se mantienen por las primeras dos horas.
De objetivarse buena respuesta a la técnica (medida por el confort del paciente, la disminución del trabajo respiratorio, la FR y la FC), se mantendrán dichos parámetros. Posteriormente, según la evolución, se disminuirán, primero la FiO2 y luego el flujo, este último luego de lograda la estabilidad clínica (en general, en 12-24 horas). De no objetivarse mejoría, puede aumentarse el flujo en forma progresiva, evaluando la respuesta. Se suspenderá la técnica cuando en el descenso de los parámetros se alcance una FiO2 de 30% y un flujo de 5 L/min. En estos casos se pasará a oxigenoterapia convencional, con catéter nasal.
Al inicio se recomienda la suspensión transitoria de la vía oral. Si esta medida debe prolongarse, se valorará la colocación de sonda oro o nasogástrica (SOG/SNG), para hidratación o alimentación, sobre todo en niños pequeños. El inicio de la alimentación enteral en estos niños será después de las primeras dos horas, con mejoría clínica y sin acidosis, de contar con gasometría de control. Se realiza con preparados para lactantes o pecho ordeñado, con volúmenes pequeños al inicio (1-2 ml/kg/hora), con aumentos progresivos, hasta 4-5 ml/kg/hora. El uso de alimentación por SNG en niños mayores en general no es necesario, ya que la mayoría de los niños puede alimentarse por vía oral durante la técnica. En todos los casos es recomendado el inicio precoz de la alimentación para evitar acidosis y disminuir trabajo respiratorio, así como para brindar confort al paciente.
El tratamiento broncodilatador se indicará de acuerdo al fármaco al cual el paciente tuvo respuesta. Éste se mantiene durante el tratamiento con CNAF.
Se recomienda contar con una radiografía de tórax previo al inicio de la técnica para descartar complicaciones mecánicas e infecciosas. La solicitud de otros estudios complementarios de laboratorio (gasometría venosa, ionograma, hemograma y reactantes de fase aguda) se realizará en forma individualizada. La realización de estos exámenes no debe retrasar el inicio de la técnica.
Los efectos beneficiosos de la técnica se objetivan en las primeras dos horas de inicio del tratamiento; de no ser así debe ser considerada la necesidad de otro tipo de soporte respiratorio.
Deben realizarse controles periódicos de:
- Saturación de oxígeno, FC y FR, en forma continua.
- Conciencia, confort, temperatura corporal, presencia de tirajes y auscultación pleuropulmonar en forma horaria.
- El control gasométrico no es obligatorio en todos los casos; se individualizará según la respuesta a la técnica y la estabilidad clínica.
- Controles del equipo: temperatura, condensación en tubuladuras, nivel de agua en calderas.
Los traslados intra e interhospitalarios del paciente con CNAF deben realizarse con equipo de alto flujo de traslado, de forma de no disminuir el nivel de soporte respiratorio.
Se considera respuesta inadecuada a la técnica cuando existe un score de Tal > 8 mantenido o aumento del puntaje previo a la conexión; acidosis respiratoria con acidemia (pH <7,2); compromiso de conciencia o falla hemodinámica; persistencia de apnea a las 2 horas de iniciada la CNAF. En estas situaciones serán necesarias otras terapias de soporte ventilatorio6,7.
Protocolo de oxigenoterapia de alto flujo3
a) Procedimiento
Una vez que ingresa el paciente:
- Armar el sistema para obtener una temperatura adecuada.
- La caldera de humidificación se carga con agua bidestilada hasta el límite establecido.
- Se utilizan conectores estériles. Recordar colocar la válvula de seguridad.
- Seleccionar tamaño de cánula nasal tomando la de mayor tamaño que permita la salida del aire espirado y no obstruya la ventana nasal (cánula nasal OPtiflow, tamaño acorde al flujo a utilizar).
- Colocar sonda por vía oro o nasogástrica en niños pequeños.
- Aspirar secreciones, reiterando la maniobra de acuerdo a la demanda del paciente.
- Monitorizar con oxímetro de pulso.
- Fijar parámetros de inicio:
- Flujo: 1-2 L/kg/min.
- FiO2: 0,6.
- Mantener tratamiento broncodilatador de acuerdo a la respuesta previa.
- Realizar fisioterapia respiratoria.
b) Monitorización clínica:
- Frecuencia respiratoria.
- Frecuencia cardíaca.
- Score de Tal.
- Examen respiratorio
- Laboratorio: gasometría a las 2 horas (puede no realizarse si la gasometría inicial no tenía alteraciones severas y se objetiva buena respuesta clínica).
c) Problemas frecuentes
Agua en las tubuladuras: se debe asegurar el descenso continuo del agua bidestilada a la caldera. En ocasiones esto se ve dificultado por el elevado flujo. En estos casos se debe llenar el depósito hasta la marca en forma manual, de forma progresiva.
d) Cambios en los parámetros
El descenso de la FIO2 debe hacerse en forma progresiva hasta 0,3%, con el objetivo de mantener la saturación de O2 de 95% o más. Debe esperarse como mínimo 30 minutos de estabilidad antes de realizar una modificación en el sistema. Posteriormente, de acuerdo a la situación clínica y la respuesta al cambio, se podrá descender el flujo.
e) Reinicio de la vía oral
Una vez que el paciente esté estable y sin acidemia, se puede iniciar un aporte de 1 ml/kg/h por gastroclisis. Se aumenta el aporte de acuerdo a la tolerancia y la situación clínica hasta 6 ml/kg/hora. En niños mayores, se puede iniciar alimentación por vía oral.
f) Pasaje a cánula nasal
Se realiza luego de 24 horas de tratamiento y 72 del inicio de la enfermedad, cuando el requerimiento de FIO2 sea de 0,3 y el flujo de 3 l/min.
g) Interrupción de la técnica
- Ausencia de respuesta al tratamiento.
- Peoría clínica con aumento del score de Tal.
- Presenta criterios de derivación a UCI:
- Acidosis respiratoria con acidemia.
- Alteración de conciencia GSG <10.
- Sepsis.
- Apneas reiteradas.
Existe numerosa evidencia que señala los beneficios de la aplicación de VNI en niños pequeños, cursando fallo respiratorio agudo, en particular secundario a IRAB. Ofrece al paciente un soporte ventilatorio, a través de una máscara facial, sin la necesidad de realizar intubación orotraqueal. En los últimos años ha sido incorporada como alternativa terapéutica en las recomendaciones de tratamiento de casos graves de bronquiolitis, previo a la AVM.
Las ventajas señaladas de la VNI sobre la ventilación convencional son: disminución de infecciones nosocomiales; disminución del uso de antibióticos y, al evitar la sedación profunda y la relajación muscular, se acorta la estadía hospitalaria.
Las complicaciones de la VNI son en general leves e infrecuentes, y están vinculadas a fuga de aire a la cara, que puede producir lesión cutánea u ocular. Estas complicaciones pueden prevenirse protegiendo la piel con parches hidrocoloides.
En el paciente que cursa una IRAB la VNI produce como efecto un apoyo de los músculos inspiratorios, mejorando la oxigenación, disminuyendo la frecuencia respiratoria y el trabajo respiratorio. También evita la producción de atelectasias. En las primeras horas de su aplicación es cuando se objetivan los beneficios y se definen el éxito o fracaso de la técnica.
CPAP (Continuous positive airway pressure). Es una modalidad de VNI con un único nivel de presión. Mantiene una presión continua durante todo el ciclo respiratorio mediante un flujo continuo, siendo espontánea la respiración del paciente.
BiPAP (Bilevel positive airway pressure). En esta modalidad la ventilación es realizada con dos niveles de presión: una sincronizada con el esfuerzo inspiratorio del paciente (presión positiva durante la inspiración o IPAP) y otra durante la espiración (EPAP). La diferencia entre IPAP y EPAP es el nivel de presión de soporte (PS).
En caso de que el paciente no haga un número mínimo de respiraciones (o el respirador no detecta la respiración espontánea del niño), el respirador cicla con una frecuencia y un tiempo inspiratorio (Ti) programado (presión controlada). La VNI con doble nivel de presión mejora el volumen corriente y el intercambio gaseoso, disminuye el trabajo respiratorio y la frecuencia respiratoria.
La modalidad a utilizar dependerá de la causa de la insuficiencia respiratoria, del nivel de soporte respiratorio requerido así como de la tolerancia del paciente.
Materiales necesarios3
a) Interfases: existen interfases nasales, buconasales y faciales completas.
- Buconasales: son las más utilizadas en pediatría.
- Nasales: pueden ser utilizadas en lactantes o en niños mayores de 10 años cuando las fugas en la interfase buconasal sean elevadas y el paciente no se encuentre cómodo. Requieren que el paciente permanezca con la boca cerrada para poder alcanzar la presión programada.
El equipo de VNI no puede ser un sistema cerrado paciente-interfase-respirador. Por este motivo debe contar con un puerto de exhalación de anhídrido carbónico, ya sea en la interfase o en la tubuladura.
b) Arnés: las interfases deben ser adosadas a la cara mediante fijadores elásticos, impidiendo las fugas, pero sin generar una compresión exagerada. Los más utilizados son los gorros.
c) Ventiladores: se utilizan ventiladores específicos para VNI. En el CHPR el modelo utilizado es el Stellar ResMed®.
Protocolo de ventilación no invasiva3
- Previo al inicio de la técnica se debe evaluar al paciente para determinar si la misma está indicada. De esta evaluación depende el éxito.
- Evaluar presencia de contraindicaciones.
- Es recomendable contar con una radiografía de tórax previo al inicio de la técnica fundamentalmente para descartar contraindicaciones.
1. Indicaciones
- Niños menores de 2 años con IRAB de probable etiología viral, con score de Tal mayor o igual a 6 mantenido a pesar del tratamiento, o score de Tal mayor a 7.
Crisis asmática moderada/severa que no mejora con tratamiento de primera línea.
En niños con obstrucción de la vía aérea superior la VNI puede reducir el trabajo respiratorio y mejorar el intercambio gaseoso. Es recomendable que se realice en un área que cuente con expertos en el manejo de la vía aérea13.
En niños con síndrome de distrés respiratorio agudo, que presenten una relación presión arterial de oxígeno/fracción inspirada de oxígeno (PaFiO2) menor a 150, no debe indicarse VNI en sala de cuidados moderados14.
2. Contraindicaciones
Son contraindicaciones para esta técnica:
- Depresión de conciencia.
- Sepsis.
- Fallo hemodinámico.
- Malformaciones faciales.
- Neumotórax.
- Cirugía digestiva alta con sutura reciente.
3. Factores predictores de éxito
Son predictores de éxito: mejoría de la frecuencia cardíaca, la frecuencia respiratoria y el intercambio gaseoso en las primeras 2 horas del inicio de la técnica.
4. Preparación del paciente
- Retirar la ropa; el lactante debe permanecer solo con pañales, el niño mayor con la menor cantidad de ropa que asegure su confort.
- Mantener oxigenoterapia.
- Posición en decúbito dorsal a 30º.
- Colocar oxímetro de pulso.
- Aspirar secreciones de cada narina previa instilación de suero fisiológico (SF) o suero salino hipertónico (SSH), cuando sea necesario.
- Aspirar secreciones bucofaríngeas (lactante).
- Colocar sonda nasogástrica u orogástrica según la edad, realizar el vaciado gástrico. Mantener la sonda abierta a bolsa a nivel de la cama.
- Suspender la vía oral hasta la estabilización, reinstalándose lo antes posible por goteo continuo, lo que habitualmente se logra a las 2 o 3 horas.
- Corroborar la permeabilidad de la vía venosa. Evaluar la necesidad de una carga con suero fisiológico a 10-20 ml/kg. Mantener una adecuada hidratación i/v.
- Armado y montaje del equipo: ventilador, humidificador cargado con agua, filtro antibacteriano, tubuladura, válvula espiratoria, mascarilla y arnés de sujeción. Debe conectarse al oxígeno.
- Elección de máscara y arnés. La máscara buconasal debe tener el tamaño adecuado a la cara y forma del cráneo. Se deben proteger las zonas de apoyo en la cara con parches de hidrocoloide. Debe evitarse que la máscara esté muy apretada (debe permitir el paso de dos dedos entre ésta y la cara). La fijación debe ser simétrica. Para la colocación y ajuste de la interfase son necesarios dos operadores.
5. Fijación de parámetros.
a) Encendido
b) Acceso menú clínico
c) Introduzca parámetros: MODO ST (spontaneous/time). MODO CPAP.
d) Parámetros iniciales:
- Se puede iniciar en modo CPAP.
- CPAP inicial de 5 - 7 cm H2O.
- FiO2 mínima necesaria para SatO2 >93%.
- Interfase:
a) Pieza nasal en niños con peso menor a 5 kg.
b) Máscara buconasal con peso mayor a 5 kg.
c) Niños de mayor peso evaluar pieza nasal según fugas y tolerancia.
- En niños con peso mayor a 5 kg, si presentan trabajo respiratorio marcado o peoría, se iniciará presión soporte:
- Presión inspiratoria máxima (IPAP): 9-11.
- Presión espiratoria (EPAP): 4-6.
- Presión de soporte (PS): 5-6.
- Sensibilidad del disparo: alto o muy alto.
- Sensibilidad del ciclado: alto.
- Frecuencia respiratoria respaldo: 20 rpm (habitualmente menor a la del paciente, 10-15 rpm menos).
- Tiempo inspiratorio máximo en ventilaciones de respaldo: 0,7-0,8 segundos.
- Tiempo inspiratorio mínimo en ventilaciones de respaldo 0,2-0,3 segundos.
- Puntos a recordar:
- IPAP: controla la ventilación. A mayor IPAP, mayor volumen corriente generado en la fase inspiratoria.
- EPAP: mejora la capacidad residual funcional y la oxigenación.
- Rampa: regula la velocidad de entrada del aire. Fundamental para la adaptación del niño. Cuanto mayor sea la rampa, más lento va a entrar el aire y mejor se adaptará el niño pequeño.
- FR: se activa como rescate cuando la FR del paciente cae por debajo de la programada. Si se programa muy cercana a la del paciente, puede interferir con su ritmo respiratorio.
- Objetivo: VC 8-10 ml/kg, descenso de FR en la primera hora.
- Recordar que con la VNI no se logran FiO2 mayores a 50%.
e) Se fijan alarmas.
f) Oxígeno en extremo proximal a un flujo inicial de 5 l/min. En la (Tabla 1) se muestran los valores de FiO2, que se logran de acuerdo a los valores del flujo de oxígeno y la IPAP.
6. Conexión
- Se coloca la máscara y luego se fija. Debe quedar ajustada a la cara, pero sin comprimir excesivamente.
- Evaluar previo a la conexión la necesidad de carga con suero fisiológico (10 ml/kg). La presión positiva intratorácica puede disminuir el retorno venoso y precipitar la inestabilidad hemodinámica.
- Puede requerir sedación para lograr la adaptación. Se inicia con lorazepam 0,05 mg/kg i/v diluido cada 4 h.
- Mantener tratamiento broncodilatador que venía recibiendo según respuesta.
- De acuerdo a los antecedentes de crisis broncoobstructivas previas se valorará la utilización de corticoides.
- Todas las maniobras que requieran retirar la máscara (nebulizaciones, aspiración de secreciones, recolocación de máscara) deben ser realizadas por dos operadores.
7. Controles
- De todo el circuito, tubuladuras, flujímetros (litros de O2), salida de O2.
- Filtro (no debe estar mojado).
- Humidificador: con agua a temperatura adecuada (que no condense en la tubuladura).
- Máscara: no debe estar demasiado ajustada, ni obstruir la narina o la boca.
- Integridad de la piel en zonas de apoyo de la máscara.
- La respuesta terapéutica se evalúa clínicamente y con gasometría.
- Clínicamente: - Adaptación y tolerancia a la máscara. - Conciencia y excitación. - Frecuencia respiratoria y adaptación al equipo. - En el equipo: respiraciones espontáneas que presenta. - Monitor: saturación de O2; frecuencia cardíaca.
- Gasometría: a las 2 h. Si el paciente se estabiliza, no es necesario reiterar la gasometría a las 12 y 24 horas.
8. Reinicio de la vía oral
Se puede indicar entre las 2 y 6 horas luego de la conexión, si se encuentra estabilizado, sin acidemia. Se sugiere comenzar con volúmenes 1 ml/kg/h e ir aumentando según la situación clínica y la tolerancia hasta 4-5 ml/kg/h.
Luego de retomar la vía oral se debe descender y luego suspender aporte parenteral.
9. Ajuste de parámetros.
Se realizan luego de 20 minutos de iniciado el soporte.
Objetivo buscado:
- Disminuir el trabajo respiratorio: si el paciente mantiene polipnea y tiraje, aumentar la PS de 2 en 2. Recordar que si se aumenta la PS disminuye la FIO2 entregada.
- Disminuir la hiperinsuflación. Aumentar EPAP 6-8 para contrarrestar la auto-PEEP. Si a la auscultación se encuentran sibilancias, administrar broncodilatadores según la respuesta previa
- Aumentar la saturación de O2. En caso de procesos con compromiso parenquimatoso (neumonía, atelectasia), se puede aumentar la EPAP para reclutar alvéolos y ampliar la superficie de intercambio. En niños con procesos bronquiales, sin compromiso parenquimatoso, se puede aumentar el flujo de 02 y por lo tanto la FIO2.
- Disminución de la sensibilidad del disparo. Se pueden ajustar los valores de inicio del disparo o el ciclado al mínimo (alto). Se evalúa con el aumento de los ciclos asistidos. Se acorta el tiempo entre la contracción diafragmática y el disparo del ventilador
- Valores máximos a utilizar:
- EPAP de 10.
- IPAP de 22.
- PS 12.
Consideraciones:
- De preferencia realizar una modificación por vez y evaluar sobre todo para disminuir los parámetros.
- Luego de realizar cualquier cambio, esperar un plazo prudente para evaluar el impacto, antes de realizar una nueva modificación.
- Las modificaciones se deben realizar con una intención predefinida. Plantear objetivos evaluables, cuantificables y medibles, que deben quedar registrados en la evolución clínica.
- Estas modificaciones deben ser realizadas en un paciente estable, tolerando la máscara, adaptado a la técnica y luego de una correcta aspiración de secreciones nasofaríngeas.
10. Respuesta esperada
- Respuesta adecuada. Situación clínica que no progresa, mantiene escala Tal igual o menor al ingreso, con valores gasométricos similares o mejores. Ausencia de acidosis respiratoria o mixta. Conducta: una vez estabilizado se mantiene conducta durante 48 horas como mínimo. Se continúa el tratamiento broncodilatador según la respuesta inicial. A las 48 horas de internación se inicia el proceso de destete.
- Respuesta no adecuada. Posibles causas a evaluar:
a)Intolerancia a la máscara o no adaptación a la técnica.
- Descartar la presencia de complicaciones mecánicas (barotrauma) como neumotórax, neumomediastino. Buscar crepitación y desviación mediastinal. Valorar nueva radiografía de tórax.
- Descartar causas de excitación (hambre, dolor de cualquier origen, máscara muy ajustada, posición incómoda, efecto adverso paradojal de la sedación, etcétera).
- Una vez alejadas las causas previas, ajustar sedación con lorazepan 0,05 mg/kg o midazolam 0,2 mg/kg i/v.
b)Asincronía mantenida no compensada del paciente-ventilador (desadaptación). Siempre chequear interfase y fugas excesivas. Descartar las tres causas posibles más frecuentes:
- Respiratoria:
- El equipo no capta las respiraciones del paciente y por tanto no apoya las respiraciones. Debe aumentarse la frecuencia respiratoria a 30/min o sensibilidad alta.
- Broncoobstrucción: tratamiento específico de acuerdo a respuesta con broncodilatadores o aspiración de secreciones.
- Compromiso parenquimatoso: aumentar parámetros del equipo IPAP.
- Metabólica.
- Acidosis metabólica - pH mayor de 7,20 y/o BE entre 0 y -10: revisar y ajustar estado de hidratación y aporte diario. - pH menor de 7,20 y BE mayor de -10: solicitar dosificación de lactato en sangre, si es mayor de 2, con pCO2 menor a 45 mm Hg, se corrige con suero bicarbonatado 1/6 molar según fórmula. Si la pCO2 es mayor a 45 mmHg, se administrará suero fisiológico 20 ml/kg. Considerar aumentar IPAP y sedación del paciente.
- Fiebre o dolor: evaluar y tratar
- Neurológica. Excitación psicomotriz: revisar vía venosa, revisar lorazepam recibido (dosis, dilución).
c)Progresión de enfermedad. Puede corresponder a:
- Fatiga inminente (tardío).
- No responde a la terapéutica, persiste con dificultad respiratoria y score de Tal elevado.
- Coinfección bacteriana (evaluar probable SIRS o sepsis).
- Apneas reiteradas.
d)Complicaciones
- Alteración de conciencia grave por exceso de sedación. Puede determinar como complicaciones:
- Bradipnea.
- Bradicardia.
- Caída de saturación de O2 por disminución de la ventilación alveolar.
- Acidemia grave con pH menor a 7,15.
- Inestabilidad hemodinámica.
- Taquicardia sinusal, descartar causa: hipovolemia, fiebre, dolor, anemia, insuficiencia cardíaca, efecto de fármacos.
- Complicaciones mecánicas (neumotórax, neumomediastino).
Criterios de suspensión de la técnica
- Intolerancia de la técnica o deterioro clínico.
- Progresión del score de Tal.
- Alteración de conciencia.
- Utilización de máximos recursos terapéuticos: requerimientos de FiO2 >0,5; EPAP >8, IPAP >20, PS >12.
- Gasometría con acidemia con pH <7,15.
- Inestabilidad hemodinámica.
- Sospecha de sepsis.
Destete