Introducción
Las miocardiopatías constituyen un grupo de enfermedades que se presentan con alteraciones en el miocardio ventricular que no pueden ser explicadas por una sobrecarga anormal o malformación congénita. Corresponden a alteraciones en la circulación coronaria, taquiarritmias crónicas, exposición a toxinas, infecciones o a desórdenes subyacentes. La clasificación fenotípica clásica incluye las formas hipertrófica, dilatada, restrictiva y no compactada. Una categoría mixta surge del solapamiento de todas las anteriores1.
La miocardiopatía arritmogénica del ventrículo derecho (MAVD) es una variedad hereditaria, infiltrativa, con sustitución progresiva de miocardio ventricular por tejido fibroadiposo, afectando principalmente el ventrículo derecho, aunque puede comprometer también al ventrículo izquierdo. La pérdida progresiva de miocardio específico determina la aparición de arritmias ventriculares y un aumento del riesgo de fibrilación ventricular y muerte súbita (MS)2. Es una patología de herencia autosómica dominante con penetrancia incompleta y expresividad variable3.
La MAVD tiene una incidencia mayor en varones (2,4:1)2. Los síntomas habitualmente se presentan entre la segunda y quinta década de la vida: palpitaciones, dolor precordial, sincope, y MS. Ésta puede ser la manifestación inicial de la enfermedad, sobre todo en aquellos que realizan actividad física. Lo más característico es la taquicardia ventricular, sostenida o no, con imagen de bloqueo de rama izquierda. La aparición de síntomas en la edad pediátrica es infrecuente4. Debe sospecharse sistemáticamente en pacientes con arritmias ventriculares originadas en el ventrículo derecho, especialmente si se acompaña de disfunción ventricular. Los niños presentan más episodios de MS, mientras que los adultos son más propensos a episodios de taquicardia ventricular sostenida (TVS). Sin embargo, el fenotipo clínico y la evolución de la enfermedad son similares entre ambas poblaciones5.
El diagnóstico se basa en un score que integra alteraciones morfológicas y funcionales del VD, alteraciones en la despolarización y repolarización, sustitución fibroadiposa, arritmias ventriculares, antecedentes familiares y mutaciones genéticas específicas6). La presencia de ondas T invertidas en el electrocardiograma (ECG), la dispersión mecánica del ventrículo izquierdo y la actividad física de alta exigencia constituyen los factores de riesgo independientes de mayor importancia. Los sujetos que presentan estos tres elementos tienen un riesgo diez veces mayor de presentar un evento arrítmico en los próximos dos años7,8. La colocación de un desfibrilador automático implantable (DAI) es el único tratamiento que hasta la fecha ha demostrado reducir la mortalidad en la MAVD2. Otros tratamientos, como cambios en el estilo de vida, uso de medicamentos betabloqueantes o antiarrítmicos y ablación por radiofrecuencia han demostrado buenos resultados en disminuir la sintomatología, pero no la mortalidad2,9,10. Más de la mitad de los pacientes con desfibrilador han recibido descargas apropiadas durante un seguimiento a largo plazo2,9,11. Se expone este paciente con el objetivo de destacar su presentación y su grave pronóstico de no mediar las medidas terapéuticas adecuadas.
Observación clínica
Paciente de 12 años, sexo masculino. El padre fallece por muerte sú bita a los 49 años. A los 7 años se constata arritmia bien tolerada durante el control pediátrico. Se deriva a cardiólogo. De la paraclínica se destaca:
ECG: ritmo sinusal de 80 cpm, onda P y Pr normal, PR 0,14 ms. Extrasistolía ventricular monomorfa frecuente con imagen de bloqueo de rama izquierda. Qtc 0,42 ms (Figura 1).
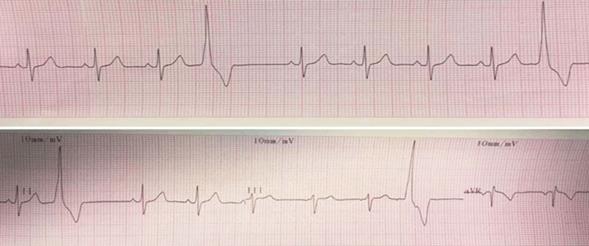
Figura 1: Extrasístoles ventriculares con imagen de bloqueo de rama izquierda en electrocardiograma.
Holter: frecuencia cardíaca promedio de 98 cpm. La frecuencia cardíaca mínima fue de 48 cpm y la máxima de 162 cpm. Episodios de taquicardia ventricular no sostenida de hasta diez latidos, 8.327 episodios de ectopías ventriculares monomorfas con imagen de bloqueo de rama izquierda. El paciente no refirió síntomas (Figura 2).
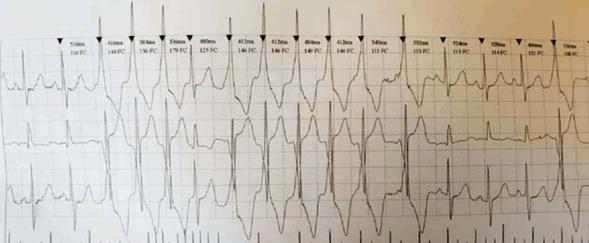
Figura 2: Monitorización Holter en donde se evidencian episodios de TVNS de hasta diez latidos. Vuelve a ritmo sinusal.
Ergometría: presencia de taquicardia ventricular no sostenida. Extrasístoles que aparecen en reposo y al esfuerzo, pero que desaparecen al máximo esfuerzo. Se constata conducción por vía accesoria, intermitente y que también desaparece al máximo esfuerzo.
Ecocardiograma: ventrículo derecho levemente dilatado sin alteraciones parietales. FEVI 65%. Resto normal.
Resonancia nuclear magnética: VI de dimensiones normales. Función sistólica en límite inferior, sin alteraciones de la contractilidad. VD de dimensiones normales, aquinesia de la pared inferior con disfunción sistólica; FEVD 39%, sin zonas de disquinesia o aneurismas.
Con la paraclínica previa y dada la persistencia de la arritmia de origen ventricular, sin respuesta al tratamiento farmacológico, se decide la realización de estudio electrofisiológico que evidencia hipoquinesia inferior del VD. Se realiza ablación en zona trabeculada del tracto de salida del VD, identificada como el origen de las extrasístoles. Dada la persistencia de la arritmia, a pesar del procedimiento se decide la implantación de un cardiodesfibrilador a la edad de 9 años.
Actualmente mantiene tratamiento farmacológico con betabloqueantes, manteniendo episodios aislados de extrasístoles ventriculares, aunque no ha presentado descargas del DAI.
Discusión
La literatura reporta que la enfermedad debuta habitualmente en pacientes de mayor edad que el de nuestro caso12. La incidencia reportada es de 1,01 cada 100.000 habitantes al año entre los 15 a 19 años, siendo muy rara su aparición antes de los 10 años13.
El padre de nuestro paciente falleció de MS antes de los 50 años. Se ha reportado que hasta un tercio de los familiares de primera línea desarrollan MAVD y que hermanos presentan un riesgo incluso mayor, por lo que deben ser estudiados14. Durante la realización de este trabajo, el hermano mayor fue referido para estudio.
Se utilizó para el diagnóstico en nuestro paciente los criterios establecidos por la Task Force 20104. Su sensibilidad en niños no ha sido demostrada. Sin embargo, ciertos elementos, como la remodelación apical y la disminución de la tensión longitudinal del VD, han demostrado mayor asociación con la MAVD en pacientes jóvenes5. Se recomiendan además la utilización de técnicas de identificación génica para evitar la implantación innecesaria de un desfibrilador15,16.
El diagnóstico imagenológico está basado en la demostración de alteraciones morfológicas (aneurismas) o alteraciones funcionales, aquinesia, disquinesia o asincronía de la pared. Esto traduce la presencia de sustitución fibroadiposa del miocardio3. En nuestro paciente se constató mediante ecografía y resonancia nuclear magnética (RNM) que el VD estaba levemente dilatado y presentaba aquinesia de la pared inferior. La interpretación de los resultados de la RNM, más sensible que la ecografía, es altamente dependiente del observador y requiere un adecuado entrenamiento13,17,18.
No se realizó biopsia de miocardio. Si bien la comprobación histológica de degeneración fibroadiposa miocárdica es considerada gold standard en el diagnóstico, la biopsia endocárdica es poco sensible en esta patología, en parte debido a la afectación miocárdica irregular y a la falta de alteraciones en etapas tempranas de la enfermedad, aun cuando ésta ya es sintomática y suponga un riesgo de MS19.
En nuestro paciente la enfermedad rápidamente mostró su carácter progresivo. A pesar de recibir tratamiento con múltiples fármacos (betabloqueantes y antiarrítmicos) se constató un aumento de extrasístoles y episodios de TVNS. Múltiples estudios reportan que la presencia de dichos fenómenos constituye un factor de riesgo para el desarrollo de taquicardia ventricular y MS. No existe evidencia que demuestre reducción en la mortalidad con tratamiento farmacológico en la MAVD, sin embargo, eliminar o descender la frecuencia de arritmias y la acción simpática sobre el corazón podría ser teóricamente útil en estos pacientes20,21.
Esto también contribuyó a la alta sospecha de esta enfermedad, por lo que se decidió realizar un estudio electrofisiológico con ablación. El procedimiento involucra la identificación del circuito de reentrada mediante estimulación, y su ablación utilizando calor por radiofrecuencia. El procedimiento produjo una leve mejoría transitoria, sin embargo, no logró eliminar la arritmia, lo que define el riesgo mantenido de MS. La literatura evidencia que la naturaleza progresiva, difusa e irregular de la enfermedad hace que existan altas tasas de recurrencia22).
La ablación por radiofrecuencia no reduce la mortalidad en la MAVD, sin embargo, provoca una disminución en la actividad arritmogénica y por lo tanto menor dependencia de tratamiento farmacológico10.
El advenimiento de técnicas como el mapeo tridimensional del endocardio y epicardio ha permitido el desarrollo de técnicas con mejores resultados. Incluso algunos trabajos muestran que dichos procedimientos podrían eliminar la arritmia de manera permanente23.
Se decidió, dada la clara progresión de la enfermedad y la poca o nula respuesta a los tratamientos instituidos, la colocación de un desfibrilador automático implantable. Este es el único tratamiento que ha demostrado disminuir la mortalidad en la MAVD10. La intervención se realizó con éxito. Hasta la fecha el paciente no ha requerido descargas de desfibrilación o resincronización del dispositivo. Esto, sin duda, configura un elemento de buen pronóstico. Faltan estudios acerca del beneficio del DAI para la prevención de muerte súbita en la población pediátrica.
Nuestro paciente se mantuvo asintomático hasta el momento actual. La insuficiencia cardíaca es una manifestación tardía en esta patología. Se evitó, sin embargo, la actividad física extenuante, ya que podría acelerar la progresión de la enfermedad. Si bien no está claro el umbral seguro de actividad física, se desaconseja el deporte de tipo competitivo con excepción de aquellos de baja intensidad2,21. Evitar el sobrepeso y la hipertensión podría enlentecer la progresión de los síntomas, por lo que un abordaje higiénico dietético es fundamental.
Conclusiones
Si bien la MAVD es infrecuente en pediatría, la importancia de conocer esta patología radica en la posibilidad de mejorar el pronóstico en aquellos pacientes que se beneficien de un desfibrilador implantable. El pediatra debe tener un alto índice de sospecha, y en aquellos pacientes que sea necesario, realizar un abordaje en conjunto con el cardiólogo en vistas a un tratamiento y seguimiento efectivo.















