Introducción
El síndrome branquio-oto-renal (BOR) es un trastorno autosómico dominante, poco frecuente, que se presenta con anomalías de los segundos arcos branquiales otológicos y renales1,2. Su incidencia es de 1:40.000, pero en niños con sordera profunda puede llegar a 2%3-5. Forma parte de los llamados síndromes del espectro BOR, junto con el síndrome branquio-ótico (BO), que se presenta con muchas de las alteraciones del BOR pero sin afectación renal.
El síndrome BOR presenta expresividad variable y penetrancia reducida, con gran heterogeneidad clínica inter e intrafamiliar5,6.
Los hallazgos clínicos más comunes son las fístulas o quistes en el cuello, déficit auditivo, malformaciones del oído externo con apéndices u hoyuelos preauriculares, afectación renal uni o bilateral que va de moderada con hipoplasia renal a severa con agenesia renal incompatible con la vida, que es causa de abortos espontáneos. Las alteraciones renales, si no son tratadas, pueden desencadenar una enfermedad renal terminal que requiere diálisis o trasplante renal6,7.
Otras manifestaciones pueden estar presentes, como estenosis o atresia del canal auditivo externo. Anomalías del oído medio como malformación, mal posición o dislocación. Malformaciones del oído interno, que incluyen hipoplasia coclear, alargamiento coclear, acueducto vestibular, hipoplasia del canal lateral semicircular5.
Si bien no es frecuente la aparición de manifestaciones cardíacas, Aycicek y colaboradores identificaron una familia con diagnóstico de BOR en la que el 71,4% de los afectados presentó prolapso de válvula mitral8. Por otro lado, Taylor y colaboradores reportaron dos casos de bradicardia significativa ante anestesia con sevoflurano9.
La discapacidad intelectual o el retraso psicomotor no se asocian al síndrome de BOR; si están presentes, deben hacer sospechar un síndrome de genes contiguos que involucra el gen EYA1 u otro síndrome de espectro fenotípico similar al de BOR2.
El diagnóstico clínico se realiza con tres o más criterios mayores, con dos criterios mayores y dos criterios menores, o un criterio mayor más un familiar de primera generación afectado (Tabla 1).
El síndrome es causado principalmente por mutaciones en el gen EYA1, las cuales se detectan en el 40% de los pacientes. EYA1 codifica para una tirosín fosfatasa que desfosforila específicamente el residuo Tyr142 de la histona H2AX, lo que le permite actuar como un regulador transcripcional durante la embriogénesis3,10. La función de EYA1 es esencial para el normal desarrollo de arcos branquiales, oídos y riñones10. Se han identificado más de 100 mutaciones en EYA1, incluidas: sustituciones, pequeños indels y grandes deleciones, en pacientes con síndromes BOR, BO y anomalías de segmento anterior, indicando que estos síndromes son alélicos3,11.
Con menor frecuencia se han identificado mutaciones en los genes SIX1 y SIX5, los cuales interaccionan con EYA1 para formar complejos transcripcionales7,12. No es posible encontrar mutaciones causantes en cerca de la mitad de los pacientes con esta enfermedad3,6,10, por lo que es posible que otros genes participen en su etiopatogenia.
Aquí se presenta un caso ilustrativo, analizado a nivel clínico y de genética molecular. Si bien se trata de una enfermedad que es infrecuente, la misma puede explicar hasta el 2% de los casos de sordera congénita profunda13 y otras alteraciones congénitas cuya valoración sería incompleta si no se diagnostican como parte de un síndrome.
Caso clínico
DMP SM; 29 días de vida.
De los antecedentes perinatales se destaca: producto de octava gestación de padres no consanguíneos. Madre de 39 años, sana. Embarazo bien controlado, mal tolerado por diabetes mellitus gestacional y estado hipertensivo del embarazo, recibió tratamiento con dieta. Síndrome antifosfolipídico. Exudado vaginorrectal para detectar estreptococo del grupo B positivo, quimioprofilaxis completa. VIH y VDRL negativa. ARh positiva. Recién nacido de término, edad gestacional 38 semanas, parto vaginal sin incidentes. PN: 2.830 g, talla 46 cm, PC: 34 cm. Apgar: 6/8. Del examen al nacimiento se destaca fístula en cara lateral de cuello que drena líquido seroso. Pasa a alojamiento conjunto. A las 20 horas de vida, episodio de vómitos reiterados escasos y dificultades en la succión, con buena evolución, alta a domicilio a los 6 días de vida.
De los antecedentes familiares surge: padre y medio hermana por línea paterna portadores de fositas preauriculares. No han sido estudiados en relación con otros aspectos del fenotipo (Figura 1).
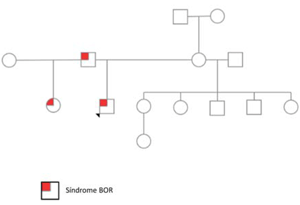
Figura 1: Genealogía de la familia del paciente, la cual es compatible con una herencia autosómica dominante. La punta de flecha señala al caso índice.
A los 29 días de vida, requirió ingreso a sala por fiebre sin foco clínico evidente. En esa oportunidad se constata una infección urinaria producida por el germen Klebsiella pneumoniae. Recibe tratamiento con ceftriaxona intravenoso durante diez días, con buena evolución.
Del examen físico se destaca: implantación baja de las orejas, fosita preauricular bilateral, pliegue medio de pabellón auricular ausente, fístula lateral en cuello a izquierda, fosita lateral en cuello a derecha (contralateral) con tumoración de 2,5 mm subcutánea, boca y lengua sin particularidades. Tercer y cuarto dedos de ambas manos de igual longitud (Figura 2, A y B). CV: RR 120 cpm, soplo sistólico 2/6 en mesocardio, pulsos presentes. PP y ABD: normal. Genitales: testes en bolsas. Ano s/p. PNM: normal, buen tono, buena succión.
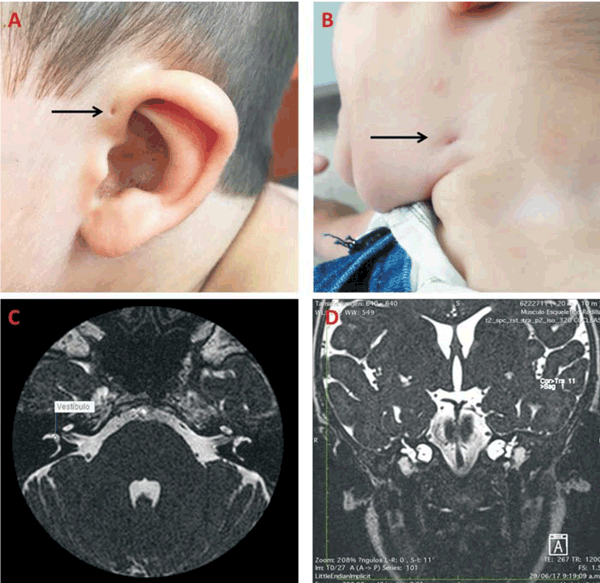
Figura 2: Hallazgos clínicos y de RNM en el paciente. La flecha señala en: A) hoyuelo preauricular; B) fístula de cuello. En C) y D) se ven cortes axial y sagital en RNM, secuencias en T2, donde se observa dilatación quística de vestíbulo asociada a displasia de canal semicircular lateral mayor a derecha, marcado engrosamiento del conducto y saco endolinfático a izquierda. Displasia coclear.
Se plantea clínicamente síndrome genético BOR, por lo que se solicita valoración por genetista y otorrinolaringólogo (ORL).
Valorado por cardiólogo infantil, se descarta cardiopatía congénita (electrocardiograma y ecocardiograma normales).
Se repitió la pesquisa auditiva (emisiones otoacústicas) en tres oportunidades, siendo negativa. Valorado por ORL en el Centro Hospitalario Pereira Rossell: timpanograma normal (oído medio). Estudio anatómico de oído medio (resonancia nuclear magnética) (Figura 2, C y D): anomalías congénitas cócleo-vestibulares y de canales semicirculares (dilatación quística del vestíbulo asociado a displasia del canal semicircular lateral bilateral, mayor a derecha). Marcado engrosamiento del conducto y saco endolinfático a izquierda. Displasia coclear dada por disminución del número de vueltas de la cóclea. No se aprecian alteraciones de trayectos de pares craneales VII y VII. En la evolución se realizaron potenciales evocados auditivos que evidenciaron hipoacusia severa de oído izquierdo y severa a profunda de oído derecho.
Se realizaron dos cirugías para colocación de tubos transtimpánicos con éxito. El cierre quirúrgico de las fistulas fue planteado para una instancia posterior.
Ecografía de aparato urinario: riñones levemente disminuidos de tamaño (hipoplasia renal), de ecoestructura normal (4/10/2016). Se realiza seguimiento semestral de la función renal. Cistouretrografía miccional retrógrada normal (28/12/2016). Ecografía abdominal y transfontanelares normales (4/10/2016).
Con el planteo de síndrome BOR tipo 1 se realizó estudio molecular mediante secuenciación completa de la región codificante y regiones intrónicas adyacentes (±8 pb) del gen EYA1 (8q13.3) mediante tecnología de secuenciación de nueva generación (MiSeq,Illumina, Inc). Se identificó la variante: NM_000503.5: c.1081C>T (p.Arg361*) en heterocigosis en el gen EYA1.
Discusión
Presentamos el caso de un niño con síndrome de BOR. El diagnóstico se realizó en base a los antecedentes familiares y a la clínica con criterios diagnósticos mayores: fositas preauriculares, fístulas branquiales, sordera, compromiso renal (hipoplasia renal)1,4. Otros hallazgos clínicos en este paciente que aumentan la sospecha clínica son las alteraciones del conducto auditivo externo y las anomalías del oído medio e interno (displasia coclear).
En este caso no se plantearon diagnósticos diferenciales dado lo claro de la presentación clínica y los antecedentes familiares. Se debe plantear en algunos casos con otros síndromes del espectro BOR y con algunos de los múltiples síndromes que asocian sordera congénita.
El diagnóstico etiológico específico fue confirmado a nivel del genoma, al encontrar una variante patogénica en el gen EYA1. La variante c.1081C>T (p.Arg361TER) introduce un codón de terminación prematuro en el codón 361, lo que produce una proteína truncada que conduce a una pérdida de casi el 40% de la proteína (tamaño normal 592 aminoácidos NP_742055.1). Por lo tanto, es considerada una variante de efecto mayor que probablemente genere una pérdida de función de la proteína involucrada. Frecuentemente, los ARNm con este tipo de mutaciones son degradados por el mecanismo de degradación del ARNm mediada por mutaciones terminadoras14, lo que acentúa la pérdida de función del producto proteico.
Se trata de un gen con baja tolerancia a la haploinsuficiencia (https://decipher.sanger.ac.uk/), lo que apoya que sus mutaciones se manifiesten como dominantes15, modo de herencia propuesto para esta enfermedad. La variante encontrada en este paciente ha sido reportada y clasificada previamente como patogénica7,11,16 en bases de datos de variantes: ClinVar (https://www.ncbi.nlm.nih.gov/clinvar/variation/7943/), dbSNP: rs12190 9202 (https://www.ncbi.nlm.nih.gov/snp). Por lo tanto, con la información actualmente disponible debe considerarse una variante patogénica y que explica el fenotipo.
En relación con el manejo de este caso, se debe resaltar que las anomalías branquiales pueden resolverse por cirugía cuando las fístulas predisponen a infecciones reiteradas o con fines estéticos2. Las dificultades auditivas requieren intervención médica, ya que si no se tratan, pueden tener consecuencias en el desarrollo del lenguaje. Los problemas auditivos tienen una gran variabilidad en su severidad y pueden resolverse fácilmente con el uso de audífonos, aunque en ocasiones son necesarias cirugías sobre el canal auditivo o implante coclear17. En pacientes con este síndrome se recomienda realizar una evaluación completa de la agudeza auditiva con potenciales evocados, emisiones, audiometría y estudios de imagen de huesos temporales si la alteración de la audición es progresiva13. También es recomendable realizar audiometrías seriadas para evaluar la progresión de la alteración auditiva.
Las alteraciones renales deben controlarse con estudio de la función renal, ecografía renal o pielografía intravenosa para determinar la extensión del daño renal y prevenir la aparición de enfermedad renal terminal5. El 6% de los pacientes desarrollarán patología renal severa y pueden requerir terapia de reemplazo renal con diálisis o trasplante renal2,3. En este paciente, que se presenta con una hipoplasia renal, el seguimiento debe ser dirigido a la observación del patrón de crecimiento renal, junto con la evaluación de la función renal6.
Es recomendable realizar el estudio molecular a los familiares del caso índice, ya que debido a la baja penetrancia y a la expresividad variable, individuos sin signos clínicos de la enfermedad pueden transmitirla.
Con la confirmación molecular se puede ofrecer, además, un diagnóstico prenatal o preimplantacional a los individuos portadores de la mutación. Sin embargo, la amplia variabilidad en las manifestaciones clínicas hace complejo al asesoramiento genético y la toma de decisiones reproductivas6.
Conclusiones
Presentamos un caso clínico de una enfermedad poco frecuente pero que puede explicar hasta el 2% de los casos de sordera congénita profunda y 6% de los pacientes con enfermedad renal terminal4. El diagnóstico clínico del síndrome BOR es complejo debido a la gran variabilidad en su presentación y puede sospecharse tan solo por la presencia de fositas preauriculares. En esta oportunidad, completamos el proceso diagnóstico al encontrar una variante patogénica en uno de los genes asociados a este síndrome. Este hallazgo puede ser utilizado para detectar precozmente individuos en riesgo e implementar medidas de prevención para disminuir la morbilidad y mortalidad por el síndrome BOR.
















