Introducción
Se define prescripción de medicamentos off label como aquella que se realiza en condiciones distintas a las indicadas en la ficha técnica o prospecto y, por lo tanto, diferentes para las que fueron autorizados y registrados. Esto implica la prescripción de medicamentos con diferente indicación, posología (dosis, intervalo), vía de administración, así como a edades y pesos diferentes. En este tipo de prescripción no existe suficiente evidencia científica; la eficacia y seguridad no han sido claramente contrastadas1.
En la práctica clínica la prescripción de medicamentos off label es frecuente en niños. Algunos ejemplos son la indicación de adrenalina inyectable por vía nebulizada, sildenafil para la hipertensión pulmonar, amitriptilina para la depresión en niños a partir de los 12 años y la profilaxis de migraña, ibuprofeno para el cierre del conducto arterioso persistente en recién nacidos prematuros, sulfato de magnesio intravenoso o nebulizado para la crisis asmática incluido el “estatus asmático”2.
La falta de disponibilidad de fórmulas farmacéuticas apropiadas, el escaso desarrollo de estudios clínicos y la escasa evidencia científica y la extrapolación de información derivada de estudios realizados en adultos, explican en parte esta práctica. La investigación clínica con medicamentos en niños es compleja, ya que plantea problemas éticos. Por otra parte, esta población no resulta económicamente “rentable” para la industria farmacéutica restándole interés a su desarrollo3).
El uso de medicamentos off label conlleva la necesidad de realizar una mayor cantidad de investigaciones que involucren a niños y adolescentes con la finalidad de dar respuestas a sus problemas específicos de salud. Es importante promover el desarrollo responsable de ensayos clínicos u otro tipo de investigaciones con la protección necesaria hacia esta población vulnerable. Sus aportes contribuirían a disminuir el uso de tratamientos no probados o insuficientemente probados en estos gru pos etarios.
La prescripción off label expone a los niños a posibles fallos terapéuticos y mayor riesgo de efectos adversos3,4. Sin embargo, las necesidades asistenciales requieren en muchas ocasiones continuar prescribiendo medicamentos en estas condiciones. En este caso es fundamental sustentar la prescripción off label con la mejor información disponible, realizando un análisis crítico de la relación beneficio-riesgo e incluyendo a los padres en la toma de decisiones5.
En algunos países el uso off label de medicamentos es legal quedando fuera de las garantías de las agencias reguladoras de medicamentos, y en caso de “reclamos”, fuera de la responsabilidad de las compañías farmacéuticas6,7. En Uruguay no se dispone de un marco normativo que reglamente este tipo de uso. Independientemente de esto, es necesaria la sensibilización e información de los profesionales de la salud, y especialmente de los pediatras, en relación con el uso y prescripción de medi camentos en estas condiciones.
Se desconoce el conocimiento que tienen los pediatras sobre este tema en nuestro medio. En función de estas consideraciones, se diseñó una investigación para intentar responder las siguientes interrogantes: los profesionales que asisten niños, ¿conocen todas las dimensiones del concepto off label?, ¿identifican usos off label en medicamentos de prescripción frecuente en pediatría?, ¿solicitan consentimiento informado?
Objetivo
Describir el conocimiento que tienen estudiantes de posgrado de Pediatría y pediatras sobre la prescripción off label.
Metodología
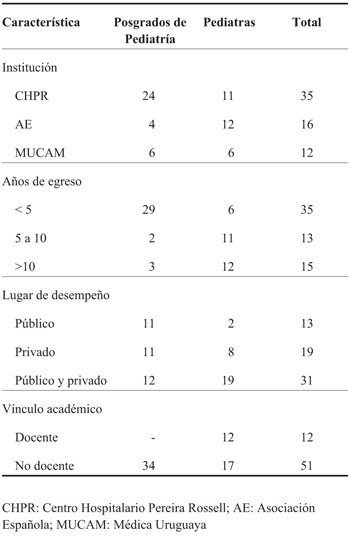
Se realizó una encuesta (Anexo 1) anónima, voluntaria, a estudiantes de posgrado de Pediatría y pediatras que se desempeñan en ámbitos públicos o privados durante julio y agosto de 2015. Se seleccionó una muestra por conveniencia en el Centro Hospitalario Pereira Rossell (CHPR), Asociación Española (AE) y Médica Uru guaya (MUCAM).
En relación con los encuestados se registró formación, lugar de desempeño de su actividad profesional (público, privado, niveles de atención) y vínculo aca démico (docente o no).
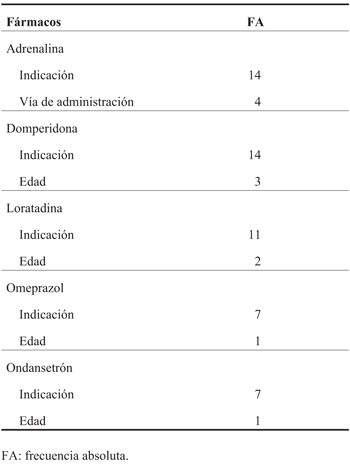
Para indagar el conocimiento sobre la prescripción off label se incluyeron preguntas dirigidas a explorar si conocían el término off label o “fuera de prospecto” y su definición; en caso afirmativo si lo podían conceptualizar en todas sus dimensiones (indicación, dosis, intervalo, vía de administración, edad o peso) y si lo consideraban un problema en su práctica clínica. Se indagaron, además, las prácticas frente a la prescripción off label: frecuencia de la prescripción, información a los padres, registro en historia clínica y fuentes de información utilizadas para prescribir dichos medicamentos. Se seleccionaron cinco fármacos de prescripción frecuente en pediatría que presentan alguna forma de uso off label: adrenalina, domperidona, loratadina, omeprazol y ondansetrón2. Para determinar los usos off label de estos medicamentos se consideraron los usos registrados en el Ministerio de Salud y, por lo tanto, que figuran en los prospectos. Se incluyeron preguntas dirigidas a iden tificar uso off label (ver Anexo 2).
Análisis estadístico: las variables se expresaron en frecuencias absolutas y relativas. Para el procesamiento de los datos se utilizó Microsoft Excel 2013.
Aspectos éticos: el protocolo de estudio fue aprobado por el Comité de Ética de la Facultad de Medicina y contó con la autorización de cada institución. Se solicitó consentimiento informado a cada participante y se resguardó la confidencialidad de los datos.
Resultados
Se encuestaron 63 profesionales (35 en el CHPR, 16 en la AE y 12 en la MUCAM), de los cuales 34 eran posgrados y 29 pediatras; entre los pediatras, 12 eran docentes. Refirieron desempeñar su actividad en el ámbito público 13, en el privado 19 y en ambos 31. En la (Tabla 1) se resumen las características de los encuestados.
Refirieron conocer el término off label 25 de los 63 encuestados (40%): 11 posgrados y 14 pediatras; de estos últimos, 9 eran docentes. Tenían el concepto correcto 15 encuestados (24%). De estos, 3 lo conceptualizaron en todas sus categorías. En la (Tabla 2) se muestran las dimensiones del concepto manejado por ellos. Utilizaban el término de forma inadecuada o imprecisa 10 encuestados: 2 que consideraban el uso off label igual a uso compasivo, 3 que consideraban que no disponían de ficha técnica y 5 que refirieron desconocer el significado con claridad.
Tabla 2: Dimensiones del concepto off label que manejaban los encuestados que tenían el concepto correcto del término (N=15)*

Lo consideraron un problema en su práctica clínica 17/25 y 3 manifestaron que nunca utilizaron medicamentos en estas condiciones. La frecuencia con la que estos profesionales consideraron prescribir medicamentos off label fue: casi nunca 6, a veces 15, casi siempre 1. Refirieron informar a los padres acerca de este uso 11 y registrarlo en la historia clínica 15.
En la (Tabla 3) se muestran las fuentes de información que utilizan los encuestados para obtener evidencia sobre el uso de medicamentos off label.
Tabla 3: Fuentes de información para obtener evidencia sobre el uso de medicamentos off label. (N= 25)*

Identificaron uso off label de adrenalina 18, domperidona 17, loratadina 13, omeprazol 8 y ondansetrón 8. En la (Tabla 4) se resumen las formas de uso off label identificadas para cada uno de los fármacos incluidos en la encuesta.
Discusión
A pesar de las limitaciones metodológicas de este trabajo relacionadas con el pequeño tamaño de la muestra sin estimación de este y su selección por conveniencia, siendo una muestra heterogénea, se puede observar que la mayoría de los encuestados no conocían el término prescripción off label o fuera de prospecto. Si bien para conocer su prevalencia es necesario realizar encuestas nacionales con muestras representativas, estos hallazgos permiten señalar que es probable que la falta de información en relación con este tipo de uso y prescripción de medicamentos sea un problema. Más aún considerando que aquellos que refirieron tener alguna información, no lo conceptualizaron en todas sus dimensiones o categorías, o tenían un concepto erróneo del mismo. Algunos encuestados lo caracterizaron como medicamento de uso compasivo; sin embargo, este uso se define como la prescripción y aplicación de medicamentos no autorizados a pacientes que no están incluidos en un ensayo clínico, con el fin de atender situaciones clínicas concretas7. Otros encuestados consideraron que se trataba de medicamentos sin ficha técnica, no obstante, estos son los medicamentos que se encuentran en fases de investigación y que solo serán prescriptos en el contexto de un ensayo clínico con consentimiento del paciente y bajo las normativas internacionales y na cionales de la ética de la investigación8.
La prescripción off label no implica un uso indebido, ilegal, contraindicado o de investigación. Si bien nuestros formularios terapéuticos de medicamentos no identifican el uso off label, se destaca que 40% de los medicamentos del vademécum realizado por el Comité de Medicamentos de la Asociación Española de Pediatría tienen por lo menos una indicación off label. Existen referencias que señalan que en aproximadamente 70% de los pacientes pediátricos se prescribe un fármaco bajo esas condiciones y que ha aumentado en los últimos años9-11. En esta serie, a pesar de que la mayoría lo reconocen como un problema, muchos profesionales tienen dificultad en admitir que lo prescriben con frecuencia. En este trabajo, quienes conocían el significado pudieron identificar usos off label de fármacos que se utilizan frecuentemente en la práctica clínica, lo que reflejaría que la frecuencia de la prescripción es más elevada que la que reportaron los encuestados. Futuros estudios son necesarios para aproximarnos al perfil de uso de estos fármacos en pediatría en Uruguay.
La toma de decisiones terapéuticas siempre debe basarse en la mejor evidencia disponible y la importancia de los beneficios para el paciente individual12. Con frecuencia, los clínicos basan su prescripción en consensos y guías, considerándolos como la fuente de mayor evidencia, lo que lleva a no cuestionar su contenido. Las guías deberían incluir la aclaración de si un medicamento se recomienda en condiciones off label. A la hora de utilizar la información de las guías, el clínico debería evaluar la calidad metodológica de su elaboración, las fuentes de información utilizadas y la existencia o no de apoyo de la industria farmacéutica.
La industria farmacéutica destina gran parte de su presupuesto a la promoción de sus productos. En este trabajo solo un médico refiere basarse en la información brindada por los visitadores médicos, pero probablemente este resultado se encuentra sesgado. Varios estudios han mostrado que una proporción importante de médicos confía en la información de origen comercial como fuente primaria para seleccionar medicamentos y “aprender acerca” de aquellos poco conocidos. Se ha demostrado que cuanto más confían los médicos en este tipo de información, menos adecuada es su pres cripción13.
La prescripción off label muchas veces es la mejor alternativa que se dispone para el tratamiento de un caso particular. Pero es importante la sensibilización del equipo de salud frente a las implicancias y probables riesgos que puede conllevar este tipo de prescripción14. Se debe informar a los padres, solicitar consentimiento informado y registrar de forma adecuada en la historia clínica. En un estudio español se constató que solo dos de cada diez pediatras llegan a completar todos los pasos necesarios para el registro correcto del uso off label de medicamentos sin indicaciones específicas para niños. Por otro lado, los profesionales de la salud deben conocer su rol y comprometerse en la farmacovigilancia. Esto es importante para detectar posibles efectos ad versos y notificarlos de forma pertinente5,6.
Es importante reforzar la enseñanza de estos conceptos en la formación grado y posgrado, promoviendo el desarrollo de un espíritu crítico para el análisis de la literatura biomédica y la adquisición de las habilidades de prescripción para toda la vida profesional13.