Introducción
La hemorragia alveolar difusa (HAD) se define como el pasaje de sangre desde los capilares pulmonares al espacio alveolar secundario a efracción de la membrana alvéolo-capilar, es una entidad clínica grave y poco frecuente. La gran mayoría de los casos ocurren a consecuencia de enfermedades autoinmunes o inflamatorias pulmonares que dañan la estructura de la membrana alvéolo-capilar. La HAD de causa no inmunológica es aún más infrecuente tanto en la población pediátrica como en adultos. La etapa neonatal constituye una excepción, ya que en este período la hemorragia alveolar no es una entidad tan infrecuente llegando a tener una incidencia de hasta el 10% de los prematuros de muy bajo peso al nacer1,2.
Si bien las bases fisiopatológicas de esta enfermedad están bien establecidas, la forma en la que interactúan estos factores no están del todo claras3.
En el presente trabajo se discuten cuatro casos clínicos que presentaron HAD no inmune, en base a los cuales desarrollamos una hipótesis con el objetivo de explicar la interacción entre los factores que inciden en la instauración de dicha entidad, ya sea por debilitamiento de la membrana alvéolo-capilar y/o la presencia de otros fac tores determinantes.
Casos clínicos
Caso 1
Recién nacido pretérmino de 26 semanas, cesárea de urgencia por restricción del crecimiento intrauterino. Pequeño para edad gestacional, peso al nacer 653 g, vigoroso. Recibe dos dosis de surfactante a través de sonda orotraqueal. Extubación coordinada a las 6 horas de vida a ventilación no invasiva presión positiva espiratoria (cPAP) nasal. Ecocardiograma a las 36 horas de vida constata ductus arterioso (DA) permeable, por lo que se inicia tratamiento farmacológico con paracetamol. Aumento de requerimientos de oxígeno y soporte respiratorio desde las 44 horas de vida. Intubación orotraqueal (IOT), se constata sangrado en vía aérea. A pesar de soporte respiratorio, apoyo inotrópico y reposición con hemoderivados, fallece a las 54 horas de vida. Estudio anatomopatológico confirma HAD.
Caso 2
Recién nacido de término, parto vaginal, líquido amniótico meconial fluido. Adecuado para la edad gestacional, vigoroso. Desarrolla dificultad respiratoria con requerimiento de oxígeno. A las 12 horas de vida deterioro respiratorio, IOT de emergencia. Durante intubación se constata sangrado en vía aérea. Trastorno de coagulación con sangrado digestivo y respiratorio, requiriendo reposición de hemoderivados. Ventilación de alta frecuencia oscilatoria con altos parámetros, tres dosis de surfactante. Se administra factor protrombínico humano. Evolución favorable del control de sangrado pulmonar. Asistencia ventilatoria mecánica (AVM) durante 10 días, apoyo con cPAP nasal y luego oxígeno de alto flujo (OAF) durante 15 días. Alta a domicilio a los 30 días del ingreso, requerimiento de oxígeno hasta los 3 meses de vida.
Caso 3
Lactante de 5 meses. Coartación de aorta y comunicación interventricular amplia. En el período neonatal se realiza reparación de coartación y cerclaje de tronco de arteria pulmonar. En la evolución alejada se constata cerclaje ajustado que determina hipoflujo pulmonar con tendencia a la desaturación. Nueva cirugía a los cinco meses con cierre de CIV y retiro de cerclaje en arteria pulmonar. Cursa posoperatorio inicialmente sin eventos, estabilidad hemodinámica y respiratoria. Extubación coordinada a las tres horas de reingreso, drenaje quirúrgico mediastinal con gasto bajo de sangre. Radiografía de tórax (RxTx) posextubación se constata edema pulmonar (Figura 1a). Tendencia a la desaturación y trabajo respiratorio en aumento, a las 24 horas IOT y AVM. Sangrado severo por vía aérea, parámetros ventilatorios elevados y reposición de hemoderivados. Ecocardiograma no evidencia lesiones residuales con buena función sistólica biventricular. Paciente fallece a las 48 horas del posoperatorio. Estudio anatomopatológico confirma presencia de HAD y gran coágulo perihe pático por pasaje inadvertido de sangre a peritoneo.
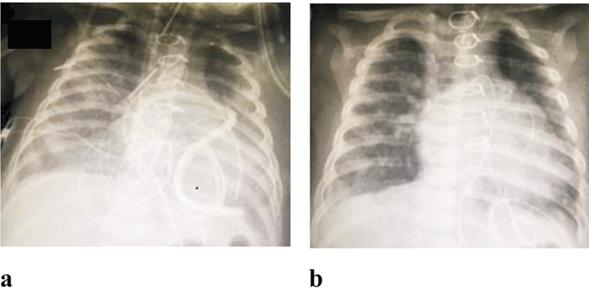
Figura 1: Radiografía de tórax de los casos 3 (a) y 4 (b) donde se evidencia la opacidad inhomogénea pulmonar secundario al pasaje de sangre al intersticio pulmonar y al espacio alveolar. Radiográficamente no es posible distinguir dicho patrón de otras causas de infiltrado intersticial o consolidación alveolar (por ejemplo, edema pulmonar, neumonía, etcétera).
Caso 4
Lactante de 6 meses. Síndrome de Down y canal atrioventricular (AV) completo. Posoperatorio inmediato de reparación de canal AV con extubación a las 6 horas de la intervención quirúrgica. En las primeras 24 horas trabajo respiratorio que requiere IOT y AVM, soplo holo sistólico a la auscultación. RxTx evidencia edema pulmonar (Figura 1b). Sangrado en vía aérea que se controla con incremento de parámetros ventilatorios y reposición de hemoderivados. Ecocardiograma posoperatorio constata insuficiencia valvular severa a izquierda con fracción de eyección de ventrículo izquierdo conservada. A la semana de la cirugía se reinterviene reparando insuficiencia valvular, alta a domicilio a los 15 días con requerimiento de oxígeno durante 30 días.
Discusión
La membrana alvéolo-capilar pulmonar constituye una interfase aire-agua que permite el intercambio gaseoso entre los alvéolos y los capilares, es requisito fundamental para dicha función tener el menor espesor para permitir la difusión de gases. Esta característica convierte al lecho capilar pulmonar en un sitio único en el árbol vascular, con potencial fragilidad y riesgo de rotura3,4.
La membrana alvéolo-capilar posee una gran resistencia que le permite hacer frente a una amplia variedad de situaciones fisiológicas y patológicas. Dicha resistencia está dada por la membrana basal conformada básicamente por colágeno tipo IV dispuesto como una malla entre la célula endotelial y el neumocito tipo I. A esto se suma el soporte generado por el intersticio pulmonar y la disposición alveolar, estableciendo un sistema de sostén capilar (Figura 2a)3,4.
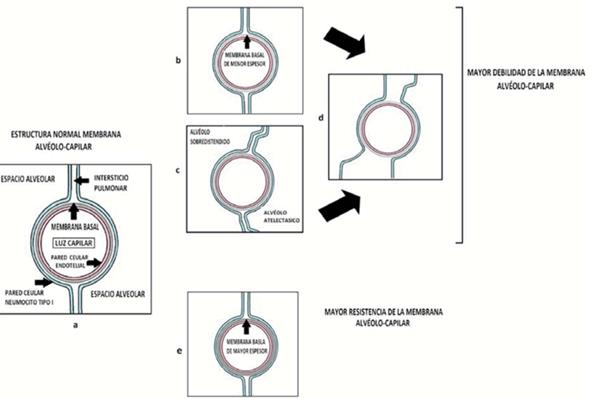
Figura 2: Se esquematizan los componentes básicos de la membrana alvéolo-capilar. (a). Debilitamiento de la resistencia de la membrana alvéolo-capilar por menor espesor de membrana basal (b), o pérdida del sostén capilar generado por los alvéolos y el interticio pulmonar (c), o combinación de ambos en el pulmón prematuro (d). Como contrapartida un mayor espesor de la membrana basal incrementa la resistencia de dicha membrana (d).
Ante una lesión directa de la membrana basal se produce sangrado pulmonar, como ocurre en la enfermedad de Good Pasture (ataque directo al colágeno tipo IV), lo que deja en evidencia la importancia de dicha membrana y en especial la malla de colageno tipo IV4,5.
Se denomina falla por estrés capilar a la producción de efracciones a nivel de la pared endotelial, de los alveolos y la membrana basal. Dicha falla ocurre ante situaciones fisiológicas exageradas o condiciones patológicas, permitiendo el pasaje de sangre desde la luz capliar a la luz alveolar3.
La membrana basal es producida por las células endoteliales y los neumocitos tipo I, las cuales constantemente están monitorizando el estrés parietal capilar. Está descripto que en pacientes con estenosis mitral la membrana basal tiene mayor espesor para contrarrestar el incremento estés parietal generado por la hipertensión veno-capilar (Figura 2e). Es plausible pensar que en situaciones donde la presión capilar se encuentra disminuida ocurra el fenómeno inverso, debilitamiento de la membrana basal y por ende la membrana alvéolo-capilar (Figura 2b)3.
Por lo previamente descripto, las cardiopatías con hipoflujo pulmonar y los recién nacidos (con hipoflujo pulmonar intrauterino) presentan mayor fragilidad capilar secundaria al bajo estrés parietal a la que estuvo expuesto el lecho vascular pulmonar. Dicha fragilidad se puede manifestar ante situaciones patológicas y ello determinar una mayor frecuencia de falla por estrés de la membrana alveolo-capilar, como ocurrió en los casos 2 y 33,6.
En este contexto, el factor prematurez con la consiguiente inmadurez pulmonar (etapa alveolo-sacular) determina una especial fragilidad de la membrana alvéolo-capilar , ya que a una membrana basal mas débil se suma un déficit en el sostén capilar dado por una inadecuada estructura alveolar e intersticial (Figura 2d). Ésta fue la base para el desarrollo de sangrado alveolar ocurrido en el caso 12.
La presencia de unidades alveolares atelectasicas o sobre distendidas determina pérdida del sistema de sostén capilar generado por la disposición alveolar y el intersticio pulmonar, situación que favorecería la falla por estrés (Figura 2c)2.
La fragilidad de la membrana alvéolo-capilar es clave para el desarrollo de hemorragia pulmonar, pero dicha patología es poco frecuente incluso en pacientes con lecho capilar pulmonar susceptible. La etapa neonatal es el período donde existe una mayor incidencia de HAD pero está es relativamente infrecuente incluso en esta población. Es probable que la presencia de factores asociados sea determinante a la hora de desarrollar HAD. Estos factores influirían en la frecuencia y/o severidad de falla por estrés, así como en la perpetuación del pasaje de sangre al parénquima pulmonar1,3.
El primer factor asociado a la HA es el estrés parietal capilar, dicho factor incrementaría la frecuencia y/o severidad de falla por estrés. El estrés capilar aumenta en casos donde existe un gradiente de presión elevado entre la luz capilar y el espacio alveolar (hipertensión capilar). Ejemplos de ello son la hipertensión arterial-capilar pulmonar (hipertensión anterógrada) o hipertensión veno-capilar pulmonar (hipertensión retrógrada). El caso número 4 es un ejemplo de hipertensión veno-capilar pulmonar, la insuficiencia severa y aguda de la válvula AV izquierda determinó hipertensión aurícular izquierda la cual fue transmitida en forma retrógrada generando edema pulmonar severo y secundariamente hemorragia alveolar. Este caso pone en evidencia que la alteración de un solo factor puede ser determinante para desencadenar un sangrado pulmonar, si el mismo es de gran entidad3,6.
El hiperflujo o cambios súbitos en el gasto pulmonar determina incremento del estrés parietal capilar. Como ya es conocido, durante la de transición a la vida extrauterina, la expansión y aireación pulmonar genera una caída súbita en la resistencia vascular pulmonar, lo cual determinaría un incremento súbito en el flujo a dicho lecho capilar. A esto último hay que sumarle la presencia de DA permeable, durante al menos las primeras 48hrs de vida, que genera recirculación de sangre hacia el circuito pulmonar. Esta constituía la situación fisiológica en la que se encontraban los casos 1 y 2 con el consiguiente estrés parietal que esto conlleva. Por otro lado, en el caso 3 se produjo un incremento súbito en el flujo pulmonar al levantar el obstáculo generado por el cerclaje pulmonar, siendo dicho estrés capilar determinante en el desarrollo de sangrado pulmonar7,8.
Es importante destacar que en el caso 2 existió una patología asociada, la presencia de meconio en vía aérea. La misma desencadena inflamación pulmonar (con lesión secundaria del lecho capilar pulmonar) y pérdida del sistema de sostén capilar debido a la existencia de áreas de pulmón poco o mal ventiladas, incrementando la fragilidad de la membrana alvéolo capilar.
Siguiendo la misma línea, la circulación extracorpórea necesaria para realizar cirugía cardíaca también determina inflamación pulmonar. Este factor puede haber incidido en mayor fragilidad de membrana en los casos 3 y 46.
Dentro de los factores que inciden en el incremente del estrés parietal endotelial es importante tener presente la falla diastólica como sistólica del ventrículo izquierdo. Mayores presiones de llenado determinan mayor presión veno-capilar pulmonar. Distintas situaciones pueden generar un incremento en la presión de llenado ventricular, como la presencia de recirculación de sangre a través de ductus DA (casos 1 y 2) o falla cardíaca asociado al síndrome post-bomba en el contexto de cirugía cardíaca (casos 3 y 4) (6-8.
El segundo factor determinante asociado a HAD es la presencia de alteración en la cascada de la coagulación con predisposción al sangrado. Distintos trabajos demuestran que las efracciones del endotelio son frecuentes en situaciones fisiológicas, pero estas son ocluidas rápidamente por las plaquetas y la activación de la cascada de la coagulación. La imposibilidad de generar dicho mecanismo de hemostasis llevaría a la perpetuación del pasaje de sangre al parénquima pulmonar. Tal es la relevancia de este factor que se han descrito episodios de HAD en pacientes sin patología pulmonar que solamente presentaban un trastorno severo de la coagulación. En los tres primeros casos, la presencia de coagulopatía adquirida fue un factor que incidió en el desarrollo y progresión de la HAD3,6,8.
Como referimos en la introducción, existe una incidencia relevante de HAD en prematuros de muy bajo peso al nacer. Ahmad y cols. estudiaron los casos de HAD precoz en prematuros menores de 28 semanas con un N de casi de 3000 pacientes. En dicho trabajo queda claro que la prematurez es el principal factor de riesgo, pulmón en etapa alvéolo-sacular (membrana alvéolo-capilar frágil), reduciendo su incidencia luego de las 32 semanas. A su vez establecieron una clara asociación de dicha patología con la presencia de DA permeable, es decir estrés capilar secundario al flujo pulmonar aumentado previamente desarrollado. La exposición a surfactante también constituyó un factor significativo ya que se asocia a una reducción en la resistencia pulmonar incrementando el shunt a nivel del DA. Resulta interesante la asociación que encontraron entre el uso de intrópicos con un mayor riesgo de HAD, si bien no es posible establecer una causa específica podríamos argumentar que el uso de estas drogas incrementaría el gasto cardíaco y secundariamente la recirculación de sangre a través del DA. También debemos considerar que al incrementar la presión arterial sistémica aumenta el flujo a través del DA (shunt), este incrementaría la precarga del VI y por ende la presión diastólica final del VI. Todos estos elementos mencionados determinan mayor estrés capilar pulmonar8.
La hemorragia aleolar sin manifestación clínica es frecuente. Estudios necrópsicos realizados en neonatos encontraron presencia de distintos grados de hemorragia pulmonar hasta en un 70% de los casos. Maximilian y cols. evaluaron 114 necropsias de pacientes con cardiopatía congénita encontrando hemorragia alvelolar en más de la mitad de los casos. Esto pone en evidencia que la falla por estrés de los capilares pulmonares es frecuente, pero dicho evento no suele manifestarse clínicamente ya que es necesario una interacción entre los factores mencionados para el desarrollo de HAD. Es importante tener presente que un sangrado pulmonar puede no ser evidente pero dicho sangrado determinar un descenso en el recuento eritrocitario y siderosis pulmonar secundaria, esto último podría asociarse al desarrollo de enfermedad pulmonar crónica. Los casos 2 y 4 requirieron aporte de oxígeno luego del egreso y es probable que ello fuera una manifestación de hemosiderosis pulmonar8-10.
En la (Figura 3) se presenta un esquema que representa la interacción de los distintos factores que pueden incidir en el sangrado alveolar. Se destaca la importancia de la membrana alveolo capilar y la presencia de fragilidad de la misma lo que incrementa el riesgo de falla por estrés y eventual sangrado. A su vez la presencia de estrés parietal capilar y/o alteración en la cascada de la coagulación pueden ser determinantes en el desarrollo de la patología. Estos factores pueden incidir en el desarrollo de HAD incluso en pulmones sanos, ya sean afectados en forma aislada o combinados.
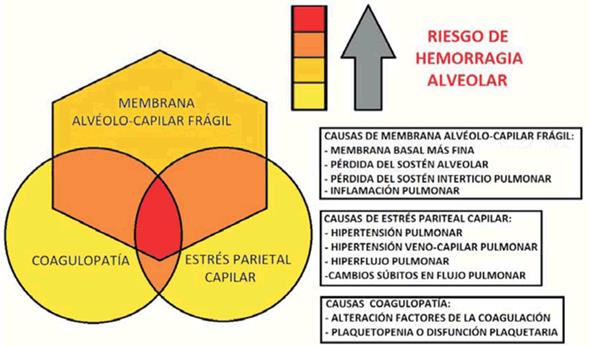
Figura 3: Esquema propuesto para sangrado pulmonar alveolar no inmune. Diagrama de Venn-Euler donde se esquematiza la importancia de la membrana alvéolo-capilar frágil así como la interacción de los factores desarrollados en el texto.
Frente a un paciente con HAD es importante analizar los factores antes mencionados. La presencia de una membrana alvéolo-capilar frágil es clave, la optimización del sostén brindado por los alvéolos y el intersticio pulmonar es el único recurso sobre el que se puede incidir para contrarrestar dicha fragilidad. La asistencia ventilatoria no invasiva, o invasiva, con presión positiva puede ayudar a mantener unidades aleveolares reclutadas y generar sostén capilar. A su vez la presión positiva puede contrarrestar el gradiente transmembrana existente en los casos de hipertensión capilar. Como contrapartida, la sobredistensión alveolar produce el efecto opuesto y predispone a la falla por estrés. A lo anterior se suma el daño pulmonar por ventilación no protectiva (barotrauma, volutrauma, biotrauma, endotrauma y atelectrauma). Debemos tener un uso juicioso de los inotrópicos, especialmente en la población neontatal, teniendo claro el objetivo buscado con estos fármacos y su posible incidencia en el contexto clínico del paciente. Ante un paciente con buena función ventricular que presenta cortocircuitos intra o extra cardíacos estos fármacos no implicarían un claro beneficio. El mantenimiento de una adecuada hemostasis es primordial, esto se puede lograr a través del uso de hemoderivados (plasma fresco, plaquetas y factores de la coagulación). Al momento de la reposición debemos tener presente la cantidad de volumen que se suministra, este último puede incrementar las presiones de llenado ventricular incrementando el estrés parietal capilar. El Factor VII activado ha demostrado beneficios en el manejo de la HAD, parte de este beneficio puede ser debido a que evita la reposición con volúmenes elevados. Siguiendo la misma línea, es de vital importancia mantener una adecuada hidratación evitando estados la sobre hidratación que inciden negativamente en el estrés capilar pulmonar e incrementa la mortalidad de pacientes críticos. La asistencia con ECMO (soporte pulmonar y cardíaco extracorpóreo) constituye el último recurso cuando las estrategias convencionales no son efectivas2,3,11.
Conclusiones
La HAD no inmune es una entidad poco frecuente con elevada mortalidad. Para poder cumplir con la función de intercambio gaseoso la membrana alvéolo-capilar debe tener el menor espesor posible, lo que la expone a falla por estrés y eventualmente extravasación de sangre al parénquima pulmonar. El colágeno tipo IV de la membrana basal, sumado a la disposición de los alvéolos y el intersticio pulmonar, en su conjunto, le dan resistencia extraordinaria a dicha membrana. En los casos que presentan una membrana alvéolo-capilar debilitada, alteraciones hemodinámicas o de la coagulación pueden ser factores determinantes en el desarrollo de HAD. El incremento del estrés parietal por alteraciones hemodinámicas predispondría a mayor incidencia en frecuencia y severidad de las fallas por estrés. Por otro lado, la presencia de coagulopatía impediría la correcta hemostasis ante falla por estrés de la membrana, lo cual favorecería el pasaje de sangre al parénquima pulmonar. Es importante tener en cuenta la estructura de la membrana alvéolo-capilar así como los otros factores determinantes, ya que pueden anti ciparnos a los casos que presenten hemorragia alveolar, convirtiéndose éstos en prioridades a resolver como parte del objetivo terapéutico.















