Introducción
La aparición de trastornos del ritmo cardíaco en niños es una entidad nosológica propia de la edad y cada vez más reconocida. Los niños con cardiopatía congénita tienen una prevalencia de arritmias mayor, pero la gran mayoría de casos de arritmias que llegan a un servicio especializado tienen corazones estructuralmente normales. Aunque no tengan una cardiopatía estructural los sustratos anatómicos que causan las arritmias son congénitos1,2.
La prevalencia de trastornos del ritmo aumenta hasta la adolescencia. Ha sido estimada en 1,25% en niños de 5 y 6 años y 2,32% en niños de 12 y 13 años. Si tenemos en cuenta que la prevalencia de cardiopatías congénitas es 0,4% a 1,2‰ podemos afirmar que las arritmias son la principal enfermedad cardíaca del niño1,3.
Las arritmias pueden iniciarse a cualquier edad e incluso estar presentes en el feto. Luego de los 13 años el manejo es similar a la edad adulta y es por ello un punto de corte habitual en los trabajos sobre el tema4-6.
El tipo de arritmia varía de acuerdo al sitio donde se estudien. En la consulta ambulatoria la prevalencia es la mencionada y predominan las formas benignas. En la consulta cardiológica y policlínica de arritmias siguen predominando las arritmias benignas, pero se concentran las más graves.
El objetivo primordial del tratamiento es evitar las complicaciones mayores, como son la miocardiopatía inducida por taquicardia y la muerte súbita. La mayoría de las veces el tratamiento está orientado a mejorar los síntomas y posibilitar que el niño tenga una vida psíquica y física normal. Afortunadamente, la mayoría de las taquicardias del niño tienen tratamiento curativo.
La medicación antiarrítmica tiene una eficacia limitada, debe tomarse de forma permanente, por plazo indefinido y tiene una lista extensa de efectos adversos1,5.
El estudio electrofisiológico (EEF) permite tomar decisiones en algunos casos de ritmos lentos y hacer el diagnóstico certero en la gran mayoría de los ritmos rápidos. Luego de realizado el diagnóstico se puede avanzar hacia el tratamiento definitivo mediante ablación con radiofrecuencia. La ablación ha demostrado ser un tratamiento muy eficaz y con una tasa de complicaciones muy baja. Sus indicaciones están bien pautadas internacionalmente y cada vez se extienden a niños más pequeños. Es una opción razonable como alternativa a la medicación en todas las arritmias supraventriculares y también ventriculares7,8.
En nuestro servicio ingresamos para procedimientos de EEF y ablación de coordinación a niños de al menos 5 años y 20 kg de peso. Solo intervenimos niños menores en caso de necesidad. En las pautas internacionales este criterio ha bajado a 15 kg de peso y la edad se considera un aspecto secundario8.
Para realizar un EEF y ablación clásicamente se realizan cuatro y hasta cinco abordajes vasculares. Por abordajes venosos femorales se pasan: un electrocatéter que se posiciona en la aurícula derecha, otro para el ventrículo derecho y un tercero para el registro permanente del potencial de His. Por un cuarto abordaje venoso, en general vena subclavia o yugular, se pasa un electrocatéter para registro permanente del seno coronario. Al momento de pasar a la ablación se utiliza un quinto abordaje que puede ser arterial o venoso, según la técnica empleada por cada equipo y la necesidad de la arritmia. Cuando la ablación es en las cavidades derechas a veces se prescinde del quinto catéter y se utiliza uno de los cuatro abordajes ya realizados. Esta forma clásica de trabajar algunos grupos la han simplificado, pero no se utilizan menos de tres catéteres endovasculares (CEVs) cuando se hace una ablación.
El Dr. Josep Brugada y sus colaboradores han propuesto un método simplificado en el que se utiliza solo dos CEVs9-15. En nuestra práctica vimos que muchas veces uno de ellos era solo imprescindible para tener un registro auricular al momento de la taquicardia, la ablación o la estimulación ventricular. Comenzamos entonces a utilizar un catéter para el registro intraesofágico (RIE) y de esa manera reducir aún más el número de accesos y CEVs. Presentamos la primera experiencia en el Congreso Uruguayo de Cardiología del año 200816. En base a ella elaboramos un protocolo para los procedimientos que desde entonces aplicamos.
Protocolo: en la (Figura 1) mostramos el esquema gráfico del protocolo definido.
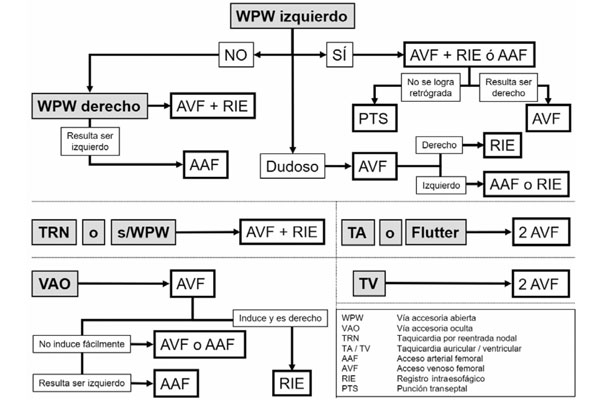
Figura 1: Esquema del protocolo de procedimiento para la realización de EEF y Ablaciones del Servicio de Estudio y Tratamiento de Arritmias del Instituto de Cardiología Integral (SETA-ICI). Para explicación ver el texto.
En pacientes con signos de Wolff Parkinson White (WPW) procuramos inferir la localización de la vía accesoria por el electrocardiograma (ECG). Si suponemos que está a izquierda realizamos un acceso venoso femoral, introducimos un catéter cuadripolar de ablación y buscamos el foramen oval. Si lo encontramos permeable agregamos un RIE. Si no logramos acceder a la aurícula izquierda realizamos un acceso femoral arterial. Por este pasamos el catéter de ablación y por el acceso venoso un catéter decapolar de estudio. En ambas situaciones, al verificar la conducción retrógrada luego de la ablación, podremos estimular en ventrículo y tener un registro de la actividad auricular. Para verificar la conducción anterógrada nos alcanza estimular aurícula y ver la señal ventricular en el ECG de superficie.
Si la vía accesoria abierta -WPW- es probablemente derecha comenzamos directamente con un abordaje venoso femoral y el RIE. Ante la duda si es derecha o izquierda, ponemos solo el acceso venoso y con este resolvemos cómo seguir.
Cuando sospechamos la existencia de una vía accesoria oculta comenzamos con un abordaje venoso femoral. Si la taquicardia es fácil de inducir, se puede ablacionar en taquicardia y si la vía es derecha agregamos solo un RIE. En caso contrario, realizaremos un segundo acceso vascular, arterial o venoso según corresponda.
Cuando sospechamos una reentrada nodal comenzamos con un abordaje venoso femoral y el RIE. Este nos permite tener registro de la actividad auricular durante la aplicación de radiofrecuencia. Lo mismo si el ECG basal es normal y no tenemos diagnóstico del tipo de taquicardia.
Cuando nos enfrentamos a una taquicardia auricular, flutter o taquicardia ventricular comenzamos directamente con dos accesos venosos y dos catéteres.
El RIE lo empleamos solo para ver el registro auricular (sensar) y muy rara vez para estimular. El protocolo que definimos es una guía, pero no se antepone a las necesidades de cada caso en particular. Existen múltiples situaciones que obligan a modificar el plan inicial. ¿Cuál es en definitiva el número de accesos y CEVs que utilizamos? Realizamos este estudio a efectos de tener la información sobre la práctica real que teníamos con nuestro protocolo y cómo eso afectaba los resultados.
El objetivo de este trabajo es presentar los resultados de la realización de EEF y ablaciones bajo el protocolo descrito, en niños de hasta 13 años, sin cardiopatía estructural conocida, realizando un seguimiento posterior de al menos un año.
Material y método
Realizamos un estudio epidemiológico, descriptivo, cuantitativo, prospectivo, longitudinal de pacientes tratados en nuestro servicio.
A partir del año 2008 realizamos los EEF y ablaciones bajo el protocolo de procedimiento mostrado16. Al finalizar cada procedimiento se recaban todos los datos de lo realizado, diagnóstico, tratamiento y resultado. Esto se volcó a una base de datos que se va completando con el seguimiento, si hubo o no recurrencia y eventuales complicaciones agudas y alejadas.
Incluimos 120 pacientes consecutivos, de hasta 13 años, que no tenían una cardiopatía estructural conocida y en los que se había realizado un procedimiento de EEF o ablación, o ambos. Se excluyeron ablaciones con sistema no radiológico de navegación. En agosto del 2016 tenían que tener al menos un año de realizado el primer procedimiento. En estos pacientes realizamos 125 procedimientos. Aunque todos fueron hechos con el mismo protocolo, de los cinco pacientes en que realizamos dos procedimientos solo incluimos el primero para evitar desvíos. Todos los pacientes fueron seguidos por algún miembro del equipo.
Equipos y catéteres: para todos los procedimientos utililizamos un polígrafo Cardiolab® GE Medical Systems, versión del producto 5.2.0.5088, versión de la base de datos 5.2.60.000. Dispusimos los electrogramas endocavitarios con una ganancia de entre 1.000 y 5.000 veces y filtramos entre 30 y 500 Hz. Para las señales provenientes del RIE ajustamos los filtros ente 30 y 1.000 Hz. Hicimos todos los procedimentos con un angiógrafo Adventx® GE Medical System.
Para la ablación utilizamos catéteres cuadripolares Medtronic Mariner® 5 y 6 french (F) de las curvas que entendimos conveniente. Cuando requerimos un segundo catéter utilizamos siempre Medtronic Mariner® decapolar deflectable unidireccional 6 F.
El equipo de radiofrecuencia fue un Medtronic Atakr® RF Generator.
Para el RIE utilizamos electrodos bipolares St Jude Isoflex® 1646 de fijación pasiva, a los que quitamos el sistema de fijación. Una vez que el paciente estaba dormido y con la vía aérea controlada el segundo operador pasaba el electrodo por las narinas y avanzaba por faringe y esófago. El bipolo lo posicionamos radiológicamente a nivel del fondo de saco de Haller, entre las venas pulmonares superiores. Allí solemos tener la mejor amplitud del registro auricular con la menor ventricular (relación A/V >0,7) (Figura 2). Luego lo ajustamos buscando el mejor electrograma (Figura 3).
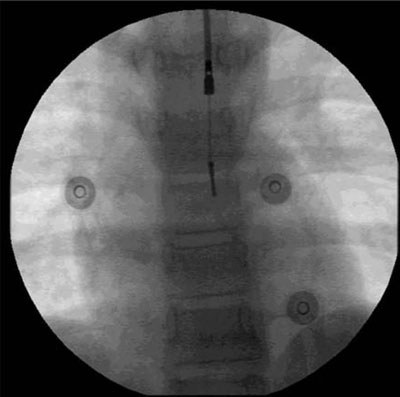
Figura 2: Radiografía en póstero-anterior mostrando el electrodo para registro intraesofágico (RIE) posicionado por anatomía y antes de optimizar la posición por la señal eléctrica. Obsérvese que queda algo por encima de las derivadas precordiales V1 y V2. No se ven los cables de las derivadas porque se utiliza material radiolúcido.
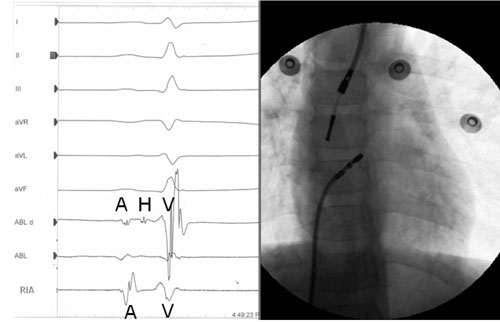
Figura 3: Radiografía en póstero-anterior mostrando el electrodo intraesofágico posicionado en la mejor señal auricular y un electrodo cuadripolar de ablación (5F), introducido por acceso femoral derecho y posicionado en el registro del haz de His. Captura del monitor donde se muestran todas las derivadas de los miembros, los dos electrogramas bipolares del catéter endovascular (ABLd y ABL) y el del registro intraesofágico (RIA). A es la señal auricular, V la ventricular y H la señal del haz de His.
Consideramos que la ablación era efectiva tomando las definiciones habituales de no inducibilidad, demostración de ausencia de conducción en ambas direcciones por las vías accesorias, hasta un eco en las reentradas nodales con estimulación basal o bajo isoproterenol. En esta serie no quedaron incluidos niños con flutter. Consideramos que hubo una recurrencia si se documentaba nuevamente una taquicardia que podía ser la misma que la ablacionada o si se volvía a indicar un estudio electrofisiológico y se inducía la misma arritmia.
Anestesia: en todos los pacientes realizamos anestesia general balanceada con intubación orotraqueal y ventilación controlada. Inducción con propofol 1-2 mg/kg, fentanyl 1-2 g/kg y atracurium 0,5 mg/kg. Mantenimiento con sevorane 1 a 1.5 CAM. Patrón ventilatorio controlado por volumen: volumen corriente 7-8 ml/kg, frecuencia respiratoria de acuerdo a la edad, fracción inspirada de oxígeno 70%-80%, relación inspiración/espiración 1:2 y pausa inspiratoria de 30%. Protocolo de decurarización con neostigmina y atropina en dosis de acuerdo al peso, extubación y despertar en la sala de electrofisiología. Reposición hidroelectrolítica con suero Ringer-lactato a 5 ml/h con bomba de infusión.
Variables: registramos la edad en meses y la expresamos en años y decimales. Localizamos las vías accesorias en diez sectores: seis sectores derechos y cuatro izquierdos. Consideramos que hubo intento de ablación si hicimos al menos una aplicación de radiofrecuencia. El tiempo total del procedimiento lo tomamos desde que el paciente se durmió y hasta que despertó. El tiempo de radioscopía es el real que registra el angiógrafo. Por ello, expresamos los tiempos con cifras significativas distintas. Registramos todas las complicaciones, aunque no hayan requerido un tratamiento ni tuvieran una consecuencia funcional. Este es un criterio más riguroso que lo tomado en la bibliografía internacional7,8. Se considera complicación mayor al daño vascular que requiere reparación, el bloqueo auriculoventricular (AV) que requiere implante de marcapasos, el accidente cerebrovascular clínico, el derrame pericárdico agudo con taponamiento o que requiere evacuación, la insuficiencia cardíaca, tromboembolia pulmonar, la lesión valvular, el infarto y la muerte.
Análisis: se realizó con paquete estadístico SPSS Statistics ® versión 17.0. Las variables continuas se expresan en media ± 1 desvío estándar. Las variables cualitativas o categóricas se expresan en frecuencia absoluta y porcentaje.
Resultados
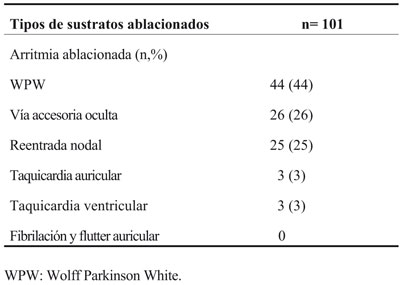
La edad media de los pacientes incluidos fue 9,5±2,9 años (entre 7 meses y 13 años) y 72 (62%) eran de sexo masculino. En 101 (84%) se realizó el intento de ablación (Tabla 1).
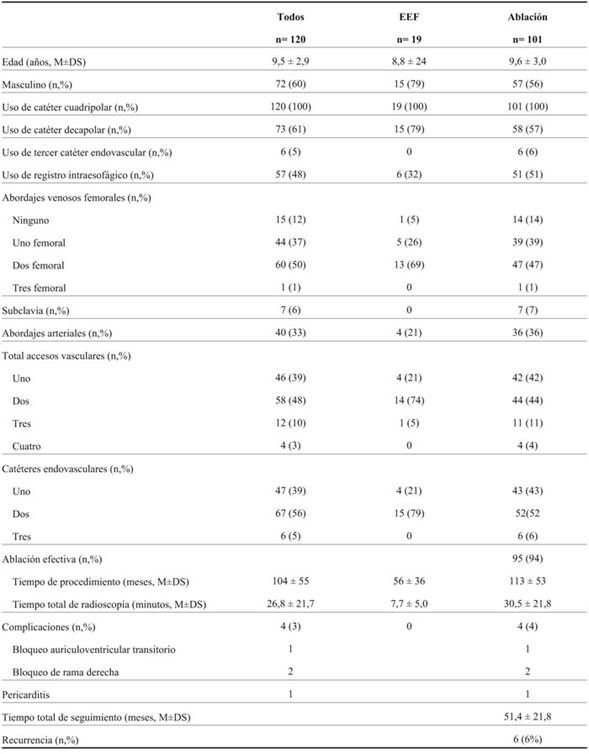
Tabla 1: Descripción de la población y de los procedimientos. Características demográficas, tipo de procedimiento, catéteres empleados, abordajes realizados, tiempos del procedimiento, resultado y evolución de toda la serie de pacientes incluidos y por tipo de procedimiento.
De los 19 niños en que no se intentó la ablación, cinco habían sido ingresados solo para EEF. Uno por una displasia del ventrículo derecho, dos por bradicardia y dos por síncope. De los 14 ingresados por un ritmo rápido y que no se intentó la ablación en nueve no se indujo ninguna arritmia ni se encontraron vías accesorias. En cinco se encontró una vía accesoria muy cercana al registro del haz de His y el riesgo de la vía accesoria no justificaba el riesgo de bloqueo AV por la ablación.
En 58 niños intentamos un RIE de buena calidad y se logró obtener en 57 (58%) de todos los pacientes incluidos. El 95% de los procedimientos se hicieron con uno a dos CEVs (Tabla 2). El tiempo de procedimiento fue 104±55 minutos y el de radioscopía 26,8±21,7 minutos.
Estudios electrofisiológicos
Los datos de los EEF sin ablación se muestran en la segunda columna de la (Tabla 1). En seis (32%) se utilizó el RIE. Todos se hicieron con uno o dos CEVs y en ninguno hubo necesidad de poner un tercero. En un paciente se realizó un tercer acceso vascular para pasar uno de los catéteres por vía arterial a izquierda. Los procedimientos duraron 56 ± 36 minutos y se utilizaron 7,7±5,0 minutos de rayos. No hubo ninguna complicación mayor ni menor vinculada al procedimiento.
Ablaciones
Los datos de las ablaciones se muestran en la tercera columna de la (Tabla 1) y los sustratos ablacionados en la Tabla 2. En 70% de los pacientes ablacionamos una vía accesoria. Fueron más frecuentes las vías abiertas que las ocultas (n=44 versus 26). El siguiente sustrato en frecuencia fue la reentrada nodal. No hubo pacientes con flutter ni fibrilación auricular.
En todos los pacientes se utilizó un catéter cuadripolar de ablación. En 43% de los pacientes este fue el único CEV empleado. En 50% se utilzó un RIE. Hubo un solo paciente en que no se logró una señal de buena calidad por ruido en el registro y hubo que poner un segundo CEV. Hubo seis pacientes que requirieron emplear tres CEVs de forma simultánea y 15 pacientes que requirieron más de dos accesos endovasculares. Los seis pacientes que requirieron tres CEVs en forma simultánea fueron vías accesorias: cuatro ocultas y dos abiertas, dos en el anillo derecho, tres en el izquierdo y una posterior dentro del seno coronario. En cuatro de estos pacientes se hicieron tres accesos y en dos se hicieron cuatro. En cinco de los seis hubo que realizar un abordaje de vena subclavia, pero en tres de ellas fue para intentar la ablación desde allí y no para colocar el catéter en el seno coronario. Para estos casos el tiempo de procedimiento estuvo entre 130 y 310 minutos y el de rayos entre 32,5 y 72,7 minutos. Las cotas inferiores de ambos tiempos están por encima del promedio de toda la serie. Si quitáramos este grupo del total de ablaciones el tiempo de procedimiento caería a 105 minutos. A pesar de todo los recursos utilizados, en dos de los seis casos no se logró la ablación y uno de ellos recurrió a la semana del alta. Evidentemente eran vías difíciles.
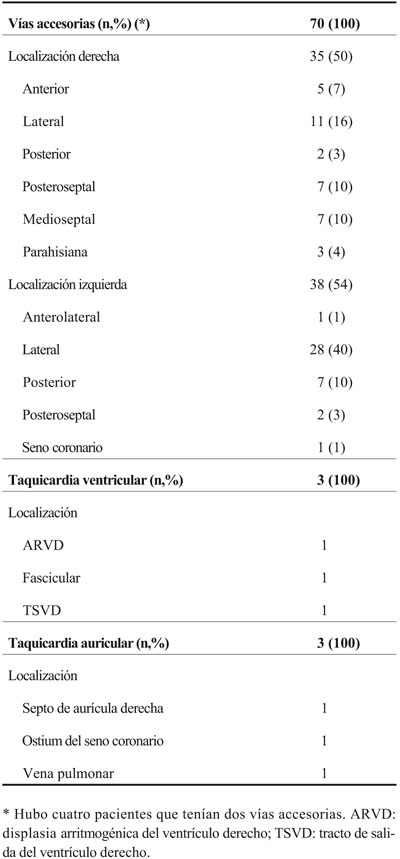
En la (Tabla 3) se muestra la localización de las vías accesorias. Hubo cuatro pacientes en quienes encontramos dos vías. Hubo un número similar de vías derechas e izquierdas (35 versus 38).
Se ablacionaron tres pacientes con taquicardias ventriculares; una fascicular en el ventrículo izquierdo y dos en el tracto de salida del ventrículo derecho. Una de las últimas era en un niño en que hicimos angiografía y diagnosticamos displasia arritmogénica (Tabla 3). Hubo tres pacientes con taquicardias auriculares. Las localizaciones se muestran en la (Tabla 3).
La ablación se consideró efectiva en 95 de los 101 pacientes en que se intentó (94%). A la fecha de cierre el seguimiento era de 51 ± 22 meses y, por definición, ninguno menos de un año. Hubo seis pacientes que presentaron recurrencia (6%): una taquicardia auricular, tres vías ocultas y dos abiertas. En los pacientes con vías accesorias se realizó un segundo procedimiento de ablación exitoso y a más de un año de seguimiento no han vuelto a recurrir.
Hubo cuatro complicaciones. Un paciente presentó un bloqueo AV de segundo grado transitorio luego de la ablación de una vía oculta medio septal y que desapareció al día siguiente. Hubo dos niños que quedaron con bloqueo de rama derecha sin ninguna consecuencia funcional. Ambos tenían una vía accesoria abierta (medioseptal y parahisiana) que se ablacionó de forma efectiva.
Tuvimos un niño que reingresó a la semana y se diagnosticó pericarditis supurada. Hubo necesidad de drenaje y tratamiento antibiótico. Fue dado de alta sin secuelas clínicas. Esta fue la única complicación mayor y la hemos informado en otro reporte porque hay pocos antecedentes.
No hubo ninguna complicación mayor ni menor en relación con los accesos y todos los niños fueron dados de alta antes de las 48 horas.
Discusión
La ablación mediante la utilización únicamente de dos CEV fue descrita inicialmente para las vías accesorias por el grupo de Brugada y colaboradores9 y luego extendida para todas la arritmias10-13. El servicio de arritmias del Hospital Clínico de Barcelona ha sido sumamente activo en la formación de especialistas de todo el mundo y particularmente de Sudamérica. Se ha establecido una escuela internacional que entrena y aboga por el uso de un número mínimo de catéteres para los procedimientos. El profesor Josep Brugada inició también el Servicio de Arritmias del Hospital Pediátrico San Juan de Dios, centro de referencia mundial. De ambos centros trajimos la técnica.
No hay estudios aleatorizados que comparen la técnica ortodoxa con la mínimamente invasiva o simplificada. Cada operador está entrenado en una forma. Los resultados de trabajar de dos maneras distintas tendrían un desvío muy importante y no serían comparables. La comparación dentro de un servicio en períodos de tiempo distintos o la comparación entre dos servicios distintos también. Probablemente nunca vayamos a tener evidencia de mejor calidad metodológica que la descriptiva.
En general hay acuerdo de que cada médico -operador- debe formarse y practicar de forma sistemática la misma técnica. Realizar procedimientos invasivos de una forma en la que uno no está entrenado es siempre la opción menos conveniente y más peligrosa.
Las técnicas simplificadas tendrían muchas ventajas:
-Reducen el número de abordajes vasculares y con ello las complicaciones inmediatas y alejadas de su intento. Hay que destacar que las complicaciones vasculares son por lejos las más frecuentes de los procedimientos. Hematomas, sangrados, fístulas arteriovenosas, disección arterial, oclusión arterial, trombosis venosa, etcétera. También sus consecuencias a largo plazo sobre la irrigación o drenaje del miembro afectado. Cuando se intentan abordajes altos, de vena subclavia o yugular, se debe agregar la posibilidad de neumo/hemotórax y las complicaciones mayores que devienen de ellos.
La Sociedad Americana de Electrofisiología Pediátrica define complicación como un problema que requiere tratamiento perentorio o que deja un defecto que interfiere con la función normal. En su base de datos, a principios de la década de 1990, la tasa de complicaciones inicial era de 4,2%. Más tarde descendió a 3%. El 70% al 80% de las complicaciones durantes los procedimientos estuvieron vinculadas a los abordajes y no a la ablación17,18. Esto es así a pesar que las complicaciones menores, como los pseudoaneurismas, las fístulas arteriovenosas y sangrados menores no se reportan7. Las complicaciones mayores más frecuentes relacionadas con la ablación son el bloqueo AV permanente de segundo o tercer grado, la perforación y/o derrame pericárdico y los accidentes tromboembólicos. Las tasas informadas son 0,56%, 0,69% y 0,19% respectivamente7.
En la serie que acá presentamos no tuvimos ninguna complicación de accesos. Las complicaciones ocurridas fueron tres menores y una mayor relacionadas con la aplicación de radiofrecuencia. El bloqueo de rama derecha es esperable cuando se aplica radiofrecuencia en vías accesorias medio y anteroseptales. Se debe aplicar la radiofrecuencia algo por delante del anillo para minimizar el riesgo de bloqueo AV y por ello se lesiona la rama derecha. No conocemos reportes de que esto desarrolle problemas a largo plazo.
La pericarditis es una complicación muy poco frecuente pero también descrita. Lo raro de nuestro caso es que no fue de tipo inflamatorio reaccional (tipo síndrome de Drexler) sino supurada. Probablemente hubo una infección secundaria a un derrame inflamatorio posterior al procedimiento.
La reducción de abordajes vasculares es particularmente importante en niños dado el menor calibre de sus vasos. También por la posibilidad mayor de que tengan que utilizarse más veces a lo largo de su vida.
-Saber realizar los procedimientos con un mínimo de registros es casi imprescindible cuando se trabaja con niños con cardiopatía congénita (CPC). En ellos, por la propia CPC o las intervenciones previas, la posibilidad de accesos vasculares puede estar muy reducida.
-Las técnicas simplificadas reducirían el tiempo de los procedimientos y la necesidad de radioscopía. La realización de varios abordajes y el posicionamiento de electro-catéteres a veces no es sencillo. Los catéteres estáticos posicionados se suelen mover durante los procedimientos y hay que volver a llevarlos al lugar que se necesitan.
El tiempo total de procedimiento de dos horas, (113,5± 3,1 minutos, Tabla 1), incluyendo la anestesia es bien bajo. Tengamos en cuenta que desde que el niño se duerme transcurre un tiempo hasta que se lo acondiciona para comenzar a puncionar, luego de la ablación considerada efectiva se deja pasar aproximadamente media hora para ver que no vuelva a aparecer y no menos de 20 minutos lleva retirar los materiales y despertar. Los trabajos que consideran todos los tiempos informan por encima de 230 minutos18,19 y trabajos más recientes con técnica convencional al finalizar la punción informan tiempos cercanos a los 180 minutos20.
El tiempo de radioscopía es bajo para este tipo de procedimientos. El último reporte de la Sociedad Americana de Electrofisiología Pediátrica informa 40 ± 35 minutos y tiempos similares se informan en la actualidad18,20. Nosotros tuvimos 30,5±22. No sería correcto realizar la comparación estadística, pero es claro que nuestros tiempos al menos no son mayores (Tabla 1)18. Igual se pueden considerar altos en relación con lo reducido del tiempo total. Esto es porque la técnica que empleamos requiere estar moviendo permanentemente el (los) catéter (es). Obsérvese que para los estudios electrofisiológicos que no terminaron en ablación el tiempo es muchísimo mas bajo (7,7 ± 5,0 minutos, (Tabla 1)).
Los costos de los procedimientos aumentan cuanto más materiales se utilicen. Vainas, electrocatéteres, conectores, tiempos de la sala, manejo de heridas y complicaciones, todo suma. Nosotros no realizamos un estudio de costos, pero es inmediato que el gasto de materiales se minimiza. Esto tiene particular importancia en países con recursos limitados.
La realización de EEF y ablaciones con un número mínimo de registros se basa en cuatro técnicas o destrezas comunes.
-Todos los registros que se utilizan de forma convencional, tomados con cuatro a cinco catéteres, son necesarios, pero no de forma simultánea. Los que utilizamos técnicas simplificadas estamos moviendo permanentemente el o los dos catéteres introducidos a la posición que necesitamos en cada momento.
-El registro del seno coronario también puede ser necesario, pero aprendiendo a introducirse desde abordajes bajos se puede prescindir, la mayoría de las veces, de los abordajes altos.
-En todos los procedimientos resulta importante tener topografiada la localización del haz de His. De forma convencional se deja un catéter en esa posición durante todo el procedimiento. Los que realizamos técnicas simplificadas comenzamos los procedimientos localizando dicha estructura. Filmamos el catéter en esa posición y disponemos la imagen en un monitor para tenerla siempre presente. Así lo tenemos localizado sin tener un catéter en forma permanente. Esto lo verificamos las veces que sea necesario.
-Utilizamos mucho la función “gatillada” de los polígrafos. Se programa cuál es el registro eléctrico que queremos tomar de referencia. El equipo despliega en el monitor cada latido en el mismo lugar de acuerdo a ella. Sobre esa imagen podemos colocar barras de referencia y tomar medidas de tiempo. Dadas dos señales que se quieren comparar y saber cuál está antes, basta registrar cada una de forma sucesiva y localizarlas temporalmente de acuerdo a la referencia. No precisamos tener un registro simultáneo de ambas posiciones y compararlas directamente.
-Utilizamos mucho el ECG convencional de superficie. En base al ECG basal y de la taquicardia registrada tomamos decisiones acerca de cómo comenzar. Por ejemplo, si tenemos la sospecha de que hay una vía accesoria izquierda comenzamos con un abordaje arterial. Durante el procedimiento desplegamos muchas derivadas del ECG de superficie en el monitor. Incluso las tomamos de referencia para la función “gatillada” antes mencionada.
La utilización de un electrodo intraesofágico no es algo nuevo. Desde hace tiempo está descrito para realizar EEF de estimulación auricular, para revertir taquicardia por macro-reentrada auricular, fundamentalmente flutter típico, por sobreestimulación y para obtener un registro auricular cuando el mismo no es claro en el ECG de superficie.
Teníamos cierta experiencia con todos estos usos en unidades de cuidados intensivos y en puerta de emergencia. De allí se nos ocurrió incorporarlo como herramienta para la realización de los EEF y ablaciones invasivas.
Una vez aprendida la técnica de dos CEVs, poder realizar muchos procedimientos con uno solo depende de tener una visualización correcta y permanente de la onda de despolarización auricular. Con el RIE lo podemos tener, lo comprobamos y ahora lo utilizamos sistemáticamente.
Este es el aspecto más novedoso de nuestro protocolo que pensamos difundir. Ya hay dos centros en Argentina que están utilizando un RIE en los niños pequeños.
La baja tasa de complicaciones se vincula también al empleo de materiales adecuados al tamaño de los pacientes. Como describimos en la técnica, nuestro servicio usa materiales diseñados para uso pediátrico. Los catéteres de ablación de 5 y 6 F deben ser encargados especialmente ya que no están disponibles en nuestro medio.
Otra variable que entendemos muy importante es la realización de anestesia general a cargo de un especialista de niños. Que el paciente esté tranquilo y sin movimientos inesperados. El electrofisiólogo operador debe estar dedicado exclusivamente a su tarea. No hubo ninguna complicación en relación con la anestesia.
La tasa de ablación efectiva (94%) es buena y la de recurrencia (6%) es baja (Tabla 1). El registro de ablaciones más grande que existe es el realizado por la Sociedad Latinoamericana de Estimulación Cardíaca y Electrofisiología (SOLAECE), la enorme mayoría son pacientes adultos e informa una tasa de éxito de 92%21. El registro más grande a nivel país es el español que informa sobre adultos una efectividad aguda de 94%, similar a la nuestra22. En el registro uruguayo de arritmias cardíacas informamos una tasa de éxito agudo de 91% y de complicaciones de 2%23.
Nuevamente no estamos en condiciones de realizar un estudio estadístico correcto sobre nuestros resultados, pero parece claro que al menos no son inferiores. La simplificación de la técnica de ablación al menos no determina peores resultados y pudieran ser incluso superiores.
Conclusiones
A partir de la experiencia en distintos servicios elaboramos un protocolo para la realización de EEF y ablación en niños que combina la técnica simplificada promulgada por la escuela del Prof. Dr. Josep Brugada y el uso de un registro intraesofágico.
Evaluamos de forma rigurosa el resultado de aplicación de nuestro protocolo en 120 niños de hasta 13 años, sin cardiopatía estructural conocida y con un seguimiento mayor a un año.
Encontramos que realizamos los procedimientos con un número muy bajo de accesos y catéteres vasculares. El 42% de las ablaciones las hicimos con un solo acceso y un solo CEV. Solo en 5% de los procedimientos requerimos tres catéteres y en ninguno más que eso. Los tiempos de procedimiento fueron bajos.
La ablación fue efectiva en 94% de los casos con una recurrencia de 6%. Estas son cifras buenas para la población tratada. Hubo un solo paciente con una complicacion importante subsanada, sin ningún fallecimiento ni ninguna secuela clínica.