Introducción
El retorno venoso pulmonar anómalo total (RVPAT) se caracteriza por la falta de conexión de las venas pulmonares a la aurícula izquierda (AI). El ventrículo izquierdo (VI) suele desarrollarse dentro de los valores de referencia, próximo al límite inferior de la normalidad1. Esto se debe a que en la vida intrauterina las cavidades izquierdas reciben un volumen menor de lo esperado ya que todo el retorno venoso pulmonar se mezcla con el sistémico a través de la persistencia de conexiones embrionarias2.
La AI es una cámara contráctil que actúa como conector entre las venas pulmonares y el VI, siendo esencial para la succión del retorno venoso pulmonar y el llenado ventricular3.
En el RVPAT la falla de conexión de las venas pulmonares determina que la AI no se desarrolle adecuadamente, siendo pequeña (valores de score Z por debajo de lo normal) con miocardio atrófico1,2.
En el posoperatorio de RVPAT las cavidades izquierdas reciben mayor carga de volumen determinando presiones de llenado elevadas3.
El péptido natriurético es secretado por los miocitos sometidos a estrés parietal, favoreciendo la natriuresis y diuresis, contrarrestando los efectos del eje renina-angiotensina-aldosterona activado por la disfunción cardíaca. La fracción N terminal del péptido natriurético cerebral (NTproBNP) es la porción terminal de la prohormona BNP y es un reflejo de los niveles de esta última4.
Casos clínicos
Presentamos dos casos de RVPAT supradiafragmático no obstructivo a vena innominada, analizando la evolución clínica, incremento del área de AI y los niveles de NTproBNP, durante los 2 meses posteriores a la cirugía. Los mismos fueron casos sucesivos y como consecuencia de los hallazgos en el primer caso en el segundo se elaboró una estrategia de monitorización diferente.
Ambos pacientes fueron sometidos a igual técnica quirúrgica: anastomosis latero-lateral de colector a AI, dejando una comunicación interauricular (CIA) residual de 3 mm y la vena vertical izquierda permeable con banding de 3 mm.
Caso 1
Un mes de vida, cierre esternal diferido a los 5 días y asistencia ventilatoria mecánica por 8 días. A los 10 días presenta área AI de 1,6 cm2 con niveles de NTproBNP de 16.812 pg/ml. Alta a los 30 días. A los 60 días, el área AI fue de 2,4 cm2 con NTproBNP de 1.300 pg/ml. El incremento del score Z auricular fue de -4,6 preoperatorio a -1,3 a los 2 meses de la cirugía.
Caso 2
Dos meses de vida, tórax cerrado y asistencia ventilatoria mecánica por dos días. A los 10 días presentaba área AI de 2,7 cm2 y niveles de NTproBNP de 8.000 pg/ml. Alta a los 15 días. A los 60 días, el área de AI era 3,2 cm2 con NTproBNP de 741 pg/ml. El incremento del score Z auricular fue de -3,1 preoperatorio a -0,8 a los 2 meses. Se realizó monitoreo de presión venosa pulmonar mediante catéter venoso yugular izquierdo a colector. Dicho registro presentó valor medio de 18 mmHg en las primeras 48 h y 15 mmHg a las 72 h. Se realizó registro Doppler pulsado transmitral, Doppler tisular del anillo mitral y Doppler de las venas pulmonares a los 10 y 60 días del posopertaorio.
El edema pulmonar fue la principal complicación en ambos pacientes, con resolución progresiva en menos de un mes.
A los 6 meses de la cirugía ambos pacientes estaban asintomáticos, presentando crecimiento y desarrollo acorde para la edad sin necesidad de tratamiento farmacológico.
Discusión
En el posoperatorio de RVPAT las cavidades izquierdas deben manejar todo el retorno venoso pulmonar, lo cual puede resultar en sobrecarga para las mismas. En algunos centros se opta por dejar sistemas de descarga hacia cavidades derechas (CIA y/o persistencia de vena vertical) ante el riesgo de hipertensión veno-capilar y/o hipertensión pulmonar (HTP). En los casos presentados se optó por dejar shunt de descarga5.
En el posoperatorio de RVPAT son factores determinantes de morbimortalidad la presencia de HTP y la obstrucción al drenaje venoso pulmonar, no presente en estos pacientes6.
En ambos la aurícula izquierda era pequeña en el período preoperatorio y alcanzó valores de normalidad a los 60 días del posoperatorio (Figura 1). Dicho fenómeno ocurrió en forma rápida y ello aleja la posibilidad que sea consecuencia del crecimiento somático exclu sivamente.
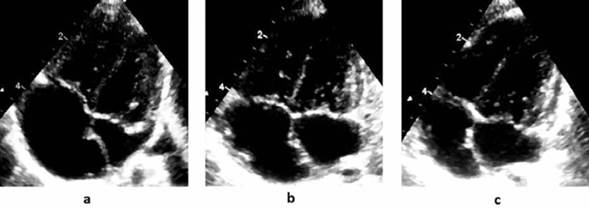
Figura 1: Evolución ecográfica del tamaño auricular corte 4 cámaras caso 2. (a) preoperatorio; (b) 30 días posoperatorio; (c) 60 días posoperatorio.
La cirugía cardíaca determina valores pico de péptido natriurético a las 24 horas del posoperatorio para luego disminuir y llega a valores de referencia a los 7 días (menor 300 pg/ml de NTproBNP)4.
En los casos analizados los niveles de NTproBNP estaban elevados al mes de la cirugía alejando la posibilidad de asociación con la misma. Dicho hallazgo puede ser resultado de mayor tensión parietal a nivel de las cavidades cardíacas producto de una disfunción cardíaca. La HTP y/o la existencia de sistemas de descarga realizados podrían explicar el comportamiento en los niveles de NTproBNP. No se objetivaron elementos sugestivos de HTP y al mes de la cirugía no presentaban flujo en vena vertical.
El incremento del área auricular fue acompañado de un descenso en los niveles de NTproBNP (Figura 2). En estados patológicos existe una asociación entre disfunción de VI y la disfunción de AI3. El aumento de tamaño auricular en el posoperatorio puede ser un epifenómeno de estrés parietal al cual se ven sometidas las cavidades izquierdas, en particular la AI. Dicho estrés parietal puede ser consecuencia de presión diastólica final elevada del VI asociado a una AI de pequeño tamaño, disfuncional y poco complaciente.
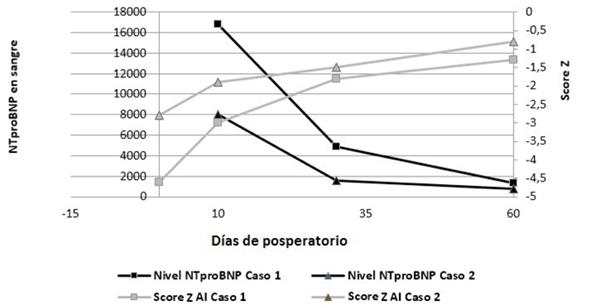
Figura 2: Comparación evolución de niveles de porción N terminal de péptido natriurético tipo B (NTproBNP) y el score Z de aurícula izquierda (AI) en posoperatorio de ambos casos.
En el segundo caso fue posible determinar la existencia de presión venosa pulmonar elevada en las primeras 72 h del posoperatorio. La presión veno-capilar pulmonar elevada podría explicar el edema pulmonar presente en ambos casos.
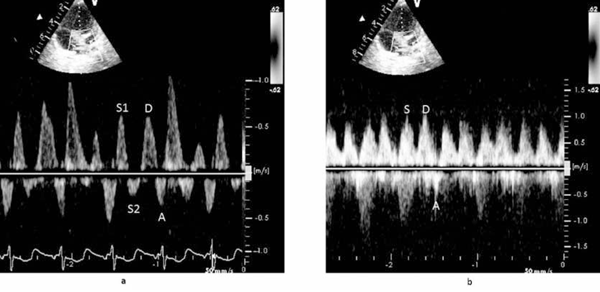
En el Doppler pulsado transmitral fue posible objetivar una relación E/A alterada de 2,5 a los 10 días del posoperatorio (onda A menor a percentil 10), que desciende a 0,9 a los 60 días. El Doppler tisular del anillo mitral evidenció función sistólica conservada con compromiso del llenado ventricular y posterior mejoría a los 60 días (incremento onda E´ y A´) (Figura 3). Es relevante destacar que la relación E/E´ varió poco en el período observado, de 14,3 a los 10 días a 13 a los 60 días (dentro de rango de referencia)7. Todo ello orienta a pensar en un mayor compromiso en la función auricular respecto a la función diastólica del VI. En el flujo Doppler de venas pulmonares se objetivó un patrón patológico a los 10 días con flujo retrógrado de onda S2 (sístole ventricular), bajo flujo anterógrado en onda D y flujo retrógrado de onda A. Podríamos atribuir este patrón a la rigidez de la aurícula asociada a una disfunción diastólica del VI, sin poder descartar influencia de la persistencia de shunt residual en dicho patrón (Figura 4). En el control a los 60 días presentó onda S unimodal con onda D predominante y pequeña onda A retrógrada, este patrón es el esperado en el posoperatorio alejado de esta patología8.
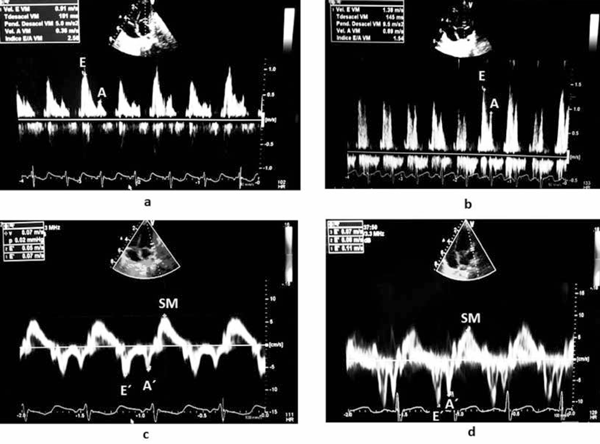
Figura 3: Registro Doppler transmitral en el caso 2 a los 10 (a) y 60 días (b) de la cirugía. Registro Doppler tisular anillo mitral caso 2 a los 10 (c) y 60 días (d) de la cirugía.
Conclusiones
En el RVPAT existen cavidades izquierdas pequeñas que luego de la cirugía sufren modificaciones anatómicas y funcionales adaptativas. Dicho proceso se caracteriza por transcurrir con presiones de llenado elevadas. Establecemos como hipótesis la existencia de una alteración en la función auricular asociado a una disfunción diastólica del VI, siendo el crecimiento de la AI un fenómeno adaptativo. Los altos niveles de NT-proBNP podría deberse a la presión elevada en las cavidades izquierdas, en especial la AI, y por tanto constituir un biomarcador en el seguimiento de dicho fenómeno. A la luz de estos hallazgos hemos iniciado el estudio prospectivo de pacientes con RVPAT haciendo énfasis en la función diastólica del VI, el tamaño y la función AI para verificar nuestra hipótesis.