Introducción
La alimentación adecuada del recién nacido de pretérmino se ha convertido en un desafío creciente para la neonatología. Habitualmente se utilizan recomendaciones elaboradas por consenso que tienen como meta alcanzar un patrón de crecimiento similar al fetal.
Actualmente la publicación de estudios randomizados clínicos1-4 y experimentales5,6 aportan información básica que puede ayudar a realizar un manejo más racional de la alimentación del nacido de pretérmino. También la incorporación del uso de los monitores continuos de glucosa (MCG) muestran la variabilidad de la glucemia y permiten encontrar hipoglucemia o hiperglucemia asintomática7-9. Dado el alto contenido del disacárido lactosa en la leche, los niveles de glucosa sanguínea entre lactadas proveerían una evaluación parcial de la alimentación enteral. La lactosa es hidrolizada (76%-80%) a glucosa y galactosa en el intestino delgado por la lactasa presente en el borde en cepillo en el extremo de las vellosidades intestinales y la no absorbida es fermentada en el colon, dando lugar a una serie compleja de compuestos, de los cuales el acetato es el más abundante y puede absorberse resultando en una fuente de energía10.
La evaluación de la glucemia en el período entre lactadas podría ser una buena fuente de información para el manejo del volumen y concentración de otros nutrientes en la alimentación continua e intermitente del neonato. El objetivo de este estudio fue evaluar cuales son los cambios producidos en la glucosa plasmática (GP) por diferentes concentraciones de lactosa administrados por vía enteral cada 3 horas.
Material y método
El estudio se realizó en la Unidad de Cuidados Intensivos Neonatal y Laboratorio Central del Hospital de Clínicas.
Muestra
Se realizó un estudio prospectivo en 19 niños nacidos de pretérmino en los que se evaluó la concentración de glucosa plasmática (GP) previa a la alimentación y a 1, 2 y 3 horas después de cada toma. Todos estaban recibiendo desde 72 horas o más alimentación enteral exclusiva. Se realizó una muestra por conveniencia.
Para su inclusión en el estudio los neonatos tenían que tener entre 30 y 35 semanas de edad gestacional, un peso entre 1.000 y 2.000 g, una edad posnatal entre 6 y 18 días de vida y un valor de GP previo a la alimentación mayor de 45 mg/100 mL evaluada por la técnica del refractómetro (Figura 1). Se definía la hipoglucemia cuando la cifra era menor de 45 mg/100 ml (<2,5 mmol/l)11.
Todos los neonatos estaban clínicamente estables, respirando aire sin ningún tipo de ayuda ventilatoria. Ninguno tenía malformaciones ni recibía medicación durante el estudio, excepto cafeína. Cada niño entraba al estudio sólo una vez. La edad gestacional era calculada en base a datos materno-fetales: la fecha del último período menstrual o ecografía o ambas, y por clínica por el método de Ballard12. Cuando la diferencia de la edad gestacional clínica y los datos del embarazo era mayor a dos semanas, el niño era excluido del estudio. Para evaluar el crecimiento intrauterino se usó la tabla de Usher13 y se consideró como pequeño para la edad gestacional (PEG) a quienes estaban por debajo del percentil 10.
En todos los casos los niños fueron alimentados con leche de su propia madre o fórmula sin el agregado de ningún tipo de enriquecimiento. De acuerdo a un estudio previo14 se asumió que la concentración de lactosa en la leche materna era de 6,2 g por 100 ml (1 ml contiene 62 mg de lactosa), y la fórmula fue preparada con la misma concentración. Para los cálculos se estimó la concentración de lactosa como el producto del volumen en ml por 62 (volumen de leche administrado x 62 = mg de lactosa estimados).
Con respecto a la concentración de lactosa, los niños se separaron en dos grupos: en el grupo 1 estaban los alimentados cada 3 h que recibían un volumen de 20 ml o más, con un contenido promedio de lactosa de 1.59 gramos. El grupo 2 se alimentaba cada dos horas y los niños recibían un volumen menor de 20 ml con un contenido promedio de lactosa de 0,83 g. Si a las 2 horas el valor de la glucemia era más elevado que 45 mg/100 ml, la alimentación se retardaba 1 h y se evaluaba a las 3 h (Figura 1). El volumen indicado para 24 horas varió entre 168 y 200 ml para cada grupo.
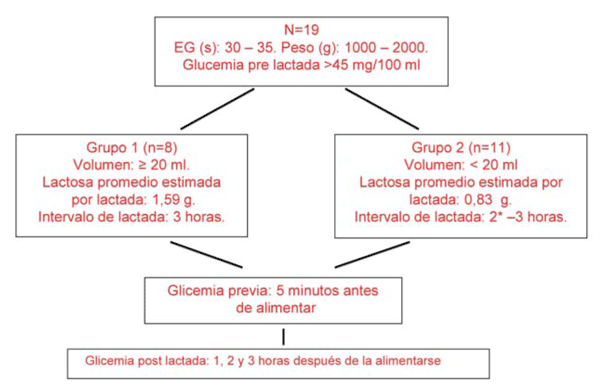
Figura 1 Esquema que muestra las características de cada grupo y la secuencia de las muestras de glucosa. * El grupo 2 recibía alimentación cada 2 h, pero si la glucemia en la muestra de 2 h era mayor de 45 mg/100 ml se retarda la alimentación por 1 h. Así ambos grupos se alimentaron cada 3 h.
Tres niños del grupo 1 y dos del grupo 2 se alimentaron por succión del pecho materno, el resto por sonda oro gástrica. En todos los casos previamente se evaluó el residual gástrico. Cuando se alimentó por succión el volumen se evaluaba por doble pesada15. Un gramo de leche consumida era tomada como 1 ml de leche ingerida. El resto se alimentó por sonda orogástrica medido por jeringa, pasado por gravedad en no más de 2 ml/min y con continua observación del niño. La saturación de oxígeno al inicio de la alimentación y durante las 3 horas siguientes era controlada, y se mantuvo entre 90% y 97%. Ninguno requirió administración adicional de oxígeno.
Medidas
La GP era medida 5 minutos antes de cada alimentación y 1, 2 y 3 horas después de la misma por refractómetro y determinación enzimática para conocer la cantidad de glucosa ingerida. El tiempo cero para la primera hora se contabilizó a partir del momento en que el niño comenzó a alimentarse.
Las muestras de sangre fueron extraídas por punción capilar en el borde externo del talón. El sitio de punción se calentó previamente con pañales embebidos en agua entre 38º y 40º C y luego se frotó suavemente la zona con una gasa estéril durante un minuto. Después de la extracción de la muestra se colocó en la zona de punción una compresa estéril. Para obtener las muestras siguientes se retiraba la gasa y se repetía el procedimiento, excepto la punción. Ningún niño fue puncionado más de una vez. Si se fracasaba en una muestra, el niño era excluido.
Para la determinación enzimática de la glucosa se obtenía la sangre en tubos capilares heparinizados. El plasma era separado por centrifugación y almacenado a menos -20º C. Después de obtener la última muestra, a las 3 h se aspiraba el contenido gástrico, y si el residual gástrico hubiera sido mayor del 10% del volumen administrado, ese niño también se excluiría del estudio, pero ninguno quedó fuera por esta causa. Finalmente, entre 12 y 24 horas después de la alimentación se investigaban sustancias reductoras en las materias fecales.
Análisis
Los datos cuantitativos de este estudio son expresados usando el promedio y la desviación estándar (DE) como medidas de resumen central y variabilidad respectivamente, para las distribuciones simétricas. Se utilizan la mediana y el rango para las distribuciones asimétricas.
Se calculó la diferencia entre el valor absoluto de GP previa a la alimentación (“nivel basal”) y a 1, 2 y 3 horas después de la alimentación. Para comparar el nivel de GP en los diferentes tiempos, en cada grupo se realizó un análisis de varianza para muestras dependientes. También se calculó el incremento entre el valor previo y a 1, 2 y 3 horas después de la alimentación. Para la comparación entre los grupos se empleó la prueba de “t” para variables independientes y variables dependientes. En las distribuciones asimétricas se uso la prueba de Mann-Whitney. Para la predicción del valor de la GP en la primera hora se realizó un análisis de regresión múltiple. Se estudiaron las siguientes variables: el valor de GP previo a la alimentación, la concentración de lactosa administrada, la edad gestacional y posnatal, el peso del niño al nacer y el peso actual. Para el análisis de los resultados se aceptó como válido un nivel de significación menor del 5% (p < 0,05).
Resultados
De acuerdo con todos los datos analizados, se comprobó que no hubo diferencias significativas entre los dos grupos en cuanto a la consideración de la edad postnatal, el peso, la edad gestacional y en la proporción de bajo peso para la edad (Tabla 1).
Tabla 1 Característica de los niños de cada grupo
| Grupo 1 | Grupo 2 | Valor de p | |
|---|---|---|---|
| Volumen promedio por lactada | 25,7 ml | 13,4 ml | 0,0001 |
| Lactosa en g por lactada | 1,59 | 0,83 | 0,0001 |
| Nº de casos | 8 | 11 | NS |
| Edad en días | 11,6 (3,6) | 11,4 (3,9) | NS |
| Peso actual en g | 1.487 (332,2) | 1.417,4 (286,6) | NS |
| Edad gestación actual (semanas) | 32,6 (1,7) | 31,5 (1,5) | NS |
| Sexo: fem/masc | 5/3 | 7/4 | NS |
| Porc. PEG | 2/6 | 3/8 | NS |
Los valores entre paréntesis corresponden al desvío estándar.
Cuatro niños en el grupo 1 y seis en el grupo 2 se alimentaron con leche materna, mientras los otros lo hacían mediante fórmula. Tampoco entre estos niños se hallaron diferencias significativas en el nivel de glucosa ni en los incrementos de esta. Ninguno presentó materias líquidas o sustancias reductoras en las heces entre las 12 y 24 horas después de la alimentación.
Evolución de la glucemia posalimentación
En todos los neonatos del grupo 1 y en nueve del grupo 2 el mayor incremento de GP se produjo en la primera hora después de la alimentación. En dos niños del grupo 2, el mayor incremento de glucosa se produjo a las 2 horas.
Grupo 1
Estuvo conformado por ocho niños. El promedio del volumen de alimento administrado fue de 25,7 ml/kg (DE: 4,37; rango: 22-36) que aporta un promedio de 1,59 g de lactosa (rango: 1,36-2,23). Para un intervalo de 3 h, aporta 8,83 mg/kg/min (rango 7,5 y 12,3 mg/min). La concentración de la GP previa a la alimentación fue de 64,1 mg/100 ml (DE: 15,20).
En la primera hora después de alimentarse, el nivel de glucosa aumentó a 94,9 mg/100 ml (DE: 16,70). Descendió a 83,1 mg/100 ml (DE: 14,1) a las 2 h, y a 78,6 mg/100 ml (DE: 15,50) después de 3 h. En la primera, segunda y tercera hora, el nivel de total de GP fue significativamente más alto que el valor de GP previo (p< 0,05) (Figura 2 y Tabla 2).
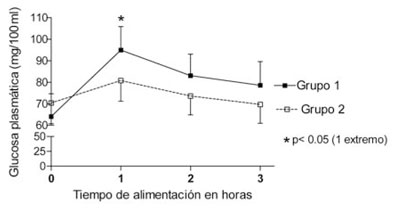
Figura 2 Evolución del valor absoluto de la GP en ambos grupos. Incremento en la primera hora y luego un descenso progresivo. En la primera hora el incremento de la GP total fue más alto en el grupo 1 (p<0,05).
Tabla 2 Glucosa plasmática basal y a 1, 2 y 3 horas después de alimentarse
| Glucosa plasmática | Basal | 1ª hora | 2ª hora | 3ª hora |
|---|---|---|---|---|
| Grupo 1 (n=8) | ||||
| Promedio mg/100 ml | 64,1 | 94,9 | 83,1 | 78,6 |
| Desvío estándar | 15,2 | 16,7 | 14,1 | 15,5 |
| GP previa versus 1, 2 y 3 horas | p=0,001 | p=0,003 | p=0,03 | |
| Grupo 2 (n=11) | ||||
| Promedio (mg/100 ml) | 70,4 | 80,6 | 73,6 | 69,7 |
| Desvío estándar | 13,7 | 16,9 | 14,8 | 14,5 |
| GP previa versus 1, 2 y 3 horas | p=0,002 | p=0,3 | p=0,7 | |
| Comparación grupo 1 y 2: basal y 1,2 y 3 | p=0,36 | p=0,09 | p=0,17 | p=0,21 |
Grupo 2
En él participaron once niños. El promedio del volumen administrado fue de 13,4 ml/kg (DE: 2;82; rango: 10-18) que aportó 0,83 g de lactosa (rango: 0,62-1,12) por lactada para un intervalo de 3 horas a un promedio de 4,6 mg/kg/min (rango: 3,4-6,2 mg/min). El valor previo de GP fue 70,4 mg/100 ml (DE: 13,72).
En la primera hora después de la alimentación la glucosa se elevó a 80,6 mg/100 ml (DE: 16,90). Disminuyó a 73,6 mg/100 ml, a las 2 horas y a 69,7 mg/100 ml a las 3 h después de la alimentación. El valor absoluto de GP fue significativamente más alto al valor previo en la primera hora (p<0,05), pero no en la segunda y tercera hora (Figura 2, Tabla 2).
Diferencia del incremento con respecto al valor basal entre grupos
El grupo 1, que recibió un aporte de lactosa de 4,23 mg/kg/min más que el grupo 2, tenía valores significativamente más altos de GP en la primera, segunda y tercera hora después de la alimentación (Figura 3 y Tabla 3). A las 3 h, un niño del grupo 1 y cuatro del grupo 2 presentaban niveles inferiores al valor previo de GP (sin llegar a alcanzar valores de hipoglucemia). Ningún niño presentó niveles de hipoglucemia a las 2 h de la alimen tación.
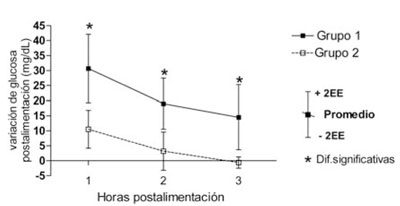
Figura 3 Evolución del incremento de GP con respecto al valor previo en ambos grupos. El grupo 1 presenta un incremento más elevado que el grupo 2 a 1, 2 y 3 horas después de la alimentación.
Tabla 3 Incremento posalimentación
| Grupo 1 (n=8) | Grupo 2 (n=11) | ||||
| Glucosa mg/100 ml | Glucosa mg/ml | Valor de p | |||
| Promedio | EE | Promedio | EE | ||
| 1ª hora | 30,7 | 5,72 | 10,5 | 3,16 | 0,001 |
| 2ª hora | 19,0 | 4,24 | 3,2 | 3,25 | 0,002 |
| 3ª hora | 14,5 | 5,44 | -0,60 | 1,89 | 0,002 |
EE: error estándar
Regresión lineal
Según el modelo de regresión lineal, solamente el aporte de lactosa resultó significativo como predictor del incremento de la GP 1 h después de la alimentación (p=0,001) (Figura 4). La ecuación de regresión fue la siguiente:
a= -11.07; b=25.5; coeficiente de determinación: r2= 0.56
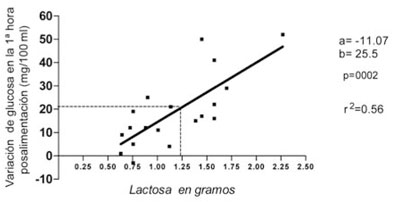
Figura 4 La concentración de lactosa administrada permite predecir la variación de la GP a 1 hora después de alimentarse. Se muestra la ecuación de regresión y se marca con líneas punteadas el ejemplo del texto.
Ejemplo para usar la ecuación de regresión lineal- Incremento de glucosa (en mg)
Se administran 20 ml en una lactada. Se estima la cantidad de lactosa administrada en 20 ml/kilo de leche es de 1,24 g. Este valor es el producto del contenido de lactosa por mililitro, que es de 62 mg multiplicado por el volumen administrado 20 ml (62 x 20= 1.240 mg (1,24 g). Aplicando la ecuación de la regresión lineal se tendrá que:
y= a + b . x = -11,07 +25,5 x 1,24= 20,5 mg glucosa/100 ml
A 1 hora de la alimentación se observará un incremento de 20,5 mg/100 ml de glucosa sanguínea.
Discusión
Se encontró una asociación significativa entre la cantidad de lactosa administrada a un niño recién nacido de pretérmino y el aumento de los niveles de glucosa en la primera hora postalimentación. Este incremento en la primera hora podría ser explicado en los dos grupos por el mayor porcentaje de vaciamiento gástrico en la primera hora que sigue a la alimentación, producido especialmente en los alimentados con la leche materna16,17.
Otras variables que pueden afectar el nivel de GP posalimentación son la actividad de la lactasa intestinal y la transformación de galactosa a glucosa en el hígado. A la edad de 8 días o más la actividad de la lactasa es funcionalmente adecuada18,19 y el cierre del ductos de Arancio ya se habría producido20,21 asegurando el pasaje de toda la galactosa ingerida por el hígado22. La transformación de galactosa a glucosa sería total.
La regresión lineal muestra el incremento de glucosa en la primera hora después de la alimentación, esto puede ser utilizado para evaluar las variables anteriores u otras enfermedades en la que se sospeche una alteración nutricional por mala absorción de lactosa.
Con respecto a la evolución el incremento de GP, este resultó estadísticamente más alto en el valor previo a la alimentación en el grupo 1 que en el grupo 2, en la evaluación a 1, 2 y 3 horas después de la alimentación. Esta elevación de la GP que sigue al final de la primera hora posterior es característica de la alimentación intermitente, y ha sido descrita en neonatos humanos2,3,8 y en la experimentación animal4-6. Esta elevación aguda de la GP produce un incremento de insulina y cambios en la concentración de aminoácidos circulantes que activa la síntesis proteica3-6. Bozzetti23 encontró un aumento de la perfusión en la mesentérica después de la alimen tación por bolo que la continua.
En los registros individuales de cada niño no se encontró, en el presente trabajo, oscilaciones de la glucosa entre dos lactadas, como ha sido descrito por los que usan el monitor continuo de glucosa. Bearsall24, en un estudio de validación de la glucosa por este método, encuentra un error de ± 2 milimoles (aproximadamente 36 mg/dl) de glucosa. Esta tecnología ayudaría en la evaluación de la tendencia de la GP, y aunque la medida puntual no parece confiable, sí cabría tomarla como nivel de alarma.
Con respecto a la evolución el incremento de GP postalimentación, el estudio reveló que fue estadísticamente mayor en el grupo 1. En la primera hora el incremento fue un 48% del valor previo, mientras que en el grupo 2, fue de 14.7%. A las 2 y 3 horas después de la alimentación hubo un descenso progresivo en ambos grupos. En el grupo 1, a las 3 horas, previa a la siguiente alimentación, los niños presentaban un promedio de 14.5 mg/100 ml más alto de GP que el valor inicial (p<0,05). Es posible que el grupo 1 tuviera un exceso de material energético que supera la proteína administrada.
Se ha descrito4 una correlación negativa entre la oxidación de proteínas y el aumento de los carbohidratos que produciría un ahorro de la metabolización oxidativa de las proteínas para el crecimiento. Si el exceso de carbohidratos supera la necesidad del consumo de energía se almacena como grasa2. Además de obesidad, el exceso de glucosa producirá más insulina, lo que en un futuro podría conducir a una resistencia de la misma y a alteraciones cardiovasculares25-27.
Con la finalidad de acelerar el crecimiento en pretérminos, en algunas unidades neonatales se administran leches hipercalóricas a expensas de hidratos de carbono o triglicéridos de cadena media que producen un nivel más alto de GP. Se recomienda evitar la aceleración del crecimiento porque tendría consecuencias negativas tardías en la salud de estos niños26,27.
En el grupo 2 la administración de lactosa fue la mitad del grupo 1, y a las 2 h el valor de la GP ya no se diferenciaba del nivel previo. No hubo diferencia entre las 2 y 3 h en la GP en estos niños. Para mantener esos valores a las 3 h posiblemente debieron recurrir a la producción endógena, que en este caso fue suficiente porque tenían reservas, y se puso en marcha el proceso de la glucogenólisis para no entrar en hipoglucemia28. Esta información es valiosa en el caso de niños que reciben aportes bajos o muy en el límite de lactosa, para que no se demore la siguiente lactada, como puede suceder con la libre demanda o cuando se presentan regurgitaciones o vómitos que producen disminución del aporte de nutrientes y puede derivar en hipoglucemia. Este problema fue observado por Staffler29 y Hume30 quienes detectaron hipoglucemias en niños después de permanecer estables varios días con alimentación enteral exclusiva, aún a la edad del alta, especialmente en pretérminos que presentaron morbilidades graves. La evaluación de la glucemia no es una práctica de rutina una vez que el niño se mantiene estable con alimentación enteral exclusiva. Nuestros resultados y la información bibliográfica muestran que la ingestión de carbohidratos debe ser evaluada y balanceada con la administración de proteínas y grasas. La nutrición adecuada de los niños debe ser controlada no solamente por el peso sino también por otros datos antropométricos como el crecimiento múscu lo-esquelético, el incremento de grasas, además de la talla, el perímetro craneano y si es posible el crecimiento óseo.
Una debilidad de nuestro estudio es la falta de medida de la lactosa en cada alimentación. Se asumió como válida la concentración expuesta en un trabajo previo realizado en una población similar14 del que se extrae que la lactosa es el componente con menos variabilidad (coeficiente de variación de 9,8%). Otra carencia es no haber realizado un estudio simultáneo de vaciamiento gástrico por ecografía para estimar el porcentaje de vaciado previo a cada medida. La cantidad de casos no parece ser insuficiente, ya que los resultados analizados con el número usado, no cambiarían el perfil de la evolución de la glucemia evaluado por el Anova. Pero aumentando la cantidad de población estudiada se podría contribuir al ajuste de la regresión lineal, y contribuiría a mejorar la dispersión de la distribución de la GP en el grupo 1 a las 3 h después de la alimentación.
En conclusión, la intención de este trabajo es realizar un aporte mostrando un perfil de la evolución de la glucemia entre dos alimentaciones en niños que recibieron diferentes concentraciones de lactosa. Aquellos que recibieron concentraciones más altas tendrían mayor probabilidad de tener valores por encima de GP del valor previo antes de alimentarse nuevamente generando una mayor carga de hidratos de carbono.
Son necesarios nuevos estudios que ayuden a comprender mejor la fisiología y fisiopatología de la alimentación temprana en estos niños. Los futuros estudios de seguimiento deberían evaluar el valor predictivo en la salud de estos niños que tiene la alimentación y el crecimiento en los primeros meses de vida.














