Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Pediatría del Uruguay
versión impresa ISSN 0004-0584versión On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.88 no.1 Montevideo feb. 2017
Leishmaniasis visceral en Uruguay
Visceral leishmaniasis in Uruguay
Fabio Grill1, Marcela Zurmendi1
1. Infectólogo. Unidad Enfermedades Infecciosas. Hospital Maciel. ASSE.
Unidad Enfermedades Infecciosas. Hospital Maciel.
Trabajo inédito.
Declaramos no tener conflictos de intereses.
Resumen
La leishmaniasis comprende un grupo de enfermedades zoonóticas causadas por protozoarios del género Leishmania y transmitidas mediante flebótomos.
Se describen tres formas clínicas básicas: formas cutáneas, cutáneo-mucosas y viscerales, siendo esta última, la presentación más grave por su alta letalidad cuando no se realiza tratamiento específico.
Leishmaniasis visceral (LV) es causada por L. donovani complex que incluye L donovani en el subcontinente indio, Asia y África, L. infantum en la cuenca mediterránea y L. chagasi en América del Sur.
La infección en el hombre se puede dar a partir de parásitos provenientes de un reservorio animal (ciclo zoonótico)
Leishmaniasis tienen una distribución mundial muy amplia, estimándose unos 14 millones de personas infectadas, con una incidencia anual de 2 millones de nuevos casos, de los cuales 500.000 son de leishmaniasis visceral.
En nuestro continente se registraron, entre 2001 y 2014, unos 48.700 casos de leishmaniasis visceral de los cuales el 33,4% de los casos se registraron en menores de 5 años y en el 6,7% en pacientes infectados con VIH. La mortalidad global es de del 6,6%.
En nuestro país, en el litoral norte, específicamente Salto, desde el año 2010 se han diagnosticado en forma progresiva casos de leishmaniasis canina coincidiendo con la identificación del vector: Lutzomyia longipalpis. Aún no hay casos en personas identificados. Esto ha producido un cambio epidemiológico inédito en nuestro país.
Palabras clave: LEISHMANIASIS VISCERAL
Summary
Leishmaniasis comprises a group of zoonotic diseases caused by protozoa of the genus Leishmania and transmitted by sandflies.
There are three basic clinical forms: cutaneous, cutaneous-mucous and visceral, the latter being the most serious presentation due to its high lethality rate if no specific therapy is initiated.
Visceral leishmaniasis (VL) is caused by L. donovani complex, which includes L donovani in the Indian subcontinent, Asia and Africa, L. infantum in the Mediterranean basin and L. chagasi in South America.
The infection occurs from parasites harboured in an animal reservoir (zoonotic cycle)
Leishmaniasis has a very wide global distribution, with an estimated14 million people infectedand an annual incidence of 2 million new cases, of which 500,000 correspond to visceral leishmaniasis.
In our continent between 2001 and 2014, approximately 48,700 cases of visceral leishmaniasis were registered.33.4% of these were in children under 5 years of age and 6.7% occured in patients infected with HIV. The overall mortality was 6.6%.
In our country, in the north, specifically in Salto, since 2010, cases of canine leishmaniasis have been identified progressively, coinciding with the identification of the vector: Lutzomyia longipalpis. No cases in humans have yet been identified. This has caused an unprecedented epidemiological change in our country.
Key words: VISCERAL LEISHMANIASIS
Introducción
La leishmaniasis comprende un grupo de enfermedades zoonóticas causadas por protozoarios del género Leishmania y transmitidas mediante flebótomos.
Se reconocen tres formas clínicas básicas: formas cutáneas, cutáneo-mucosas y viscerales, siendo esta última, la presentación más grave por su alta letalidad cuando no se realiza tratamiento específico.
Leishmaniasis visceral es causada por L. donovani complex que incluye L donovani en el subcontinente indio, Asia y África, L. infantum en la cuenca mediterránea y L. chagasi en América del Sur.
La infección en el hombre se puede dar a partir de parásitos provenientes de un reservorio animal (ciclo zoonoìtico), o a partir de parásitos que el vector ha adquirido desde otro hospedero humano (ciclo antroponoítico) aunque esto es menos frecuente.
Leishmaniasis tienen una distribución mundial muy amplia, desde el sudeste asiático, África oriental, América latina hasta la cuenca mediterránea. Con más de 350 millones de personas viviendo en estas áreas de riesgo, se estima que hay 14 millones de personas infectadas, con una incidencia anual de 2 millones de nuevos casos, de los cuales 500.000 casos son de Leishmaniasis visceral (LV)(1).
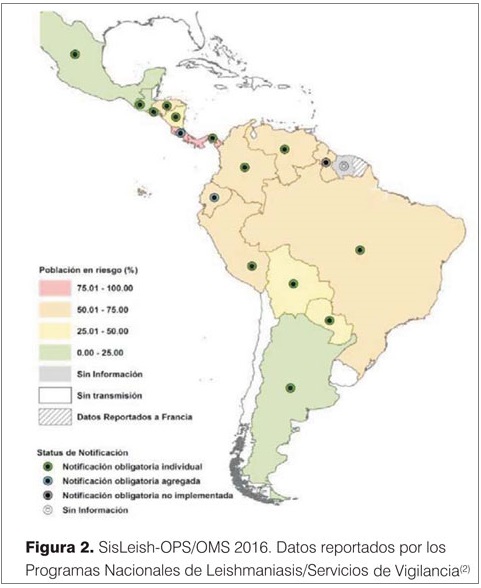
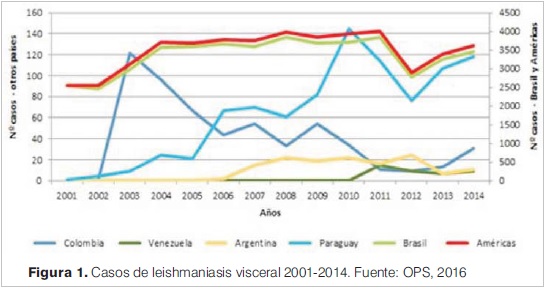
En nuestro continente, de acuerdo a OPS, se registraron entre 2001-2014 unos 48.700 casos de leishmaniasis visceral(2). En 2016, el 33,4% de los casos de LV se registran en menores de 5 años y en el 6,7% en pacientes infectados con VIH (figura 1). La mortalidad global fue del 6,6%.
En los últimos años se vienen reconociendo mayor frecuencia de casos de LV en América del sur, producida por Leishmania infantum, como consecuencia del tránsito fluido de mercaderías y de las migraciones de personas y animales domésticos entre otras razones. Esto ha favorecido la expansión del vector, reconociéndose una distribución paulatinamente mayor hacia el sur del continente(3).
En el continente americano hay 12 países con LV endémica que comprenden tres escenarios epidemiológicos: de transmisión esporádica (Costa Rica, Honduras, Guatemala, Nicaragua, Bolivia, Guyana y México), de transmisión estable (Colombia y Venezuela) y de transmisión en expansión (Argentina, Paraguay y Brasil).
Solo Chile y Uruguay no tienen casos registrados de LV a la fecha (figura 2).
Fue en el trabajo de campo de
Ante esta situación y el riesgo inminente de aparición de casos humanos,
Leishmaniasis visceral es una enfermedad de declaración obligatoria en nuestro país.
Leishmania
El agente etiológico de la leishmaniasis es un protozoario dimórfico del género Leishmania, que pertenece al orden Kinetoplastida y a la familia Trypanosomatida.
El género Leishmania se divide en dos subgéneros: Leishmania y Viannia.
Las especies de Leishmania reconocidas en América latina integra el subgénero Leishmania por lo que su nombre taxonómico completo es Leishmania infantum (= Leishmania chagasi).
Leishmania infantum es originaria del viejo mundo y su llegada a nuestro continente se relaciona con la época de la conquista española (y al tránsito de perros domésticos). En América esta especie se adaptó al flebótomo autóctono Lutzomyia longipalpis y se configuró un ciclo de transmisión con características propias, con una presencia continua todo el año y una mayor virulencia, tanto en perros como en humanos.
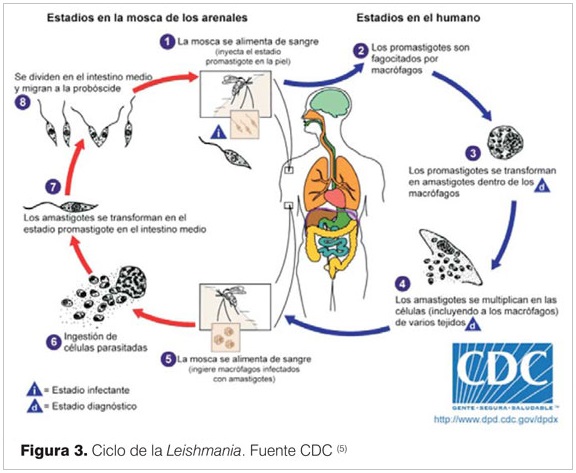
Leishmania presenta dos estadios diferentes en su ciclo vital: una forma extracelular (promastigotes) en el huésped invertebrado (flebótomos) y una forma intracelular (amastigote) en el hospedero vertebrado.
El ciclo biológico se inicia cuando una hembra de flebótomo parasitada obtiene sangre de un huésped vertebrado. Los promastigotes con capacidad infectiva (promastigotes metacíclicos) penetran en la piel del hospedero a través de la probóscide del insecto. Posteriormente los promastigotes son fagocitados por los macrófagos y en el interior de los mismos se transforman en amastigotes que se reproducen por fisión binaria. Cuando se alcanza un límite de protozoos intramacrofágicos, la célula estalla y los amastigotes liberados colonizan células adyacentes (figura 3)(5).
Dependiendo de la especie de Leishmania y de las características inmunológicas del hospedero, la infección puede quedar limitada a la piel, o extenderse por vía linfática local, acceder a las mucosas o diseminarse a órganos con elevado contenido en macrófagos como son el bazo, hígado y médula ósea.
El ciclo se cierra cuando un nuevo flebótomo ingiere sangre con macrófagos infectados.
Clínica
La leishmaniasis visceral tiene generalmente un curso clínico inicial asintomático, ya que las personas desarrollan una respuesta inmune efectiva. El riesgo de evolucionar a enfermedad sintomática es mayor en pacientes con desnutrición, coinfección con VIH, y en los niños menores de 1 año, lactantes o inmunocomprometidos. En más del 90% de los casos ocurre en menores de 10 años, pudiendo aparecer de manera súbita o con carácter insidioso y prolongado.
Se reconocen varias formas clínicas; asintomática, donde es solo a través de una prueba serológica o de biología molecular como único indicador positivo de infección. Forma oligosintomática, descrita en áreas endémicas, con sintomatología inespecífica. Puede presentarse como síndrome febril prolongado, con fiebre de alto grado que puede ser intermitente o en picos. Otros síntomas descritos son debilidad, astenia, adinamia, anorexia y adelgazamiento. Habitualmente se reconocen en el examen físico, adenomegalias generalizadas y/o hepato-esplenomegalia.
La forma sintomática es la que presenta mayor gravedad y se manifiesta con fiebre elevada, hepato-esplenomegalia síndrome poliadenomegálico, elementos hemorragíparos (epistaxis, gingivorragia, etcétera).
Entre los hallazgos de laboratorio es común encontrar anemia (generalmente normocítica-normocrómica), leucopenia y trombocitopenia, hipergamaglobulinemia e hipoalbuminemia. El funcional hepático también puede verse afectado, con aumento de transaminasas.
La caquexia y los signos de desnutrición proteico-calórica severa como edemas y ascitis y la hiperpigmentación se manifiestan en forma tardía, generalmente relacionada al postratamiento.
En ocasiones puede presentarse como síndrome hemofagocítico, aunque es una forma muy rara(6).
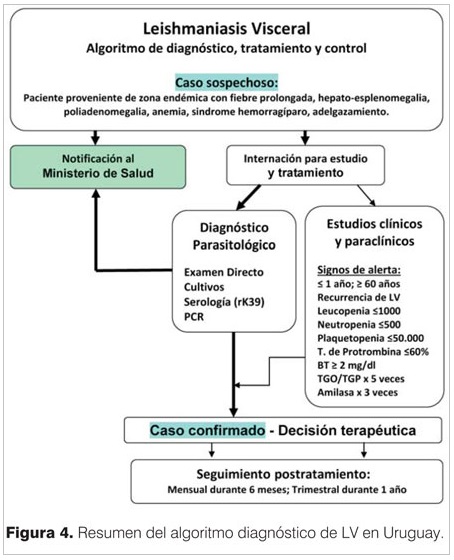
Tanto los casos sospechosos de leishmaniasis visceral como los confirmados por técnicas microbiológicas, deben ser evaluados para identificar la presencia de signos de alerta que determinarán un seguimiento clínico-terapéutico más estricto.
Los signos de alerta se resumen en:
- Signos de alerta clínicos:
- Edad menor de 1 año.
- Recidiva de la enfermedad.
- Presencia de diarrea o vómitos.
- Edema localizado, ascitis.
- Sobreinfección bacteriana.
- Fiebre de más de 60 días.
- Signos de alerta de laboratorio:.
- Leucopenia <1.000 cel/mm3.
- Neutropenia <500 cel/mm3.
- Plaquetopenia <50.000.
- Tiempo de protrombina <60%.
- Bilirrubina total >2 mg/dl.
- TGO / TGP x 5 veces valor normal.
- Amilasa x 3 veces valor normal.
Diagnóstico
El diagnóstico se basa inicialmente en la sospecha clínica, por un síndrome clínico compatible como fue descrito, y un contexto epidemiológico. Debe ser confirmado microbiológicamente por cualquier técnica parasitológica.
En nuestro país la zona '
Existen múltiples pruebas parasitológicas disponibles que incluyen la detección de parásitos por examen microscópico, el cultivo, pruebas serológicas, y pruebas moleculares de detección del ADN del parásito (reacción en cadena de la polimerasa [PCR]).
En nuestro país es posible realizar el diagnóstico parasitológico de acuerdo al algoritmo propuesto por el grupo de expertos para la guía clínica editada por el MSP.(4) (tabla 1).
1. Parasitológico directo
Se realiza generalmente en material biópsico en nódulos linfáticos, médula ósea o tejido esplénico. El estudio de material esplénico es el que mayor sensibilidad tiene, con la contrapartida de los riesgos inherentes a la punción diagnóstica.
Se realizan extendidos coloreados por técnicas específicas (May Grunwald Giemsa), permitiendo observar a los amastigotas característicos en el interior de macrófagos.
2. Cultivo
Se procesan en medios específicos (denominados NNN), a partir de muestras de aspirado o biopsias (ganglio, bazo, etcétera).
3. Biología molecular
4. Diagnóstico serológico:
Las pruebas serológicas no son definitorias sino que sus resultados deben ser valorados en el contexto clínico y epidemiológico.
4.1 El test más utilizado es un ensayo inmunocromatográfico denominado rK39, que detecta anticuerpos en forma cualitativa con base en el antígeno recombinante rK39 propio del complejo Leishmania donovani que incluye a Leishmania infantum.
Es una prueba rápida y sencilla de realizar, que tiene valores de sensibilidad y especificidad por encima de 95 %.
No debe ser utilizado como único criterio para el diagnóstico de leishmaniasis y nunca debe ser utilizado como única referencia para definir un tratamiento.
Un resultado negativo no excluye la infección parasitaria y deben realizarse estudios adicionales. Falsos negativos pueden verse en personas inmunocomprometidas (HIV y otros).
4.2 La inmunofluorescencia indirecta (IFI), detecta anticuerpos en forma cuantitativa. Tiene valores de sensibilidad un poco por debajo del test inmunocromatográfico rK39 y similares valores de especificidad. Puede complementar al test rápido, dado que la utilización de más de una técnica serológica aumenta la sensibilidad general.
4.3 Aglutinación directa (AD) detecta anticuerpos en forma cuantitativa. La sensibilidad y especificidad son similares a los de
Tratamiento
Tradicionalmente el tratamiento antileishmaniasico ha sido en base a los antimoniales pentavalentes y
No hay una única opción terapéutica satisfactoria y existen diferentes planes opcionales que dependen entre otras cosas, de las características socioeconómicas de la región, accesibilidad a tratamientos por sus costos, el patrón de resistencia de Leishmania sp. a los fármacos tradicionales y las comorbilidades o coinfecciones asociadas, como la infección por VIH.
Aunque la literatura científica nos muestra múltiples estudios clínicos con antimoniales pentavalentes, éstos no están disponibles en Uruguay.
En Uruguay, solo tenemos disponibilidad de anfotericina B en su forma deoxicolato y liposomal, por lo que, para esta breve revisión, no expondremos del resto de tratamientos farmacológicos antileishmania descritos en la literatura médica.
La anfotericina B es el antileishmaniásico de elección tanto en adultos como en población pediátrica.
Hay suficiente información relacionada con el uso de anfotericina B deoxicolato (AmB-D) y éxito clínico en LV(7-10). Aunque no hay un esquema terapéutico único, dosis entre 0,5-1 mg/kg/día han demostrado tasas de efectividad clínica >98%, aun en pacientes con fracasos terapéuticos previos con antimoniales(8).
La guía de recomendación de tratamiento para la leishmaniasis en las Américas de
Sin embargo, la efectividad de AmB-D y su bajo costo, contrasta con su elevada toxicidad y efectos secundarios, que pueden estar presentes en más del 40% de los casos. Es frecuente la presencia de fiebre, fenómenos alérgicos, alteraciones electrolíticas y nefrotoxicidad como efectos secundarios más importantes.
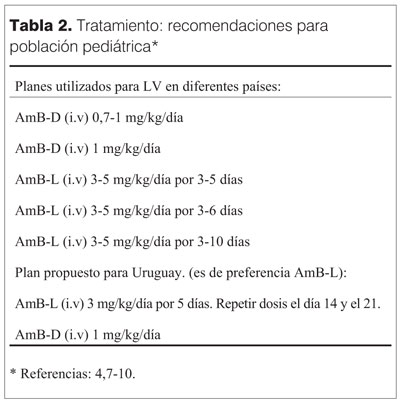
En Uruguay tenemos disponibilidad de anfotericina B liposomal (AmB-L) con un mejor perfil de toxicidad y eficacia comparada con AmB-D, de acuerdo a múltiples ensayos clínicos en LV, mostrando una efectividad >95%, y en diferentes dosificaciones, desde 3-5 mg/kg/día hasta una dosis total de
De acuerdo con las recomendaciones de la guía de consenso del MSP (4), AmB-L está posicionada como primera opción en embarazadas, pacientes pediátricos, pacientes con coinfección por VIH y pacientes con inmunocompromiso.
La tabla 2 (4,7-10) resume los diferentes planes terapéuticos disponibles en la actualidad.
Las recaídas ocurren aproximadamente en el 5% de los pacientes con LV y se observan mayoritariamente en el primer año postratamiento.
Tras la finalización del tratamiento, el paciente debe ser evaluado clínicamente una vez al mes durante los primeros 6 meses y luego cada 3 meses hasta completar 1 año de seguimiento postratamiento.
Si el paciente permanece asintomático durante ese periodo, se considera clínicamente curado.
Vigilancia epidemiológica: Notificación
Es obligatorio reportar todo caso sospechoso a la división de Epidemiología del MSP (decreto 41/012), a través de la siguiente manera: (requiere formulario de notificación)
- Teléfono (24 h) 24091200
- Fax: 24085 838
- Email: vigilanciaepi@msp.gub.uy
- Sistema on-line: www.msp.gub.uy
Conclusiones
Leishmaniasis es un problema de salud importante en todo el mundo. El espectro de la infección es muy amplio, subclínica la mayoría de las veces, localizada (lesión de la piel), o diseminada (mucocutánea y visceral), dependiendo del estado inmune del huésped, del parásito, y de la respuesta inmune inflamatoria.
Los principales factores de riesgo de la distribución de Leishmania son las condiciones socioeconómicas, la malnutrición, la movilidad (migración) de la población, y los cambios ambientales y climáticos.
Desde hace 6 años se reconoce en nuestro país el vector: Lutzomyia longipalpis y casos en forma creciente de leishmaniasis canina. Los expertos internacionales nos dicen que una vez introducido el flebótomo, y casos de leishmaniasis canina, los casos humanos son esperables en los años siguientes.
El control de esta enfermedad se basa en el diagnóstico temprano y el tratamiento, en el control de vectores, en la vigilancia activa de la enfermedad, sobre todo canina, y en la educación de la comunidad.
Es importante, a nuestro entender, que se desarrollen actividades médicas educativas para el conocimiento de esta 'nueva' enfermedad en nuestro medio, ya que el éxito depende del reconocimiento y tratamiento temprano.
Finalmente, el algoritmo diagnóstico-terapéutico de LV propuesto en nuestro país se resume en la figura 4.
Referencias bibliográficas
1. Organización Mundial de
2. Organización Panamericana de
Disponible en: http://www.paho.org/hq/index.php?option= com_topics& view=readall&cid=6018&Itemid=40754 ang=es. (Consulta: 1 agosto 2016).
3. Salomón O, Basmajdian Y, Fernández MS, Santini MS. Lutzomyia longipalpis in Uruguay: the first report and the potential of visceral leishmaniasis transmission. Mem Inst Oswaldo Cruz 2011; 106(3):381-2.
4. Uruguay. Ministerio de Salud. Guía de diagnóstico, tratamiento y control de
Disponible en: http://www.msp.gub.uy/sites/default/files/archivos_adjuntos/Guia%20Leishm%20Visceral%20MSP%20-%20ULTIMA%20-%20abril2016%20.pdf.
(Consulta: 2 agosto 2016).
5. Centers for Disease Control and Prevention. Parasites: leishmaniasis. Atlanta, GA: CDC, 2013. Disponible en: http://www.cdc.gov/parasites/leishmaniasis/biology.html. (Consulta: 1 agosto 2016).
6. Sotoca JV, García L, Lillo M, García O, Carrascosa MC, Tébar R. Síndrome hemofagocítico secundario a leishmaniasis visceral. An Pediatr 2008; 69(1):46-8.
7. Argentina. Ministerio de Salud. Leishmaniasis visceral: guía para el equipo de salud. Buenos Aires: Ministerio de Salud, 2015. Disponible en: http://www.msal.gob.ar/images/stories/bes/graficos/0000000798cnt-2012-03-15_leishmaniasis-visceral-guia.pdf. (Consulta: agosto 2016).
8. Monge-Maillo B, López-Vélez R. Therapeutic options for visceral leishmaniasis. Drugs 2013; 73(17):1863-88.
9. Organización Panamericana de
10. Kafetzis D, Maltezou H. Visceral leishmaniasis in paediatrics. Curr Opin Infect Dis 2002; 15(3):289-94.
Correspondencia: Dr. Fabio Grill.
Correo electrónico: fabio.grill@asse.com.uy