Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
Print version ISSN 0004-0584On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.87 no.4 Montevideo Dec. 2016
Urgencias en pacientes oncológicos pediátricos
Emergency in pediatric cancer patients
María Silvina Evangelista1, Agustina Molina2, Mariel Della Corte3, Lidia Fraquelli4, Pedro Bonifacio5
2. Médica. Centro atención integral del paciente hematooncológico (CAIPHO). Hospital de Pediatría Juan. P. Garrahan. Buenos Aires, Argentina.
3. Médica. Sector Emergencias. Hospital de Pediatría Juan. P. Garrahan. Buenos Aires, Argentina.
4. Médica. Coordinadora Centro atención integral del paciente hematooncológico (CAIPHO). Hospital de Pediatría Juan. P. Garrahan. Buenos Aires, Argentina.
5. Médico. Coordinador Sector Emergencias. Hospital de Pediatría Juan. P. Garrahan. Buenos Aires, Argentina.
Hospital de Pediatría Juan. P. Garrahan. Buenos Aires, Argentina.
Trabajo inédito
Declaramos no tener conflictos de interés.
Fecha recibido: 1° de agosto de 2016
Fecha aprobado: 7 de octubre de 2016
Resumen
Las tasas de supervivencia del cáncer infantil han mejorado considerablemente en las últimas décadas. Sin embargo, las emergencias relacionadas con la propia enfermedad o complicaciones derivadas del tratamiento implican un alto grado de morbimortalidad.
El personal de salud de un servicio de emergencia debe identificar y tratar en forma temprana estas situaciones clínicas que ponen en riesgo la vida del paciente.
Revisaremos aquellas urgencias oncológicas que reconocidas y tratadas de inmediato mejoran drásticamente el pronóstico del paciente.
Palabras clave:
URGENCIAS MÉDICAS
ONCOLOGÍA MÉDICA
SÍNDROME DE LISIS TUMORAL
COMPRESIÓN DE LA MÉDULA ESPINAL
HIPERLEUCOCITOSIS
SÍNDROME DE LA VENA CAVA SUPERIOR
NEUTROPENIA
Summary
Survival rates for child cancer have significantly improved in the last decades. However, emergencies in connection with the disease itself or complications arising from the treatment imply a high morbimortality.
The health staff at an emergency service needs to identify and treat as early as posible these clinical situations that result in the patient’s risk of life.
Key words:
EMERGENCIES
MEDICAL ONCOLOGY
TUMOR LYSIS SYNDROME
SPINAL CORD COMPRESSION
HYPERLEUCOCITOSIS
SUPERIOR VENA CAVA SYNDROME
NEUTROPENIA
Introducción
Los avances alcanzados en el tratamiento del cáncer pediátrico han llevado a una mejora significativa de la supervivencia, como consecuencia del empleo de terapéuticas más agresivas y mejora del sostén clínico.
Si bien algunas emergencias son comunes al resto de la población pediátrica, tales como distrés respiratorio, alteraciones hidroelectrolíticas, etcétera, otras son de particular presentación en este tipo de pacientes.
La experiencia y la rapidez en la resolución de situaciones de emergencia son cruciales en la práctica médica pediátrica pudiendo prolongar la supervivencia y mejorar la calidad de vida.
Las complicaciones clínicas derivadas de las neoplasias pediátricas pueden aparecer como manifestación inicial de la enfermedad no diagnosticada previamente, al debut de la enfermedad, o durante todo el tratamiento.
El manejo adecuado de una emergencia pediátrica oncológica requiere un primer reconocimiento del proceso de la enfermedad así como también los efectos y consecuencias de las terapias implementadas en el tratamiento del cáncer.
Con el objetivo de instruir al pediatra general en el manejo inicial de las situaciones clínicas que se pueden presentar en un servicio de emergencias frente a la atención de niños con cáncer, abordaremos diferentes escenarios, poniendo énfasis en el reconocimiento del problema y su abordaje inicial.
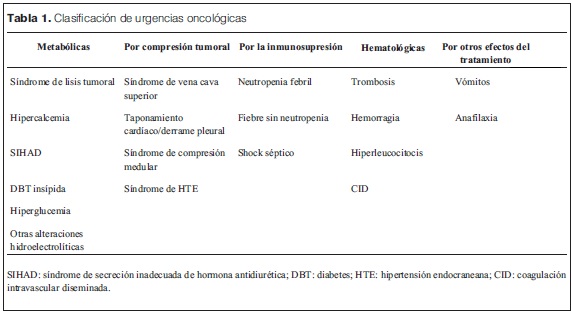
Clasificamos las emergencias oncológicas en cinco grandes grupos siendo indistinto el momento de su presentación dentro del curso de la enfermedad (tabla 1).
SIHAD: síndrome de secreción inadecuada de hormona antidiurética; DBT: diabetes; HTE: hipertensión endocraneana; CID: coagulación intravascular diseminada.Nos referiremos en detalle a aquellas urgencias que consideramos de mayor relevancia clínica por su condición amenazante para la vida del paciente.
Sección 1. Síndrome de lisis tumoral
El síndrome de lisis tumoral resulta de la rápida destrucción de células neoplásicas, superando los mecanismos homeostáticos de eliminación renal con el consecuente aumento plasmático de iones, ácidos nucleicos, proteínas y metabolitos intracelulares, y generando entonces hiperuricemia, hiperfosfatemia, hipercalemia.
Es una condición clínica que puede derivar en falla renal, arritmias y convulsiones, y resulta potencialmente mortal(1).
Puede observarse en pacientes con neoplasias hematológicas entre las 12 y 72 horas de instaurado el tratamiento quimioterápico(1,2) o presentarse espontáneamente en tumores con alta tasa de replicación o gran tamaño(3).
Exceptuando las complicaciones infecciosas, es la emergencia oncológica más frecuente(4,5). Reconocer los pacientes en riesgo, instalar medidas de prevención y tratar de manera vigorosa una vez establecido el cuadro constituyen las claves para disminuir la morbimortalidad.
Definición
Cairo y Bishop (2004), distinguen entre el SLTA analítico (de laboratorio), definido por la presencia de alteraciones en la concentración de ácido úrico y/o electrolitos, y el SLTA clínico, constituido por el SLTA de laboratorio acompañado de complicaciones secundarias a los desequilibrios metabólicos subyacentes.
SLTA de laboratorio:
- Ácido úrico: > a 476 micromol/l (4.5mg/dl) o aumento del 25%.
- Potasio: > a 6meq/l o aumento del 25%.
- Fósforo: > a 2.1 mmol/l (6,5mg/dl) o aumento del 25%.
- Calcio: < a 1.75 mmol/l o descenso del 25%.
SLTA clínico:
SLTA de laboratorio con al menos una de las siguientes:
- Creatinina > 1,5 veces del valor normal.
- Arritmias.
- Muerte súbita.
- Convulsiones.
Fisiopatología
Obedece a la ruptura masiva de células neoplásicas y liberación de productos intracelulares al torrente sanguíneo.
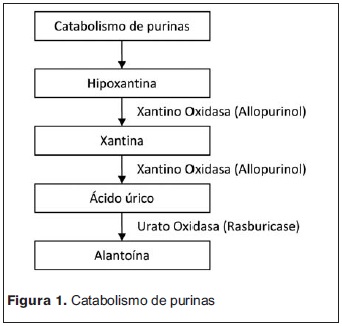
La hiperuricemia resulta de la liberación y catabolismo de los ácidos nucleicos intracelulares que son metabolizados por medio de la xantino-oxidasa a hipoxantina, xantina y finalmente a ácido úrico. Su aclaramiento ocurre en el riñón y la solubilidad es máxima con pH entre 6,5 y 7,5. La xantina y la hipoxantina precipitan a pH alcalinos.
La hiperpotasemia es debida a la ruptura celular masiva y conlleva un alto riesgo de arritmias cardíacas.
La hiperfosfatemia resulta de la liberación de fósforo de las células neoplásicas, que pueden contener hasta cuatro veces más de fósforo que una célula normal. Se ve exacerbada por la insuficiencia renal aguda (IRA) que se asocia con la precipitación de ácido úrico o inclusive puede conducir a IRA por la precipitación de fosfato de calcio a nivel tubular. La hipocalcemia es secundaria a la hiperfosfatemia y la formación de cristales de fosfato de calcio que precipitan en los túbulos renales. Cuando el producto entre el fósforo y el calcio excede 60 existe riesgo de depósito de fosfato de calcio a nivel renal y tisular. Se puede acompañar de manifestaciones clínicas neuromusculares (calambres, tetania, parestesias), cardiovasculares (arritmias, bloqueos, hipotensión) o neurológicas (confusión, alucinaciones y convulsiones)(1,3).
Incidencia
Su determinación es dificultosa ya que existen diferencias entre las poblaciones analizadas en los diferentes estudios y por el uso de diferentes parámetros para definir el síndrome(5).
Se sugiere que la incidencia de SLTA clínico para las leucemias es 3%-7% y para los linfomas es 4-11%. Ciertos grupos de linfomas tienen mayor incidencia, como el linfoma de Burkitt que alcanza un 25%(1,2).
Dependen del tipo y características de la neoplasia, y a factores intrínsecos del paciente(3).
1. Tipo de neoplasia:
- Linfoma de Burkitt.
- Linfoma linfoblástico.
- Linfoma difuso de células B.
- Leucemia linfoblástica aguda.
- Tumores sólidos con alta tasa de proliferación y respuesta a quimioterapia.
2. Características específicas de la neoplasia:
- Masa bulky (>10 cm).
- Enzima láctico deshidrogenasa (LDH) elevada (> 2 veces el valor normal).
- Recuento de glóbulos blancos > 25.000 elementos/ mm3.
3. Factores relacionados con el paciente:
- Falla renal preexistente.
- Oliguria.
Estratificación según riesgo de presentar SLTA
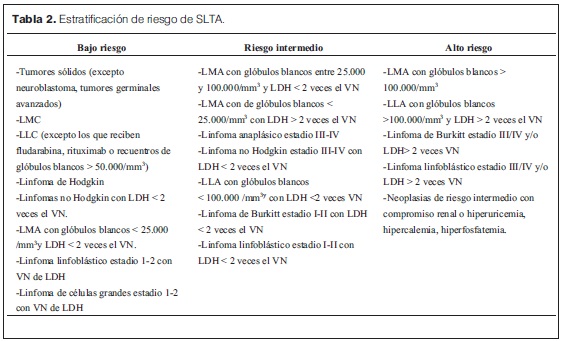
La estratificación del riesgo de presentar SLTA se basa en el tipo de neoplasia, grado, extensión y tamaño (estadío tumoral, valor de LDH), uso de determinados agentes quimioterápicos, edad al diagnóstico, falla renal preexistente e infiltración renal (tabla 2).
Realizar una evaluación completa y continua del paciente, debido al dinamismo que presenta este cuadro clínico.
- Confeccionar una historia clínica detallada.
- Examen físico general exhaustivo y que incluya examen neurológico. Signos vitales, presencia de edemas, tensión arterial, estado de hidratación.
- Balance de ingresos y egresos (diuresis y otras pérdidas). Peso diario.
- Estudios complementarios:
- Hemograma, estado ácido base, natremia, kalemia, fosforemia, calcemia, magnesemia, uremia, creatininemia, albúmina, hepatograma, ácido úrico y LDH.
- Radiografía de tórax (evaluación de signos hipervolemia, compromiso mediastinal o presencia de derrame pleural).
- Ecografía abdominorrenal (para evaluar presencia de infiltración renal u obstrucción).
- Examen completo de orina.
- Electrocardiograma (ECG) para evaluar signos de hipercalemia e hipocalcemia.
Manejo clínico y prevención
Hiperuricemia
- Hiperhidratación: es una de las medidas más importantes. En niños con peso >10 kg se debe aportar 3 l/m2/día y con peso <10 kg 200 ml/kg/día. Inicialmente no añadir potasio. Lograr ritmo diurético >4 ml/kg/h y en niños mayores >100 ml/m2/h(4).
Hoy existe consenso en no recomendar la alcalinización urinaria ya que predispone al depósito de precursores de ácido úrico y de sales de fosfato de calcio en los túbulos renales(4).
- Drogas uricosúricas:
- Alopurinol: inhibe competitivamente la xantinooxidasa, bloqueando la conversión de hipoxantina y xantina y disminuyendo así la formación de ácido úrico. Es ineficaz sobre el ácido úrico ya formado. Puede aumentar los niveles de xantina e hipoxantina y la posibilidad de precipitación de cristales de xantina en los túbulos renales(3). Comienza a actuar a las 24-72 horas de su administración. Su dosis es 10 mg/kg/día cada 8 horas por vía oral (dosis máxima: 300 mg/m2/día). Debe ser ajustada en pacientes con falla renal(3,4,6).
- Enzima urato oxidasa recombinante (rasburicase): transforma el ácido úrico a alantoína, siendo más soluble y facilitando la eliminación renal. Es altamente eficaz, con comienzo de acción inmediato. Su dosis es 0,2 mg/kg EV(6). Para evitar errores, la muestra con dosaje de ácido úrico debe ser procesada rápidamente y remitida en medios fríos(4). En las guías actuales de manejo de SLTA se recomienda su uso en forma profiláctica en pacientes categorizados de alto riesgo. En nuestro medio la utilización de esta droga se ve afectada por su alto costo y baja disponibilidad. Es utilizado cuando el ácido úrico es >8 mg/dl (figura 1).
- Bajo riesgo de SLTA: monitorización, balance de ingresos/egresos, hidratación, se puede agregar alopurinol.
- Riesgo intermedio de SLTA: hiperhidración y alopurinol por 7 días.
- Alto riesgo: hiperhidratación y rasburicase en forma profiláctica.
- LLA: edad menor a un año, translocación 11q23, LLA tipo T con masa mediastinal, compromiso de sistema nervioso central (SNC), cromosoma Philadelphia, hipodiploidía.
- LMA: edad menor a un año, translocación 11q23, Subtipos FAB M4, M5, M3.
- Citoreducción gradual: puede utilizarse prednisona en las LLA con dosis de 15-30 mg/m2/día y en las LMA hidroxiurea(10) o dosis bajas de citarabina. Es importante tener en cuenta que los valores de laboratorio de SLTA deben encontrarse estables, dadoque la implementación de estas medidas puede derivar en la lisis de células neoplásicas.
- Citorreducción rápida: se utiliza la leucoaféresis. A pesar de su uso frecuente en el manejo de los síntomas de hiperleucocitosis, no existen estudios randomizados publicados sobre su uso. Para su realización se necesita personal especializado, contar con un acceso venoso central y soporte clínico en Unidad de Cuidados Intensivos. Su uso es limitado en pacientes más pequeños. Se indica cuando existe clínica de leucoestasis(12) y cuando el recuento de leucocitos en LLA es mayor a 400.000 elementos/mm3 o en LMA mayor a 100.000 elementos/mm3.
- Edema en esclavina, con plétora y cianosis facial y cervical e ingurgitación de extremidades superiores. Desarrollo de circulación colateral.
- Estado mental alterado, cefalea, vértigo, acúfenos, alteraciones visuales, como consecuencia de la disminución del retorno venoso cerebral. Estos, aunque son menos frecuentes, entrañan mayor gravedad.
- Síntomas respiratorios como tos, disfonía, disnea, sibilancias y estridor. Es característico que la posición supina empeore los síntomas, no solo por efecto de la compresión secundario a la masa sino también por la compresión generada por la gravedad.
- Anamnesis, examen físico.
- Laboratorio: hemograma, laboratorio de SLTA, coagulograma, marcadores tumorales (b-HCG y aFP).
- Radiografía de tórax de frente y perfil. Útil en identificación de masa mediastinal, de menor utilidad en la detección de la compresión y/o desviación traqueal(13).
- TAC de tórax: Delimita masa, identifica presencia y grado de obstrucción vascular y/o traqueal. No siempre existe correlación entre la clínica observada y la compresión objetivada por TAC(19).
- ECG y ecocardiograma: valoran contractilidad cardiaca, grado de deterioro del retorno venoso.
- Punción /aspiración de medula ósea y biopsia.
- Biopsia de ganglio linfático periférico.
- En caso que exista derrame pleural y/o pericárdico podrá realizarse punción de la serosa, remitiendo muestras para anatomía patológica, determinación de inmunofenotipo y estudio citogenético.
- Punción aspiración de masa mediastinal por vía percutánea bajo sedoanalgesia en los casos que se continúe sin diagnóstico etiológico y con elevado riesgo para realizarlo bajo anestesia general.
- El manejo de estos pacientes exige un cuidado multidisciplinario que incluye a pediatras, hematooncólogos, cirujanos y anestesiólogos.
- Posición en 45º.
- Administración de oxígeno suplementario.
- Colocación de acceso venoso, evitando la punción a nivel de miembros superiores, por el alto riesgo de presentar hemorragias debido a mayor estasis venoso.
- Manejo hidroelectrolítico cuidadoso (evaluar la necesidad de administración de diuréticos).
- En caso de trombosis, indicar anticoagulación.
- extensión del tumor al espacio epidural a través del foramen intervertebral;
- compromiso del cuerpo vertebral por tumor primario o metástasis;
- lesión causada por una neoformación a nivel intradural.
- Desde el inicio en todos los casos con disfunción neurológica.
- Compresión en un nivel irradiado previamente.
- Progresión en curso de radioterapia.
- Clínica rápidamente progresiva sin confirmación histológica (en el acto quirúrgico se recogerá material histológico para el diagnóstico y posterior tratamiento oncológico con radioterapia y/o quimioterapia.)
- Columna inestable o fractura patológica.
- Confirmación histológica y columna estable.
- Tras cirugía en casos seleccionados.
- Como tratamiento combinado en tumores quimiosensibleso exclusivo en caso de progresión
- Tras cirugía o radioterapia.
- Tumores primarios del SNC; por ejemplo, astrocitomas, meduloblastomas, ependimomas de frecuente localización infratentorial, y glioma hipotálamo-hipofisario y tumores pineales de localización en línea media.
- Infiltración leptomeníngea de leucemias o linfomas.
- Raramente metástasis cerebrales de un tumor de otra localización.
- Historia clínica detallada.
- Examen físico con hincapié en el examen neurológico.
- Fondo de ojo, en busca de papiledema. Las primeras características observables son un borramiento de los bordes papilares dilatación venosa y ausencia del pulso venoso. En caso de HIC aguda pueden observarse hemorragias y exudados. Recordar que su ausencia no descarta la HIC.
- TAC con y sin contraste: de elección en situaciones agudas por utilidad y accesibilidad. Útil en la valoración del sistema ventricular y en la detección de tumores (95%).
- RNM cerebral: ideal para diagnosticar la posible etiología de HIC. Presenta como desventaja dificultades en la accesibilidad en algunos medios(26).
- Posición con elevación de la cabeza a 30°(23).
- Analgésicos y antieméticos.
- Dexametasona(19): es el corticoide de elección para el tratamiento del edema cerebral, por su llegada a SNC. Dosis recomendadas: Dosis de carga: 1,5 mg/kg intravenoso (EV). Dosis máxima 10 mg y luego continuar con 0,5-1 mg/kg/día, cada 4-6 horas EV o VO por 3-5 días. Dosis máxima: 24 mg/día.
- Manitol al 20%: la dosis recomendada es: 0,5-1 g/kg EV. Su efecto osmótico comienza entre los 15 a 30 minutos de la infusión y dura aproximadamente 6 horas. Su mecanismo de acción no es claro(23).
- Solución NaCl hipertónica (3%): utilizado como terapia hiperosmolar. Su mecanismo de acción también es desconocido; en la actualidad los reportes apoyan más su utilización que la del manitol. Requiere monitoreo de la osmolaridad, la que no debe superar los 360 mosmol/l. Se utiliza en dosis de 0,1-1 ml/kg/h en infusión continua EV.
- En casos resistentes a medidas antes implementadas, se necesitará el ingreso a Unidades de Cuidados Intensivos, para hiperventilación, con intubación y ventilación mecánica, manteniendo la PCO2 entre 30 a 35 mmHg. Niveles inferiores a 30 mmHg no están recomendados pe producen disminución del flujo cerebral y posterior isquemia(19).
- Impregnación con difenihidantoína 20 mg/kg EV para la prevención y/o tratamiento de las convulsiones.
- Hemocultivos x 2 más retrocultivo de catéter implantable o semiimplantable (si es que porta).
- Urocultivo (recordar que el sedimento no es útil debido a la neutropenia).
- Radiografía de tórax.
- Piel y partes blandas: punción aspiración, biopsia de lesión cutánea o muestra para anticuerpos monoclonales para virus herpes / varicela en lesiones sospechosas.
- LCR: en el caso de sospecha de infección en SNC.
- Foco respiratorio: inmunofluorescencia, ELISA o Reacción en cadena de polimerasa de secreciones nasofaríngeas. Los estudios invasivos como lavado broncoalveolar (BAL), o biopsia pulmonar no se realizan de rutina. Se evaluará cada caso en particular.
- Foco abdominal: si el paciente tiene diarrea se deberá tomar muestra de materia fecal para coprocultivo, parasitológico en fresco y seriado, muestra para Adenovirus, Rotavirus y búsqueda de toxina A y B para Clostridium difficile.
- Edad menor a un año y mayor a 12 años.
- Tipo de cáncer: leucemia, enfermedad de base en inducción, recaída o segundo tumor.
- Intervalo entre el término del último ciclo de quimioterapia e inicio de lafiebre menor a 7 días.
- Predicción de la duración de neutropenia mayor a 7 días.
- Fiebre > 39 °C axilar.
- Signos clínicos de sepsis.
- Compromiso respiratorio y/o intestinal.
- Comorbilidad asociada (insuficiencia hepática, renal, otras).
- Recuento absoluto de neutrófilos <100 elementos/mm3.
- Recuento de plaquetas <50.000 elementos/mm3.
- Proteína C reactiva sérica > 90 mg/l.
- Recaída de fiebre dentro del mismo episodio de neutropenia.
- Fiebre intranosocomial
- Buen estado general.
- Enfermedad oncológica en remisión.
- Expectativa de neutropenia menor a 7 días.
- Sin foco clínico de riesgo.
- Temperatura < 39 ° C axilar.
- Ausencia de comorbilidad.
- Sin recaída de fiebre dentro del mismo episodio de neutropenia.
- Fiebre extranosocomial.
- Sepsis.
- Foco clínico correspondiente a infección de piel y partes blandas en regiones donde exista una tasa de más del 15% de Staphilococcus aureus resistentes a meticilina.
- Infección osteoarticular.
- Sospecha clínica de infección asociada a catéter venoso central.
- Infección en los tres últimos meses por S. pneumoniae resistente a cefalosporinas de tercera generación.
Según la evaluación del riesgo categorizado de SLTA se recomiendan las siguientes estrategias de prevención:
Hipercalemia
El manejo no difiere de la hipercalemia de otra etiología. Disminuir el aporte de potasio. En pacientes asintomáticos se recomienda el uso de kayexalate 1 g/kg por vía oral. Recordar que en pacientes neutropénicos no se puede utilizar la vía rectal por el riesgo de bacteremia. Otras medidas a emplear son los usos de salbutamol y de insulina.
Con valores mayores a 6 meq/L, se debe realizar monitoreo con ECG. En caso que aparezcan alteraciones en el ECG, indicar gluconato de calcio como estabilizador de membrana.
Hiperfosfatemia
Los quelantes de fósforo reducen la absorción de fosfatos provenientes de la dieta. El control del fósforo sérico puede prevenir la hipocalcemia.
Se utiliza carbonato de calcio 1-2 g con las comidas en 2-4 dosis e hidróxido de aluminio a 50-150 mg/kg vía oral(4).
Hipocalcemia
Si es asintomática se prefiere mantener una conducta expectante. No difiere de otras etiologías. Si aparecen síntomas corregir con 1-2 ml/kg de gluconato de calcio 10% en bolo endovenoso. La administración de calcio en exceso aumenta la cristalización de sales de fosfato de calcio(4).
Diálisis: su uso es excepcional. Sus indicaciones son resorte del nefrólogo. Se prefieren la hemodiálisis y las terapias lentas, por ser más efectivas para la correción de anomalías electrolíticas, principalmente la hiperkalemia e hipocalcemia(7). Sus indicaciones son: oligoanuria, sobrecarga de volumen, hipercalemia mayor a 7 mEq/l, hiperuricemia mayor a 10 mEq/l, hiperfosfatemia mayor a 10 mEq/l o con presencia de síntomas clínicos de hipocalcemia.
Sección 2. Hiperleucocitocis
Se define como el recuento de glóbulos blancos en sangre periférica >100.000 elementos/mm3. Este valor es arbitrario y depende del tipo de leucemia el valor de corte que se utiliza. Mientras que los pacientes con diagnóstico de leucemia mieloide aguda (LMA) pueden presentar síntomas con recuentos de 50.000 glóbulos blancos/mm3, los pacientes con leucemia linfocítica crónica (LLC) pueden tener valores de 500.000 glóbulos blancos/mm3 y permanecer sin manifestaciones clínicas(8,9).
Es un evento amenazante para la vida que requiere el inicio inmediato de la terapia apropiada, con una alta tasa de mortalidad que se estima entre 20%-40%(10).
Se observa en 9%-13% de los pacientes con leucemia linfocítica aguda (LLA) y en aproximadamente 12%-25% de aquellos con diagnóstico de LMA(9).
Se proponen como factores de riesgo(11-13):
La fisiopatología responde a una hiperviscosidad sanguínea provocada por elaumento del recuento y tamaño de glóbulos blancos y a la menor capacidad de deformación de los blastos al pasar por los vasos sanguíneos.
La agregación de blastos en la microvasculatura impacta a nivel pulmonar y en SNC predominantemente.
Muchos pacientes pueden encontrarse asintomáticos pero los síntomas se pueden instalar rápidamente.
Los signos respiratorios más comunes son la taquipnea, disnea, hipoxemia y la presencia de rales.
Dentro de las manifestaciones neurológicas pueden observarse cambios en el estado neurológico, cefalea, acúfenos, ataxia, convulsiones, accidente cerebrovascular (ACV).También puede aparecer priapismo, dactilitis, falla renal, infarto agudo de miocardio (IAM) y falla cardíaca.
Evaluación del paciente
Debe evaluarse cuidadosa y exhaustivamente en búsqueda de signosintomatología secundaria a leucoestasis, con especial atención en el estado neurológico, de hidratación (diuresis, presencia de edemas, signos de insuficiencia cardíaca) y respiratorio (disnea, aparición de rales). Recordar que esta evaluación es dinámica.
Estudios complementarios:
Hemograma, laboratorio de SLTA, coagulograma.
Ante síntomas respiratorios solicitar radiografía de tórax.
En caso que exista alteración neurológica solicitar TAC de cerebro, que puede revelar hemorragias o placas leucémicas.
Manejo clínico
El tratamiento definitivo de la hiperleucocitocis corresponde al inicio de quimioterapia apropiada tan pronto como sea posible.
Se debe iniciar monitoreo continuo de signos vitales, saturación de oxígeno, balance de ingresos y egresos, cuantificación de diuresis y peso y contar con al menos un acceso venoso.
Hidratación adecuada con medidas de prevención del SLTA.
Sostén transfusional: Transfundir plaquetas cuando el recuento sea menor a 20.000/ mm3 debido al riesgo de hemorragia en SNC.
Se prefiere mantener valor de hemoglobina <8 g/dl, para evitar mayor hiperviscosidad sanguínea.
Los siguientes procedimientos deberán ser indicados por el hematooncólogo tratante valorando la mejor opción para cada paciente en particular.
En los pacientes más pequeños se opta por la exanguinotransfusión.
Sección 3. Síndrome mediastinal superior (SMS). Síndrome de vena cava superior (SVCS)
Las lesiones ocupantes a nivel mediastinal pueden impactar severamente en estructuras vitales causando compromiso cardiovascular o respiratorio.
El SVCS es el conjunto de signos o síntomas asociados a la compresión u obstrucción de la VCS. El SMS se compone de síntomas de compresión de VCS asociado a sintomatología respiratoria secundario a compresión traqueal. En pediatría, los términos SVCS y SMS se utilizan generalmente como sinónimos dadas las características anatómicas de estos pacientes(14).
Se trata de una condición rara e infrecuente que constituye una emergencia médica y requiere un tratamiento inmediato.
Fisiopatología
El mediastino es el espacio localizado en la parte central del tórax, comprendido lateralmente entre ambas cavidades pleurales, por debajo por el diafragma y a nivel superior por la entrada superior del tórax. Se encuentra dividido en tres compartimentos: mediastino anterior, medio y posterior. Esta división tiene implicancias para el diagnóstico de sospecha de la presencia de masas en los mismos. El mediastino anterior contiene grasa, timo, ganglios linfáticos. El mediastino medio contiene el corazón, pericardio, aorta ascendente y transversal, VCS, venas braquiocefálicas, tráquea, bronquios y ganglios, mientras que el mediastino posterior presenta la aorta torácica descendente, el esófago, la vena ácigos, ganglios linfáticos y autónomos(15-18).
La VCS es el principal conducto de drenaje del flujo sanguíneo venoso proveniente de la cabeza, cuello, extremidades superiores y parte superior del tórax. Se localiza a nivel del tercio medio mediastinal y es rodeada por estructuras relativamente rígidas, como el esternón, tráquea, bronquio principal derecho, aorta, arteria pulmonar, ganglios perihiliares y paratraqueales. Sus paredes son delgadas y fácilmente colapsables en procesos ocupantes(16).
A diferencia de lo observado en adultos, en los niños la tráquea y los bronquios fuentes son relativamente más compresibles y el diámetro intraluminal es menor. Es por eso que en la mayoría de los casos la signosintomatología respiratoria acompaña a este síndrome(13).
Etiología
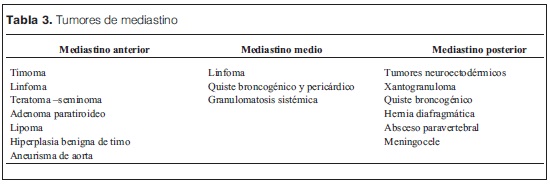
Los tumores de mediastino distribuidos según su localización anatómica se mencionan en la tabla 3(10).
Dentro de las enfermedades oncohematológicas que pueden afectar el mediastino, en orden decreciente se encuentran: linfoma no Hodgkin (LNH), LLA, linfoma de Hodgkin (LH), neuroblastoma, paraganglioma, tumores de células germinales, sarcoma, timoma, carcinoma tiroideo y paratiroideo.
También puede ocurrir como complicación trombótica asociada al uso de catéteres centrales.
Manifestaciones clínicas
Pueden predominar los síntomas cardiovasculares o respiratorios en función del sistema que se halle con mayor colapso.
Pueden existir también síntomas secundarios a derrame pleural o taponamiento cardiaco.
Diagnóstico
Diagnóstico etiológico
Se debe intentar llegar al diagnóstico definitivo de la forma menos invasiva. Los estudios y procedimientos bajo anestesia general en estos pacientes representan elevado riesgo por posible colapso cardiovascular y respiratorio(15).
Recordar que existe poco correlato entre la signosintomatología y el riesgo de presentar complicaciones anestésicas(13).
Durante la anestesia existe una exacerbación de la obstrucción de la vía aérea por relajación del músculo liso traqueobronquial y que esta agravado por la posición supina. Por otro lado, se genera una disminución del tono muscular abdominal durante la inspiración y así del volumen pulmonar. Existe también efecto inotrópico negativo, con vasodilatación, que disminuye el flujo sanguíneo sistémico y pulmonar, con mayor disminución del retorno venoso.
Los métodos para arribar al diagnóstico etiológico son:
Medidas generales
Medidas específicas
No debe retrasarse el tratamiento a la espera de la realización procedimientos de diagnósticos si el paciente está en estado crítico.
En los casos que no se puede arribar a un diagnóstico etiológico, se utilizan, como medidas terapéuticas empíricas, corticoides (prednisona a 60 mg/m2/día en tres tomas) y/o radioterapia a nivel mediastinal. Tener en cuenta que tratamientos por un lapso mayor a las 48-72 h pueden interferir con los resultados de los estudios diagnósticos por realizarse.
Sección 4. Síndrome de compresión medular
Otra de las urgencias oncológicas es la compresión medular (CM) donde el diagnóstico y tratamiento temprano son factores fundamentales para evitar daño neurológico severo e irreversible. La incidencia en niños oncológicos se estima entre 5 y 25%(20-27).
Definición
La CM ocurre más frecuentemente como forma de presentación de los procesos malignos (67% casos), pero puede aparecer en etapas avanzadas de la enfermedad(27,28).
La causa más frecuente de CM son los tumores extradurales, siendo los más implicados neuroblastoma, sarcoma de tejidos blandos, sarcoma de Ewing y rabdomiosarcoma(27).
Fisiopatogenia
Las situaciones que propician la aparición de la CM son:
Clínica
El cuadro clínico consta de una serie de etapas con una sucesión de síntomas y signos, hasta llegar a la compresión completa medular y/o radicular. La velocidad de instauración es la que determina la urgencia del cuadro ya que la efectividad terapéutica está directamente relacionado con su precocidad.
El dolor es el síntoma más temprano y es progresivo, de características mecánicas que empeora con el movimiento y la maniobra de Valsalva; la localización depende del nivel de la lesión.
Cuando existe la afectación de una raíz nerviosa o de la cola de caballo, el dolor es de tipo radicular unilateral o bilateral.
En una revisión de 70 pacientes pediátricos con compresión medular sus autores reportan que el dolor dorsal estuvo presente en el 94% de los casos(27,28).
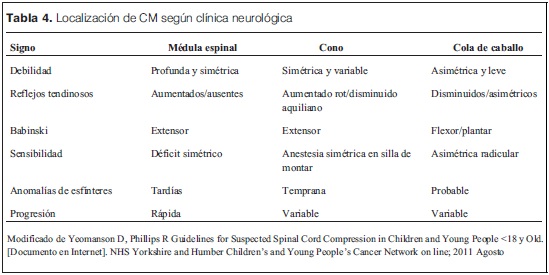
Alteraciones neurológicas (tabla 4)
El segundo síntoma más frecuente es la claudicación que puede aparecer gradualmente en la segunda etapa o abruptamente por fallo vascular severo agudo, el shock medular.
Inicialmente es más marcado en la musculatura proximal, y con el paso del tiempo, la debilidad es más intensa y afecta también a los músculos distales. La deambulación está muy comprometida, y la flaccidez y arreflexia de los primeros momentos son reemplazados por plejía. Suele preceder a las alteraciones de la sensibilidad que aparece en el 46-80% de los casos; el paciente refiere parestesias e hipoestesia, que suele iniciarse en los pies y va ascendiendo hasta llegar al nivel afectado(29).
Cuando la compresión es en la cola de caballo la pérdida de la sensibilidad normalmente es bilateral y afecta a la región perineal, cara posterior del muslo y lateral de la pierna.
Las lesiones a nivel del cono medular pueden presentarse con impotencia e incontinencia de esfínteres en la etapa inicial.
La disfunción autonómica habitualmente se asocia a debilidad motora muy severa o paraplejía y se ve en etapas avanzadas.
Si existen masas paraespinales a nivel cervical–torácico alto se puede presentar el síndrome de Horner.
La ataxia se debe a la compresión del haz espinotalámico, entonces hay que descartar lesiones en el vermix cerebeloso(29).
Cuando la columna cervical es la afectada la función respiratoria está comprometida por fallo diafragmático y de los músculos intercostales. A este nivel el daño medular cursa con tetraplejía.
Diagnóstico
Una historia clínica y examen físico completo deben orientar al cuadro clínico y el nivel medular involucrado.
La radiografía vertebral detecta en porcentaje variable alteraciones óseas como aplastamiento vertebral, destrucción del pedúnculo vertebral y/o cambios líticos. La información aportada por este método reforzará la sospecha de compromiso medular, pero siempre debe solicitarse una resonancia magnética nuclear (RMN) de columna.
La RMN de toda la columna y estructuras adyacentes tiene una sensibilidad del 93% y especificidad del 97%(27).
Es necesaria la administración de contraste de gadolinio intravenoso para completar el estudio en caso de masas paravertebrales y metástasis intramedulares
La sensibilidad de la TAC es menor que la de la RNM para detectar lesiones óseas.
Tratamiento
Para obtener los mejores resultados el tratamiento debe ser temprano.
Es individualizado y la elección del mismo dependerá de la expectativa de vida, la localización, el número de lesiones, el mecanismo de producción de la compresión, la histología tumoral, la velocidad de progresión, la semiología neurológica y si recibió o no previamente radioterapia.
Con el tratamiento quirúrgico se observan porcentajes similares(27).
La lesión puede ser estable (aquellas en las que el cuerpo vertebral se encuentra intacto) o inestablecomo en el caso de aplastamiento vertebral o compresión por un fragmento óseo. En términos generales, el manejo de las lesiones inestables requiere una intervención quirúrgica mientras que en el caso de estabilidad la terapéutica puede ser combinada.
La dexametasona es el corticoide más usado.La dosis es de 0,5 a 2 mg/kg EV pesar de que no existe consenso definitivo sobre dosis y duración del tratamiento. Es conocido su efecto beneficioso inicial sobre el control del dolor y la mejoría neurológica al disminuir el edema, inhibe la síntesis de PG-E, regula el crecimiento vascular y controla los cambios que se producen en el citoesqueleto por el aumento de la permeabilidad aunque su mecanismo de acción no se sabe por completo.
A continuación se resumen las recomendaciones del manejo en pacientes con CM.
Manejo general del paciente con compresión medular
Corticoides
Cirugía
Radioterapia
Quimioterapia
Uso frecuente en pacientes pediátricos.
El síndrome de hipertensión endocraneana (HIC) se define por la presencia de signos y síntomas secundarios al incremento de la presión endocraneana (PIC). Una de las causas de esta sintomatología es la tumoral.
Los tumores del sistema nervioso central constituyen la segunda causa de cáncer infantil luego de las leucemias. Su incidencia aproximadamente es de un 20%(19).
Los síntomas iniciales pueden ser inespecíficos y pasar desapercibidos hasta la instalación de manifestaciones graves.
Etiología
Clínica
La presentación es variable según la edad del paciente, dado por la característica de distensión y moldeamiento del cráneo y por el tiempo de instauración de los síntomas.
La denominada tríada de Cushing con hipertensión arterial, bradicardia y alteración en el patrón respiratorio, es un signo de aparición tardío.
En los lactantes, los síntomas más frecuentemente observados son vómitos, letargia, irritabilidad, convulsiones, detención en el desarrollo psicomotriz o pérdida de pautas madurativas adquiridas. Puede observarse un aumento del perímetro cefálico con abombamiento de fontanela y dehiscencia de suturas. Otra manifestación es el 'signo de ojos en sol naciente' debido al desplazamiento inferior del globo ocular con oclusión parcial del iris por el párpado inferior y visualización de la esclera. Otras alteraciones son el estrabismo y la diplopía por afectación del VI par.
En los niños mayores la cefalea es el síntoma más frecuente. Difusa y constante, matutina, que empeora con maniobras de Valsalva. Merece especial atención el niño que presenta cefalea occipital ya que es sospechosa de lesión ocupante. Otro síntoma casi inequívoco, son los vómitos, generalmente sin estar precedidos por náuseas (en escopetazo), matutinos. Puede asociar alteraciones visuales, con estrabismo, y laterización cervical compensatoria, diplopía por afectación del VI par, nistagmus, disminución de la agudeza visual.
Otras manifestaciones focales resultan de la localización del tumor. Pueden ser convulsiones, déficit motor con hemiparesia y alteraciones en la marcha.
Como manifestación de desplazamiento de la masa cerebral por aumento de la PIC pueden presentarse signos de herniación cerebral. Cuando la afectación es a nivel transtentorial central aparecen síntomas como el deterioro de la conciencia, trastornos en la motilidad ocular, pupilas midiátricasarreactivas. Cuando la afección es a nivel uncal es más progresiva, con midriasis homolateral y hemiparesia contralateral. Si es de localización amigdalina genera alteración de pares craneanos bajos, bradicardia y bradipnea, con alteración de la conciencia. Es frecuente en lesiones de fosa posterior.
Diagnóstico
Tratamiento
Tratamiento médico
Tratamiento neuroquirúrgico
Si el deterioro clínico progresa, a pesar del tratamiento médico o tras estabilizar al paciente, se realizará cirugía de derivación de la hidrocefalia con colocación de válvula de derivación ventriculoperitoneal o una tercerventriculostomía. Generalmente se prefiere que la exéresis tumoral se realice en forma diferida y no en el mismo acto quirúrgico.
Sección 6. Neutropenia febril
El pronóstico del cáncer en pediatría ha mejorado ostensiblemente con el empleo de terapéuticas más agresivas. Sin embargo, las infecciones son responsables de la principal causa de muerte en los niños con enfermedad hematooncológica bajo tratamiento.
El grado de inmunocompromiso es variable y depende de la enfermedad y del tipo de tratamiento. Aún dentro de un mismo esquema terapéutico, los riesgos son muy variables; dependen de la infiltración de la médula ósea, de las dosis de quimioterápicos y su combinación, uso de radioterapia, de la etapa del tratamiento y de la presencia de catéteres de larga permanencia. A todo esto se agrega la susceptibilidad particular de cada paciente a los tratamientos administrados.
En general, estos niños presentan un estado de inmunosupresión que puede favorecer la aparición de infecciones graves.
Como regla general, la aparición de fiebre en un paciente oncológico requiere evaluación urgente por parte del pediatra con el fin de realizar un rápido y adecuado diagnóstico y tratamiento. El origen infeccioso de la fiebre debe ser priorizado siempre en un paciente oncológico.
Se debe tener en cuenta que suelen ser pacientes oligosintomáticos a pesar de estar cursando una infección grave.
Existen diversas definiciones de fiebre en la literatura internacional. Sin embargo, preferimos utilizar la comúnmente usada en la práctica clínica, como un único registro ³ 38°C.
Si bien la neutropenia es un evento frecuente el continuo avance de los tratamientos antineoplásicos (anticuerpos monoclonales, terapias antilinfocitarias, diferentes procedimientos de trasplante de células hematopoyéticas, etc.) ha determinado que muchos enfermos con cáncer presenten riesgo elevado de padecer infecciones graves aunque no se encuentren neutropénicos.
Definición de neutropenia
Recuento absoluto de granulocitos (polimorfonucleares y formas en banda) = 500 elementos/mm3 o entre 500 y 1.000 células/mm3 con caída del valor en la última semana o con predicción de descenso a menos de 500 elementos/mm3. Cuando el recuento es menor de 100 elementos/mm3 se considera neutropenia profunda.
Existe neutropenia funcional en aquellos pacientes en los que la enfermedad hematológica subyacente produce un defecto cualitativo de los neutrófilos circulantes, aun cuando el recuento periférico sea normal, como por ejemplo en LLA en etapa de inducción.
El riesgo y la gravedad de la infección están relacionados con la duración y la profundidad de la neutropenia y resulta sumamente importante la recuperación de los polimorfonucleares (PMN) para la buena evolución.
Las infecciones bacterianas son la principal causa de morbimortalidad en estos pacientes. Continúan constituyendo la complicación infecciosa más frecuente y se presentan durante los estadios más tempranos de la neutropenia.
Las infecciones fúngicas, particularmente por Aspergillus spp., ocurren más tardíamente.
Los virus respiratorios pueden presentarse manteniendo la distribución estacional.
El conocimiento de la epidemiología de las infecciones en los pacientes neutropénicos en cada centro y sus cambios a través del tiempo permiten elegir el tratamiento antibiótico empírico más adecuado. Iniciado en forma precoz resulta una de las medidas más importantes para disminuir la morbimortalidad.
Se demostró la reducción de la mortalidad en pacientes neutropénicos con bacteriemia y otras infecciones graves cuando los tratamientos empíricos y dirigidos fueron tempranos y apropiados. Es por ello que la evaluación inicial y secuencial debe ser minuciosa y rápida.
Evaluación diagnóstica
Anamnesis
Se recabarán datos referentes al diagnóstico de enfermedad de base, etapa de tratamiento en la que se encuentra, quimioterápicos y otras terapéuticas recibidas con fechas, antecedentes de infecciones previas, antecedente de enfermedad actual.
Examen físico
En forma completa, prestando especial atención a piel y faneras, mucosas, aparato respiratorio y abdomen. Se registrarán todos los signos vitales. Tener en cuenta otros signos equivalentes de infección tales como hipotensión o hipotermia.
No olvidar que debido a la neutropenia son poco probables los signos inflamatorios de infección en forma florida.
Estudios complementarios
En todos los pacientes, independientemente del foco clínico hallado, se realizará:
Se agregarán a los estudios ya detallados exámenes específicos de acuerdo al foco clínico sospechoso de infección:
Merece una mención especial dentro del foco abdominal la tiflitis, complicación aguda y seria de los pacientes neutropénicos, caracterizada por la inflamación aguda del ciego, apéndice cecal, íleon y colon ascendente, siendo también posible, aunque menos frecuente el compromiso del intestino en su totalidad.
Clínicamente se manifiesta con dolor en fosa ilíaca derecha y a veces diarrea de tipo sanguinolenta.
Como primer estudio ante la sospecha diagnóstica se deberá solicitar ecografía abdominal para evaluar engrosamiento de la pared abdominal o líquido libre (se tomará valor límite como normal aquel menor a 5 mm).La radiografía de abdomen podrá mostrar niveles hidroaéreos o escaso aire distal.
Se considera una emergencia médica, que requerirá evaluación quirúrgica, con alta mortalidad, por lo que implica tratamiento temprano con antibióticos con cobertura anaerobia, desfuncionalizar el intestino y seguimiento en conjunto con el equipo de cirugía(30-43).
Evaluar minuciosamente signos de infección anorrectal (fisura, celulitis perianal, fístula perianal). Se considerará realización de TAC de abdomen y pelvis para evaluar posibles colecciones.
Tratamiento
Entre 15% y 25% de los niños con NF presentarán bacteriemia, especialmente si se encuentran bajo una neutropenia profunda o prolongada y otro porcentaje similar (20%-30%) infecciones bacterianas localizadas(44).
La neutropenia febril debe ser considerada una emergencia infectológica y el tratamiento empírico inicial no debe demorarse más allá de la primera hora para disminuir el riesgo de mortalidad y sepsis(45).
Durante la década de 1980 se reportaba un predominio de infecciones causadas por bacilos gramnegativos (por ejemplo Escherichia coli, Klebsiella pneumoniae, Pseudomona aeruginosa). Posteriormente se observó un descenso significativo de la frecuencia de estos microorganismos, y se encontró concomitantemente un aumento de cocos grampositivos, los que en la actualidad tienen una frecuencia entre 45% y 70% de acuerdo a la serie considerada(31,45,46).
Debe considerarse además la emergencia de patógenos habituales pero con cambios en la susceptibilidad a antimicrobianos como Enterococus spp resistentes a vancomicina, estreptococo grupo viridans resistente a b-lactámicos, Staphylococcus aureus resistente a meticilina [SAMR], bacilos gramnegativos productores de b-lactamasas de espectro extendido o de carbapenemasas), que pueden afectar a pacientes neutropénicos febriles(47).
En la actualidad y de acuerdo a la serie y los centros considerados predominan las infecciones por gérmenes gram positivos. Ocasionan 45%-70% de las infecciones documentadas, la mayoría de ellas son bacteriemias(44).
La etiología de las bacteriemias en los pacientes neutropénicos febriles y en consecuencia el esquema antibiótico empírico se encuentra en continua revisión de acuerdo al patrón de resistencia del centro médico donde se encuentre bajo tratamiento el paciente.
Se han propuesto diferentes modelos para la predicción de riesgo en niños con cáncer y episodios de NF.
La categorización en grupos de riesgo que predicen la posibilidad de estar cursando una infección bacteriana invasiva ha permitido implementar estrategias de manejo selectivo más conservadoras para los episodios de bajo riesgo. La clave del éxito de cualquier terapia selectiva se basa en una adecuada definición de los grupos de riesgo.
Factores de alto riesgo para infección bacteriana invasiva/sepsis y/o mortalidad en niños con cáncer y neutropenia febril.
Criterios de bajo riesgo al ingreso para infección bacteriana invasiva/ sepsis y/o mortalidad en niños con cáncer y neutropenia febril al ingreso
Fuente: elaboración propia
Paciente con episodio de alto riesgo
Aquellos pacientes que hayan sido categorizados como de alto riesgo deben hospitalizarse y recibir en forma urgente tratamiento antibiótico por vía endovenosa, previa toma de los cultivos pertinentes.
Se recomienda elegir el tratamiento antibiótico empírico de acuerdo a la epidemiología del centro donde se encuentre el paciente.
Considerar en el tratamiento antimicrobiano empírico cobertura frente a P. aeruginosa. La combinación de un ß lactámico de amplio espectro (ceftazidima, cefepime, meropenem, imipenem y piperacilina/tazobactam) con un aminoglucósido (amikacina) han sido los regímenes recomendados(7).
En algunas regiones se ha producido en la actualidad la emergencia de infecciones causadas por S. aureus resistente a meticilina, proveniente de la comunidad, cuyo tratamiento de elección es vancomicina considerando que la tasa de resistencia a clindamicina de estas cepas en niños con cáncer supera el 30%. La asociación inicial de cobertura con glucopéptidos se reserva para las siguientes situaciones clínicas específicas:
Posteriormente, se adaptará el tratamiento de acuerdo a la evolución clínica, y resultado de cultivos con sensibilidad antibiótica.
Pacientes de bajo riesgo
Se recomienda tratamiento con ceftriaxona sola o más amikacina. No se recomienda el uso empírico de cefalosporinas ni penicilinas con acción antipseudomónica ya que el riesgo de padecer una infección por P. aeruginosa en estos pacientes es extremadamente bajo, menor a 5%(33,38,40,48-50).
Todos los niños que cursan con NF deben ser evaluados en forma diaria hasta que el RAN sea ³ 500 elementos/mm³ y se encuentren sin fiebre. La eficacia del tratamiento antimicrobiano empírico deberá ser evaluada luego de72 horas (4º día) en los pacientes de alto riesgo y a las 24-48 horas en los niños con episodios de bajo riesgo(33,48).
Se debe sospechar enfermedad fúngica invasiva en los pacientes con episodios de neutropenia febril categorizados de alto riesgo, y que continúen con fiebre y neutropenia al 4º día de evolución.
Se sugiere indicar tratamiento antifúngico empírico en los pacientes que presenten antecedente de infección fúngica previa con compromiso orgánico, aparición de infiltrado pulmonar nuevo, persistencia de la fiebre a pesar de laterapia antibacteriana adecuada entre el 5º y 7º día de evolución del episodio, recaída de fiebre intraneutropenia y shock séptico.
Referencias bibliográficas
1. Cairo MS, Bishop M. Tumour lysis syndrome: new therapeutic strategies and classification. Br J Haematol 2004; 127(1):3-11.
2. Cairo MS, Coiffier B, Reiter A, Younes A; TLS Expert Panel. Recommendations for the evaluation of risk and prophylaxis of tumour lysis syndrome (TLS) in adults and children with malignant diseases: an expert TLS panel consensus. Br J Haematol 2010; 149(4):578-86.
3. Coiffier B, Altman A, Pui C, Younes A, Cairo MS. Guidelines for the management of pediatric and adult tumor lysis syndrome: an evidence-based review. J Clin Oncol 2008; 26(16):2767-78.
4. Jones G, Will A, Jackson G, Webb N, Rule S; British Committee for Standards in Haematology. Guidelines for the management of tumour lysis syndrome in adults and children with haematological malignancies on behalf of the British Committee for Standards in Haematology. Br J Haematol 2015; 169(5):661-71.
5. Howard S, Jones D, Pui C. The tumor lysis syndrome. N Engl J Med 2011; 364(19):1844-54.
6. Galardy P, Hochberg J, Perkins S, Harrison L, Goldman S, Cairo MS. Rasburicase in the prevention of laboratory/clinical tumour lysis syndrome in children with advanced mature B-NHL: a Children’s Oncology Group Report. Br J Haematol 2013; 163(3):365-72.
7. Sakarcan A, Quigley R. Hyperphosphatemia in tumor lysis syndrome: the role of hemodialysis and continuous veno-venous hemofiltration. Pediatr Nephrol 1994; 8(3):351-3.
8. Inaba H, Fan Y, Pounds S, Geiger T, Rubnitz J, Ribeiro R, et al. Clinical and biologic features and treatment outcome of children with newly diagnosed acute myeloid leukemia and hyperleukocytosis. Cancer 2008; 113(3):522-9.
9. Ganzel C, Becker J, Mintz P, Lazarus H, Rowe JM. Hyperleukocytosis, leukostasis and leukapheresis: practice management. Blood Rev 2012; 26(3):117-22.
10. Porcu P, Cripe L, Ng E, Bhatia S, Danielson C, Orazi A, et al. Hyperleukocytic leukemias and leukostasis: a review of pathophysiology, clinical presentation and management. Leuk Lymphoma 2000; 39(1-2):1-18.
11. Lowe E, Pui C, Hancock ML, Geiger T, Khan R, Sandlund J. Early complications in children with acute lymphoblastic leukemia presenting with hyperleukocytosis. Pediatr Blood Cancer 2005; 45(1):10-5.
12. Schwartz J, Padmanabhan A, Aqui N, Balogun R, Connelly-Smith L, Delaney M, et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice-Evidence-Based Approach from the Writing Committee of the American Society for Apheresis: The Seventh Special Issue. J Clin Apher 2016; 31(3):149-62.
13. Mullen E, Gratias E. Oncologic emergencies. En: Orkin SH, Nathan DG, Ginsburg D, Look AT, Fisher DE, Lux SE. Nathan and Oski´s hematology and oncology of infancy and childhood. 8 ed. Philadelphia: Elsevier-Saunders, 2015: 2267-91.
14. Lanzkowsky P. Supportive care and management of oncologic emergencies. En: Lanzkowsky P. Manual of pediatric hematology and oncology. 4 ed. San Diego: Elsevier Academy Press, 2005:695-748.
15. Perger L, Lee E, Shamberger R. Management of children and adolescents with a critical airway due to compression by an anterior mediastinal mass. J Pediatr Surg 2008; 43(11):1990-7.
16. Davis G, Zolezzi R, Zumelzu D. Síndrome de vena cava superior: una emergencia oncológica en niños con linfoma. Revisión de 5 casos. Rev Chil Pediatr 2005; 76(5):507-12.
17. Hack H, Wright N, Wynn R. The anaesthetic management of children with anterior mediastinal masses. Anaesthesia 2008; 63(8):837-46.
18. Duwe B, Sterman D, Musani A. Tumors of the mediastinum. Chest 2005; 128(4):2893-909.
19. Nazemi K, Malempati S. Emergency department presentation of childhood cancer. Emerg Med Clin North Am 2009; 27(3):477-95.
20. Kelly K, Lange B. Oncologic emergencies. Pediatr Clin North Am 1997; 44(4):809-30.
21. Lobo-Antunes N. (Urgent neurological consultation in children with systemic cancer). Rev Neurol 1999; 29(4):349-59.
22. Daya M, Spiro D, Thomas C Jr. Cancer emergencies. Hematol Oncol Clin North Am 2010; 24(3):515-35.
23. Weiss S, Wegg-Uzunlar L, Bowman R, Brannen ML. Diagnosis of a craniopharyngioma after acute brainstem herniation in an emergency department. Pediatr Emerg Care 2011; 27(8):747-50.
24. Campistol J, Arroyo H, Ruggieri V. Neurología para pediatras: enfoque y manejo práctico. Buenos Aires: Panamericana; 2011.
25. Wilne S, Collier J, Kennedy C, Koller K, Grundy R, Walker D. Presentation of childhood CNS tumours: a systematic review and meta-analysis. Lancet Oncol 2007; 8(8):685-95.
26. Jefferson MR, Fuh B, Perkin R. Pediatric oncologic emergencies. Pediatr Emerg Med Rep 2011; 16(5):57-72.
27. Mullen E, Gratias E. Oncologic emergencies. En: Orkin S, Nathan D, Ginsburg D, Look A, Fisher D, Lux S. Nathan and Oski´s hematology and oncology of infancy and childhood. 8 ed. Philadelphia: Elsevier-Saunders, 2015:2271-7.
28. Pollono D, Tomarchia S, Drut R, Ibañez O, Ferreyra M, Cédola J. Spinal cord compression: a review of 70 pediatric patients. Pediatr Hematol Oncol 2003; 20(6):457-66.
29. Romero P, Manterola A, Martínez E, Villafranca E, Domínguez MA, Arias F. Compresión medular. Anales Sis San Navarra 2004; 27(Supl 3):155-62.
30. Paganini H, Santolaya ME. Diagnóstico y tratamiento de la neutropenia febril en niños con cáncer: consenso de la Sociedad Latinoamericana de Infectología Pediátrica. Rev Chil Infect 2011; 28(Supl 1):10-38.
31. Ramphal R. Changes in the etiology of bacteremia in febrile neutropenic patients and the susceptibilities of the currently isolated pathogens. Clin Infect Dis 2004; 39(Suppl 1):S25-31.
32. Miedema K, Tissing W, Abbink F, Ball L, Michiels E, van Vliet MJ, et al. Risk-adapted approach for fever and neutropenia in paediatric cancer patients-A national multicentre study. Eur J Cancer 2016; 53:16-24.
33. Hakim H, Flynn P, Knapp K, Srivastava D, Gaur A. Etiology and clinical course of febrile neutropenia in children with cancer. J Pediatr Hematol Oncol 2009; 31(9):623-9.
34. Lehrnbecher T, Phillips R, Alexander S, Alvaro F, Carlesse F, Fisher B, et al; International Pediatric Fever and Neutropenia Guideline Panel. Guideline for the management of fever and neutropenia in children with cancer and/or undergoing hematopoietic stem-cell transplantation. J Clin Oncol 2012; 30(35):4427-38.
35. Downes K, Zaoutis T, Shah S. Guidelines for management of children with fever and neutropenia. J Pediatric Infect Dis Soc 2013; 2(3):281-5.
36. Teuffel O, Ethier MC, Alibhai S, Beyene J, Sung L. Outpatient management of cancer patients with febrile neutropenia: a systematic review and meta-analysis. Ann Oncol 2011; 22(11):2358-65.
37. Johnson P. Fever and neutropenia in the pediatric oncology patient. J Pediatr Health Care 2013; 27(1):66-70.
38. Ammann R, Bodmer N, Hirt A, Niggli F, Nadal D, Simon A, et al. Predicting adverse events in children with fever and chemotherapy-induced neutropenia: the prospective multicenter SPOG 2003 FN study. J Clin Oncol 2010; 28(12):2008-14.
39. te Poele E, Tissing W, Kamps W, de Bont E. Risk assessment in fever and neutropenia in children with cancer: What did we learn? Crit Rev Oncol Hematol 2009; 72(1):45-55.
40. Santolaya ME, Alvarez A, Avilés C, Becker A, Cofré J, Cumsille MA, et al. Early hospital discharge followed by outpatient management versus continued hospitalization of children with cancer, fever, and neutropenia at low risk for invasive bacterial infection. J Clin Oncol 2004; 22(18):3784-9.
41. Paganini H, Aguirre C, Puppa G, Garbini C, Ruiz Guiñazú J, Ensinck G, et al; Febrile Neutropenia Study Group. A prospective, multicentric scoring system to predict mortality in febrile neutropenic children with cancer. Cancer 2007; 109(12):2572-9.
42. Santolaya ME, Alvarez A, Avilés C, Becker A, Mosso C, O’Ryan M, et al. Admission clinical and laboratory factors associated with death in children with cancer during a febrile neutropenic episode. Pediatr Infect Dis J 2007; 26(9):794-8.
43. Santolaya ME, Alvarez A, Aviles C, Becker A, King A, Mosso C, et al. Predictors of severe sepsis not clinically apparent during the first twenty-four hours of hospitalization in children with cancer, neutropenia, and fever: a prospective, multicenter trial. Pediatr Infect Dis J 2008; 27(6):538-43.
44. Freifeld A, Bow E, Sepkowitz K, Boeckh MJ, Ito J, Mullen C, et al; Infectious Diseases Society of America. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 update by the infectious diseases society of america. Clin Infect Dis 2011; 52(4):e56-93.
45. Hughes W, Armstrong D, Bodey G, Bow E, Brown A, Calandra T, et al. 2002 guidelines for the use of antimicrobial agents in neutropenic patients with cancer. Clin Infect Dis 2002; 34(6):730-51.
46. Marchetti O, Calandra T. Infections in neutropenic cancer patients. Lancet 2002; 359(9308):723-5.
47. Sociedad Argentina de Infectología. Guías de recomendaciones sobre diagnóstico, tratamiento y prevención de infecciones en pacientes con cáncer 2013: consenso de la Sociedad Argentina de Infectología. Rev Argent Microbiol 2014; 46(Supl 1):7-144.
48. Sociedad Argentina de Pediatría. Consenso sobre el cuidado del paciente oncológico neutropénico febril: actualización 2008-2009. Arch Arg Pediatr 2010; 108(2):47-70.
49. Ariffin H, Arasu A, Mahfuzah M, Ariffin W, Chan L, Lin H. Single-daily ceftriaxone plus amikacin versus thrice-daily ceftazidime plus amikacin as empirical treatment of febrile neutropenia in children with cancer. J Paediatr Child Health 2001; 37(1):38-43.
50. Salstrom JL, Coughlin R, Pool K, Bojan M, Mediavilla C, Schwent W, et al. Pediatric patients who receive antibiotics for fever and neutropenia in less than 60 min have decreased intensive care needs. Pediatr Blood Cancer 2015; 62(5): 807-15.
Correspondencia: Dra. María Silvina Evangelista.
Correo electrónico: sil_evan@yahoo.com.ar