Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Archivos de Pediatría del Uruguay
versión impresa ISSN 0004-0584versión On-line ISSN 1688-1249
Arch. Pediatr. Urug. vol.87 no.2 Montevideo jun. 2016
Meningitis tuberculosa en un lactante. Reporte de caso y revisión de la literatura
Tuberculous meningitis in an infant. Case report and literature review
Mariana Moraes1, Sebastián González2, Alicia García3, Amanda Menchaca4
1. Pediatra. Residente. Cuidados Intensivos Pediátricos. Facultad de Medicina. UDELAR. UCIN-CHPR.
2. Pediatra. Intensivista. Asistente Cuidados Intensivos Pediátricos. Facultad de Medicina. UDELAR. UCIN-CHPR.
3. Pediatra. Intensivista. Prof. Agda. Cuidados Intensivos Pediátricos. Facultad de Medicina. UDELAR. UCIN-CHPR.
4. Pediatra. Intensivista. Prof. Titular Cuidados Intensivos Pediátricos. Jefa Servicio. Facultad de Medicina. UDELAR. UCIN-CHPR.
UDELAR. UCIN–CHPR.
Trabajo inédito.
Declaramos no tener conflicto de intereses.
Fecha recibido: 26 de noviembre de 2015.
Fecha aprobado: 23 de marzo de 2016.
Resumen
La tuberculosis (TBC) sigue siendo uno de los principales problemas de salud pública mundial. Actualmente es considerada una enfermedad reemergente, notificándose un aumento de la incidencia en niños. La meningitis tuberculosa (MT) es la forma más grave y temida de TBC en la infancia, siendo los niños menores los más susceptibles a desarrollarla. Un diagnóstico temprano y el tratamiento oportuno son esenciales para mejorar el pronóstico. Se debe iniciar el tratamiento empírico temprano de los casos sospechosos, sin esperar los resultados confirmatorios. Comunicamos el caso de un varón de 5 meses que presentó una MT con manifestaciones clínicas características y mala evolución. Se revisan los mecanismos fisiopatológicos subyacentes y las recomendaciones diagnósticas y terapéuticas actuales.
Palabras clave:
TUBERCULOSIS MENÍNGEA
LACTANTE
Summary
Tuberculosis (TB) remains a major public health problem worldwide. It is currently considered a re-emergent disease and its incidence in children is increasing. Tuberculous meningitis (TBM) is the most feared and deadly form of TB, being the younger children particularly susceptible to develop it. Early diagnosis and prompt treatment are essential to improve outcomes. Empirical treatment in suspected cases without confirmatory tests must be initiated. We analyze the case of a 5 month old infant with typical TBM and poor outcome. We review the underlying pathophysiology and the current diagnostic and management recommendations.
Key words:
MENINGEAL TUBERCULOSIS
INFANT
Introducción
La TBC sigue siendo un problema de salud pública mundial. La magnitud real de esta epidemia está subestimada debido a las dificultades en el diagnóstico en niños y al escaso reporte. La Organización Mundial de la Salud (OMS) estima más de medio millón de casos nuevos de TBC infantil y al menos 74.000 muertes cada año en todo el mundo(1).
La TBC tiene tan alto impacto como causa de mortalidad infantil, que su control ha sido propuesto por la OMS como uno de los objetivos de desarrollo del milenio, involucrando a todos los actores que participan en la prestación de salud de los niños(1).
A nivel regional, en Chile la incidencia en el año 2014 fue de 12,3 casos por 100.000 habitantes, con una lenta disminución de las tasas de TBC en todas sus formas desde el año 2004 (16/100.000 habitantes) al 2014(2). En Argentina se notificaron 9.070 casos nuevos de tuberculosis en todas las edades (tasa 22/100 000 habitantes); 901 casos fueron en menores de 15 años(3). En Uruguay en el año 2013 se registraron 852 casos de TBC en todas las edades (25,1/100.000 habitantes); y un marcado aumento en el año 2011, que se ha mantenido, contrastando con la situación de estabilidad que se venía observando desde mediados de la década de 1990(4).
Actualmente es considerada una enfermedad reemergente, notificándose un aumento de casos en niños, con formas de presentación clínica pulmonar y extrapulmonar. Debemos incorporar el conocimiento de esta nueva realidad epidemiológica a la práctica clínica(5).
La MT es la forma más grave de la infección por Mycobacterium tuberculosis en la edad pediátrica y representa la principal causa de muerte por dicha enfermedad(6,7); con una mortalidad del 25% en las formas más severas. Un 50% de los sobrevivientes desarrollan secuelas neurológicas a pesar de un tratamiento adecuado(7).
El diagnóstico temprano y el tratamiento oportuno mejoran el pronóstico y es un objetivo sanitario(7-9).
Las publicaciones actuales destacan que existen pocos reportes de MT en niños. En Uruguay, hasta nuestro conocimiento no existen publicaciones al respecto.
Comunicamos el caso de un varón de 5 meses sin enfermedad previa conocida, que presentó una MT con manifestaciones clínicas típicas y mala evolución.
Es nuestro objetivo mostrar la presentación de esta patología, sus características clínico-evolutivas y explorar además las conductas diagnóstico - terapéuticas recomendadas en esta devastadora enfermedad.
Caso clínico
Varón de 5 meses. Procedente de zona urbana del interior del país. Medio socioeconómico deficitario. Convivió con su madre hasta los 2 meses de vida y tras abandono materno pasó a convivir con su bisabuela, quien no tenía enfermedad conocida.
Antecedentes perinatales: producto de primera gestación. Embarazo mal controlado. Madre consumidora de cocaína y benzodiacepinas, desnutrida. Sífilis (VDRL 1/64 U); recibió tratamiento con penicilina benzatínica una semana previo al parto. HIV negativo. Recién nacido de 37 semanas, 2280 gramos, vigoroso. VDRL de cordón 1/16 U. Tratamiento con penicilina cristalina iv durante 10 días. No se realizó VDRL del líquido cefalorraquídeo (LCR).
Controlado en salud. Crecimiento y desarrollo adecuado. Calmetizado. Recibió una dosis de vacuna antineumocócica 13 valente, antipoliomielitis Salk, anti-Hepatitis B, anti-Haemophilus influenza tipo B y triple bacteriana (difteria-tétanos-pertussis).
Consultó por episodios de supraversión ocular y movimientos de los cuatro miembros, de instalación brusca, caracterizados por hipertonía e hiperextensión de tronco, de breve duración. En apirexia. Sin otros síntomas. Al examen se constató hipertonía generalizada, fontanela anterior normotensa, pupilas simétricas y reactivas, sin signos focales. No contamos con valoración de Score Coma Glasgow (SCG) en ese momento. Interpretadas como convulsiones se realizó dosis carga de fenobarbital (FB) a 15 mg/kg, yugulando crisis y se realizaron estudios:
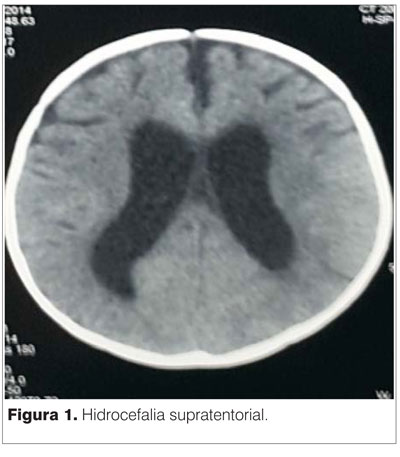
GB: 23.000 mm3/ml. Linfocitos: 59%. Hb: 11,5 g/l. Plaquetas: 868.000 mm3/ml. PCR: 6,9 mg/dl. Estudio citoquímico del líquido cefalorraquídeo (LCR): límpido, normotenso, hipoglucorraquia de 0.22 mg/dl proteínas: 1,15 g/l. PANDY +, 0 células. Tomografía computada (TC) encefálica: hidrocefalia asociada a lesiones temporales profundas (figura 1).
Se inició ceftriaxona y aciclovir por vía intravenosa e ingresó a unidad de cuidado intensivo pediátrico (UCIP) regional. Surgió entonces el antecedente materno de TBC pulmonar confirmada, con tratamiento irregular e incompleto, por lo que inició tratamiento antibiótico con isoniazida, rifampicina, pirazinamida y espiramicina (esta última se suspendió a los pocos días dado que la madre presentaba bacilo multisensible); y dexametasona. Se suspendió aciclovir.
Se realizó nuevo estudio del LCR que mostró: baciloscopía 5 bacilos ácido alcohol resistentes (BAAR). Radiografía de tórax (RTx) normal. VDRL no reactivo. HIV negativo.
Al tercer día de tratamiento evolucionó al fallo neurológico con alteraciones del tono y deterioro del estado de conciencia con posición en opistótonos, pulgares incluidos, mayor hipertonía, extensopronación intermitente de miembros superiores (MMSS), por lo que se inició asistencia ventilatoria mecánica (AVM). Se mantuvo tratamiento con FB y se agregó goteo de midazolam para yugular episodios.
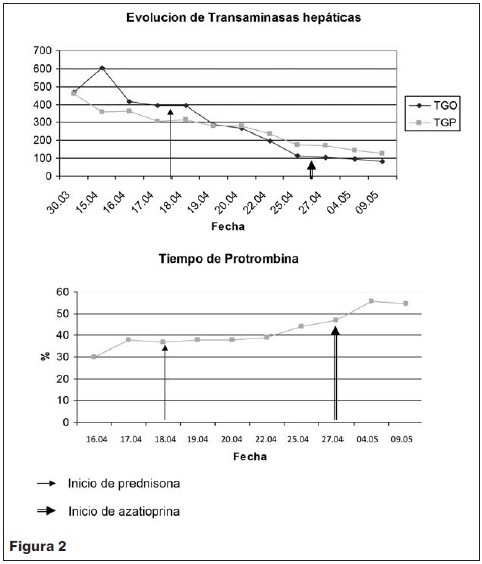
A las 24 h del ingreso se realiza derivación ventricular externa (DVE). Electroencefalograma (EEG): sufrimiento cerebral intenso y difuso. Sin actividad epileptógena. Agregó midriasis arreactiva a izquierda y estrabismo divergente bilateral. DVE sin signos de obstrucción ni infección. Mantuvo hipertonía generalizada, posición en opistótonos y pulgares incluidos. TC cráneo: hemorragia subaracnoidea en fosa posterior y supratentorial. Hemorragia cortical frontal izquierda. Hipodensidad corticosubcortical temporo-parietal derecha, compatible con área de isquemia (infarto cerebral). Dilatación del sistema ventricular (figura 2).
Se comenzó tratamiento quimioprofiláctico primario a la bisabuela con isoniazida 300 mg cada 24 horas por 6 meses. RxTx y baciloscopías normales.
Síndrome de secreción inadecuado de ADH (SIADH) con hiponatremias mantenidas de hasta 123 mEq/L, tratadas con goteo de suero salino hipertónico al 3% en los primeras 72 horas. Normalización posterior. Se retira DVE a los 14 días. TC de control: hidrocefalia ventricular supratentorial, sin desplazamiento de la línea media. Resto incambiado respecto a estudios previos. Mejoría de movimientos anormales. Distermias con temperaturas axilares que oscilaban de 34-40,5 ºC durante 15 días, con cultivos negativos. Fueron interpretadas como de origen central. Requirió soporte respiratorio con AVM por 20 días, ventilación no invasiva durante cuatro, quedando luego con respiración espontánea adecuada. RxTx de control posterior normales.
Al alta de la unidad el paciente presentaba apertura ocular al estímulo, no seguía con la mirada, respuesta motora inadecuada de los 4 miembros, con movimientos de extensión al estímulo. Hipertonía generalizada, con ROT vivos. Con CN SaO2 99%. Alimentación enteral por sonda nasogástrica. Escala de estado funcional (FSS): 20 puntos, que corresponde a disfunción moderada-severa(10).
Discusión
El paciente que se reporta presenta los elementos clínicos y evolutivos característicos de esta enfermedad y que pasaremos a desarrollar.
La MT es la forma de infección tuberculosa más devastadora. Los menores de 5 años –y en particular los lactantes- son un grupo etario con especial susceptibilidad a desarrollarla, y donde la MT ocasiona alta letalidad (hasta 25% de los casos) y en los sobrevivientes las más graves secuelas(7,11,12). Las mismas se deben al retraso en el diagnóstico y tratamiento e incluyen déficit intelectual, trastornos psiquiátricos, alteraciones oculomotoras y visuales, convulsiones, hemiparesia o déficit motor(7,13). La mayor susceptibilidad infantil a la MT se debe en parte a la relativa incapacidad de éstos de contener la infección más allá del pulmón(7,14).
La MT se suele desarrollar luego de dos a seis meses de la primoinfección por M. tuberculosis, siendo inusual en menores de 4 meses. Se debe a la formación de una lesión caseosa metastásica en la corteza cerebral o en las meninges (foco de Richi) durante la fase de diseminación linfohemática de la infección primaria; que descarga un pequeño número de bacilos en el espacio subaracnoideo con la consiguiente inflamación granulomatosa. Dicho exudado inflamatorio afecta principalmente la cisura de Silvio, cisternas basales, tallo cerebral y cerebelo; pudiendo obstruir el drenaje de LCR, lo que ocasiona hidrocefalia comunicante y compromiso en las eferencias de los pares craneales. El proceso inflamatorio puede dar paso a la formación de tuberculomas o abscesos cerebrales. La consecuencia más grave de la infección es la vasculitis, en los vasos del polígono de Willis, el sistema vertebrobacilar y las ramas perforantes de la arteria cerebral media(13-19). Estos fenómenos se dieron en nuestro paciente, ocasionando las manifestaciones clínicas observadas.
Los síntomas y signos iniciales son inespecíficos, por lo que el diagnóstico temprano representa un desafío y generalmente la sospecha diagnóstica surge días o semanas después, en etapas tardías, cuando ya se han producido daños irreversibles, ensombreciendo el pronóstico(7,17,12). Clásicamente se describen tres períodos clínicos: fase prodrómica (Fase 1) caracterizada por síntomas inespecíficos, que refleja la inflamación meníngea. Una Fase 2, más florida: donde aparecen elementos de hipertensión endocraneana (HTE) e injuria cerebral; además, aparecen datos de focalización: alteración de pares craneales III, VI y VII, hemiparesia, paraparesia y convulsiones. En la tercera fase (Fase 3) el nivel de conciencia se altera en forma progresiva, desde somnolencia, confusión y estupor hasta coma; opistótonos, posición de descerebración o decorticación y muerte(7,14,18). Nuestro paciente fue diagnosticado en Fase 2, lo cual estuvo íntimamente ligado a la mala evolución observada. La ausencia del diagnóstico temprano pudo deberse en parte a la baja incidencia de MT en nuestro país. La llave diagnóstica de nuestro caso (el antecedente tuberculoso materno) apareció cuando la fase 2 estaba manifestándose en forma florida.
Se ha reportado que los niños sufren complicaciones más frecuentemente en comparación con los adultos(12). Dentro de las complicaciones presentadas por el paciente, destacamos a la hidrocefalia comunicante, debida a la alteración en la normal circulación del LCR secundaria al exudado inflamatorio(19). Con menor frecuencia, la hidrocefalia puede ser obstructiva por efecto de tuberculomas o ependimitis granulomatosa sobre la circulación del LCR(20). Si bien es una complicación frecuente, no es específica de tuberculosis ya que se observa en otras formas de meningitis, bacterianas, fúngicas. De todas formas hay que anotar que en los países con alta incidencia de TBC, la presencia de hidrocefalia en una meningitis es muy sugestiva de dicho diagnóstico etiológico y obliga a un tratamiento inmediato(21). La otra complicación grave y típica observada fue el infarto ganglio basal secundario a vasculitis. Las infecciones tienen un rol importante entre las causas de stroke isquémico en pediatría y la TBC persiste como un agente infeccioso relevante a considerar siempre(22). La distribución del exudado inflamatorio en las cisternas subaracnoideas basales explica la distribución de los infartos más frecuentes a nivel ganglios basal(17) y se asocian con mal pronóstico.
Las anomalías en el metabolismo del sodio (como el síndrome de secreción inapropiada de ADH: SIADH o el síndrome pierde sal) son bien conocidas, a tal punto que algunos autores sugieren sospechar TBM en toda meningitis asociada a SIADH(23).
Aunque la identificación temprana y oportuna de la tuberculosis meníngea es crucial para el pronóstico, el diagnóstico es complejo y se retrasa en la mayoría de los casos, como sucedió en el caso presentado(9).
La demostración de un caso de TBC infantil, representa un evento centinela dentro de una comunidad, pues sugiere una transmisión reciente por parte de un adulto bacilífero(16). Cuanto más pequeño es el paciente, mayor es la posibilidad de detectar el contacto bacilífero, porque generalmente es intradomiciliario; esta posibilidad disminuye con el paso del tiempo porque los niños pueden adquirir la enfermedad en sus comunidades(12,18). Por lo antes dicho el estudio epidemiológico de los contactos y el diagnóstico temprano es sumamente importante, tanto para el control en una población, como para su erradicación(16-18).
La prueba más importante para el diagnóstico es el análisis y cultivo del LCR(19). Se trata generalmente de un líquido claro, con pleocitosis moderada (10-500 células/mm3), que si bien al principio pueden corresponder a polimorfonucleares, en la mayoría de los casos son linfocitos. Llama la atención la ausencia de células en el LCR del paciente, si bien se han reportado resultados iniciales negativos en algunos pacientes. La concentración de glucosa es típicamente menor a 0.40 mg/dl como se objetivó; y la de proteínas puede ser muy elevada (400-5000 mg/dl)(9-19). El diagnóstico se confirma por la demostración de bacilos tuberculosos por cultivo del LCR o por el aislamiento de BAAR en frotis de LCR mediante tinción de Ziehl-Neelsen. La sensibilidad de la técnica guarda relación con el volumen de la muestra, 30 % para la tinción y 50-70% para el cultivo(19-23).
El tratamiento se basa en tres pilares: administración de fármacos antituberculosos, modulación de los efectos destructivos de la respuesta inmune, y control de la PIC. Previo al uso de drogas antituberculosas, la MT causaba la muerte invariablemente(14), sin embargo el pronóstico de esta enfermedad continúa siendo pobre a pesar del tratamiento. Esto podría estar relacionado con: el bajo rendimiento de las pruebas microbiológicas, la dificultad en el diagnóstico en fases tempranas de la enfermedad, las diferencias en los criterios diagnósticos y la pobre evidencia científica sobre esta forma de TBC para elaborar recomendaciones terapéuticas eficaces(7). Por todo lo dicho y teniendo en cuenta que el tratamiento temprano, condiciona el pronóstico, se debe mantener una alta sospecha clínica de esta entidad, conocer las limitaciones en el diagnóstico y comenzar tratamiento empírico ante la mínima sospecha clínica(7,17,25).
Contrariamente a lo que se aplica en la tuberculosis pulmonar, las recomendaciones para el tratamiento antituberculoso en MT no están bien definidas. Previo a la aparición de resistencia a antibióticos, se empleaban tres fármacos. Actualmente con el fin de abordar el problema de la resistencia, se prefieren cuatro drogas (isoniazida, rifampicina, pirazinamida y etambutol) para los primeros 2 meses de tratamiento, continuando 7 a 10 meses más con rifampicina e isoniazida(26,27). En el caso presentado se inició dicho tratamiento con cuatro fármacos, pero dado que la madre presentaba un bacilo tuberculoso multisensible, se continuó con tres.
Dados los mecanismos inflamatorios subyacentes a la MT se sugiere el empleo de corticoesteroides. Los glucocorticoides reducen significativamente el riesgo de muerte y las secuelas neurológicas con mínimos efectos adversos, por lo que debe añadirse a la terapia antituberculosa en todos los niños(9). Las OMS recomienda administrar dexametasona durante cuatro semanas(27).
La derivación ventricular externa (DVE) está recomendada en aquellos pacientes con hidrocefalia y alteración de la conciencia, ya que el diagnóstico de HEC es poco fiable por la clínica y la TC de cráneo(28,29).
La dificultad del diagnóstico temprano y el alto riesgo de muerte y secuelas, resaltan la importancia de la prevención de esta enfermedad, específicamente la vacunación. Existe evidencia de que la vacuna BCG es una de las mejores medidas preventivas para las formas graves de TBC, incluyendo la MT en niños. Si bien el paciente presentaba la vacuna BCG esta prevención no es absoluta(30). En un estudio observacional realizado por Kelekçi S y colaboradores se muestra que la vacuna BCG protege de la muerte encontrándose que la tasa de mortalidad en el grupo de vacunados con BCG fue cero(31). Otro aspecto de suma importancia en la prevención, es la investigación de contactos y la quimioprofilaxis oportuna(7).
Conclusiones
El caso que se presenta ejemplifica las razones por las cuales la TBC sigue siendo un problema de salud pública y refleja porqué la MT es la forma más grave de la infección en la edad pediátrica; con una alta morbilidad y mortalidad asociada.
Un diagnóstico temprano y el tratamiento oportuno son esenciales para un mejor pronóstico. El diagnóstico representa un desafío, por lo que se debe tener un alto índice de sospecha, y se establece en la mayoría de los casos por la presencia de síntomas y signos neurológicos en un niño con el antecedente de contacto epidemiológico.
Las complicaciones más frecuentes son la hidrocefalia y el infarto ganglio basal que se asocian con peor pronóstico. Ambos merecen un tratamiento enérgico y aportan claves diagnósticas en los casos dudosos.
Se debe iniciar el tratamiento empírico temprano de los casos sospechosos, sin esperar a la prueba confirmatoria, que a su vez presenta sus limitaciones.
Referencias bibliográficas
1. World Health Organization. Roadmap for childhood tuberculosis: towards zero deaths. Geneva: WHO, 2013. Disponible en: http://apps.who.int/iris/bitstream/10665/89506/1/9789241506137_eng.pdf. [Consulta: 29 octubre 2014].
2. Chile. Ministerio de Salud. Programa Nacional de Control y Eliminación de la Tuberculosis. Departamento de Enfermedades Transmisibles. División de Prevención y Control de Enfermedades. Tuberculosis: informe de situación Chile 2014. Santiago: Ministerio de Salud, 2015. Disponible en: http://web.minsal.cl/sites/default/files/Informe_tbc_2014.pdf. [Consulta: 10 octubre 2015].
4. Uruguay. Comisión Honoraria para la Lucha Antituberculosa y Enfermedades Prevalentes. Programa Nacional de control de la Tuberculosis. Montevideo: CHLA-EP, 2013:1-8.
5. Giachetto G. Tuberculosis en niños: una enfermedad reemergente. Arch Pediatr Urug 2013; 84(3):179-80.
6. Donald P. The North American contribution to our knowledge of childhood tuberculosis and its epidemiology. Int J Tuberc Lung Dis 2014; 18(8):890-8.
7. Chiang S, Khan F, Milstein MB, Tolman A, Benedetti A, Starke JR, et al. Treatment outcomes of childhood tuberculous meningitis: a systematic review and meta-analysis. Lancet Infect Dis 2014; 14(10):947-57.
8. Farinha N, Razali K, Holzel H, Morgan G, Novelli V. Tuberculosis of the central nervous system in children: a 20-year survey. J Infect 2000; 41(1):61-8.
9. Principi N, Esposito S. Diagnosis and therapy of tuberculous meningitis in children. Tuberculosis (Edinb) 2012; 92(5): 377-83.
10. Pollack M, Holubkov R, Glass P, Dean JM, Meert K, Zimmerman J, et al; Eunice Kennedy Shriver National Institute of Child Health and Human Development Collaborative Pediatric Critical Care Research Network. Functional Status Scale: new pediatric outcome measure. Pediatrics 2009; 124(1):e18-28.
11. Saitoh A, Pong A, Waecker N, Leake JA, Nespeca MP, Bradley JS. Prediction of neurologic sequelae in childhood tuberculous meningitis: a review of 20 cases and proposal of a novel scoring system. Pediatr Infect Dis J 2005; 24(3):207-12.
12. Miftode E, Dorneanu O, Leca D, Juganariu G, Teodor A, Hurmuzache M, et al. Tuberculous Meningitis in Children and Adults: a 10-year retrospective comparative analysis. PLoS One 2015; 10(7):e0133477.
13. Castillo C, Cisneros C. Tuberculosis meníngea: reporte de un caso. Rev Méd MD 2013; 4(3):209-3.
14. Starke JR. Tuberculosis of the central nervous system in children. Semin Pediatr Neurol 1999; 6(4):318-31.
15. Bermejo M, Clavera I, de la Rosa M, Marín B. Epidemiología de la tuberculosis. Anales Sis San Navarra 2007; 30(Supl 2):7-19.
16. Cruz I, Velásquez JR. Tuberculosis infantil: ¿cómo diagnosticarla? Arch Argent Pediatr 2012; 110(2):144-51.
17. Donald P, Schoeman J. Tuberculous meningitis. N Engl J Med 2004; 351(17):1719-20.
18. Cornejo J, Pérez JC. Meningitis tuberculosa en niños: una revisión de aspectos clínicos, de laboratorio, epidemiológicos y terapéuticos y de la utilidad de la vacunación con BCG. Iatreia 2010; 23(3):250-8.
19. Starke J, Munos F. Tuberculosis (Mycobacterium tuberculosis). En: Kliegman R, Behrman R, Jenson H, Stanton B. Nelson Tratado de Pediatría. 18 ed. Barcelona: Elsevier, 2009:1240-54.
20. Sheller JR, Des R. CNS tuberculosis. Neurol Clin 1986; 4(1):143-58.
21. Raut T, Garg R, Jain A, Verma R, Singh M, Malhotra H, et al. Hydrocephalus in tuberculous meningitis: Incidence, its predictive factors and impact on the prognosis. J Infect 2013; 66(4):330-7.
22. Andronikou S, Wieselthaler N, Smith B, Douis H, Fieggen A, van Toorn R, et al. Value of early follow-up CT in paediatric tuberculous meningitis. Pediatr Radiol 2005; 35(11):1092-9.
23. Tung Y, Lai MC, Lui C, Tsai K, Huang L, Chang Y, et al. Tuberculous meningitis in infancy. Pediatr Neurol 2002; 27(4):262-6.
24. Trautmann M, Kluge W, Otto H, Loddenkemper R. Computed tomography in CNS tuberculosis. Eur Neurol 1986; 25(2):91-7.
25. Graham S, Sismanidis C, Menzies H, Marais B, Detjen A, Black R. Importance of tuberculosis control to address child survival. Lancet 2014; 383(9928):1605-7.
26. American Thoracic Society; Centers for Diseases Control and Prevention; Infectious Diseases Society of America. Treatment of tuberculosis. MMWR Recomm Rep 2003; 52(RR-11):1-77.
27. World Health Organization. Guidance for national tuberculosis programmes on the management of tuberculosis in children. 2 ed. Geneva: WHO, 2014. Disponible en: http://apps.who.int/iris/bitstream/10665/112360/1/9789241548748_eng.pdf?ua=1. [Consulta: 29 octubre 2014].
28. Palur R, Rajshekhar V, Chandy MJ, Joseph T, Abraham J. Shunt surgery for hydrocephalus in tuberculous meningitis: a long-term follow-up study. J Neurosurg 1991; 74(1):64-9.
29. van Toorn R, Solomons R. Update on the diagnosis and management of tuberculous meningitis in children. Semin Pediatr Neurol 2014; 21(1):12-8.
30. Khemiri M, Bagais A, Becher S, Bousnina S, Bayoudh F, Mehrezi A, et al. Tuberculous meningitis in Bacille Calmette-Guerin-vaccinated children: clinical spectrum and outcome. J Child Neurol 2012; 27(6):741-6.
31. Kelekçi S, Karabel M, Karabel D, Hamidi C, Hoþoðlu S, Gürkan MF, et al. Bacillus Calmette-Guérin is a preventive factor in mortality of childhood tuberculous meningitis. Int J Infect Dis 2014; 21:1-4.
Correspondencia: Dra. Mariana Moraes.
Correo electrónico: marianamoraes_16@hotmail.com