Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.86 no.2 Montevideo June 2015
CASO CLÍNICO
Intoxicación aguda por cocaína en un lactante no asociada a lactancia materna. A propósito de un caso clínico
Acute cocaine intoxication in an infant that is not associated to maternal breastfeeding. A clinical case
Mónica Decia1, Melina Pan2, Héctor Telechea3, Amalia Laborde4, Amanda Menchaca5
1. Pediatra. Ex Residente UCIN. CHPR. Médico de Guardia UCIN.
2. Médico. Ex Residente Toxicología. Facultad de Medicina. UDELAR.
3. Prof. Adj. UCIN. Prof. Adj. Farmacología y Terapéutica. Facultad de Medicina. UDELAR.
4. Prof. Dra. Depto. Toxicología. Facultad de Medicina. UDELAR. Dir. Centro Información y Asesoramiento Toxicológico. Hospital de Clínicas.
5. Prof. Dir. UCIN. Facultad de Medicina. UDELAR. CHPR.
UCIN. CHPR. Hospital de Clínicas.
Trabajo inédito.
Declaramos no tener conflictos de intereses.
Fecha recibido: 6 de setiembre de 2014.
Fecha aprobado: 25 de abril de 2015.
Resumen
La intoxicación aguda por cocaína es infrecuente en lactantes y niños. Las formas más frecuentes de presentación clínica son las convulsiones tónico-clónicas en apirexia, alteraciones motoras y la excitación psicomotriz. Se presenta el caso de un lactante de 1 mes que ingresó a la Unidad de Cuidados Intensivos de Niños del Centro Hospitalario Pereira Rossell por una intoxicación aguda por cocaína. El cuadro clínico consistió en manifestaciones secundarias a un estado hiperadrenérgico generalizado, con lesión miocárdica, excitación psicomotriz, distonías cervicales, convulsiones y acidosis metabólica persistente. Presentó el test de detección de benzoilecgonina en orina positivo al momento del ingreso a la emergencia. No se pudo establecer con exactitud cuál fue la vía de ingreso de la cocaína. Es necesario un alto índice de sospecha para llegar al diagnóstico de intoxicación por cocaína en lactantes.
Palabras clave:
COCAÍNA CRACK
ENVENENAMIENTO
LACTANTE
Summary
Acute intoxication with cocaine is infrequent in children. Generalized tonic-clonic seizures, movement disorders and agitation are the most frequently observed clinical features in cocaine intoxication. We present the case of acute cocaine intoxication in a 1 month old boy who was hospitalized in the Pediatric Critical Care Unit of
Key words:
CRACK COCAINE
POISONING
INFANT
Introducción
En Uruguay la cocaína se encuentra en segundo lugar dentro de las drogas ilícitas, de acuerdo a la quinta encuesta de la Junta Nacional de Drogas 2011 de la Presidencia de la República Oriental del Uruguay. En la actualidad probablemente sea la primera desde la legalización del consumo y producción de marihuana en el año 2014 en Uruguay. La cocaína es un psicoestimulante que está disponible como droga ilícita en dos formas básicas: el clorhidrato de cocaína como polvo blanco que se inhala y la pasta base de cocaína (PBC) como polvo pastoso de color blanco amarillento que se fuma con la ayuda de dispositivos, la mayoría precarios. El consumo de PBC se caracteriza por tener un alto índice adictivo, generando dependencia tanto física como psicológica(1).
En la última década se ha producido un aumento del consumo de clorhidrato de cocaína y de PBC en las mujeres en edad reproductiva. La exposición intrauterina ha sido ampliamente estudiada y se describe en el recién nacido el desarrollo de síndrome de abstinencia luego del nacimiento(2).
La lactancia materna es una vía posible de intoxicación para el lactante y se han reportado casos a través de esta vía. Eso ha motivado el establecimiento de pautas de manejo de los recién nacidos expuestos a estas sustancia(2).
Se describen otras vías de intoxicación en la infancia aunque en forma anecdótica. La vía digestiva por ingesta accidental de restos de polvo o PBC o por la contaminación de los utensilios, recipientes de alimentos, biberones, etcétera. La vía inhalatoria es una vía probable por la exposición ambiental al humo generado por el consumo de cocaínas fumables en ambientes cerrados(3).
La intoxicación aguda por cocaína es menos frecuente que en adultos pero ha aumentado en las últimas décadas a nivel internacional(4-6). Se presenta el caso de un lactante de 1 mes hospitalizado a la Unidad de Cuidados Intensivos de Niños (UCIN) del Centro Hospitalario Pereira Rossell (CHPR) que ingresó por movimientos anormales, hipertonía muscular en el cuál se confirmó intoxicación aguda por cocaína.
Observación clínica
Lactante de 1 mes y 19 días, de sexo masculino, procedente del departamento de Montevideo. Es el producto del tercer embarazo, el cual fue mal controlado y complicado con consumo de PBC durante el mismo y sífilis materna no tratada. El parto se produjo a las 38 semanas, institucionalizado en el CHPR, con un peso al nacer de 2.345 gramos, pequeño para la edad gestacional y bajo peso al nacer. Vigoroso. Sífilis connatal, que recibe tratamiento completo. Alimentado exclusivamente con leche modificada al 13%, por consumo materno de PBC. Con antecedentes de haber estado hospitalizado a los 19 días de vida por temblores finos de miembros, desencadenados por estímulos táctiles y auditivos que fueron interpretados como síndrome de hiperexcitabilidad. Se coordinó electroencefalograma en forma ambulatoria que no se realizó.
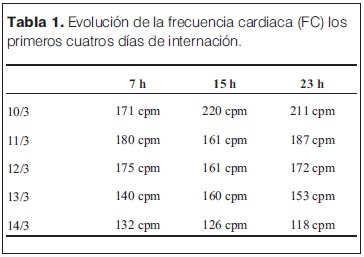
El 10 de marzo de 2013, en la madrugada, la madre notó episodio de hipertonía de cuello y tronco con cianosis peribucal. No le impresionó pérdida de conocimiento. Niega fiebre, decaimiento, no traumatismos previos, no ingesta de tóxicos ni medicamentos. Reiteró episodio de similares características a los 15 minutos. Consulta en emergencia de Institución Médica de Montevideo y es trasladado al Departamento de Emergencia Pediátrica (DEP) del CHPR. En el DEP se presentó irritable, con llanto incontrolable. Reitera movimientos anormales caracterizados por hipertonía de miembros superiores, con llanto, flexión de miembros inferiores sobre tronco y rubicundez facial. Se realizó ecografía de abdomen que no comprobó invaginación intestinal. Posteriormente movimientos tónico-clónicos de los cuatro miembros y mirada en sol poniente. Se solicitó ingreso a la Unidad de Reanimación y Estabilización (URE). Se interpretó como episodios convulsivos, se trató con diazepam y fenobarbital intravenoso. Del examen físico en la URE se destacó taquicardia de 200 cpm, con complejos finos en el monitor, pulsos presentes con un tiempo de recoloración de 2 segundos. Presentaba midriasis bilateral y se encontraba polipneico sin funcional respiratorio.
De los exámenes paraclínicos se destaca, en la gasometría venosa, la presencia de acidosis metabólica severa (pH: 7,13, pCO2: 25, HCO3: 8 meq/l; BE: -20). En el hemograma presentó una hiperleucocitosis (glóbulos blancos: 21.300/mm3), anemia (hemoglobina 6,6 g/dl,) e hiperplaquetosis (recuento plaquetario de 517.000/mm3) La dosificación de proteína C reactiva fue 8,8 mg/l. Los valores de creatinina y urea fueron normales al igual que el funcional y enzimograma hepático. La glucemia fue 200 mg/dl. Se realizó punción lumbar donde se obtuvo líquido cefalorraquídeo de color cristal de roca, normotenso, a nivel químico proteinorraquia de 0,83 g/dl, glucorraquia 1,12 g/dl (glicemia: 200 mg/dl) y lactato 10,2 mmol/l. A nivel citológico 2 glóbulos blancos/mm3. Posteriormente se completó la valoración neurológica con ecografía transfontanelar y tomografía de cráneo que no evidenció alteraciones estructurales.
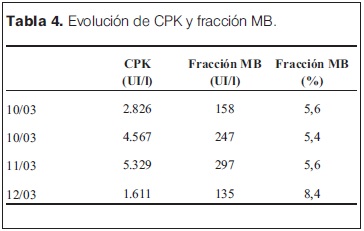
Se realizó detección de benzoilecgonina (metabolito de la cocaína) en orina por radioinmunoanálisis (punto de corte 300 ng/ml) que fue positivo. Los metabolitos de cannabis y de benzodiacepinas fueron negativos. Posteriormente se dosificó creatinin-fosfo-kinasa (CPK) con un valor de 2.826 UI/l con fracción MB 158 UI/l (5,6%). Se plantea como diagnóstico más probable intoxicación aguda por cocaína.
Se solicitó ingreso a UCIN del CHPR para continuar con el tratamiento. Se reinterrogó a la madre en la unidad tratando de establecer cuál fue la vía de ingreso del tóxico. La misma descartó la lactancia y a su vez negaba que el niño haya estado expuesto al humo de PBC. También se realizó una radiografía de abdomen con el objetivo de descartar que se utilizara al niño como “body packer”, la cual fue normal.
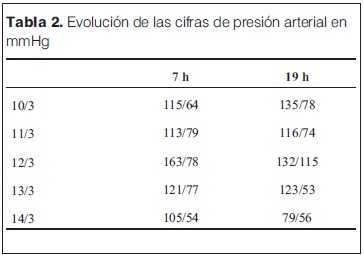
Al momento del ingreso a UCIN (10 de marzo de 2013, hora 10:30) se destacan los siguientes signos del examen físico: llanto continuo, frecuencia respiratoria de 52 rpm, taquicardia de 220 cpm con complejos QRS finos en el monitor, con adecuada perfusión periférica, PA: 117/64 mmHg (> percentil 95 para su edad y sexo). Presentaba temblor fino de los cuatro miembros, hiperextensión del cuello y desviación conjunta de la mirada hacia arriba y a la izquierda, sin pérdida de conocimiento, sin cambios en la coloración de las mucosas y sin caídas de la saturación de O2. A nivel de las pupilas presenta midriasis bilateral con respuesta a la estimulación luminosa. Se realizó gasometría venosa en la cual persistía acidosis metabólica, a pesar de haber recibido corrección de la misma con bicarbonato. Se reiteró el enzimograma cardíaco que mostró CPK 4.567 UI/l, MB 247 UI/l (5,4%). Para completar la valoración cardiológica se realizó dosificación de troponinas con un valor de 378,4 ng/l (valor normal hasta 100 ng/l). En el electrocardiograma (ECG) se confirmó la presencia de taquicardia de origen sinusal, sin elementos compatibles con isquemia miocárdica. El ecocardiograma no mostró disquinesias segmentarias y la fracción de eyección ventricular izquierda fue normal.
El tratamiento instituido consistió en mantener sobrehidratación, realizar nueva corrección de acidosis metabólica con suero bicarbonatado y mantener el tratamiento antibiótico. Se solicitó detección de benzoilecgonina en orina por radioinmunoanálisis (punto de corte 300 ng/ml) a la madre, siendo negativo el resultado. La muestra fue entregada por personal de UCIN al laboratorio, pero no se realizó cadena de custodia. No se realizó búsqueda de metabolitos específicos de PBC, como anhidrecgonina.
Con diagnóstico de intoxicación aguda por cocaína se consultó al Centro de Información y Asesoramiento Toxicológico (CIAT). El médico toxicólogo estuvo de acuerdo con el diagnóstico de intoxicación por cocaína y sugirió el uso de benzodiacepinas para el manejo de la excitación psicomotriz. Se completó valoración neurológica con electroencefalograma, el cual fue normal. Valorado por neuropediatra a las 24 horas del ingreso, no se plantea origen ictal de la hipertonía.
En las primeras 48 horas en UCIN, mantuvo las distonías cervicales y oculares, adoptando posición de opistótonos, que se mantuvieron a pesar de recibir múltiples dosis de diazepam, lorazepam y haber iniciado infusión continua con midazolam, que fue utilizada para el manejo de la excitación psicomotriz. Tanto las distonías como la excitación cedieron en forma progresiva, sin mediar medicación específica. Se mantuvo taquicárdico e hipertenso las primeras 72 h de su ingreso a UCIN, con posterior mejoría como se constata en las tablas 1 y 2 respectivamente. Al momento del alta presentaba frecuencia cardíaca de 118 cpm.
A nivel gasométrico presentó una acidosis metabólica con acidemia al inicio, que persistió las primeras 48 horas de internación, a pesar de correcciones con suero bicarbonatado a 2 mEq/kg (tabla 3). El 11 y 12 de marzo se realizó nueva dosificación de CPK con los siguientes valores 5.319 UI/l, fracción MB 297 UI/l (5.6%) y 1.611 UI/l y la fracción MB a 135 (8.4%) UI/l. respectivamente (tabla 4).
Los cultivos bacteriológicos y el VRDL del LCR fueron negativos. En ningún momento presentó alteración de la diuresis ni de la coloración de la orina, manteniéndose en el rango de la normalidad los valores de azoemia y creatininemia.
A las 48-72 horas del ingreso hospitalario se realizó búsqueda de benzoilecgonina en orina por cromatografía gaseosa acoplada a espectrómetro de masa (punto de corte de 2 ng/ml) siendo negativo. No se realizó búsqueda de droga madre (cocaína), ni tampoco metabolitos específicos de PBC. Se otorgó alta a sala de pediatría el 18 de marzo del 2013 recibiendo tratamiento con fenobarbital y clonazepam como parte del tratamiento del síndrome de hiperexcitabilidad.
Discusión
El caso analizado presentó una clínica compatible con intoxicación aguda por cocaína. En la búsqueda bibliográfica realizada no se encontraron reportes con la gravedad de este caso, con alteraciones del tono muscular y compromiso miocárdico. Los casos comunicados en lactantes se caracterizan por la presentación como convulsión en apirexia y como episodios de excitación psicomotriz con la presencia de un test de screening positivo (detección de benzoilecgonina por radioinmunoanálisis, punto de corte 300 ng/ml). Los mismos son de escasas horas de evolución y ninguno se asoció con el estado hiperadrenérgico florido, con lesión cardíaca y del músculo estriado, como se observó en este caso. Estas diferencias probablemente sean secundarias a la intensidad de la exposición a la cocaína(4-6).
La intoxicación aguda cursó con excitación psicomotriz, convulsiones, distonía cervical y ocular, acidosis metabólica sostenida, taquicardia, hipertensión y elementos compatibles con lesión miocárdica y del músculo esquelético. Estas manifestaciones clínicas son secundarias a la existencia de una “tormenta” adrenérgica. Los elementos característicos de estado hiperadrenérgico son la taquicardia mantenida, la midriasis, el temblor y las convulsiones(7).
La cocaína es considerada desde el punto de vista toxicológico como un simpaticomimético de acción indirecta y sus efectos se derivan de una activación generalizada de distintas neurotransmisiones (noradrenérgica, serotoninérgica, dopaminérgica). Estimula la liberación e inhibe la recaptación de tipo I de catecolaminas y monoaminas (dopamina, noradrenalina y serotonina) a nivel de las terminaciones presinápticas, tanto en el sistema nervioso central como en el sistema nervioso autónomo(8,9). Además bloquea canales rápidos de sodio (efecto estabilizante de membrana) a nivel central y cardiovascular, y estimula receptores N-metil D-aspartato (NMDA) con aumento de la actividad glutamatérgica (excitatoria). Uno de los sitios principales de acción de la cocaína es en la vía dopaminérgica mesocorticolímbica; generando un aumento de la liberación de dopamina en el núcleo accumbens, considerado el “centro del placer”(1,10,11).
A nivel metabólico se evidenciaron efectos característicos de la activación generalizada adrenérgica, como la hiperglicemia y la presencia de acidosis metabólica con aumento en las cifras de lactato. La hiperglicemia es secundaria a la inhibición de la secreción de insulina, estímulo de la liberación de glucagón e inhibición de la captación de glucosa por parte del músculo estriado. A su vez a nivel hepático se estimulan la degradación de glucógeno y la neoglucogénesis. El desarrollo de acidosis láctica es un efecto característico del aumento de las catecolaminas y sería secundario por aumento del metabolismo muscular. A su vez el temblor fino distal se debe también al estímulo de las fibras musculares por parte de los receptores a2 adrenérgicos(7).
Una de las complicaciones descritas de la intoxicación aguda por cocaína es la rabdomiólisis. En ésta se produce necrosis de las fibras musculares con pasaje a la circulación de sus componentes. Para su diagnóstico es necesario un valor de CPK superior a 1.000 UI/l o mayor a 5 veces del valor normal. A su vez debe existir predominio de la fracción MM de la enzima, debiendo ser la fracción MB menor a 6% del total en ausencia de infarto de miocardio. En el caso descrito existió compromiso concomitante del miocardio y del músculo esquelético. Esto fue evidenciado por la dosificación de troponina, a pesar de lo cual la fracción MB de la CPK superó el 6% en una sola de las dosificaciones (tabla 2)(17,18). La rabdomiólisis ha sido asociada al consumo de cocaína tanto en adultos como en adolescentes. Éste sería resultado de una toxicidad directa de la cocaína sobre los miocitos, así como por isquemia muscular secundaria a vasoconstricción. La duración de la isquemia muscular es el principal determinante de la lesión. En aquellos casos de rabdomiolisis severas puede desarrollarse insuficiencia renal aguda por obstrucción tubular por precipitación de la mioglobina. En el caso analizado no se realizó mioglobinuria, pero en todo momento la diuresis se mantuvo conservada y las cifras de azoemia y creatininemia no aumentaron. Dentro de las medidas terapéuticas necesarias para prevenir la falla de la función renal se encuentran la sobrehidratación que en este caso se realizó a 150 ml/kg/día. Otras de las medidas son el uso de diuréticos de asa y la alcalinización de la orina, las cuales no fueron necesarias en este paciente ya que no presentó falla renal(17-19).
La duración de los síntomas secundarios a la intoxicación aguda por cocaína es variable. Es mayor en lactantes debido a la menor actividad de las enzimas encargadas de la metabolización de la cocaína(22). En los casos comunicados los síntomas secundarios a la exposición a cocaína presentaron una duración menor de 6 a 12 horas(4-6). Esto se diferencia con el caso actual, que duraron de 48 a 72 horas. Esta mayor duración probablemente se deba a la intensidad de la exposición al tóxico.
La cocaína se absorbe rápidamente y es metabolizada a nivel hepático por hidrólisis y en plasma por acción de la colinesterasa y pseudocolinesterasa a sus principales metabolitos inactivos (benzoilecgonina, ecgonina, ecgonina metil éster). Esta es la principal vía metabólica y solamente un 10% es oxidado por el sistema microsomal hepático (citocromo P450) a norcocaína. En un porcentaje variable (entre 5%-10%) se excreta sin cambios por la orina. Los niños pequeños, sobre todo los neonatos, presentan menor cantidad de colinesterasa plasmática en comparación con niños mayores y adultos, lo que determina mayores niveles plasmáticos de cocaína(22).
La detección de benzoilecgonina en orina por radioinmunoanálisis confirma la absorción de la sustancia, aunque el diagnóstico de intoxicación es clínico. Estas técnicas de screening son inmunoensayos que detectan la presencia de metabolitos de cocaína. La benzoilecgonina es el principal metabolito testeado en los tests de screening urinarios, con un punto de corte de hasta 300 ng/ml tanto en niños como adultos, que puede ser detectado hasta 24 a 72 horas posconsumo. Sus resultados son considerados presuntivos, con necesidad de su confirmación posterior por técnicas más específicas. Tienen bajo porcentaje de falsos negativos, que pueden ser secundarios a concentraciones menores al límite de detección que es 300 ng/ml para benzoilecgonina. Presentan un bajo porcentaje de falsos positivos, secundarios a anestésicos tópicos, actualmente retirados del mercado. Los porcentajes de falsos positivos y negativos pueden variar en función de la marca comercial(21-24).
La confirmación debe realizarse por cromatografía gaseosa/espectrometría de masas (GC/MS), estudio de alta especificidad con bajo porcentaje de falsos positivos, considerado como un criterio gold standard para la confirmación (21,23). En este caso se realizó luego, a las 48-72 horas del ingreso hospitalario, y fue negativo, lo cual no excluye el diagnóstico debido al tiempo transcurrido entre el inicio de los síntomas y el estudio. Los lactantes pequeños hidrolizan en menor proporción la cocaína a sus metabolitos (benzoilecgonina, ecgonina) por inmadurez enzimática. A su vez es menos probable encontrar una prueba de screening urinario positiva (radioinmunoanálisis) con cocaínas fumables (PBC y crack) y en niños expuestos a las mismas, en parte por la menor biodisponibilidad comparado con el clorhidrato de cocaína y por tener una menor producción y excreción urinaria del metabolito benzoilecgonina. Estos hechos pueden explicar la negatividad de la detección de benzoilecgonina ente las 48 y 72 horas del ingreso. El principal metabolito de las cocaínas fumables (PBC y crack) es la anhidroecgonina metil éster (AEME) y no es detectado en los tests de screening urinarios de uso habitual(25). En este caso no se realizó detección de la droga madre (cocaína), la que probablemente estaba presente durante la duración de los síntomas.
En el presente caso no se logró identificar con certeza la vía de ingreso del tóxico al organismo. La lactancia materna ha sido una de las vías más estudiadas encontrándose reportes que plantean estrategias para su manejo, en este caso la madre niega darle pecho a su hijo y además durante la internación en UCIN se comprobó la ausencia de producción de leche. Una de las vías de ingreso posibles es la inhalatoria ya que en su domicilio el niño pudo haber estado expuesto al humo de la PBC, si bien la vía inhalatoria ha sido conformada exclusivamente para el crack (cocaína fumable)(6). Reportes muestran que niños expuestos al humo de crack presentan complicaciones fundamentalmente neurológicas siendo las convulsiones las más frecuentes, de tipo tónico-clónico generalizadas, lo que supone un riesgo potencial para la salud de los niños que conviven con consumidores habituales o esporádicos(22,26,27). El consumo de cocaína por parte de los padres, se ha relacionado con mayor incidencia de síndrome de muerte súbita del lactante (SMSL) y episodio de aparente amenaza de vida (ALTE), y síntomas de intoxicación como hipertonía, midriasis, temblor, agitación, taquicardia, arritmias e hipertensión arterial. Si bien los casos comunicados refieren exclusivamente a la cocaína fumada, crack, la presencia del alcaloide cocaína en la PBC es también muy elevada por lo que si bien no se ha reportado, es posible plantear su presencia en el humo difundido al ambiente(28-30).
Conclusiones
Del presente caso surge la necesidad de aumentar el índice de sospecha sobre la posibilidad de exposición a cocaína frente a manifestaciones tales como convulsiones sin causas evidentes, distonías sin exposición previa a antipsicóticos y demás antagonistas dopaminérgicos y otras manifestaciones secundarias al estado hiperadrenérgico.
Referencias bibliográficas
1. Dell´Acqua C, Pronczuk J, Recalde A. Drogas de abuso. En: Fogel de Korc E. Patología toxicológica. Montevideo: Oficina del Libro, 2000: 97-110.
2. Moraes, M, Boccarato A, Bazan G, Grunbaum S, Canavessi M, Hope A, et al. Consenso para la atención integral de recién nacidos expuestos a sustancias psicoactivas durante la gestación. Arch Pediatr Urug 2010; 81(4):251-7.
3. García-Algar O, Papaseit E, Velasco M, López N, Martínez L, Luaces C, Valla, O. Consultas en urgencias de pediatría por intoxicación aguda por drogas de abuso. An Pediatr (Barc) 2011; 74(6):413.
4. Shannon M, Lacouture P, Roa J, Woolf A. Cocaine exposure among children seen at a pediatric hospital. Pediatrics 1989; 83(3):337-42.
5. Rivkin M, Gilmore H. Generalized seizure in an infant due to environmentally acquired cocaine. Pediatrics 1989; 84(6):1100-2.
6.
7. Campos Franco J, Gonzalez Quintela A, Alende Sixto M. Complicaciones médicas del uso de cocaína. Jano 2004; 66(1515):38-50.
8. Westfall T, Westfall D. Catecolaminas y fármacos simpaticomiméticos. En: Brunton L, Chabner B, Knolfman B, eds. Goodman & Gilman: Las bases farmacológicas de la terapéutica. 12 ed. México: McGraw-Hill, 2012: 277-333.
9. García-Sevilla J, Meana J. Transimisión catecolaminérgica: fármacos agonistas catecolaminérgicos. En: Florez J, Armijo JA, Mediavilla A. Farmacología humana. 5 ed. Barcelona: Elsevier-Masson, 2008:295-320.
10. Meikle M, Urbanavicius J, Prunell, Umpiérrez E, Abín- Carriquiry A, Scorza M. Primer estudio preclínico de la acción de pasta base de cocaína en el sistema nervioso central. Rev Psiquiatr Urug 2009; 73(1):25-36.
11. Fernández-Espejo E. Bases neurobiológicas de la drogadicción. Rev Neurol 2002; 34(7):659-64.
12. Tirado Rodríguez P, coord. Guía clínica para el tratamiento de los trastornos por consumo de sustancias estimulantes. II Plan Andaluz sobre drogas y adicciones. Sevilla: Junta de Andalucía, Consejería para la Igualdad y Bienestar Social, 2008.
13. McCord J, Jneid H, Hollander JE, de Lemos JA, Cercek B, Hsue P, et al; American Heart Association Acute Cardiac Care Committee of the Council on Clinical Cardiology. Management of cocaine-associated chest pain and myocardial infarction: a scientific statement from the American Heart Association Acute Cardiac Care Committee of the Council on Clinical Cardiology. Circulation 2008; 117(14):1897-907.
14. Zimmerman JL. Cocaine intoxication. Crit Care Clin 2012; 28(4):517-26.
15. Hoffman RS. Treatment of patients with cocaine-induced arrhythmias: bringing the bench to the bedside. Br J Clin Pharmacol 2010; 69(5):448-57.
16. DeWitt CR, Cleveland N, Dart RC, Heard K. The effect of amiodarone pretreatment on survival of mice with cocaine toxicity. J Med Toxicol 2005; 1(1):11-8.
17. Alconcher L, Meneguzzi M, Rudolf G, Criado F. Rabdomiólisis asociada a consumo de alcohol y cocaína. Arch Argent Pediatr 2008; 106(5):443-57.
18. Álvarez Cordovés MM, Mirpuri Mirpuri PG, Pérez Monje AJ. Rabdomiólisis asociada al consumo de cocaína. Semergen 2012; 38(2):102-6.
19. Carrasco R, Salinas M, Rossel V. Rabdomiólisis e insuficiencia renal aguda por consumo de cocaína: caso clínico. Rev Med Chile 2011; 139(4):480-3.
20. Fines RE, Brady WJ, DeBehnke DJ. Cocaine-associated dystonic reaction. Am J Emerg Med 1997; 15(5):513-5.
21. Catalano G, Catalano MC, Rodriguez R. Dystonia associated with crack cocaine use. South Med J 1997; 90(10):1050-2.
22. Moeller KE, Lee KC, Kissack JC. Urine drug screening: practical guide for clinicians. Mayo Clin Proc 2008; 83(1):66-76.
23. Mirchandani HG, Mirchandani IH, Hellman F, English-Rider R, Rosen S, Laposata EA. Passive inhalation of free-base cocaine (‘crack’) smoke by infants. Arch Pathol Lab Med 1991; 115(5):494-8.
25. Moraes M, Scorza C, Abin-Carriquiri JA, Pascale A, González G, Umpierrez E. Consumo de pasta base de cocaína en Uruguay en el embarazo, su incidencia, características y repercusiones. Arch Pediatr Urug 2010; 81(2):100-4.
26. Pascale A. Consumo de drogas durante el embarazo: efectos sobre el binomio materno-fetal, recién nacido y primera infancia. Modalidades terapéuticas y estrategias de prevención. Montevideo: MSP, Programa Nacional de Salud de la Niñez, 2010.
27. Mott SH, Packer RJ, Soldin SJ. Neurologic manifestations of cocaine exposure in childhood. Pediatrics 1994; 93(4): 557-60.
28. Bateman D, Heagarty M. Passive Freebase Cocaine “Crack” Inhalation by Infants and Toddlers. Am J Dis Child 1989; 143(1): 25-27
29. Havlik DM, Nolte KB. Fatal “crack” cocaine ingestion in an infant. Am J Forensic Med Pathol 2000; 21(3):245-8.
30. National Library of Medicine. Cocaine. En: National Library of Medicine. Drugs and Lactation Database: LactMed. [base de datos en línea]. Bethesda: NLM, 2009. Disponible en: http://toxnet.nlm.nih.gov/. [Consulta: 18 de junio de 2014].
Correspondencia: Mónica Decia.
Correo electrónico: monicadecia@gmail.com