Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.86 no.1 Montevideo Mar. 2015
ARTÍCULO ORIGINAL
Arch Pediatr Urug 2015; 86(1)
Seguimiento clínico y serológico de recién nacidos con IgM materna reactiva para toxoplasmosis. Policlínica de Infectología Pediátrica. Hospital Escuela del Litoral, Paysandú. Años 2008-2013
Belén Amorín1, Leticia Pérez2, Luis Martínez3
1. Diplomada Infectología Pediátrica, Asistente Clínica Pediátrica, Facultad de Medicina. UDELAR. Hospital Paysandú.
2. Pediatra, Ex Residente Pediatría, Hospital Paysandú.
3. Intensivista Pediátrico, Prof. Adj. Clínica Pediátrica, Facultad de Medicina,UDELAR, Hospital Paysandú.
Hospital Escuela del Litoral de Paysandú. MSP. Paysandú, Uruguay
Declaramos no tener conflictos de intereses.
Trabajo inédito.
Fecha recibido: 9 de setiembre de 2014. Fecha aprobado: 4 de marzo de 2015.
Resumen
Introducción: la infección por Toxoplasma gondii durante el embarazo puede resultar en graves complicaciones para el feto y dejar importantes secuelas en el recién nacido (RN). El objetivo del estudio fue realizar un seguimiento clínico y serológico de los recién nacidos cuyas madres tenían IgM reactiva para toxoplasmosis en el embarazo y analizar las características clínicas y serológicas de los que presentaron toxoplasmosis congénita (TC).
Material y método: estudio descriptivo, prospectivo y longitudinal de RN cuyas madres tuvieron serología IgM reactiva en el embarazo y que fueron derivados para su seguimiento a la Policlínica de Infectología Pediátrica del Hospital de Paysandú en el período junio de 2008 a junio de 2013.
Resultados: de los 51 RN evaluados, 50 fueron de término con una media de peso al nacer de 3.120 g y 5 fueron pequeños para la edad gestacional (PEG). Dos presentaron microcefalia y dos estuvieron expuestos a otras infecciones durante el embarazo (sífilis y virus de la inmunodeficiencia humana). De los 42 (82,3%) que completaron su seguimiento, en siete se diagnosticó TC (13,7%) y se descartó la infección en 35 (68,5%). En éstos la media de desaparición de la IgG fue de 6,2 meses. Tres de los infectados fueron sintomáticos y tenían IgM reactiva al nacer. Cuatro presentaron secuelas en la evolución. De ocho RN a los que se les indicó tratamiento, tres lo completaron. En 6 (85,7%) de los infectados se confirmó la seroconversión materna durante el embarazo.
Conclusiones: si bien la TC no es muy frecuente en nuestro país, la morbilidad es muy importante. La presencia de seroconversión materna obliga a estudiar y tratar al RN hasta que se descarte la infección. La serología en el RN demuestra, en nuestro medio, una escasa sensibilidad y a falta de otras técnicas obliga a realizar el seguimiento clínico y serológico con IgG durante el primer año de vida.
Palabras clave:
TOXOPLASMOSIS CONGéNITA
RECIéN NACIDO
Summary
Introduction: Toxoplasma gondii infection during pregnancy can result in serious complications for the fetus and causes serious sequelae in the newborn. The study aimed to conduct a clinical and serological follow-up of newborns whose mothers were toxoplasma IgM positive during pregnancy and to analyze the clinical and serological evolution of those with congenital toxoplasmosis (CT) features.
Method: descriptive, prospective, longitudinal study of newborns whose mothers were toxoplasma IgM positive during pregnancy and who were referred for follow-up to the Pediatrics Infectious Diseases Polyclinic. Escuela del Litoral Hospital, Paysandú, from June, 2008 through June, 2013.
Results: out of 51 newborns assessed, 50 were term newborns with a mean birth weight of 3,120 g and 5 were small for gestational age (SGA). Two had microcephaly and 2 were exposed to other infections during pregnancy (syphilis and human immunodeficiency virus). Seven (13.7%) of the 42 (82.3%) newborns who completed follow-up CT were diagnosed with toxoplasmosis, and infection was ruled out in 35 (68.5%) newborns. In the latter half of the disappearance of IgG was 6.2 months. Three (43%) were infected symptomatic and had reactive IgM at birth. Four (57%) evidenced sequelae in evolution. Eight newborns were prescribed treatment, 3 of them completed it. In six (85.7%) of them infected maternal seroconversion during pregnancy was confirmed.
Conclusions: although CT is not very common in our country, the disease is very important. The presence of maternal seroconversion forced to study and treat the newborns until infection is ruled out. Serology in the newborns demonstrates, in our environment, poor sensitivity and lack of other techniques necessary to undertake clinical and serological follow-up of IgM during the first year of life.
Key words:
TOXOPLASMOSIS, CONGENITAL
INFANT, NEWBORN
Introducción
La toxoplasmosis congénita es la consecuencia de la trasmisión fetal por vía transplacentaria de Toxoplasma gondii, un coccidio intestinal del gato con numerosos hospederos intermediarios que se adquiere tras la primoinfección materna (1). Su distribución es universal y la tasa de prevalencia varía según el país o la región. En Uruguay, la prevalencia en mujeres embarazadas es casi del 53% (2), lo que muestra una alta exposición y circulación del parásito. La probabilidad para el feto de contraer la infección en estudios realizados en Montevideo oscilaba entre 2 y 4 por cada 1.000 niños. De acuerdo a estos datos, nacerían anualmente unos 150 niños afectados de toxoplasmosis (2-4). En general, entre 0,6 y 3% de las gestantes adquieren la infección durante el embarazo. Este riesgo es mayor en adolescentes, quienes tienen un riesgo de seroconversión más alto (5). La incidencia de las manifestaciones clínicas varía en función de la edad del feto en el momento de la primoinfección materna. La infección congénita se manifiesta de forma variada e inespecífica (6,7). Si bien existen otras infecciones congénitas que comparten muchos de esos síntomas y signos, las lesiones encefálicas y coriorretinianas son las más típicas y graves. El 80% de los RN infectados serán asintomáticos al nacer pero desarrollarán, en la evolución, alteraciones oftalmológicas o neurológicas que pueden ser invalidantes. El diagnóstico de infección durante el embarazo se realiza mediante el tamizado serológico. El beneficio de realizar serología en la embarazada es controvertido y su aplicación variable según los países. La misma depende de la prevalencia e incidencia de la toxoplasmosis gestacional de cada país o región. En Uruguay se solicita en la primera consulta y en el tercer trimestre del embarazo, mientras que en algunos países europeos a las gestantes seronegativas se les solicita serología mensual (Francia), trimestral (Austria) o no se solicita como es el caso de Dinamarca (5,8). La serología es muchas veces compleja y a menudo difícil de interpretar. El diagnóstico de infección en la embarazada se realiza mediante la demostración de una seroconversión de IgG, por el aumento de tres o más de los títulos de IgG en dos extracciones consecutivas separadas por 3-4 semanas o por la presencia de IgM positiva con anticuerpos IgG de baja avidez .El resultado de una IgM positiva en el primer trimestre hace sospechar una infección reciente. Sin embargo, ésta puede mantenerse positiva hasta por lo menos dos años, por lo que hay que saber que una IgM positiva durante el embarazo representa una infección reciente solo en un 40% de los casos(1). Por lo tanto, antes de decidir cualquier conducta es necesario realizar otras técnicas más sensibles como la inmunofluorescencia indirecta o repetir la IgM junto a un test de avidez que no siempre está disponible en todos los hospitales. Un índice fuerte o elevado de avidez descarta una infección reciente de toxoplasmosis dentro de los últimos cuatro meses, y realizado durante el primer trimestre excluye una infección aguda en aquellas embarazadas IgG e IgM positivas. Una vez que se confirma la infección materna se debe iniciar tempranamente el tratamiento y valorar la posible afectación del feto.
La infección fetal se detecta mediante reacción en cadena de polimerasa (PCR) del líquido amniótico a partir de la semana 18 de gestación. Esta técnica presenta una sensibilidad entre el 65%-92% y una especificidad cercana al 100%. Parecería que la sensibilidad es superior a la que se obtiene de sangre, orina o LCR del RN por lo que debe ofrecerse siempre ante la sospecha de infección materna en cualquier trimestre(1). Sin embargo, la punción amniótica y la PCR del líquido no son pruebas que se realicen de rutina en los laboratorios clínicos de nuestro país. No obstante, se puede realizar un seguimiento ecográfico del feto buscando ventriculomegalia o calcificaciones cerebrales. Se ha observado que existe una buena correlación entre la gravedad de las lesiones ecográficas y el pronóstico fetal (1). Una vez de producido el parto, se puede también realizar una PCR de la placenta, siendo la especificidad de ésta con respecto a la posibilidad de infección en el RN de un 97%. El estudio anatomopatológico de la placenta es poco rentable debido a su falta de especificidad y no se aconseja (1). El diagnóstico de infección en el RN también puede resultar complejo para el pediatra porque los anticuerpos IgG se los transfiere la madre a través de la placenta y la IgM e IgA que de ser reactiva confirma el diagnóstico, puede ser falsamente negativa en un 20% a 50% de los casos. Por otro lado la técnica de reacción en cadena de polimerasa (PCR) en sangre, orina o líquido cefalorraquídeo (LCR), que en nuestro país no está aún estandarizada, presenta una buena especificidad pero menor sensibilidad , por lo que un resultado negativo no excluye la infección (1).En estos casos, el único marcador diagnóstico de infección es la IgG. Existe una fuerte caída de la misma en los dos meses posteriores al nacimiento, mientras que luego el descenso es más lento. De existir infección congénita éste marcador se estabiliza o asciende de forma significativa a los seis meses de vida o persiste reactivo luego del año de vida (1,7). Es en estos casos que el pediatra debe decidir si tratar a un RN sin infección evidente, con el riesgo de provocar efectos secundarios, o esperar a ver cómo evoluciona, con el peligro de que aparezcan secuelas tardías(9). En Uruguay no se conocen datos publicados sobre el tema. El objetivo del trabajo fue analizar la evolución clínica y serológica de los RN cuyas madres presentaban serología IgM reactiva para toxoplasmosis en el Hospital de Paysandú, en un período de 6 años y dar a conocer la evolución de aquellos que presentaron TC. El estudio y su publicación tuvieron la aprobación de la dirección del Hospital de Paysandú.
Material y métodos
Estudio descriptivo y prospectivo de todos los RN cuyas madres presentaron una IgM reactiva para Toxoplasma gondii durante el embarazo en el Hospital Escuela del Litoral de Paysandú (HELP) en un período de 6 años (junio del 2008 a junio de 2013). Se analizaron los datos antropométricos, edad gestacional (EG), clínica, paraclínica y serología de todos los RN derivados. Se indagó también en el manejo diagnóstico y tratamiento de las madres durante el embarazo.
Los RN eran valorados en la maternidad por un pediatra que les solicitaba: hemograma, función hepática, fondo de ojo (FO), ecografía transfontanelar (ET) y determinación de IgG e IgM específica. Los mismos eran derivados a Neonatología y/o Policlínica de Infectología de acuerdo si requerían internación o no. A los RN de mayor riesgo de infección congénita (seroconversión y/o baja avidez de IgG materna) se les solicitaba también IgM, IgA e IgE. Si presentan alteraciones en las radiologías de cráneo o ET se les solicitaba tomografía de cráneo (TAC de cráneo). El estudio citoquímico del líquido cefalorraquídeo (LCR) no se realizó de rutina. A este grupo de riesgo se le iniciaba en los primeros días de vida tratamiento con pirimetamina, sulfadiazina y ácido folínico hasta que el RN presentaba dos determinaciones seriadas de IgG no reactivas separadas por un mes, donde se suspendía y se otorgaba el alta. Si los resultados serológicos y/o de imagen confirmaban la misma, se mantenía el tratamiento farmacológico durante un año con controles de hemograma y serología. Se consideró RN infectado al que presentaba síntomas o signos de la infección y/o presentaba IgM y/o IgA reactiva al nacer y a los RN cuyos títulos de IgG venían en descenso y a los seis o siete meses de vida se estabilizaban o aumentaban significativamente. A los RN con bajo riesgo de infección (sin seroconversión materna o con títulos de IgG e IgM maternos bajos y/o avidez fuerte se les realizaba la evaluación paraclínica y serológica inicial, no se le indicaba tratamiento al nacer y se lo seguía con determinaciones seriadas de IgG hasta que los títulos se negativizaban, lo cual ocurría habitualmente hacia los seis o siete meses de vida y en ese momento se les daba el alta. En la tabla 1 se muestra el protocolo que se aplicó a todos los RN infectados. A las embarazadas y a los RN se les realizó la determinación de IgG e IgM mediante Quimioluminiscencia DPC-immulite. En el año 2008 en el Hospital se solicitaba a la embarazada solo IgG. Si los títulos de IgG eran ³ 250 UI/ml se solicitaba IgM. Se consideraba IgG reactivo valores mayores a 5 U/ml y de Ig M mayores a 1 U/ml. En el año 2010 se comenzaron a utilizar técnicas enzyme linked fluorescente assay (ELFA) siendo los valores de IgG normales menores a 4 U/ml e IgM menores a 0,55 UI/ml. Ese mismo año se comenzó a solicitar el test de avidez de IgG. Se considera avidez débil £200, dudoso entre 200 y 300 y alta avidez >300. La determinación de IgM, IgA e IgE al RN se realizó mediante técnicas de inmunocaptura y aglutinación en el Laboratorio de Salud Pública en Montevideo.
Los datos fueron analizados mediante el programa Rsigma. Las variables cuantitativas fueron analizadas con media, mediana y desvío estándar. Las variables cualitativas se expresan en proporciones. Para estudiar la asociación de variables cualitativas se analizó los odds ratio y se aplicó la prueba exacta de Fischer, considerándose una diferencia estadística significativa con p <0,05 y muy significativa con p <0,01.
Resultados
De las embarazadas
De toda la población de embarazadas con IgM reactiva cuyos hijos fueron derivados a la policlínica para estudio, el 13,7% (7/51) no tenían cuantificado los títulos de la misma (años 2008-2009). Doce embarazadas presentaron infección durante su embarazo. Se detectó un 22% (11/51) de seroconversiones y en un caso la gestante tenía IgG e IgM reactiva desde el primer control del embarazo. De las 11 seroconversiones, tres se detectaron en el segundo trimestre del embarazo (2T) y seis en el tercer trimestre (3T). En un caso se sospechó la infección durante el primer trimestre y en otra embarazada la seroconversión ocurrió entre las 16 y las 34 semanas. Los resultados se muestran en la tabla 2. Se detectó seroconversión en seis de las siete embarazadas que tuvieron hijos con toxoplasmosis congénita. La media de edad de éstas fue de 25 años (rango 15-44 años), tres de ellas eran adolescentes.
A partir del año 2010 se implementó la realización del test de avidez de IgG, solicitándose a 11 de las 29 embarazadas cuyos RN se remitieron para estudio esos años. De las cuatro embarazadas que tuvieron test de avidez débil, dos de sus RN presentaron TC. La que presentó un test dudoso (que no se repitió) tuvo un RN sano y de las 6 que tuvieron test de avidez fuerte ninguno presentó TC.
El 75% de las embarazadas (38/51) recibió espiramicina. Cuatro de seis que tenían el test de avidez fuerte recibieron esa droga. De las cuatro gestantes que recibieron piremetamina y sulfadiacina, tres tuvieron RN con TC.
De las 12 embarazadas infectadas, dos no recibieron tratamiento porque no se les detectó la seroconversión y una lo recibe 15 días previo al parto resultando sus RN infectados.
De los recién nacidos
De los 51 derivados, 42 (82%) completaron su seguimiento. A 35 (68%) se les dio el alta, a siete (13,7%) se les diagnosticó TC y 9 (18%) no volvieron a la policlínica.
a) Características de los RN derivados
Del total de niños derivados, 29 (57%) eran de sexo femenino, cincuenta (98%) eran de término y la media de peso al nacer fue de 3.120 g. Cinco fueron pequeños para la edad gestacional (PEG), de los cuales uno presentó TC; dos presentaron microcefalia y uno presentó hepatoesplenomegalia. Los hemogramas y funcional hepático (FH) fueron normales excepto en un paciente. Todas las ecografías transfontanelares fueron informadas como normales. Se realizó FO al nacer en 41 (80%), de los cuales 40 (98%) fueron informados como normal y uno como dudoso. En tres se realizó estudio citoquímico del LCR que fue normal. En un caso se solicitó PCR de LCR que fue negativo. Todas tenían emisiones otoacústicas (EOA) normales al nacer. Dos de los niños fueron expuestos al virus de la inmunodeficiencia humana (VIH) y uno presentó sífilis congénita. Durante el seguimiento se pudo descartar la infección en 35, siendo la media de desaparición de los anticuerpos de 6,2 meses.
b) Características de los RN infectados
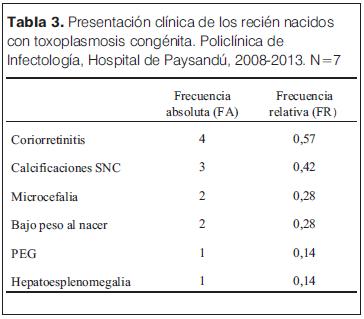
Se detectaron siete infectados. En tres se detectó IgM reactiva al nacer y en dos IgA. Tres fueron sintomáticos al nacer. En las tablas 3 y 4 y la figura 1 se muestran las características clínicas y la evolución serológica. De los 4 asintomáticos al nacer, en 2 la infección se detectó durante el seguimiento (a los 6 y 8 meses de edad los títulos de IgG que venían en descenso, se cuadruplicaron). Dos de ellos presentaron coriorretinitis en la evolución.
Los títulos de IgG al nacer fueron variables. Se evidenció una diferencia estadísticamente significativa p< 0,05 al relacionar la presencia de valores de IgG al nacer > 250 UI/ml con el diagnóstico posterior de toxoplasmosis congénita con un OR 8.50 (IC 1,17 a 76,3). En tres se detectó IgM e IgA reactiva al nacer.
Ocho recibieron tratamiento. Tres lo completaron según recomendaciones (un infectado y dos a los cuales durante el seguimiento se descartó la infección). Cinco lo abandonaron entre los 4 y los 6 meses. Las causas de la mala adherencia fueron en algunos casos falta de medicación en la farmacia, escaso interés por parte de algunas madres respecto a la enfermedad de su hijo e intolerancia digestiva en dos casos. No se observaron otros efectos secundarios. Cinco niños han presentado un desarrollo neurológico normal hasta la fecha.
Discusión
En este trabajo se pudo observar una considerable arbitrariedad respecto a la indicación de estudios y tratamiento de la embarazada con sospecha de toxoplasmosis. Entre los años 2008 y 2009 hubo embarazadas que eran IgM reactivas para el parásito pero no se habían cuantificado los títulos, no se realizaba el test de avidez y resultaba muy difícil diferenciar, en algunos casos, la infección aguda de la crónica. Como consecuencia no resultaba sencillo para los pediatras determinar si el RN estaba o no infectado. Debido a estas dificultades, en el año 2010, luego de varias puestas a punto del tema junto a los ginecólogos e infectólogo, se dispuso adecuar pautas de diagnóstico y tratamiento de la embarazada y del RN según los recursos que contaba el Hospital (figuras 1 y 2). Sin embargo, se pudo objetivar que en más de la mitad de las embarazadas IgM reactivas luego de ese año no se realizó el test de avidez, y cuando éste fue dudoso no se repitió; además, cuatro de ellas que contaban con test de avidez fuerte recibieron tratamiento. Se hace entonces esencial conocer e interpretar de forma correcta la serología para Toxoplasma gondii, así como aplicar las pautas o algoritmos existentes con el fin de disminuir los tratamientos innecesarios, la ansiedad materna e incluso las interrupciones de la gestación.
En este estudio puede existir un sesgo de selección al no estar incluidas en el mismo, aquellas embarazadas que no controlaron sus embarazos o no se realizaron la determinación serológica para toxoplasmosis; generalmente estas gestantes suelen ser de bajo nivel socioeconómico y por lo tanto con mayor riesgo de adquirir la infección en el embarazo. Por lo tanto este estudio representa a la población de embarazadas que controló su embarazo y tiene serología realizada para toxoplasmosis.
Se detectó una asociación entre la presencia de seroconversión materna y el desarrollo posterior de TC. Esto coincide con lo descrito por otros autores, que afirman que la infección congénita ocurre exclusivamente cuando una embarazada previamente negativa adquiere la infección durante la gestación (10). Sin embargo, no todas las seroconversiones terminan en infección congénita (11). Aproximadamente 30% de las mujeres que adquieren la infección durante el embarazo la transmiten al feto. En este estudio, cinco embarazadas que habían presentado seroconversión tuvieron hijos sanos.
En el único caso donde no se pudo confirmar la seroconversión y el recién nacido resultó infectado fue en una embarazada VIH positivo. Si bien se describe que en madres inmunodeprimidas puede producirse una reactivación de una infección latente durante el embarazo, es poco probable que este hubiera sido el caso, dado que la embarazada presentaba en ese momento su inmunidad normal (carga viral de 22,910 copias/ml y CD4 701 células/mm3). No obstante, se recomienda en estas pacientes prestar mayor atención a los títulos de anticuerpos contra toxoplasma durante los controles prenatales por la posibilidad no sólo de una infección aguda sino de una reinfección, dado que existen diferentes genotipos del parásito o de una reactivación de una infección latente(12). En nuestro país, el Ministerio de Salud Pública (MSP) recomienda en estas pacientes realizar serología en la primera consulta, a las 28 y a las 36 semanas del embarazo(13).
En este trabajo se pudo evidenciar que algunas embarazadas que tenían un test de avidez fuerte recibieron tratamiento. Se debe ser más cuidadoso con la indicación del mismo si no hay suficientes estudios que nos aseguren la infección materna durante el embarazo y agotar todos los recursos disponibles para confirmar la infección. Se destaca que tres de las cuatro embarazadas que recibieron tratamiento combinado tuvieron hijos con TC. A pesar de que la mayoría de los estudios no demuestran mayor efectividad cuando se usan combinadas, se sigue recomendando la asociación con pirimetamina y sulfadiazina dado que se ha documentado que la espiramicina sola atraviesa en menor cantidad la placenta, obteniéndose niveles insuficientes en sangre fetal para tratar la infección(1). Si bien aún existen muchas controversias con respecto a la eficacia del tratamiento con espiramicina, debido a que es muy difícil de evaluar, ya que depende de la edad gestacional en el momento de la infección, ésta se sigue recomendando una vez demostrada la misma o que exista una sospecha serológica razonable. Existen estudios que demuestran que la trasmisión vertical al feto es menor si éste se inicia entre las tres semanas de ocurrida la seroconversión en comparación con el inicio del mismo misma pasadas las ocho semanas o más. Desconocemos en que momento de la seroconversión se aplicó el tratamiento en esas tres gestantes cuyos hijos resultaron infectados. Aunque no hay estudios que demuestren una disminución de las lesiones intracraneales ni de la coriorretinitis posnatal, a pesar del inicio temprano del tratamiento, si se ha demostrado una reducción de las secuelas neurológicas graves y la muerte posnatal de los RN cuyas madres fueron tratadas durante el embarazo(1,14). Algunos autores plantean que debido a la potencial toxicidad de estos fármacos su uso debería restringirse únicamente a aquellas gestantes con confirmación de infección fetal en el líquido amniótico(1) que en este trabajo no se objetivó.
En Paysandú se produciría un caso por año de TC. Como ocurren aproximadamente 1.000 partos anuales, se producirían 1 a 2 casos cada 1.000 RN vivos, lo cual coincide con trabajos previos publicados en nuestro país. Sin embargo, dado que se perdieron nueve RN durante el seguimiento y que durante los años 2008 a 2009 no se remitían a la policlínica sistemáticamente todos los RN con serología IgM materna reactiva la probabilidad de infectados podría ser mayor. Casi 60% de los infectados fueron asintomáticos al nacer, cifra que resulta menor a lo descrito en la literatura(1). Este hecho no hace más que seguir fortaleciendo la necesidad de mantener un estrecho seguimiento clínico y serológico de los RN con sospecha de infección hasta el año de vida. De hecho dos pacientes fueron diagnosticados durante su seguimiento, a los 6 y 8 meses de edad. Las manifestaciones clínicas varían de acuerdo al momento en que se produce la infección materna. Si esta ocurre en el primer trimestre, el riesgo de trasmisión al feto es de 10%, si ocurre en el tercer trimestre asciende a 60% y es del 90% si ocurre en las últimas semanas, siendo la gravedad de la afectación inversamente proporcional a la edad gestacional(9,10,15). En este estudio, se observó que en los tres RN infectados sintomáticos la seroconversión materna se había producido durante el tercer trimestre del embarazo. Esto coincide con algunos autores que describen que si la infección ocurre al final del embarazo, se produce una forma aguda generalizada, donde la mitad de los RN son pretérminos y de bajo peso con un cuadro clínico de tipo séptico caracterizado por fiebre, hepatomegalia, ictericia, y en algunos miocarditis o neumonía intersticial. Estos niños rara vez presentan afectación neurológica y ocular y presentan una mortalidad elevada sin tratamiento(16). Dos pacientes presentaron enfermedad neonatal severa con microcefalia, calcificaciones cerebrales y coriorretenitis. Uno de ellos fue un pretérmino que asoció además hepatoesplenomegalia, plaquetopenia, leve alteración de las transaminasas y tiempo de protrombina descendido. Llama la atención la presencia de microcefalia en estos pacientes, dado que en las formas generalizadas del último trimestre no están descriptas. Se ha observado que la gravedad clínica estaría vinculada a determinados serotipos del parásito que existen en ciertos grupos demográficos y que se asocian a prematuridad y a enfermedad severa al nacer(17). Estas formas más graves, en comparación con Europa o Norteamérica, se han encontrado en Sudamérica, donde existe elevada mortalidad debido a una mayor virulencia de las cepas circulantes en ésta zona geográfica (5,18-21).
Un paciente (caso 4) presentó escasas calcificaciones cerebrales al nacer que desaparecieron con tratamiento antes del año de vida y hasta el momento actual tiene un examen ocular y un desarrollo normal. La presencia de calcificaciones no necesariamente se correlaciona con un mal pronóstico neurológico pero sí parece incrementar el riesgo de coriorretinitis (1) por lo que el estudio oftalmológico es obligatorio. La mayoría de los RN tenían informado el FO como normal al nacer y en un caso fue dudoso. Sin embargo cuatro niños presentaron afectación ocular en la evolución. Las lesiones oculares pueden ser tan altas como 85% y solo 20% de los casos exhiben síntomas al nacer, pudiendo ir apareciendo en los meses posteriores. La forma congénita suele ser más grave, es bilateral y con mayor riesgo de afectar la mácula y de presentar recurrencias (22-27). El estrabismo, la alteración de la agudeza o el campo visual son signos que nos deben hacer pensar en esta enfermedad. Se aconseja que la evaluación oftalmológica sea realizada por un oftalmólogo habituado en niños(1), lo cual no contamos en nuestro hospital. De existir afectación ocular, se recomienda agregar al tratamiento convencional corticoides por un mes y en caso de coriorretinitis activa se debe tratar hasta 2 semanas después que el paciente no tenga signos inflamatorios en la retina. Uno de los pacientes infectados (caso 2), que discontinuó su control y se volvió a captar a los 4 años, ya presentaba coriorretinitis periférica secuelar unilateral. Si bien es muy discutido el tratamiento en estos pacientes, algunos expertos recomiendan realizarlo durante 3 a 4 meses, pero sin el agregado de corticoides, para evitar recidivas y la posibilidad de afectación macular(1). A esta paciente se le indicó tratamiento y actualmente, a los seis años, tiene un buen desarrollo con controles oftalmológicos anuales y sin nuevas lesiones. La presencia de coriorretinitis y otras afecciones vinculadas a la toxoplasmosis congénita puede repercutir en el desarrollo normal del niño(28). Por lo tanto, se recomienda realizar un control oftalmológico minucioso y frecuente hasta la adolescencia y en el caso de detectarse una lesión cicatrizal, se aconseja un control bianual por el mayor riego de recidiva que tienen estos pacientes(1,8).
Solo uno de los RN infectados, que presentó una forma grave, mostró alteraciones en el hemograma y el funcional hepático (plaquetopenia y hepatitis). Ambos estudios carecen de especificidad, por lo que se recomienda solicitarlos con la finalidad de establecer el grado y extensión de la enfermedad (1). Con respecto a los estudios de imagen, si bien todos los RN en este trabajo tenían ecografías informadas como normales, hubo casi 30% de RN que mostraban calcificaciones en la radiografía de cráneo y un 60% en la TAC de cráneo, lo que demuestra la importancia de complementar con estos estudios cuando existen dudas o no se cuenta, en algunos casos, con técnicos experimentados. En tres de los pacientes el estudio citoquímico del LCR resultó normal y en un caso se solicitó PCR que fue informado como no reactivo.
El 71% de los niños infectados presentaron títulos de IgG al nacer mayores a 250 UI/ml lo cual fue estadísticamente significativo. La IgM específica se encontró reactiva en tres de los siete pacientes con TC, lo que supone un 57% de casos de infección congénita con IgM no reactiva. Esto confirma lo descrito por otros autores, que refieren que si bien ésta es patognomónica no tiene validez en caso de ser negativa(9). Algunos autores han descrito que la IgM aparece reactiva si la seroconversión se produce en el tercer trimestre del embarazo lo cual estaría asociado a una mayor madurez fetal y puede permanecer reactiva de forma intermitente durante meses (10). La IgA es considerada más sensible que la IgM. Se ha observado en otras series una reactividad del 100% permaneciendo positiva varios meses (29,30), hecho que no se pudo comprobar en este trabajo ya que no se solicitó en forma seriada y solo se encontró reactiva en dos RN. Sin embargo, hay que tener presente que la misma puede ser falsamente negativa en un 20-30% de los casos (1). De cuatro RN infectados a los que se les solicitó IgE, sólo uno resultó ser reactivo. La IgE presenta una alta especificidad pero baja sensibilidad. Se eleva después de la infección aguda y desaparece antes de los 4 meses, por lo que no siempre es de utilidad diagnóstica(1). Se debe tener en cuenta que estas Igs deben solicitarse luego de los 10 días del nacimiento, dado que existe un mayor rendimiento de las técnicas diagnósticas. La producción tardía de IgM puede dar resultados falsamente negativos por la acción competidora de la IgG (7,16). Entre los 6 y 12 meses ya no se detectan los anticuerpos trasmitidos por vía transplacentaria, por lo que una persistencia o aumento de los títulos de éstos demuestra que el niño comenzó a producir sus propios anticuerpos y debe considerarse como infectado, como ocurrió en dos de los pacientes. Mediante la determinación seriada de IgG se pudo descartar la infección congénita en 35 RN.
Ocho RN recibieron tratamiento al nacer. Uno de los mayores inconvenientes observados durante el seguimiento fue la dificultad en la adherencia del mismo por la mayoría de las madres que veian a sus hijos asintomáticos. Casi 40% de los RN cumplió con los 12 meses, que es el tiempo recomendado por la mayoría de los expertos de EEUU y Francia(1,5,7). El 60% restante lo suspendieron entre los 4 y 6 meses de iniciado. Existen evidencias de que el tratamiento iniciado tempranamente y en forma adecuada disminuye la probabilidad de afectación neurológica grave y oftalmológica (20). La mayoría de las sociedades científicas o expertos no dudan en recomendar el tratamiento a los neonatos con TC confirmada. A pesar de que aún no existen estudios controlados que determine su eficacia, dosis y tiempo de administración, existen estudios de cohortes con seguimiento prolongado que han demostrado que aquellos niños que recibieron tratamiento por 12 a 24 meses tuvieron menos secuelas y menor riesgo de coriorretinitis que los no tratados o tratados durante menos de 4 semanas (1). La evidencia de múltiples trabajos publicados con resultados favorables respaldan hoy en día continuar con el tratamiento tanto de la embarazada como del RN infectado a pesar de que algunos autores han demostrado que al menos para la coriorretinitis ni el tratamiento prenatal ni el posnatal incide de forma importante en el riesgo de presentar recaídas a lo largo de la vida (31,32).
El tratamiento de la infección en los RN tiene sus inconvenientes. Los fármacos disponibles son subóptimos, pues solo inhiben el crecimiento del parásito cuando está en fase activa de su ciclo vital (taquizoíto) y por otro lado no están exentos de efectos tóxicos. Se debe ir controlando al niño con hemogramas seriados por la posibilidad de efectos adversos, principalmente con la piremetamina. En este estudio se observó en dos niños intolerancia digestiva que se solucionó con el agregado de antiácidos. No se observaron alteraciones hematológicas que determinara la suspensión del mismo. Otra de las dificultades es que no existen formulaciones líquidas de los fármacos, lo que dificulta la administración a los más pequeños, requiriendo un manejo cuidadoso de las dosis. Se recomienda que durante el tratamiento, una vez que la IgG se hace negativa, se realicen dos determinaciones separadas por 4-6 semanas luego de suspendido el mismo para considerar a los lactantes como no infectados. Si la IgG se reactiva, se debe reiniciar el tratamiento hasta completar 12 meses. No hay acuerdo en estos casos si se debe considerar el tiempo de administración anterior o iniciar de cero(1). Luego del año de vida se debe realizar otra IgG que de ser reactiva confirma la infección congénita. Hay que tener en cuenta que puede producirse una positivización de la IgM o un ascenso de la IgG en los meses posteriores a la suspensión del tratamiento que no tiene explicación. En estos casos no se recomienda volver a tratar, pero si realizar controles oftalmológicos frecuentes(1).
Conclusiones
Si bien la TC es una enfermedad poco frecuente en nuestro medio, ocasiona una importante morbilidad como se pudo objetivar en este trabajo. Se sabe que la carga global de TC es de 190.100 casos anuales por año lo que equivale a 1.200.000 años de vida con discapacidad, de las cuales la mayor parte ocurren en Sudamérica (32). Por lo tanto, hay mucho por hacer a fin de reducir la carga de morbilidad que origina esta enfermedad en nuestros niños. Es una infección que se puede prevenir mediante el correcto control del embarazo, informando a la embarazada seronegativa las medidas higiénicas a tomar como evitar la convivencia con gatos, lavar correctamente frutas y verduras, ingerir agua potable, usar guantes y lavarse las manos luego de tareas de jardinería o huerta, no consumir carne mal cocida y evitar el contacto con sangre animal. Se deben mejorar las técnicas diagnósticas, las cuales deben estar al alcance en todos los hospitales y debemos seguir insistiendo en el cumplimiento riguroso de los algoritmos diagnósticos. El pediatra debe recordar que aunque un RN sea asintomático, éste puede estar infectado por lo que una vez se comprueba la seroconversión materna, se debe iniciar de inmediato el tratamiento, seguir con IgG hasta el año de vida y con controles oftalmológicos hasta la adolescencia.
Agradecimientos
A los Dres. G. Echenique y S Pintos por su participación en la realización del algoritmo de manejo de la embarazada que actualmente se usa en la Maternidad del Hospital.
Referencias bibliográficas
1. Baquero-Artigao F, Del Castillo Martín F, Fuentes Corripio I, Goncé Mellgren A, Fortuny C, de la Calle Fernández M, et al. Guía de la Sociedad Española de Infectología Pediátrica para el diagnóstico y tratamiento de la toxoplasmosis congénita. An Pediatr (Barc) 2013; 79(2):116.e1-e16.
2. Conti Diaz I, Freyre A, Queyruga G, Noya C, Mendez J, Gedda C, et al. Estudio de la Toxoplasmosis en una Unidad de Perinatología del BPS en el periódo 1991-1996.Rev Med Urug 1998;14(3):226-35.
3. Freyre A, Queiruga G, Méndez J, Lavarello L. Riesgo de Infección toxoplásmica del feto humano en Montevideo. An Clínicos (España).1992; 4:122-7.
4. González MV, Puime A, Russi C, Fernández N, Lauria W, Pose G, et al. Desarrollo de un Plan Piloto de Prevención de la Toxoplasmosis Congénita en el Centro Hospitalario Pereira Rossell: resultados preliminares. Rev Urug Patol Clin 2004; 38:27.
5. Cortés JA, Gómez JE, Silva PI, Arévalo L, Arévalo Rodríguez I, Alvarez M, et al. Guía de atención integral para la prevención, detección temprana y tratamiento de las complicaciones del embarazo, parto y puerperio: sección toxoplasmosis en el embarazo. Infectio 2012; 16(4):230-46.
6. McAuley JB. Congenital Toxoplasmosis. J Pediatric Infect Dis Soc 2014; 3(Suppl 1):S30-5.
7. Mcauley J, Boyer KM, Remigton J, Mc Leod R. Toxoplasmosis. En: Feigin RD, Cherry JD, Demmler-Harrison GJ, Kaplan SL, eds. Feigin and Cherry’s Textbook of Pediatric Infectious Disease. 6 ed. Philadelphia, PA: Saunders-Elsevier, 2009:54-71.
8. del Castillo Martín F. Toxoplasmosis congénita. Una enfermedad con demasiados interrogantes. An Pediatr (Barc) 2004; 61(2):115-7.
9. del Castillo Martín F. Diagnóstico y tratamiento de la toxoplasmosis congénita. An Pediatr Contin 2005; 3(2):65-72.
10. Roc L, Palacían P, Lomba E, Monforte L, Rebaje V, Revillo MJ, et al. Diagnóstico serológico de los casos de toxoplasmosis congénita. Enferm Infecc Microbiol Clin 2010; 28(8):517-9.
11. Alvarado-Esquivel C, Sifuentes-Álvarez A, Narro-Duarte SG, Estra-da-Martínez S, Díaz-García JH, Liesenfeld O, et al. Seroepidemiology of Toxoplasma gondii infection in pregnant women in a public hospital in northern Mexico. BMC Infect Dis 2006; 6:113.
12. Cruz ML, Cardoso CA, Saavedra MC, Santos ED, Melino T. Congenital toxoplasmosis infection in an infant born to an HIV-1-infected mother. Braz J Infect Dis 2007; 11(6):610-1.
13. Uruguay. Ministerio de Salud Pública. Dirección General de Salud. Área de Salud Sexual y reproductiva. Programa Nacional ITS-VIH/Sida. Guía clínica para la eliminación de la sífilis congénita y la trasmisión vertical del VIH: Uruguay 2013. Disponible en: http://www.msp.gub.uy/sites/default/files/archivos_adjuntos/MSP%20-%20GUIA%20TV%20.pdf. [Consulta: 30 noviembre 2014].
14. Cortina-Borja M, Tan HK, Wallon M, Paul M, Prusa A, Buffolano W, et al; European Multicentre Study on Congenital Toxoplasmosis (EMS-COT). Prenatal treatment for serious neurological sequelae of congenital toxoplasmosis: an observational prospective cohort study. PLoS Med 2010; 710):e1000351.
15. Montoya J, Kovacs J, Remigton J. Toxoplasma gondii. En: Mandell G, Douglas R, Bennett J, eds. Enfermedades infecciosas: principios y práctica. 6 ed. Madrid: Elsevier, 2006:3170-98.
16. Martin Hernández I. Toxoplasmosis congénita: una mirada al problema. Rev Biomed 2004; 15(3):181-90.
17. McLeod R, Boyer KM, Lee D, Mui E, Wroblewski K, Karrison T, et al; Toxoplasmosis Study Group. Prematurity and severity are associated with Toxoplasma gondii alleles (NCCCTS, 1981-2009). Clin Infect Dis 2012; 54(11):1595-605.
18. Gómez JE, Castaño JC, Rios MP, Montoya MT. Toxoplasmosis congénita e hidranencefalia. Acta Med Col 1992; 17:457-8.
19. Bambirra EA, Pittella JE, Rezende M. Toxoplasmosis and hydra-nencephaly. N Engl J Med 1982; 306(18):1112-3.
20. Castaño JC, Gómez JE, Duque AM. Toxoplasmosis ocular en el Quindío: caracteristicas clínicas. Biomédica 1991; Suppl 1:112.
21. Silveira C, Belfort R Jr, Burnier M Jr, Nussenblatt R. Acquired toxoplasmic infection as the cause of toxoplasmic retinochoroiditis in families. Am J Ophthalmol 1988; 106(3): 362-4.
22. Dodds M. Toxoplasmosis ocular. Arch Soc Esp Oftalmol 2003; 78(10):531-41.
23. Martín Hernández I. Toxoplasmosis ocular: un breve repaso. Rev Oftalmol Venez 2003; 59(2):38-43.
24. Kodjikian L, Wallon M, Fleury J, Denis P, Binquet C, Peyron F, et al. Ocular manifestations in congenital toxoplasmosis. Graefes Arch Clin Exp Ophthalmol 2006; 244(1):14-21.
25. Carneiro AC, Andrade GM, Costa JG, Pinheiro BV, Vasconcelos-Santos DV, Ferreira AM, et al. Genetic characterization of Toxoplasma gondii revealed highly diverse genotypes for isolates from newborns with congenital toxoplasmosis in southeastern Brazil. J Clin Microbiol 2013; 51(3):901-7.
26. Gilbert RE, Freeman K, Lago EG, Bahia-Oliveira LM, Tan HK, Wa-llon M, et al; European Multicentre Study on Congenital Toxoplasmosis (EMSCOT). Ocular sequelae of congenital toxoplasmosis in Brazil compared with Europe. PLoS Negl Trop Dis 2008; 2(8):e277.
27. Phan L, Kasza K, Jalbrzikowski J, Noble AG, Latkany P, Kuo A, et al; Toxoplasmosis Study Group. Longitudinal study of new eye lesions in children with toxoplasmosis who were not treated during the first year of life. Am J Ophthalmol 2008; 146(3):375-384.
28. Roizen N, Kasza K, Karrison T, Mets M, Noble AG, Boyer K, et al. Impact of visual impairment on measures of cognitive function for children with congenital toxoplasmosis: implications for compensatory intervention strategies. Pediatrics 2006; 118(2):e379-90.
29. Remington JS, Mclod R, CB Wilson, Desmonts G. Toxoplasmosis En : Remington JS, Klein J, Wilson CB, Nizet V. Infectious disease of the fetus and newborn infant. 7 ed. Philadelphia: Elsevier- Saunders, 2011:918-1041.
30. Lomba E, Omeñaca M, Roc L, Villuendas MC, Aldea MJ, Aisa ML. ¿Es la IgM específica un criterio diagnóstico de toxoplasmosis aguda? Rev Esp Microbiol Clin 1989; 1:498-500.
31. McLeod R, Kieffer F, Sautter M, Hosten T, Pelloux H. Why prevent, diagnose and treat congenital toxoplasmosis? Mem Inst Oswaldo Cruz 2009; 104(2):320-44.
32. Torgerson PR, Mastroiacovo P. The global burden of congenital toxoplasmosis: a systematic review. Bull World Health Organ 2013; 91(7):501-8.
Correspondencia: Dra. Belén Amorín.
Correo electrónico: belena@paysandu.com