Services on Demand
Journal
Article
Related links
Share
Archivos de Pediatría del Uruguay
On-line version ISSN 1688-1249
Arch. Pediatr. Urug. vol.85 no.2 Montevideo June 2014
CASO CLÍNICO
Arch Pediatr Urug 2014; 85(2)
Propranolol en el tratamiento de los hemangiomas: una alternativa terapéutica
Fernanda Salvo1, Nancy De Olivera2, Mariela Álvarez3, Gustavo Giachetto4
1. Residente de Pediatría. Asociación Española Primera Socorros Mutuos.
2. Prof. Adj. de Pediatría. Facultad de Medicina. UDELAR.
3. Prof. Adj. Dermatología. Facultad de Medicina, UDELAR.
4. Prof. Clínica Pediátrica. Facultad de Medicina. UDELAR.
Depto. de Pediatría. Facultad de Medicina. UDELAR
Asociación Española.
Fecha recibido: 22 de abril de 2014
Fecha aprobado: 9 de junio de 2014.
Resumen
Introducción: los hemangiomas son los tumores benignos más frecuentes de la infancia. Generalmente involucionan espontáneamente después del año. Un porcentaje pequeño requiere tratamiento debido a complicaciones. Recientemente se ha comunicado beneficio del tratamiento con propranolol.
Objetivo: describir la experiencia de tratamiento con propranolol en 6 niños con hemangiomas infantiles (HI) en dos centros asistenciales de Montevideo en el período 1/9/2010 – 31/12/2013.
Metodología: se incluyeron los menores de 15 años portadores de hemangiomas asistidos en el Centro Hospitalario Pereira Rossell y en la Asociación Española tratados con propranolol. En todos los casos se realizó evaluación cardiológica previa. Se excluyeron aquellos con contraindicaciones absolutas al fármaco. En todos los casos se solicitó, previo al tratamiento, consentimiento informado. Se describe las características clínicas de los niños y la evolución.
Resultados: se incluyeron 6 niños (5 niñas y un varón); rango 1 mes y 21 días a 20 meses. Las topografías fueron: labio superior con compromiso de narina 2, mejilla izquierda 1, raíz nasal e intraorbitario 1, intraocular 1, múltiple 1. En todos los casos la respuesta fue favorable con disminución progresiva de las lesiones en los primeros meses de tratamiento. Ninguno presentó complicaciones.
Discusión: ésta es la primera comunicación de una serie de niños con hemangiomas tratados con propranolol en Uruguay. A pesar del escaso número de pacientes, se observó beneficio terapéutico sin complicaciones. El propranolol debe considerarse como una alternativa terapéutica al tratamiento con glucocorticoides sistémicos, cuya administración prolongada se asocia con serios efectos adversos.
Palabras clave: HEMANGIOMA
PROPRANOLOL
Summary
Introduction: hemangiomas are the most common benign tumors of childhood. They usually regress spontaneously after the year of life. A small percentage require treatment due to complications. Recently it has been reported the benefit of treatment with propranolol.
Objective: describe the experience of treatment with propranolol in 6 children with infantile hemangiomas (HI) in two centers of
Methodology: included infants under de age of 15 carriers of hemangiomas assisted in the
Results: 6 children were included (5 girls and a male); range 1 month and 21 days to 20 months. The surveys were: upper lip with commitment of nostril 2, left cheek 1, nasal root and intraorbitary 1, intraocular 1, multiple 1. In all cases the response was favorable with progressive decrease in injuries in the first month of treatment. None of the patients presented complications.
Discussion: this is the first communication of a series of children with hemangioma treated with propranolol in
Key words: HEMANGIOMA
PROPRANOLOL
Introducción
Los hemangiomas infantiles (HI) son los tumores benignos más frecuentes de la infancia. Se observan en 1%-2% de los recién nacidos y hasta 10% de los lactantes de raza blanca durante el primer año de vida(1,2).
Son hamartomas proliferantes del endotelio vascular que pueden estar presentes al nacimiento, pero generalmente se hacen evidentes en las primeras semanas de vida. Son más frecuentes en niñas de raza blanca (2-4). Predominan en recién nacidos pretérminos en quienes la incidencia es inversamente proporcional al peso al nacer. Otros factores asociados son el embarazo múltiple y madre añosa(2).
Frecuentemente se observan al nacimiento lesiones precursoras sutiles como telangiectasias, zonas pálidas o lesiones equimóticas, presentando una fase de crecimiento variable durante los primeros 12 a 18 meses para involucionar con disminución de la proliferación celular y aparición de fibrosis en plazos variables de 2 a 10 años. 60% involuciona completamente a los 5 años y 90% a 95% a los 9 años(4). 20% a 40% de los pacientes queda con alguna secuela en forma de tejido fibroadiposo o piel cicatrizal con o sin telangiectasias superficiales, especialmente cuando las lesiones son de mayor volumen, profundidad y se localizan en la punta nasal, labio y región parotídea(5).
Habitualmente son lesiones únicas; sólo en 20% se presentan como lesiones múltiples(3).
Las topografías más frecuentes son: cabeza y cuello 60%, tronco 25% y extremidades 15%. Pueden distribuirse de forma segmentaria siguiendo diferentes dermatomas o de manera focal. Según la profundidad se clasifican en hemangiomas superficiales cuando comprometen la dermis y profundos cuando presentan compromiso del tejido subcutáneo, o mixtos(6). 65% de los HI son superficiales, 15% profundos y 20% mixtos(3).
La patogenia no es totalmente conocida. Se han identificado mutaciones a nivel de la proteína de expresión relacionada con la angiogénesis. También presentan elevada expresión de factores proangiogénicos como factor de crecimiento endotelial, factor de crecimiento de fibroblastos y antígeno de proliferación nuclear, los cuales estimulan el crecimiento endotelial generando disregulación a nivel de la angiogénesis. Existe una sobreexpresión del transportador de glucosa 1 (GLUT-1), lo cual es específico de los HI (4,7).
El diagnóstico es clínico. Los estudios imagenológicos se utilizan en casos dudosos, lesiones hepáticas y en hemangiomatosis neonatal benigna para descartar compromiso visceral. Los más utilizados son: ultrasonografía con doppler y resonancia magnética (RM)(1).
El carácter benigno y autolimitado de la mayoría de los HI justifica la observación clínica y conducta expectante. Un pequeño porcentaje de los pacientes debe recibir tratamiento durante la fase proliferativa debido a la presencia de complicaciones. Los glucocorticoides sistémicos en altas dosis por períodos prolongados han sido el tratamiento de primera línea, sin embargo este tratamiento presenta complicaciones derivadas de sus efectos adversos(1).
En el año 2008, se publicó el uso de propranolol en hemangiomas, al utilizarlo para el tratamiento de las complicaciones cardíacas derivadas del uso prolongado de corticoides en pacientes con hemangiomas(2,8).
A continuación se describe la primera la experiencia nacional de tratamiento de HI con propranolol en dos centros asistenciales de Montevideo, Uruguay.
Se incluyeron seis niños con HI, cinco procedentes de la Asociación Española (AE) y uno del Hospital Pediátrico del Centro Hospitalario Pereira Rossell (HP-CHPR) durante el período 1 de setiembre de 2010 al 31 de diciembre de 2013.
Previo al inicio del tratamiento con propranolol se realizó valoración cardiológica (interconsulta con especialista y electrocardiograma [ECG]). En todos los casos, luego de obtener consentimiento informado, se aplicó el mismo protocolo de tratamiento: dosis inicial 0,16 mg/kg/dosis vía oral cada 8 horas, duplicándose la dosis cada 3 días hasta alcanzar una dosis máxima de 0,64 mg/kg/dosis vía oral cada 8 horas, llegando a dosis máxima diaria de 2 mg/kg/día. Se planificó la duración mínima del tratamiento 1 año. En los primeros casos y ante la falta de experiencia del equipo tratante, el fármaco se inició con el niño hospitalizado para controlar la aparición de posibles eventos adversos (bradicardia, hipotensión arterial, hipoglicemia). Posteriormente, el tratamiento se indicó en forma ambulatoria con supervisión médica periódica, previa información e instrucción de los padres.
Se analizan las características clínicas de los niños y la respuesta terapéutica.
Casos clínicos
Caso 1.
1 mes 21 días, sexo femenino, raza blanca. Producto de primer embarazo normal. Cesárea de urgencia por desprendimiento de placenta normoinserta (DPPNI) a las 39 semanas, peso al nacer (PN): 4.100 g. Sin patología perinatal. Desde el nacimiento pequeña mácula telangiectásica en filtrum y labio superior que aumenta progresivamente, dificultando la respiración y alimentación. Pequeño hemangioma en glúteo derecho. Ecografía abdominal (ECO-ABD) y transfontanelar (ECO- TF), ECG y ecocardiograma (ECoC) normales. Hospitalizada se inicia propranolol vía oral. Alta al 4° día sin efectos secundarios. De forma ambulatoria aumento progresivo de la dosis hasta 2 mg/kg/día, evidenciándose una clara disminución de la lesión. A los 2 meses del inicio el tratamiento emigra a Perú por lo que no se continúa seguimiento.
Caso 2
5 meses, sexo femenino, raza blanca. Producto de 2° embarazo complicado por restricción de crecimiento intrauterino. Cesárea a las 35 semanas por Ecodoppler alterado. PN: 1.804 g, sin otra patología perinatal. ECO-TF y ABD normales. A los 14 días de vida, hemangioma en dedo índice izquierdo y a nivel de raíz nasal izquierda que aumentan progresivamente. RM: hemangioma en raíz de narina izquierda, que se extiende al compartimiento infraorbitario ocupando la grasa externa conal nasal. Discreto desplazamiento del globo ocular. Sin compromiso ocular. Nervio óptico normal. A los 4 meses se inicia tratamiento con glucocorticoides vía oral. A los 5 meses ante la falta de respuesta y el riesgo de efectos adversos ingresa para iniciar tratamiento con propranolol. ECoC normal. Aumento ambulatorio de la dosis hasta alcanzar 2 mg/kg/día. A los 17 meses del tratamiento remisión total de la lesión por lo que se suspende tratamiento sin reaparición de la lesión.
Caso 3
1 año y 8 meses, sexo femenino, raza blanca. Producto de primer embarazo gemelar. Cesárea coordinada, PN: 2.450 g, sin patología perinatal. A los 3 meses convulsión generalizada en apirexia, reiterada, tomografía de cráneo (TAC) y electroencefalograma normales, en tratamiento con fenobarbital. Desde el nacimiento hemangioma intraocular izquierdo, con crecimiento progresivo. Ingresa para inicio de tratamiento con propranolol. ECG normal. Alta a las 8 horas de iniciado el tratamiento. Aumento ambulatorio de la dosis hasta alcanzar 2 mg/kg/día. A los 6 meses de tratamiento remisión total de la lesión. Suspensión del tratamiento al año sin reaparición de la lesión.
Caso 4
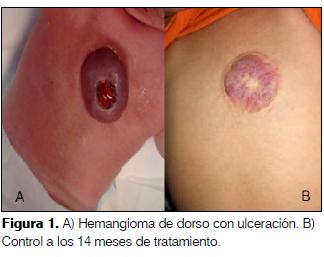
5 meses, sexo femenino, raza blanca. Producto de primer embarazo gemelar, complicado con estado hipertensivo del embarazo y trombofilia. Cesárea de urgencia a las 28 semanas por DPPNI. PN: 750 g, depresión neonatal leve, enfermedad de membrana hialina. Osteopenia grave con fractura espontánea de fémur. Hemangiomatosis múltiple cutánea, el mayor en región dorsal. ECO-TF y ECO-ABD normales. Ingresa a cuidados intensivos por ulceración y sangrado de hemangioma dorsal. Se inicia tratamiento con propranolol vía oral. Alta a domicilio al 4º día de tratamiento. A los 14 meses de tratamiento importante regresión de la lesión (figura 1).
Caso 5
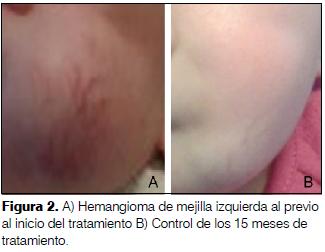
2 meses, sexo femenino. Producto de primer embarazo complicado con diabetes gestacional, trombofilia y amenaza de parto prematuro. Cesárea a las 31 semanas por Ecodoppler patológico. PN: 980 g, sin otra patología perinatal. Hemangioma de mejilla izquierda que aumenta progresivamente dificultando la alimentación. Se inicia tratamiento con propranolol de forma ambulatoria según protocolo hasta alcanzar dosis máxima de 2 mg/kg/día. Controles a de PA y HGT normales. A los 15 meses de tratamiento regresión total del hemangioma (figura 2).
Caso 6
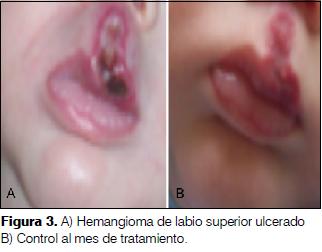
1 mes 20 días, sexo masculino. Producto de primer embarazo, complicado con diabetes gestacional, hipertensión e hipotiroidismo. Cesárea a las 35 semanas por preeclampsia. Adecuado para la edad gestacional. Desde el nacimiento angioma a nivel de filtrum y labio superior, aumento de tamaño, ulceración que determina dolor y dificultad para alimentarse. Se inicia tratamiento con el paciente hospitalizado. Al mes franca mejoría con cierre de la ulceración y disminución de la tumoración (figura 3).
En la tabla 1 se resumen las principales características de los niños y las indicaciones del tratamiento y los efectos adversos.
Discusión
La mayoría de los HI regresa espontáneamente en la primera década de la vida. La indicación del tratamiento depende su localización, presencia de complicaciones y riesgo de lesiones, secuelas cosméticas o funcionales(1).
El 20% presentan complicaciones que incluyen lesiones desfigurantes, ulceración, sangrado, compromiso visual, obstrucción de la vía aérea, insuficiencia cardíaca congestiva y rara vez muerte. La ulceración y el compromiso obstructivo de estructuras vecinas son las más frecuentes. Las complicaciones se producen durante la fase de crecimiento rápido(9). En esta serie la ulceración y el compromiso obstructivo fueron los motivos de tratamiento.
Existen tres síndromes clínicos graves vinculados con HI que representan un desafío terapéutico. La hemangiomatosis, que es la presencia de múltiples hemangiomas cutáneos con o sin compromiso visceral; el síndrome de Kasabach-Merritt, que consiste en la presencia de hemangioendotelioma kaposiforme de crecimiento rápido, trombocitopenia, anemia microangiopática y coagulopatía por consumo aguda o crónica (3), y el síndrome PHACES (hemangioma cérvicofacial extenso, de distribución segmentaria, malformación de fosa posterior (P), hemangioma (H), anomalías vasculares (A), coartación de aorta-cardiopatía congénita (C), anomalías oculares (E) y malformaciones del esternón y supraumbilical)(2,10).
Existen múltiples opciones terapéuticas, desde tratamientos farmacológicos tópicos y sistémicos hasta la cirugía. En la mayoría de los casos el tratamiento farmacológico es la primera opción.
Los tratamientos locales se reservan para hemangiomas superficiales. A los clásicos corticoides intralesionales o tópicos se suma el uso de imiquimod y timolol. En ocasiones se ha utilizado láser.
El imiquimod es un inmunomodulador con propiedades antivirales, antitumorales e inmunorreguladoras, que produce inhibición del crecimiento vascular y acelera la apoptosis(11).
Los glucocorticoides sistémicos han sido considerados la opción terapéutica de primera línea, pese a la respuesta variable, las altas dosis requeridas y los efectos adversos derivados de su uso prolongado(1,12,13). Luego de la suspensión del tratamiento existe un rebrote de la lesión, por lo que se recomienda realizar tratamiento prolongado seguido de suspensión gradual hasta el año de vida(14). Algunos HI presentan resistencia a los glucocorticoides(1,2). En esta serie solo un paciente recibió tratamiento con glucocorticoides vía oral por un mes sin evidencia de regresión de la lesión.
Son asimismo alternativas terapéuticas la vincristina, interferón alfa y ciclofosfamida, también con riesgo elevado de efectos adversos.
En 2008, Léauté-Labréze y colaboradores comunicaron resultados beneficiosos con el uso de propranolol vía oral, un betabloqueante no selectivo utilizado en niños para el tratamiento de la hipertensión, insuficiencia cardiaca, arritmias y migraña (8,10,12,15). Sus efectos adversos más comunes son bradicardia, hipotensión, hipoglicemia e hiperreactividad bronquial(5). Se propone que induce vasoconstricción, bloqueo de la angiogénesis al inhibir la producción del factor de crecimiento endotelial y el factor de crecimiento básico de fibroblastos. También induce apoptosis de células endoteliales (10,12,15).
Algunos autores recomiendan iniciar con dosis de 2 mg/kg/día fraccionada en 3 dosis y otros inicio gradual con dosis de 0,5 mg/kg/día repartido en 3 dosis hasta alcanzar una dosis máximas de 2–3 mg/kg/día según respuesta y tolerancia (10,12,16). En esta serie se adoptó este último protocolo.
Un punto de controversia se presenta en la monitorización de los efectos adversos. Algunos autores indican la internación para realizar controles estrictos de glicemia, frecuencia cardiaca (FC) y presión arterial (PA) , mientras que otros plantean que dichos efectos adversos a las dosis utilizadas en niños sin patología previa son poco frecuentes y consideran seguro iniciar el tratamiento ambulatorio. Los niños con mayor riesgo de hipoglicemia son los neonatos (12,16). Los autores de esta comunicación inicialmente ante la falta de experiencia, comenzaron el tratamiento con el paciente hospitalizado para monitorizar los efectos adversos más frecuentes. La hospitalización inicial fue de 4 días con controles de FC, PA, y HGT. Luego, en acuerdo con los cardiólogos y ante la ausencia de efectos adversos, se indicó tratamiento ambulatorio.
Tampoco existe consenso sobre la duración y forma de suspensión del tratamiento. La mayoría de la bibliografía recomienda mantenerlo durante la fase de crecimiento o hasta el año de vida. Esto evitaría la recidiva de la lesión (12,15,16). Se recomienda suspensión gradual, descendiendo la dosis a la mitad durante 1 a 2 semanas y luego un segundo descenso a la mitad de la dosis por el mismo periodo de tiempo (12,15). En esta serie, en los casos 2 y 3 se realizó la suspensión del tratamiento con descenso gradual con buena respuesta, sin evidencia de rebrote de la lesión. Los casos 4, 5 y 6 mantienen tratamiento con excelentes resultados por lo que se plantea comenzar con la suspensión del tratamiento.
Recientemente el propranolol ha sido aprobado por la FDA para el tratamiento de los HI(17).
En Chicago se realizó en 2011 el primer consenso sobre el uso de propranolol en HI. Las siguientes no son recomendaciones aprobadas por la Academia Americana de Pediatría y se basan en la revisión de casos clínicos y opinión de expertos(9).
- Se considera el tratamiento con propranolol en pacientes que presentan ulceración, compromiso de funciones vitales o riego de afectación estética permanente.
- Se debe realizar un screening previo al inicio del tratamiento para despistar contraindicaciones y riesgos del uso del propranolol: historia de patología cardiovascular y pulmonar, registro de PA y FC. Se indica ECG en los siguientes casos: pacientes con PA por debajo de lo normal para la edad, historia familiar de cardiopatía congénita o arritmia, historia personal de arritmia o hallazgo físico durante el examen. Tampoco se recomienda realizar ECoC de rutina.
- Dosis recomendada: 1-3 mg/kg/día con inicio escalonado.
- Hospitalización en niños < 8 semanas de edad corregida, cualquier edad con comorbilidad cardiaca, respiratoria o metabólica y en pacientes con mala contención familiar.
- En el resto de los pacientes iniciar el tratamiento de forma ambulatoria.
- Monitorización de efectos adversos: en pacientes internados: control de PA y FC previo al inicio, a la hora y 2 horas postadministración de la dosis. Si son normales no es necesario repetir el control y se podrá aumentar la dosis. No está indicado de forma rutinaria el control de glicemia; se debe administrar el propranolol durante el día y alimentar al niño luego de la dosis. Se deberá instruir a los padres para la detección temprana de los signos y síntomas de hipoglicemia.
- Situación especial: pacientes con síndrome de PHACE. El tratamiento con propranolol puede aumentar el riesgo de stroke debido a la presencia de alteraciones arteriales en la circulación cerebral. Se debe realizar angiorresonancia de cráneo y cuello y ecocardiografía que incluya el arco aórtico. En caso de riesgo elevado de stroke, el manejo de estos pacientes debe realizarse en conjunto con el neurólogo y el cardiólogo, utilizando dosis bajas de inicio gradual con monitorización hospitalaria.
Conclusión
Esta es la primera comunicación de una serie de niños con hemangiomas tratados con propranolol en Uruguay. A pesar del escaso número de pacientes se observó beneficio terapéutico sin complicaciones. El propranolol debe considerarse como una alternativa terapéutica segura frente al tratamiento con glucocorticoides sistémicos cuya administración prolongada se asocia con serios efectos adversos.
Referencias bibliográficas
1. Krämer D, Muñoz P, Alfaro P, Araníbar L, Cárdenas L, Morovici C, et al. Propranolol en el tratamiento de los hemangiomas faciales. Rev Chil Pediatr 2010; 81(6):523-30.
2. Chen TS, Eichenfield LF, Friedlander SF. Infantile hemangiomas: an update on pathogenesis and therapy. Pediatrics 2013; 131(1):99-108.
3. Ruvertoni M. Dermatología pediátrica. 4 ed. Montevideo: Bibliomédica, 2005:161-76.
4. Behrman R, Kleigman R, Jenson H, eds. Nelson Tratado de Pediatría. 17 ed. Madrid: Elsevier, 2004:2167-70.
5. Drolet BA, Esterly NB, Frieden IJ. Hemangiomas in children. N Engl J Med 1999; 341(3):173-81.
6. Chang LC, Haggstrom AN, Drolet BA, Baselga E, Chamlin SL, Garzon MC, et al; Hemangioma Investigator Group. Growth characteristics of infantile hemangiomas: implications for management. Pediatrics 2008; 122(2):360-7.
7. Gunturi N, Ramgopal S, Balagopal S, Scott JX. Propranolol therapy for infantile hemangioma. Indian Pediatr 2013; 50(3):307-13.
8. Léauté-Labrèze C, Dumas de la Roque E, Hubiche T, Boralevi F, Thambo JB, Taïeb A. Propranolol for severe hemangiomas of infancy. N Engl J Med 2008; 358(24):2649-51.
9. Drolet BA, Frommelt PC, Chamlin SL, Haggstrom A,
10. Bonini FK, Bellodi FS, Souza EM. Propranolol treatment for hemangioma of infancy. An Bras Dermatol 2011; 86(4):763-6.
11. Ho NT, Lansang P, Pope E. Topical imiquimod in the treatment of infantile hemangiomas: a retrospective study. J Am Acad Dermatol 2007; 56(1):63-8.
12. Sánchez-Carpintero I, Ruiz-Rodriguez R, López-Gutiérrez JC. Propranolol en hemangiomas infantiles: eficacia clínica, riesgos y recomendaciones. Actas Dermosifiliogr 2011; 102(10):766-79.
13. Lawley LP, Siegfried E, Todd JL. Propranolol treatment for hemangioma of infancy: risks and recommendations. Pediatr Dermatol 2009; 26(5):610-4.
14. Craiglow BG, Antaya RJ. Management of infantile hemangiomas : current and potential pharmacotherapeutic approaches. Paediatr Drugs 2013; 15(2):133-8.
15. Hsu TC, Wang JD, Chen CH, Chang TK, Wang TM, Chou CM, et al. Treatment with propranolol for infantile hemangioma in 13 Taiwanese newborns and young infants. Pediatr Neonatol 2012; 53(2):125-32.
16. Betlloch-Mas I, Martínez-Miravete MT, Lucas-Costa A, Martin de Lara AI, Selva-Otalaurruchi J. Tratamiento de hemangiomas infantiles con propranolol en régimen de control ambulatorio: estudio prospectivo. Actas Dermosifiliogr 2012; 103(9):806-15.
17. Brooks M. FDA OKs propranolol hydrochloride for infantile hemangioma. Medscape Mar 17, 2014.
Correspondencia: Dra. Nancy De Olivera.
Correo electrónico: nancydeolivera@hotmail.com